蜕壳是甲壳动物生长发育过程中的一个重要生命活动,老的壳被蜕去,随之新的壳被重建[1-2]。刚蜕壳的蟹被称为软壳蟹,因其方便食用、高钙低脂等特性越来越受到消费者青睐[3]。目前,已有多种蟹类被制作成软壳蟹,包括雪蟹(Chinoecetes opilio)[4]、锯缘青蟹(Scylla serrata)[5-6]、红星梭子蟹(Portunus sanguinolentus)[7]和三疣梭子蟹(Portunus trituberculatus)[3]等。Sudhakar等[7]发现红星梭子蟹软壳蟹的蛋白质、碳水化合物、脂类、矿物质和氨基酸含量均低于硬壳蟹,软壳蟹的营养价值不及硬壳蟹。而且,雪蟹和锯缘青蟹软壳蟹肌肉的蛋白质含量也低于硬壳蟹[5]。尽管三疣梭子蟹软壳蟹的蛋白质和脂类含量也比硬壳蟹低,但氨基酸和脂肪酸水平却与硬壳蟹相当。值得关注的是,三疣梭子蟹软壳蟹的钙含量显著高于硬壳蟹,因此软壳蟹可能是一种补钙佳品[3,8]。拟穴青蟹(Scylla paramamosain)是我国东南沿海重要的经济蟹类之一,因其味道鲜美、营养价值高而广受消费者欢迎[9],由其制作的软壳蟹更是受到老人和孩子的喜爱。然而,拟穴青蟹软壳蟹的营养价值是否低于硬壳蟹目前鲜见报道,因此,有必要对拟穴青蟹软壳蟹和硬壳蟹之间的营养物质组成差异进行比较分析。
传统的食品组分分析主要测定蛋白质、脂类和碳水化合物等总量,随着技术的发展,这种宽泛的组分分析方法已逐渐精细到有机小分子营养物(代谢物)的整体组成分析方法[10]。基于核磁共振(nuclear magnetic resonance,NMR)的代谢组学技术正是定性和定量分析小分子代谢物的有力工具[11-12],并已在蟹类肠道代谢物解析[13]、蟹类种类鉴别[14]、蟹糊级别鉴别[15]、蟹糊发酵过程中的质量评价[16]以及蟹类在生理和病理条件下的代谢机理解析[17-18]中得到成功应用。因此,本研究采用基于NMR的代谢组学技术并结合多变量统计分析方法比较拟穴青蟹软壳蟹与硬壳蟹肌肉和肝胰腺之间的营养物质组成差异,为正确评估软壳蟹的营养价值提供参考。
鲜活的拟穴青蟹硬壳蟹购自福建三门一水产交易市场,为获得数量足够的软壳蟹,购买60 只硬壳的雄性青蟹,每只蟹质量约250 g,分别单养在配备有循环水的蟹公寓中,盐度控制在20‰~25‰。
甲醇、二水合磷酸二氢钠、三水合磷酸氢二钾(均为色谱纯) 上海国药集团化学试剂有限公司;2,2,3,3-氘代三甲基硅烷丙酸钠(sodium 3-trimethylsilyl [2,2,3,3-2D4]propionate,TSP)、重水(99.9%氘代)(均为色谱纯) 美国Sigma-Aldrich公司。
用50%重水溶液配制0.15 mol/L磷酸缓冲液(pH 7.4),内含1.0×10-5g/mL TSP[19]。配制甲醇-水(2∶1,V/V)溶液作为组织胞内物质的提取液。
Avance III 600 MHz核磁共振谱仪(配有超低温探头)德国Bruker Biospin公司;TD-XBYM组织破碎仪 北京同德创业科技有限公司;5415R低温高速离心机 德国Eppendorf公司;2.5 L冷冻干燥机 美国Labconco公司。
1.3.1 样品前处理
从硬壳蟹中随机选取9 只青蟹作为硬壳蟹样品,采集青蟹游泳足肌肉和肝胰腺各约500 mg,用液氮速冻后-20 ℃保存备用。密切观察青蟹蜕壳情况,并记录每只青蟹的蜕壳时间,收集蜕壳时间为0 h和3 h的软壳蟹各9 只,样品处理方法同硬壳蟹。
1.3.2 营养物质提取
为提取青蟹肌肉和肝胰腺组织中的胞内物质,先在每个样品中分别加入1 mL甲醇提取液,然后置于组织破碎仪中,设置破碎频率为20 Hz,破碎时间为90 s。所得提取物在4 ℃、12 000 r/min离心10 min,以获得上清液。残渣再用1 mL甲醇提取液提取1 次。合并2 次提取所得的上清液,置于真空条件挥发上清液中的甲醇,进一步冷冻干燥。在冷冻干燥粉中加入600 μL磷酸缓冲液,充分混匀,经4 ℃、12 000 r/min离心10 min后,将500 μL上清液移入直径为5 mm的核磁管中,备用。
1.3.3 青蟹肌肉和肝胰腺提取物的NMR分析
在298 K条件下采集样品的1H NMR谱,所用的脉冲序列是标准的NOESYGPPR1D:RD-90°-t1-90°-tm-90°-ACQ,对应的质子共振频率为600.13 MHz。为抑制水峰,设置等待时间为2 s,混合时间为100 ms,并施加强度约50 Hz的低功率连续波。对于每个1H NMR谱,均设置90°脉冲宽度约10 μs,谱宽为δ 20,采样点数为32 K,自由感应信号累加次数为64 次。把采集到的1H NMR谱的自由感应信号先乘以增宽因子为0.5 Hz的指数窗函数,再进行傅里叶变换,根据内标物TSP(δ 0.0)的化学位移,手动定标1H NMR谱,并作相位和基线校正。分别选择一个具有肌肉和肝胰腺提取物典型1H NMR谱的样品用于二维NMR谱采集,采集的二维NMR谱包括同核COSY和TOCSY谱,异核HSQC和HMBC谱。二维谱的实验参数设置参见娄永江等[20]的方法。
1.3.4 NMR数据的多变量统计分析
对样品的1H NMR谱进行分段积分,选取肌肉样品的谱区间为δ 9.50~0.80,去除δ 5.00~4.70和δ 3.40~3.34的信号区间以消除水和甲醇的干扰;选取肝胰腺的谱区间为δ 9.70~0.75,去除水和甲醇的信号区间分别为δ 5.05~4.75和δ 3.37~3.34。所有1H NMR谱的积分区间均设置为2.4 Hz。为消除样品之间的重量差异,对上述积分数据进行了重量归一化处理。把归一化的NMR数据导入SIMCA-P+软件(V11.0,瑞典Umetrics公司),选择标准化的数据处理模式对NMR数据作主成分分析(principal component analysis,PCA),以获得样品的聚类情况。对不同蜕壳时间的软壳蟹分别与硬壳蟹进行两两比较的正交偏最小二乘法判别分析(orthogonal projection to latent structures-discriminant analysis,OPLS-DA),在OPLS-DA中,先对1H NMR数据进行自动规格化处理,并设为X变量,把分组信息设为Y变量。采用8 倍交叉验证和交叉验证的方差分析(cross validation-analysis of variance,CV-ANOVA)方法验证OPLS-DA模型的可靠性。OPLS-DA模型的Q2值越高且P值小于0.05,说明模型是可靠的[21]。再利用MATLAB软件制作OPLS-DA模型的相关系数图,以获得导致两组区分的具有显著性意义的物质。其中,以回溯转换处理[22]的NMR数据作为X变量,以分组信息为Y变量,这2 个变量之间的皮尔森积差相关系数(r)值作为营养物质在两组间是否具有显著性差异的标准,并以颜色代表其显著性,颜色越暖(如红色)表示显著性越大,反之,颜色越冷(如蓝色)表示显著性越小。在本研究中,当某一营养物质的|r|大于0.632时,该物质对组间区分达到显著水平(P<0.05)。
为获得软壳蟹与硬壳蟹的营养物质差异,按下式计算不同时间采集的软壳蟹的营养物质相对于硬壳蟹的相对变化率:
式中:Ci和C0分别为营养物质在软壳蟹和硬壳蟹中的浓度。

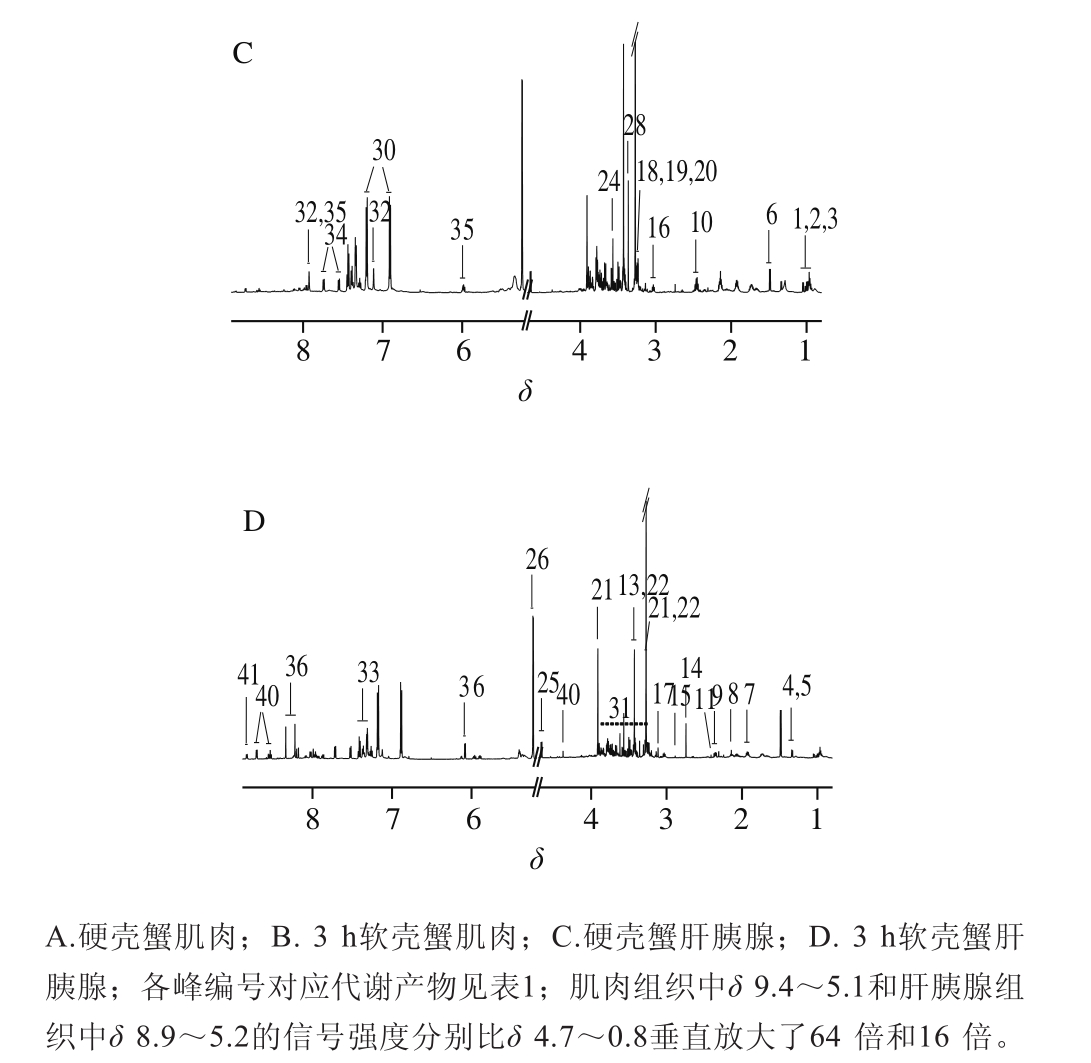
图1 拟穴青蟹肌肉和肝胰腺提取物的典型600 MHz1H NMR谱
Fig. 1 Typical 600 MHz1H NMR spectra of the extracts of muscle and hepatopancreas of S. paramamosain
表1 拟穴青蟹肌肉和肝胰腺营养物质的NMR数据
Table 1 NMR data of nutrients detected in the muscle and hepatopancreas of S. paramamosain
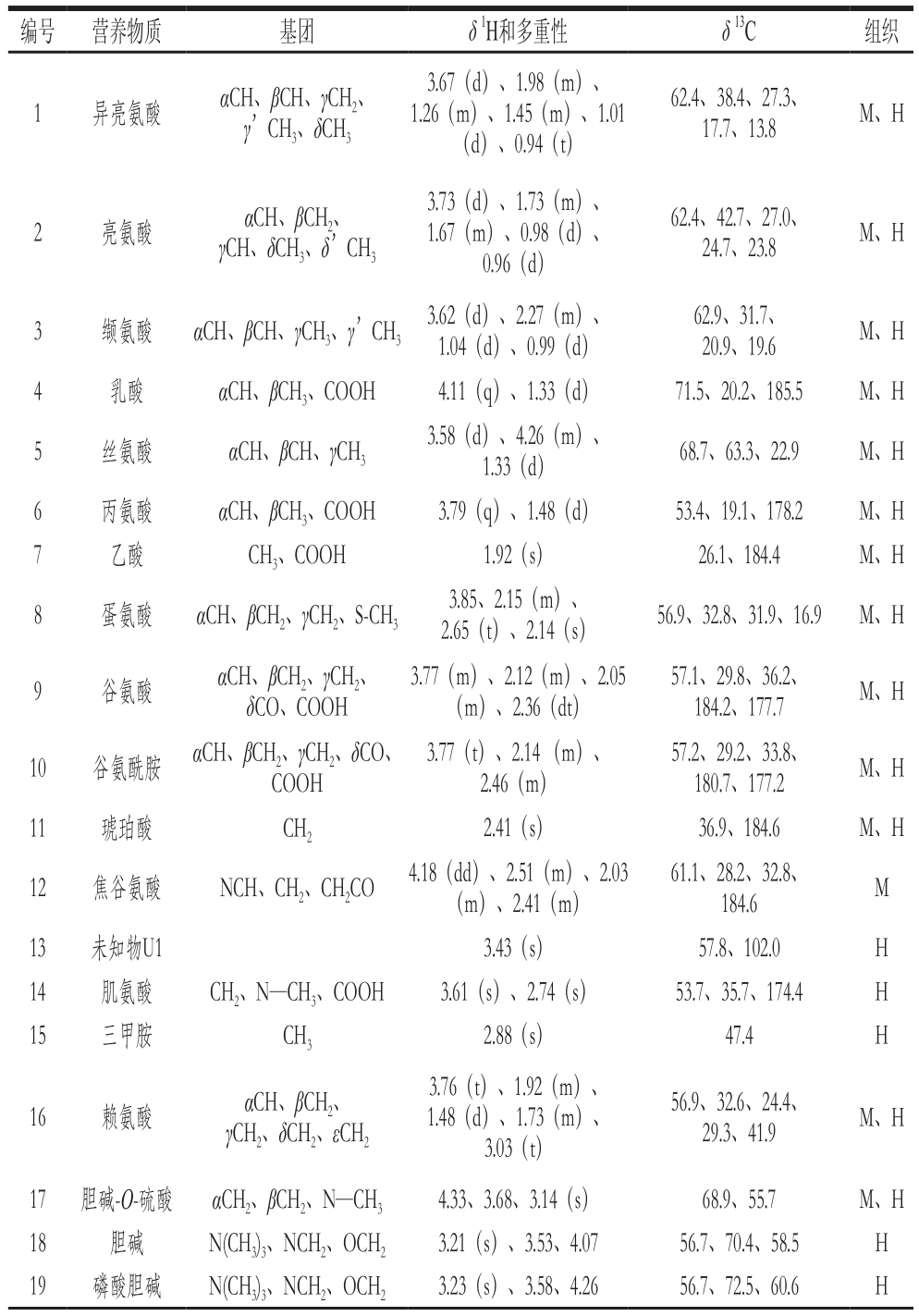
编号 营养物质 基团 δ1H和多重性 δ13C 组织1 异亮氨酸 αCH、βCH、γCH2、γ’CH3、δCH33.67(d)、1.98(m)、1.26(m)、1.45(m)、1.01(d)、0.94(t)62.4、38.4、27.3、17.7、13.8 M、H 2 亮氨酸 αCH、βCH2、γCH、δCH3、δ’CH33.73(d)、1.73(m)、1.67(m)、0.98(d)、0.96(d)62.4、42.7、27.0、24.7、23.8 M、H 3 缬氨酸 αCH、βCH、γCH3、γ’CH33.62(d)、2.27(m)、1.04(d)、0.99(d)62.9、31.7、20.9、19.6 M、H 4 乳酸 αCH、βCH3、COOH 4.11(q)、1.33(d) 71.5、20.2、185.5 M、H 5 丝氨酸 αCH、βCH、γCH33.58(d)、4.26(m)、1.33(d) 68.7、63.3、22.9 M、H 6 丙氨酸 αCH、βCH3、COOH 3.79(q)、1.48(d) 53.4、19.1、178.2 M、H 7 乙酸 CH3、COOH 1.92(s) 26.1、184.4 M、H 8 蛋氨酸 αCH、βCH2、γCH2、S-CH33.85、2.15(m)、2.65(t)、2.14(s) 56.9、32.8、31.9、16.9 M、H 9 谷氨酸 αCH、βCH2、γCH2、δCO、COOH 3.77(m)、2.12(m)、2.05(m)、2.36(dt)57.1、29.8、36.2、184.2、177.7 M、H 10 谷氨酰胺 αCH、βCH2、γCH2、δCO、COOH 3.77(t)、2.14 (m)、2.46(m)57.2、29.2、33.8、180.7、177.2 M、H 11 琥珀酸 CH22.41(s) 36.9、184.6 M、H 12 焦谷氨酸 NCH、CH2、CH2CO 4.18(dd)、2.51(m)、2.03(m)、2.41(m)61.1、28.2、32.8、184.6 M 13 未知物U1 3.43(s) 57.8、102.0 H 14 肌氨酸 CH2、N—CH3、COOH 3.61(s)、2.74(s) 53.7、35.7、174.4 H 15 三甲胺 CH32.88(s) 47.4 H 16 赖氨酸 αCH、βCH2、γCH2、δCH2、εCH23.76(t)、1.92(m)、1.48(d)、1.73(m)、3.03(t)56.9、32.6、24.4、29.3、41.9 M、H 17 胆碱-O-硫酸 αCH2、βCH2、N—CH34.33、3.68、3.14(s) 68.9、55.7 M、H 18 胆碱 N(CH3)3、NCH2、OCH23.21(s)、3.53、4.07 56.7、70.4、58.5 H 19 磷酸胆碱 N(CH3)3、NCH2、OCH23.23(s)、3.58、4.26 56.7、72.5、60.6 H
续表1
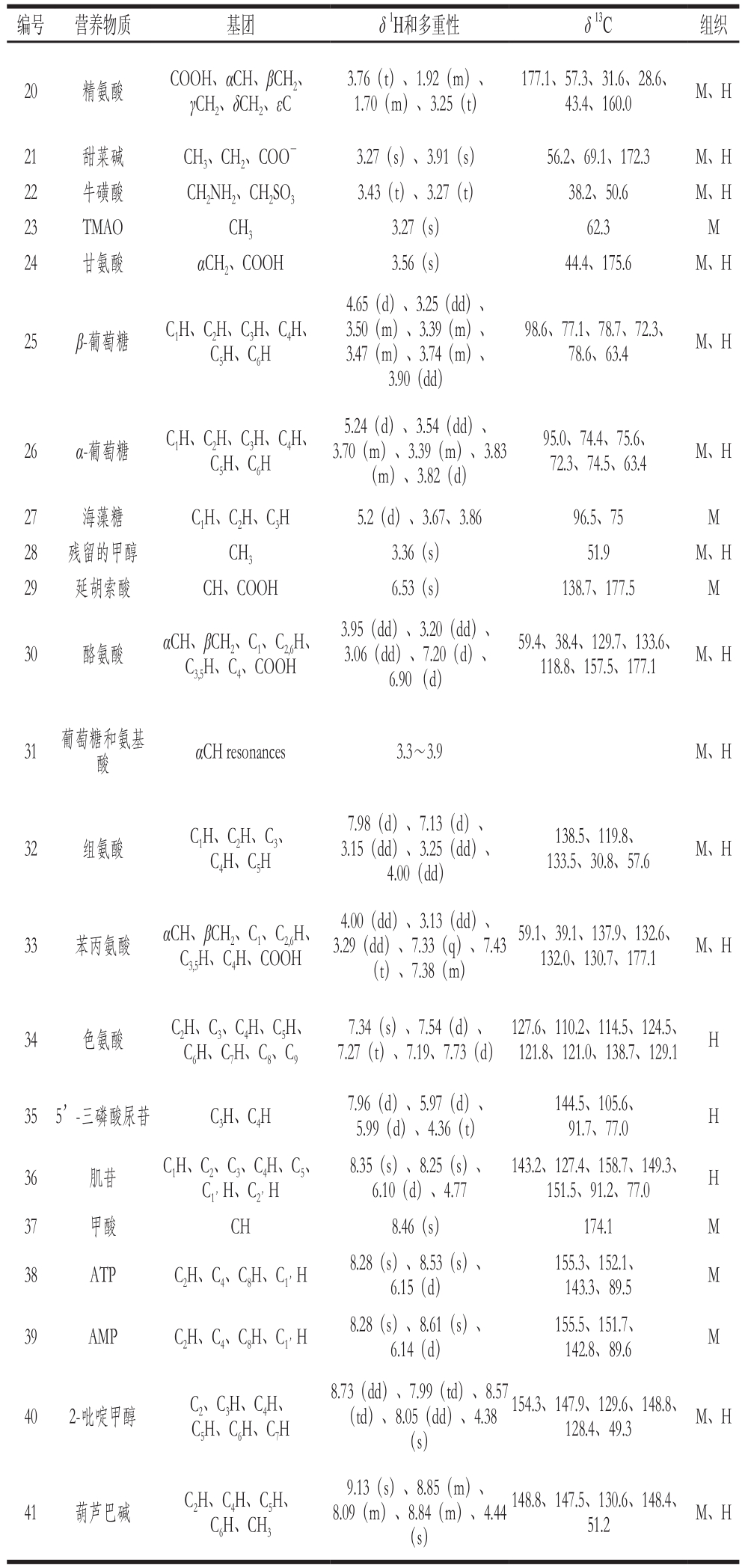
注:多重性:s.单峰;d.双峰;t.三重峰;q.四重峰;dd.双重二重峰;m.多重峰;dt.二重三重峰;td.三重二重峰;组织:M.肌肉;H.肝胰腺。
编号 营养物质 基团 δ1H和多重性 δ13C 组织20 精氨酸 COOH、αCH、βCH2、γCH2、δCH2、εC 3.76(t)、1.92(m)、1.70(m)、3.25(t)177.1、57.3、31.6、28.6、43.4、160.0 M、H 21 甜菜碱 CH3、CH2、COO-3.27(s)、3.91(s) 56.2、69.1、172.3 M、H 22 牛磺酸 CH2NH2、CH2SO33.43(t)、3.27(t) 38.2、50.6 M、H 23 TMAO CH33.27(s) 62.3 M 24 甘氨酸 αCH2、COOH 3.56(s) 44.4、175.6 M、H 25 β-葡萄糖 C1H、C2H、C3H、C4H、C5H、C6H 4.65(d)、3.25(dd)、3.50(m)、3.39(m)、3.47(m)、3.74(m)、3.90(dd)98.6、77.1、78.7、72.3、78.6、63.4 M、H 26 α-葡萄糖 C1H、C2H、C3H、C4H、C5H、C6H 5.24(d)、3.54(dd)、3.70(m)、3.39(m)、3.83(m)、3.82(d)95.0、74.4、75.6、72.3、74.5、63.4 M、H 27 海藻糖 C1H、C2H、C3H 5.2(d)、3.67、3.86 96.5、75 M 28 残留的甲醇 CH33.36(s) 51.9 M、H 29 延胡索酸 CH、COOH 6.53(s) 138.7、177.5 M 30 酪氨酸 αCH、βCH2、C1、C2,6H、C3,5H、C4、COOH 3.95(dd)、3.20(dd)、3.06(dd)、7.20(d)、6.90 (d)59.4、38.4、129.7、133.6、118.8、157.5、177.1 M、H 31 葡萄糖和氨基酸αCH resonances 3.3~3.9 M、H 32 组氨酸 C1H、C2H、C3、C4H、C5H 7.98(d)、7.13(d)、3.15(dd)、3.25(dd)、4.00(dd)138.5、119.8、133.5、30.8、57.6 M、H 33 苯丙氨酸 αCH、βCH2、C1、C2,6H、C3,5H、C4H、COOH 4.00(dd)、3.13(dd)、3.29(dd)、7.33(q)、7.43(t)、7.38(m)59.1、39.1、137.9、132.6、132.0、130.7、177.1 M、H 34 色氨酸 C2H、C3、C4H、C5H、C6H、C7H、C8、C97.34(s)、7.54(d)、7.27(t)、7.19、7.73(d)127.6、110.2、114.5、124.5、121.8、121.0、138.7、129.1 H 35 5’-三磷酸尿苷 C3H、C4H 7.96(d)、5.97(d)、5.99(d)、4.36(t)144.5、105.6、91.7、77.0 H 36 肌苷 C1H、C2、C3、C4H、C5、C1’H、C2’H 8.35(s)、8.25(s)、6.10(d)、4.77 143.2、127.4、158.7、149.3、151.5、91.2、77.0 H 37 甲酸 CH 8.46(s) 174.1 M 38 ATP C2H、C4、C8H、C1’H 8.28(s)、8.53(s)、6.15(d)155.3、152.1、143.3、89.5 M 39 AMP C2H、C4、C8H、C1’H 8.28(s)、8.61(s)、6.14(d)155.5、151.7、142.8、89.6 M 8.73(dd)、7.99(td)、8.57(td)、8.05(dd)、4.38(s)40 2-吡啶甲醇 C2、C3H、C4H、C5H、C6H、C7H 154.3、147.9、129.6、148.8、128.4、49.3 M、H 41 葫芦巴碱 C2H、C4H、C5H、C6H、CH39.13(s)、8.85(m)、8.09(m)、8.84(m)、4.44(s)148.8、147.5、130.6、148.4、51.2 M、H
NMR信号的归属依据参考文献[23-24]及二维谱提供的氢氢相关和氢碳相关信息确定,NMR谱图及代谢物NMR信息如图1、表1所示。结果表明,拟穴青蟹肌肉和肝胰腺的营养物质组成较类似,均含有相同种类的氨基酸、有机酸以及胆碱-O-硫酸、葡萄糖和2-吡啶甲醇。但这2 种组织仍有其特征性营养物质信号,如海藻糖、延胡索酸、甲酸和三磷酸腺苷(adenosine triphosphate,ATP)只在肌肉中被检测到,而肌氨酸、色氨酸和5’-三磷酸尿嘧啶(uridine 5’-triphosphate,UTP)只在肝胰腺中被检测到。这种物质组成的差异可能与其在组织中的生理功能密切相关。比较NMR谱还可以发现,与硬壳蟹相比,软壳蟹肌肉含有较低水平的乳酸和5’-单磷酸腺苷(adenosine 5’-monophosphate,AMP),而其肝胰腺则含有较高水平的丙氨酸和较低水平的酪氨酸等。
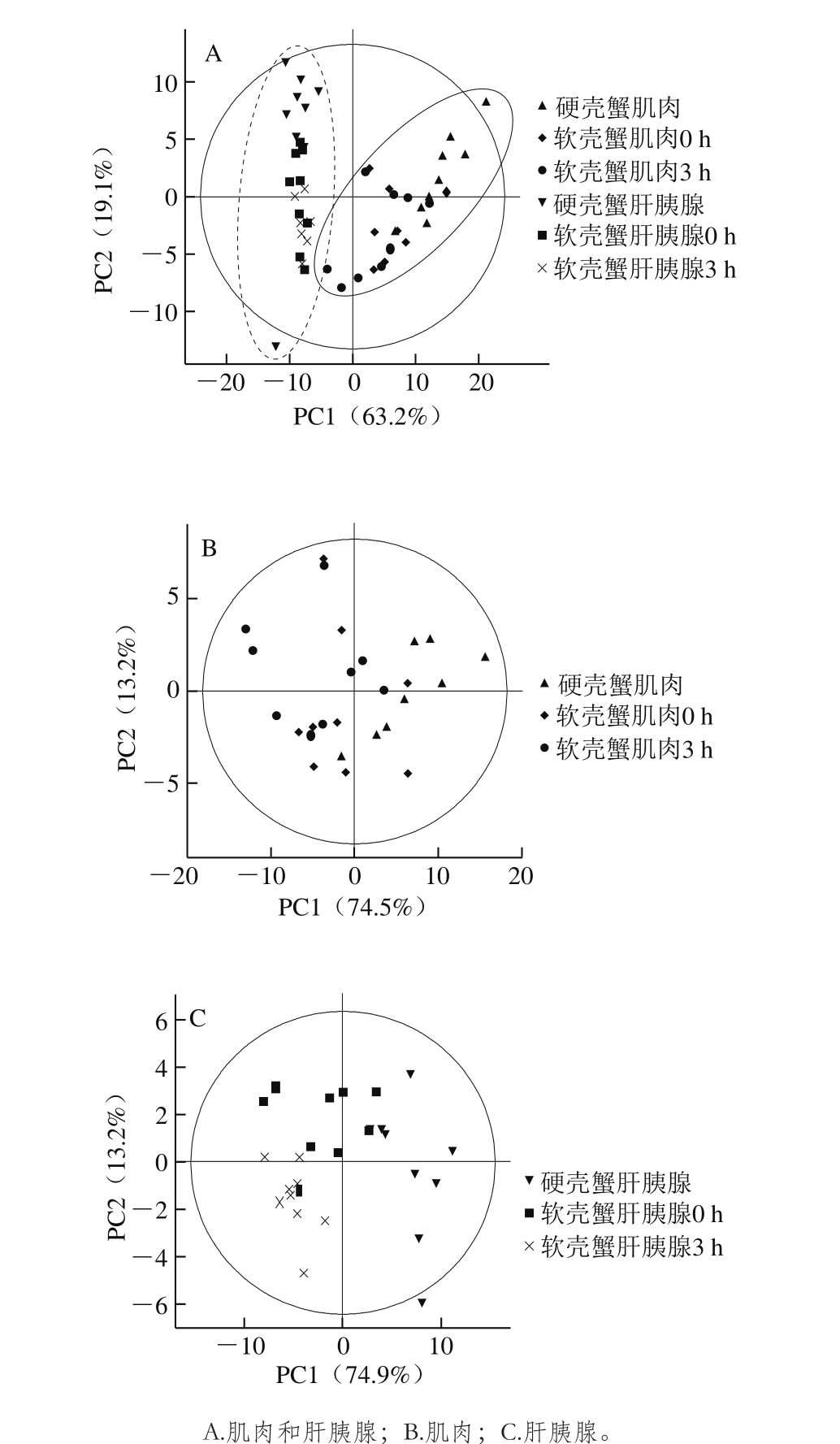
图2 拟穴青蟹肌肉和肝胰腺提取物的PCA得分图
Fig. 2 PCA scores plots of1H NMR spectra of the extracts of muscle and hepatopancreas of S. paramamosain
为获得软壳蟹与硬壳蟹的营养物质组成差异,首先采用非监督的PCA方法对肌肉和肝胰腺NMR数据的分布进行分析。如图2所示,组织不同是导致营养物质组成差异的主要原因(图2A),但蜕壳也导致了肌肉营养物质组成的轻微区分(图2B)和肝胰腺营养物质组成的明显区分(图2C)。
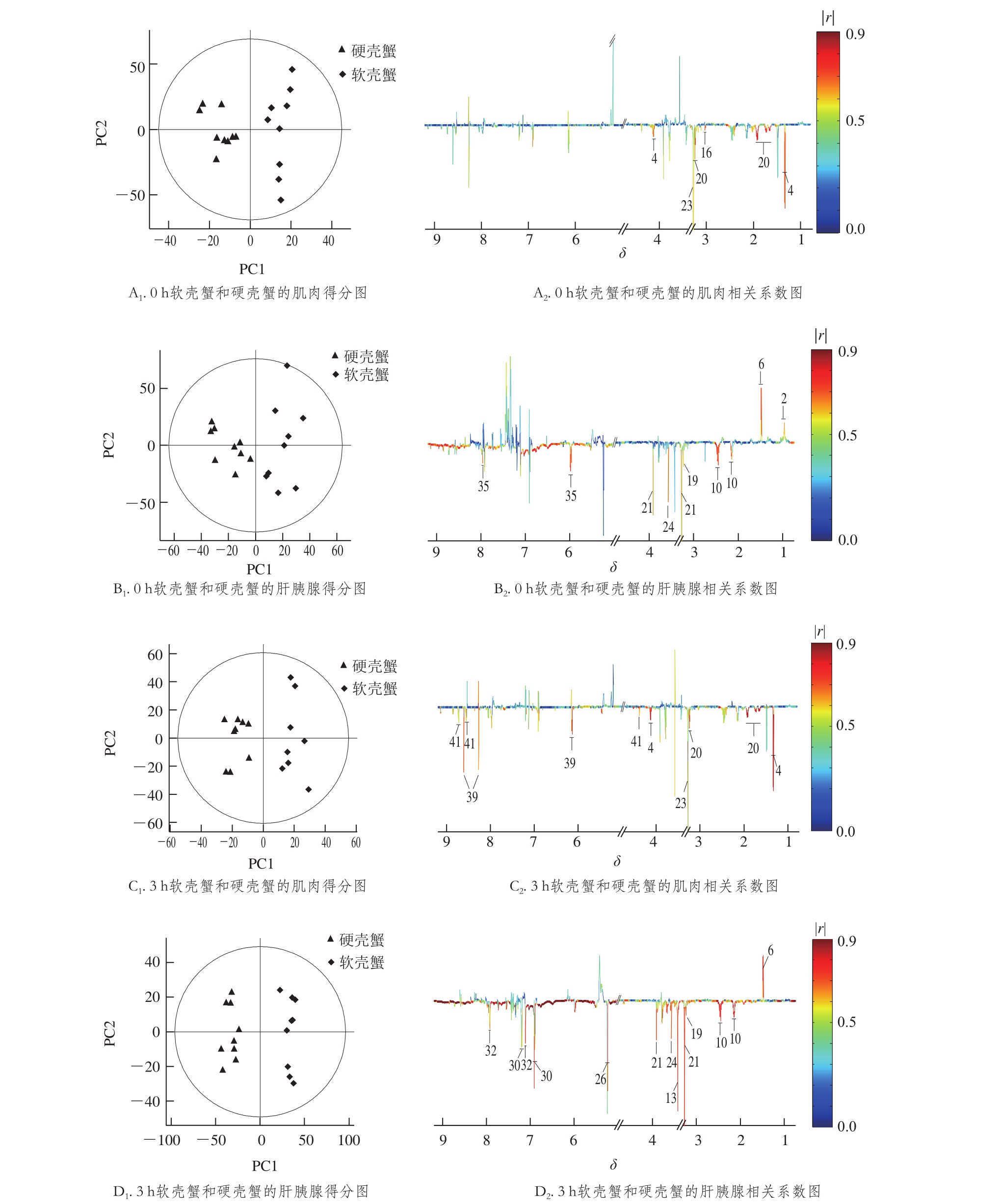
图3 拟穴青蟹硬壳蟹与软壳蟹肌肉和肝胰腺提取物的OPLS-DA得分图和相关系数图
Fig. 3 OPLS-DA scores plots and corresponding color-coded correlation coefficient loadings plots
为进一步提取软壳蟹与硬壳蟹的物质组成差异,对不同采集时间的软壳蟹组织的NMR数据与硬壳蟹进行了4 个OPLS-DA模型,如图3所示,根据模型的Q2值和CV-ANOVA所得的P值,验证了这些模型都是可靠的。OPLS-DA结果表明,与硬壳蟹相比,0 h采集的软壳蟹肌肉含有较低含量的乳酸、赖氨酸、精氨酸和三甲胺-N-氧化物(trimethylamine-N-oxide,TMAO);而其肝胰腺则含有较高含量的亮氨酸和丙氨酸,同时含有较低含量的谷氨酸、甘氨酸、磷酸胆碱、甜菜碱和UTP。如果未能及时采集软壳蟹,当采集时间延迟到蜕壳后3 h时,则软壳蟹肌肉含有更低含量的乳酸、精氨酸、TMAO、AMP和葫芦巴碱;而肝胰腺中的谷氨酸、甘氨酸、磷酸胆碱和甜菜碱含量仍然低于硬壳蟹,丙氨酸含量仍然高于硬壳蟹,其他营养物质包括组氨酸、酪氨酸、葡萄糖和未知物U1的含量也显著低于硬壳蟹。
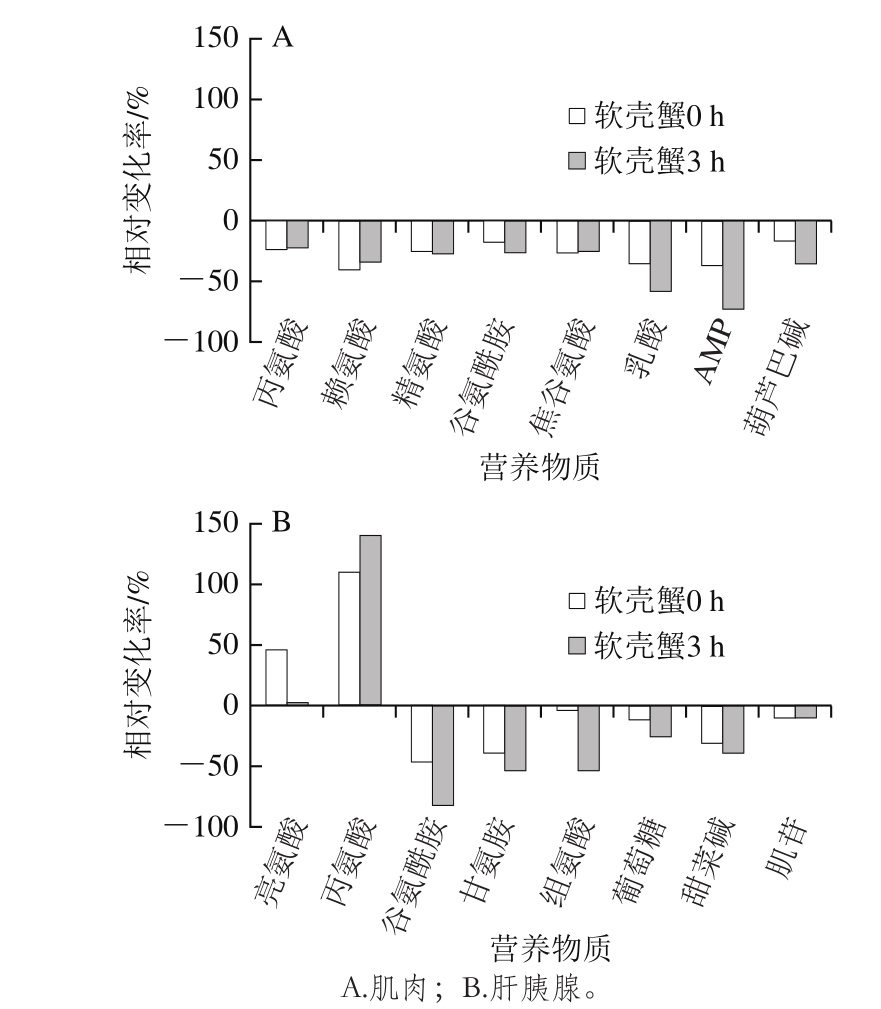
图4 拟穴青蟹软壳蟹相对于硬壳蟹的营养物质变化
Fig. 4 Variations in nutrients in soft-shell mud crabs relative to hard-shell mud crabs
如图4所示,软壳蟹肌肉中的乳酸和AMP含量下降较明显,而且随着采集时间的延长而加剧,在蜕壳后3 h时,已分别降低了57.6%和72.3%。而丙氨酸、赖氨酸、精氨酸、焦谷氨酸和葫芦巴碱含量都降低20%左右。软壳蟹肝胰腺中产生的营养物质变化要比肌肉更复杂。丙氨酸含量在蜕壳0 h即增加到硬壳蟹的109.0%,在蜕壳3 h更是增加到硬壳蟹的138.7%。相反,谷氨酰胺、甘氨酸、组氨酸、葡萄糖和甜菜碱含量都随着蜕壳时间的延长呈快速降低的趋势,下降最明显的是谷氨酰胺,在刚蜕壳后下降了硬壳蟹水平的46.8%,在蜕壳3 h下降了硬壳蟹水平的82.0%。
肌肉组织是拟穴青蟹的主要可食用部位,其营养物质组成差异对青蟹的质量起着主导作用。本研究结果表明,刚刚蜕壳的软壳蟹肌肉中只有4 种营养物质即乳酸、赖氨酸、精氨酸和TMAO的含量显著下降,尽管赖氨酸是必需氨基酸,但精氨酸是非必需氨基酸,而且这2 个氨基酸对呈味的影响较小,因此,这2 个氨基酸含量的降低可能对青蟹肌肉的质量影响较小。乳酸呈柔和的酸味[25],显著降低的乳酸含量可能只是减少了肌肉的酸味。事实上,在这4 个显著变化的营养物质中,最值得关注的是TMAO。尽管TMAO对维持海洋生物组织的渗透平衡起着重要作用[26],但人类食用了含有TMAO的海洋生物如鱼类,可能会导致血液中TMAO水平升高[27],从而提高患动脉粥样硬化的风险[28]。拟穴青蟹蜕壳后,TMAO含量显著下降,这可能预示着人们患动脉粥样硬化的风险会降低,但减少的TMAO可能在细菌或酶的作用下已降解成为有害物质三甲胺(trimethylamine,TMA)[29-30],因为TMA进入人体肝脏后同样会被黄素单加氧酶转化成为TMAO[28]。但本研究并未检测到TMA,说明TMA在肌肉中的含量低于NMR检测限或甚至为0,但拟穴青蟹肌肉中TMAO的分解值得以后进一步研究。
尽管肌肉是主要的食用部位,但肝胰腺却是消费者评价青蟹品质优劣的关键,因为消费者的评价依据是肝胰腺的色泽。但在营养学家眼里,客观的营养物质组成才是食品品质的决定因素。在新蜕壳的青蟹肝胰腺中,显著提高的有亮氨酸和丙氨酸,显著下降的有谷氨酸和甘氨酸。亮氨酸是必需氨基酸,丙氨酸、谷氨酸和甘氨酸是非必需氨基酸。从滋味角度,丙氨酸和甘氨酸带有甜味,谷氨酸呈鲜味,而亮氨酸呈苦味[25]。这些氨基酸含量的波动加上显著降低的甜菜碱含量可能会影响软壳蟹肝胰腺的最终滋味。
如果拟穴青蟹蜕壳后未能及时采集,肌肉和肝胰腺的营养物质组成变化将进一步加剧。肌肉中有5 种营养物质即乳酸、精氨酸、TMAO、AMP和葫芦巴碱的含量显著降低,其中,AMP可赋予肌肉鲜味[25,31],降低的AMP含量可能影响软壳蟹肌肉的鲜度。与肌肉相比,延迟采集对肝胰腺营养物质的影响更大,有更多的营养物质如组氨酸、酪氨酸和葡萄糖含量均显著降低,组氨酸、酪氨酸呈苦味,但葡萄糖提供甜味,更重要的是这些物质都是人体重要的营养物质。因此,延迟采集将可能影响拟穴青蟹软壳蟹的品质和风味。
本研究利用基于NMR的代谢组学技术,比较分析拟穴青蟹软壳蟹与硬壳蟹之间的小分子营养物质组成差异。与硬壳蟹相比,刚蜕壳的软壳蟹肌肉中只有赖氨酸、精氨酸、乳酸和TMAO含量发生了显著下降,可能对软壳蟹肌肉的营养价值和口感影响较小,但TMAO含量的显著下降可能降低了人们患病的风险;同时,在刚蜕壳的软壳蟹肝胰腺中,4 种氨基酸和甜菜碱含量的显著波动可能影响了肝胰腺的滋味。如果拟穴青蟹蜕壳后未能及时采集,蜕壳后3 h的软壳蟹肌肉和肝胰腺的营养物质组成变化将进一步加剧。特别是软壳蟹肌肉中的AMP水平开始呈显著下降,这可能影响肌肉的鲜度;而肝胰腺中的组氨酸、酪氨酸和葡萄糖含量也开始呈显著降低,可能影响肝胰腺的营养价值。因此,从小分子营养物质水平来看,刚蜕壳的拟穴青蟹软壳蟹可比拟于硬壳蟹,而且可能是一种更健康的水产品,但延迟采集软壳蟹将会影响青蟹软壳蟹的品质和口感。本研究结果可为拟穴青蟹软壳蟹的采集和质量评价提供参考。
[1] GHANAWI J, SAOUD I P. Molting, reproductive biology, and hatchery management of red claw crayfish Cherax quadricarinatus(von Martens 1868)[J]. Aquaculture, 2012, 358: 183-195. DOI:10.1016/j.aquaculture.2012.06.019.
[2] LI X, XU Z, ZHOU G, et al. Molecular characterization and expression analysis of five chitinases associated with molting in the Chinese mitten crab, Eriocheir sinensis[J]. Comparative Biochemistry and Physiology Part B, 2015, 187: 110-120. DOI:10.1016/j.cbpb.2015.05.007.
[3] 舒磊, 母昌考, 王春琳, 等. 蜕壳后不同时间的软壳三疣梭子蟹常规营养成分含量变化[J]. 应用海洋学学报, 2013, 32(2): 278-282.DOI:10.3969/J.ISSN.2095-4972.2013.02.019.
[4] MIZUTA S, KOBAYASHI Y, YOSHINAKA R. Chemical and histological characterization of raw muscle from soft and hard crabs of snow crab Chinoecetes opilio[J]. Journal of Food Science, 2001, 66(2):238-241. DOI:10.1111/j.1365-2621.2001.tb11324.x.
[5] BENJAKUL S, SUTTHIPAN N. Comparative study on chemical composition, thermal properties and microstructure between the muscle of hard shell and soft shell mud crabs[J]. Food Chemistry,2009, 112(3): 627-633. DOI:10.1016/j.foodchem.2008.06.019.
[6] BENJAKUL S, SUTTHIPAN N. Muscle changes in hard and soft shell crabs during frozen storage[J]. LWT-Food Science and Technology,2009, 42(3): 723-729. DOI:10.1016/j.lwt.2008.10.003.
[7] SUDHAKAR M, MANIVANNAN K, SOUNDRAPANDIAN P.Nutritive value of hard and soft shell crabs of Portunus sanguinolentus(Herbst)[J]. International Journal of Animal and Veterinary Advances,2009, 1(2): 44-48.
[8] 华晓旭, 黄福勇, 母昌考, 等. 三疣梭子蟹软壳蟹主要营养成分分析与评价[J]. 营养学报, 2013, 35(1): 89-90; 93.
[9] YE H, TAO Y, WANG G, et al. Experimental nursery culture of the mud crab Scylla paramamosain (Estampador) in China[J]. Aquaculture International, 2011, 19(2): 313-321. DOI:10.1007/s10499-010-9399-3.
[10] WISHART D S. Metabolomics: applications to food science and nutrition research[J]. Trends in Food Science & Technology, 2008,19(9): 482-493. DOI:10.1016/j.tifs.2008.03.003.
[11] NICHOLSON J K, LINDON J C. Systems biology: metabonomics[J].Nature, 2008, 455: 1054-1056. DOI:10.1038/4551054a.
[12] 陈黛安, 叶央芳. 基于NMR的代谢组学技术在食品科学中的应用[J]. 食品与发酵工业, 2016, 42(3): 256-261. DOI:10.13995/j.cnki.11-1802/ts.201603045.
[13] ZENG T L, YE Y F, MU C K, et al. Gut microbiota and metabolic phenotype of Portunus trituberculatus[J]. Chinese Journal of Analytical Chemistry, 2016, 44(12): 1867-1873. DOI:10.1016/S1872-2040(16)60978-7.
[14] ZOTTI M, DE PASCALI S A, DEL COCO L, et al.1H NMR metabolomic profiling of the blue crab (Callinectes sapidus) from the Adriatic Sea (SE Italy): a comparison with warty crab (Eriphia verrucosa), and edible crab (Cancer pagurus)[J]. Food Chemistry,2016, 196: 601-609. DOI:10.1016/j.foodchem.2015.09.087.
[15] YE Y F, ZHANG L M, TANG H R, et al. Survey of nutrients and quality assessment for crab paste by1H NMR spectroscopy and multivariate data analysis[J]. Chinese Science Bulletin, 2012, 57(25):3353-3362. DOI:10.1007/s11434-012-5119-x.
[16] CHEN D, YE Y, CHEN J, et al. Evolution of metabolomics profiles of crab paste during fermentation[J]. Food Chemistry, 2016, 192: 886-892. DOI:10.1016/j.foodchem.2015.07.098.
[17] YE Y F, AN Y P, LI R H, et al. Strategy of metabolic phenotype modulation in Portunus trituberculatus exposed to low salinity[J].Journal of Agricultural and Food Chemistry, 2014, 62(15): 3496-3503.DOI:10.1021/jf405668a.
[18] YE Y F, XIA M, MU C, et al, Acute metabolic response of Portunus trituberculatus to Vibrio alginolyticus infection[J]. Aquaculture, 2016,463: 201-208. DOI:10.1016/j.aquaculture.2016.05.041.
[19] XIAO C N, HAO F H, QIN X R, et al. An optimized buffer system for NMR-based urinary metabonomics with effective pH control, chemical shift consistency and dilution minimization[J]. Analyst, 2009, 134(5):916-925. DOI:10.1039/B818802E.
[20] 娄永江, 魏丹丹, 陈超, 等. 运用代谢组学研究保鲜处理对坛紫菜小分子物质的影响[J]. 中国食品科学, 2016, 16(11): 196-203.DOI:10.16429/j.1009-7848.2016.11.027.
[21] ERIKSSON L, TRYGG J, WOLD S. CV-ANOVA for significance testing of PLS and OPLS (R) models[J]. Journal of Chemometrics,2008, 22(11/12): 594-600. DOI:10.1002/cem.1187.
[22] CLOAREC O, DUMAS M E, TRYGG J, et al. Evaluation of the orthogonal projection on latent structure model limitations caused by chemical shift variability and improved visualization of biomarker changes in1H NMR spectroscopic metabonomic studies[J]. Analytical Chemistry, 2005, 77(2): 517-526. DOI:10.1021/ac048803i.
[23] FAN T W M. Metabolite profiling by one- and two-dimensional NMR analysis of complex mixtures[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 1996, 28(2): 161-219. DOI:10.1016/0079-6565(95)01017-3.
[24] FAN T W M, LANE A N. Structure-based profiling of metabolites and isotopomers by NMR[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 2008, 52: 69-117. DOI:10.1016/j.pnmrs.2007.03.002.
[25] SCHLICHTHERLE-CERNY H, GROSCH W. Evaluation of taste compounds of stewed beef juice[J]. Zeitschrift für Lebensmittel-Untersuchung und -Forschung A, 1998, 207(5): 369-376.DOI:10.1007/s002170050347.
[26] YANCEY P H, CLARKE M E, HAND S C, et al. Living with water stress: evolution of osmolyte systems[J]. Science, 1982, 217: 1214-1222.
[27] COUATRE D L, BELL S. Is L-carnitine the link between red meat and heart disease?[J] Journal of Nutrition & Food Sciences, 2013, 3(3):e119. DOI:10.4172/2155-9600.1000e119.
[28] WANG Z, KLIPFELL E, BENNETT B J, et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease[J]. Nature,2011, 472: 57-63. DOI:10.1038/nature09922.
[29] GRAM L, DALGAARD P. Fish spoilage bacteria-problems and solutions[J]. Current Opinion in Biotechnology, 2002, 13(3): 262-266.DOI:10.1016/S0958-1669(02)00309-9.
[30] ADHOUM N, MONSER L, SADOK S, et al. Flow injection potentiometric detection of trimethylamine in seafood using tungsten oxide electrode[J]. Analytica Chimica Acta, 2003, 478(1): 53-58.DOI:10.1016/S0003-2670(02)01431-9.
[31] YAMAGUCHI S, YOSHIKAWA T, IKEDA S, et al. Measurement of the relative taste intensity of some L-α-amino acids and 5’-nucleotides[J]. Journal of Food Science, 1971, 36(6): 846-849.DOI:10.1111/j.1365-2621.1971.tb15541.x.
Comparative Analysis of Low Molecular Mass Nutrients in Hard- and Soft-Shell Crabs (Scylla paramamosain)