溶剂提取对青稞中不同形态多酚组成及抗氧化活性的影响
杨希娟1,2,党 斌1,2,樊明涛1,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.青海大学 青海省青藏高原农产品加工重点实验室,青海 西宁 810016)
摘 要:为研究不同极性溶剂对青稞全谷物中不同形态酚类化合物含量、组成及抗氧化性的影响,建立适宜于青稞全谷物中多酚提取的方法。以4 个不同品种青稞为原料,比较4 种不同溶剂及酸法、碱法分别对青稞中游离酚和结合酚含量、组成与抗氧化活性的影响。结果表明,所有提取试剂中80%丙酮溶液提取的游离态总酚含量(139.79~235.96 mg/100 g)及总黄酮含量(9.88~15.52 mg/100 g)最高,酸法提取的青稞结合态总酚含量是碱法的1.9~3.1 倍,结合态黄酮含量是碱法的1.3~2.9 倍;80%丙酮溶液提取物中检测到8~18 种青稞游离酚类化合物,且酚类化合物含量显著高于其他溶剂,绿原酸、苯甲酸、儿茶素、槲皮素、芦丁是其主要的游离酚类化合物。与碱法相比,酸法能释放出更多的结合酚类化合物类型及含量,没食子酸、p-香豆酸、丁香酸、苯甲酸、藜芦酸、橙皮苷是其主要的结合酚类化合物;参试青稞80%丙酮溶液提取物显示出最高的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力(852.56~1 484.18 μmol/100 g),2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基清除能力(358.93~518.09 μmol/100 g)及铁离子还原能力(ferric ion reducing antioxidant power,FRAP)(1 250.55~2 041.16 μmol/100 g)。酸法水解参试青稞结合酚DPPH自由基清除能力、FRAP、ABTS+•清除能力分别是碱法水解的7.6~10.3、1.2~1.8 倍和1.1~1.3 倍。因此,80%丙酮溶剂和酸法分别是青稞中游离酚与结合酚的适宜提取溶剂,且本研究表明青稞全谷物中富含丰富的酚类物质,是一种潜在的天然抗氧化剂来源。
关键词:青稞;提取溶剂;多酚组成;抗氧化活性
临床试验和流行病学研究表明日常膳食中摄入一定量全谷物可有效预防多种慢性疾病,如心血管疾病和癌症等。研究认为全谷物与氧化应激相关的慢性病有密切关系,在一定程度上有助于缓和慢性病的发展[1-3]。而全谷物中的酚类物质作为重要的膳食抗氧化组分,具有预防机体氧化应激的功效,对人类的心血管疾病、糖尿病、肥胖和肿瘤等具有突出的防护作用[4-6]。青稞(Hordeum vulgare L. var. nudum Hook. f.)是大麦的一种,因其籽粒内外稃与颖果分离,籽粒裸露,故称裸大麦[7]。生长在海拔约1 400~4 700 m的青藏高原,是青藏高原区域第一大作物和藏区农牧民赖以生存的主要口粮[8-9]。多酚是大麦中一类丰富的次级代谢产物,现有研究指出大麦中的酚类物质含量(0.2%~0.4%)远高于其他谷物[10],并研究报道了不同种类、不同颜色大麦中多酚的组成、含量及抗氧化活性[11]。但是已有报道多关注的是皮大麦,而关于青藏高原区域生长的青稞中多酚的含量及其活性研究较少。
可食植物中天然存在的大部分多酚都是以游离或结合的形式存在,且不同植物的化学组成差异导致不同植物中多酚的最适提取溶剂不同[12-13]。现已有研究证明提取溶剂及方法对大麦[14]、荔枝果肉[15]、红薯叶[16]、石榴果肉[17]等不同植物资源中多酚含量及抗氧化活性有显著影响,但是关于提取溶剂对青稞中多酚含量及抗氧化活性影响的报道较少。申迎宾等[4]研究提取溶剂对青稞提取物总酚、黄酮含量及其抗氧化活性的影响,忽略了提取溶剂对结合酚的影响;徐菲等[18]研究青稞结合酚的提取优化工艺,但其以青稞麸皮为原料,未考虑溶剂对青稞全谷物中结合酚的影响,且鲜见不同溶剂提取对青稞不同形态多酚组成影响的深入报道。因此,本研究以4 个不同品种青稞为原料,系统研究不同提取溶剂对青稞游离酚及结合酚组成与抗氧化活性的影响。旨在建立适于青稞全谷物游离酚和结合酚提取的方法,为青稞中多酚类物质及功能性全谷物食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
青稞品种:13YN-5、946、瓦蓝、昆仑15号,均由青海省农林科学院作物育种栽培研究所青稞研究室提供。样品收获后脱粒,室温晾干,去除颗粒石子。用万能粉碎机将青稞种子粉碎,过60 目筛得青稞全谷物粉。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、三吡啶三吖嗪(tripyridyltriazine,TPTZ)、水溶性VE(Trolox)、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 美国Sigma公司;没食子酸、根皮酚、原儿茶酸、绿原酸、表儿茶素、2,4-二羟基苯甲酸、香草酸、丁香酸、p-香豆酸、阿魏酸、水杨酸、苯甲酸、藜芦酸、邻香豆酸、芦丁、柚皮苷、橙皮苷、杨梅素、槲皮素、柚皮素、山柰酚标准品(纯度≥98.0%) 上海源叶生物科技有限公司;福林-酚试剂(优级纯) 北京索莱宝科技有限公司;丙酮、正己烷、甲醇、氢氧化钠、硫酸、乙酸乙酯、碳酸钠均为国产分析纯。
1.2 仪器与设备
Centrifuge 5430R离心机 德国艾本德公司;Retavapor R-215旋转蒸发仪 瑞士Büchi有限公司;N4S紫外-可见分光光度计 上海仪电分析仪器有限公司;雷磁PHS-3C型pH计 上海雷磁仪器厂;FW-100高速万能粉碎机 天津市泰斯特仪器有限公司;KQ-500DE型数控超声波清洗机 昆山市超声波仪器有限公司;600E-2487高效液相色谱仪 美国沃特世科技有限公司。
1.3 方法
1.3.1 青稞游离酚的提取
称取不同品种的青稞全粉1 g,分别加入25 mL 80%甲醇溶液、80%乙醇溶液、80%丙酮溶液及纯水,室温条件下500 W超声波处理30 min,离心(4 000 r/min,20 min),收集上清液,残渣用同样方法提取2 次,合并3 次上清液,45 ℃减压旋转蒸干,沉淀物用甲醇定容至10 mL,0.45 μm有机膜过滤,得青稞游离酚类物质提取液,-20 ℃避光保存[19]。
1.3.2 青稞结合酚的提取
1.3.2.1 碱法
向提取过游离酚的残渣(1 g)中加入20 mL正己烷,2 000 r/min离心10 min,弃去上清液,向沉淀物中加入20 mL 2 mol/L NaOH溶液,充入氮气密封后在室温条件下振荡1 h。所得水解液用浓HCl溶液调节pH值至1,再用20 mL乙酸乙酯萃取5 次,离心(3 000 r/min,5 min),合并乙酸乙酯萃取相,45 ℃旋转蒸发至干,残余物用甲醇定容至10 mL,0.45 μm有机膜过滤,得青稞结合酚类物质提取液,-20 ℃避光保存[20]。
1.3.2.2 酸法
向提取过游离酚的残渣(1 g)中加入20 mL正己烷,振荡后离心(2 000 r/min,5 min)弃去上清液,向沉淀物中加入15 mL 10%甲醇-硫酸溶液,70 ℃水浴1 h。用20 mL乙酸乙酯萃取5 次,离心(2 000 r/min,5 min),合并乙酸乙酯萃取相,45 ℃旋转蒸发至干,残余物用甲醇定容至10 mL,0.45 μm有机膜过滤,得青稞结合酚类物质提取液,-20 ℃避光保存[19-21]。
1.3.3 青稞酚类物质含量测定
1.3.3.1 青稞提取物中酚含量的测定
采用福林-酚测定法[18,21]。吸取样品提取液125 μL于试管中,再加入500 μL蒸馏水和125 μL福林-酚试剂,摇匀,反应6 min后加入1.25 mL 7% Na2CO3溶液,再加入1 mL蒸馏水,室温条件下避光放置1.5 h后,以甲醇代替样品提取液为空白调零,在波长760 nm处测定吸光度,重复3 次。配制不同浓度梯度的没食子酸标准品制作标准曲线。总酚含量以每100 g提取物(干基)中没食子酸当量计(mg/100 g)。
1.3.3.2 青稞提取物中黄酮含量的测定
吸取100 μL样品提取液于试管中,加入5% NaNO2溶液200 μL,摇匀,6 min后加入10% Al(NO3)3溶液200 μL,摇匀,6 min后再加入4% NaOH溶液2 mL,室温避光放置15 min后,以甲醇代替样品提取液为空白调零,在波长510 nm处测定吸光度,重复3 次。配制不同溶度梯度的儿茶素标准品制作标准曲线。总黄酮含量以每100 g提取物(干基)中儿茶素当量计(mg/100 g)[18,21]。
1.3.4 高效液相色谱定量分析方法
采用高效液相色谱法对不同方法提取的青稞游离酚与结合酚提取液进行分析[11]。色谱条件:C18制备色谱柱(250 mm×4.6 mm,5 μm);流动相A为0.1%冰醋酸,流动相B为含0.1%冰醋酸的乙腈溶剂;梯度洗脱:0 min,8% B,92% A;2 min,10% B,90% A;27 min,30% B,70% A;50 min,90% B,10% A;52~56 min,100% B;56~60 min,8% B,92% A。流速0.8 mL/min;紫外检测波长280 nm;进样量20 μL;运行时间60 min。
通过与标准品保留时间比较,确定色谱峰所属化合物种类,通过峰面积计算化合物含量,结果以干基表示(µg/g)。
1.3.5 青稞酚类物质抗氧化活性测定
1.3.5.1 清除DPPH自由基能力测定
吸取样品提取液1 mL于试管中,再加入4.5 mL 0.1 mmol/L DPPH-甲醇溶液,充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在波长517 nm处测定吸光度,重复3 次。以Trolox浓度为横坐标,吸光度为纵坐标绘制标准曲线,回归方程为Y=-0.004 2X+0.916 3(0~140 μmol/L,R2=0.992 8)。根据标准曲线计算DPPH自由基清除能力,以每100 g提取物(干基)中Trolox当量计(μmol/100 g)[20-21]。
1.3.5.2 铁离子还原能力(ferric ion reducing antioxidant power,FRAP)测定
FRAP工作液的配制:300 mmol/L pH 3.6的醋酸钠缓冲液(3.076 2 g C2H3NaO2加20 mL C2H4O2,用蒸馏水定容至250 mL)、10 mmol/L TPTZ溶液(0.156 2 g TPTZ用40 mmol/L盐酸溶液定容至100 mL)和20 mmol/L FeCl3溶液,按照体积比10∶1∶1的比例混合,于37 ℃水浴锅中预热备用。
测定方法:吸取样品提取液50 µL于试管中,再加入4.5 mL FRAP工作液,充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在波长593 nm处测定吸光度,重复3 次。以Trolox作为标准品绘制标准曲线,得回归方程Y=0.007 2X-0.001 2(0~300 μmol/L,R2=0.999 2),其中,Y为吸光度,X为Trolox浓度(μmol/L)。根据标准曲线计算出样品提取液的FRAP,以每100 g提取物(干基)中Trolox当量计(μmol/100 g)[21]。
1.3.5.3 ABTS+·清除能力测定
ABTS工作液的配制:将5 mL 7 mmol/L ABTS溶液和88 μL 140 mmol/L过硫酸钾溶液混合,室温避光条件下静置12~16 h,得ABTS储备液。将此储备液按适当比例(1∶100,V/V)与无水甲醇混合,要求其在波长734 nm处的吸光度达到0.7±0.02,得到ABTS工作液,备用。
测定方法:吸取样品提取液200 μL于试管中,再加入4 mL ABTS工作液,充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在波长734 nm处测定吸光度,重复3 次。以Trolox浓度为横坐标,波长734 nm处测定的吸光度为纵坐标绘制标准曲线,回归方程为Y=-0.001X+0.624 2(0~300 μmol/L,R2=0.990 7)。根据标准曲线计算出样品提取液清除ABTS+·能力,以每100 g提取物(干基)中Trolox当量计(μmol/100 g)[21]。
1.4 数据处理
每个样品每个指标重复测定3 次,所有结果以 ±s表示。不同溶剂提取青稞游离酚与结合酚结果比较用单因素方差分析,SPSS 21.0软件进行SNK-q检验。抗氧化能力比较采用单因素方差分析,DPS 7.05软件进行最小显著差异法检验,P<0.05,差异显著。
2 结果与分析
2.1 提取溶剂对青稞中不同形态多酚含量的影响
2.1.1 提取溶剂对青稞中游离态多酚含量的影响
如表1所示,参试青稞品种在80%丙酮溶液提取物中游离酚(139.79~235.96 mg/100 g)含量最高,纯水提取含量最低,80%甲醇溶液与80%乙醇溶液提取对参试青稞游离酚含量的影响无显著差异(P<0.05),但存在品种间的差异;参试青稞品种的游离黄酮含量在80%丙酮溶液提取物中最高(9.88~15.52 mg/100 g),其次为80%乙醇溶液提取物和80%甲醇溶液提取物,纯水提取物中含量最低。说明不同溶剂对青稞不同形态多酚的提取具有选择性,且酚酸和黄酮的含量受到溶剂的极性和物质在溶剂中的溶解度的影响。因此选择80%丙酮溶液为青稞中游离酚类化合物的提取溶剂。
表1 提取溶剂对青稞提取物游离酚、黄酮含量的影响
Table 1 Contents of free phenolics and flavonoids in different solvent extracts from hulless barley mg/100 g

注:同一品种同指标不同字母表示差异显著(P<0.05)。
品种 提取溶剂 游离酚含量 游离黄酮含量13YN-5 80%丙酮溶液 235.96±0.03a9.88±0.01b80%甲醇溶液 66.47±1.57b6.65±0.04c80%乙醇溶液 65.98±0.82b8.06±0.07a纯水 43.69±0.93c1.98±0.11d946 80%丙酮溶液 181.94±0.98a15.52±0.36a80%甲醇溶液 106.80±0.85b8.71±0.00c80%乙醇溶液 109.98±0.01b10.23±0.00b纯水 40.72±0.91c1.32±0.04d瓦蓝80%丙酮溶液 139.79±1.10a12.62±0.15a80%甲醇溶液 88.37±0.45b6.87±0.13c80%乙醇溶液 88.54±0.49b8.78±0.02b纯水 9.43±0.30c0.73±0.01d80%丙酮溶液 193.44±1.10a14.87±0.44a80%甲醇溶液 88.27±1.22b9.52±0.03b80%乙醇溶液 91.29±0.91b9.38±0.04b纯水 58.02±0.01c0.92±0.00c昆仑15
2.1.2 溶剂提取对青稞中结合态多酚含量的影响
表2 水解方法对青稞提取物结合酚、黄酮含量的影响
Table 2 Effect of hydrolysis methods on contents of bound phenolics and flavonoids in hulless barley extract mg/100 g

注:同行不同字母表示差异显著(P<0.05)。表4、5同。
指标 品种 碱法 酸法结合酚含量13YN-5 69.15±0.01b172.97±1.12a946 98.9±0.95b187.74±1.25a瓦蓝 71.62±0.53b219.26±0.79a昆仑15号 95.14±0.35b199.85±0.56a13YN-5 8.48±0.21b10.73±0.07a946 8.44±0.03b16.06±0.29a瓦蓝 7.89±0.08b23.27±0.15a昆仑15号 7.42±0.02b17.34±1.29a结合黄酮含量
如表2所示,酸法提取青稞中结合酚(172.97~219.26 mg/100 g)、结合黄酮含量(10.73~23.27 mg/100 g)均显著(P<0.05)高于碱法提取液,分别是碱法提取液中含量的1.9~3.1 倍和1.3~2.9 倍。
当前,碱水解法被广泛应用于水解植物材料中的结合酚[20,22-25],然而本研究发现酸法水解青稞中的结合酚,其总酚、总黄酮含量均显著高于碱法(P<0.05)。有研究报道表明,酸法水解的苹果[26]、桃子[26]、荔枝果肉[15]的结合酚含量较碱法高。因为酸法水解过程采用的高温更有利于释放出被包埋在核内或偶联至细胞壁膳食纤维或蛋白质上的结合酚类化合物[26-27]。因此,酸水解法较碱水解法更适于提取青稞籽粒中的结合酚和结合黄酮化合物。
表3 青稞游离酚类化合物的组成及含量
Table 3 Free phenolic composition and content of hulless barleyµg/g

注:同一品种同行不同字母表示差异显著(P<0.05);ND.未检出。下表同。
品种 13YN-5 946 瓦蓝 昆仑15号80%丙酮 80%甲醇 80%乙醇 纯水 80%丙酮 80%甲醇 80%乙醇 纯水 80%丙酮 80%甲醇 80%乙醇 纯水 80%丙酮 80%甲醇 80%乙醇 纯水酚酸根皮酚 14.88±0.09a6.35±0.53bND ND 9.56 ±0.14a9.12±0.10bND ND 34.11±0.09aND ND ND ND ND ND ND没食子酸 ND ND ND ND 17.95±0.20aND ND ND ND ND ND ND ND ND ND ND原儿茶酸 109.30±0.35aND ND 48.60±0.05b14.28±0.05bND ND 15.98±0.21a39.91±0.04aND ND ND 18.31±0.03aND ND ND绿原酸 17.26±0.02bND 22.27±0.06aND 44.34±0.07a9.44±0.14c39.30±0.05bND 31.28±0.26c33.98±0.02b35.10±0.03a29.79±0.04d40.85± 0.06a41.42± 0.62a38.14±1.03bND 2,4-二羟基苯甲酸 ND 19.88±0.41aND ND 5.73±0.06aND ND ND ND ND ND ND ND ND ND ND香草酸 10.29±0.50b13.38±0.27a11.79±0.17b9.03±0.08c6.17±0.08c15.45±0.05a8.69±0.14b6.07±0.05c7.44±0.06aND ND ND ND ND ND 5.70±0.68a丁香酸 4.45±0.08aND ND ND ND 6.58±0.08aND ND ND 3.97±0.01b4.32±0.09aND ND ND ND ND p-香豆酸 5.45±0.06b17.08±0.28aND ND 5.58±0.11c24.19±0.17a6.24±0.03b5.71±0.09c13.72±0.10aND 5.53±0.06bND ND 12.18± 0.11aND ND阿魏酸 9.67±0.40a2.86±0.23c4.22±0.06b4.01±0.08bND ND 2.75±0.03b4.02±0.10a8.10±0.03a2.97±0.27b3.04±0.06bND ND ND ND ND水杨酸 8.51±0.36b5.37±0.26c4.17±0.06d11.77±0.02a4.70±0.01bND 4.25±0.04c26.24±0.04a8.37±0.07a3.98±0.01b3.89±0.09bND 7.73±0.06a3.99±0.15c3.79±0.16c6.27±0.50b苯甲酸 124.70±0.50a74.72±0.51b63.62±0.03c28.82±0.09d9.01±0.1a6.24±0.06c8.56±0.09bND ND ND ND 18.77±0.11aND ND ND ND邻香豆酸 ND 9.01±0.25a9.02±0.02a8.71±0.06a10.22±0.07bc16.71±0.33a10.83±0.10b10.00±0.08cND 8.69±0.11b8.96±0.04a7.63±0.08cND ND ND 7.88±0.34a藜芦酸 23.27±0.19a10.96±0.43bc11.16±0.03b10.26±0.07c9.65±0.12b10.28±0.11a5.57±0.02c9.58±0.07b10.21±0.16a9.24 ±0.15b9.35±0.08bND 17.98±0.04a9.32 ±0.09b9.26±0.50bND总酚酸 371.19±1.06a159.60±3.83b126.25±0.14c121.19±0.34c137.19±0.59a98.02±1.21b86.19±0.41c77.60±0.55d153.14±0.16a62.82±0.42c70.19±0.28b56.19±0.15d84.88±0.17a66.91±0.26b51.20±0.91c19.84±1.53d黄酮儿茶素 49.64±0.45a25.93±0.65b16.56±0.05d24.43±0.08c42.97±0.13b68.42±0.13a40.53±0.16c13.98±0.20dND 19.28±0.13b22.54±0.15aND 56.93± 0.04a40.41± 0.20c41.34±0.46bND柚皮苷 7.30±0.21a2.88±0.29c4.29 ±0.05bND 4.13±0.08c3.97±0.03c6.32±0.01a4.24±0.08b5.37±0.08a4.41±0.04c4.66 ±0.07bND ND ND ND ND橙皮苷 7.20±0.28a3.87±0.25b2.45 ±0.04c3.47±0.13b2.71±0.09aND ND 2.27±0.05b18.22±0.08aND 2.60±0.04c3.20±0.17bND ND ND ND杨梅素 ND ND ND 3.29±0.13aND 4.56±0.06b12.63±0.10aND ND ND ND ND ND ND ND ND槲皮素 ND ND ND ND 12.49±0.09a11.99±0.08b9.78±0.07cND 70.03±0.05aND ND ND ND ND ND ND柚皮素 14.68±0.41a12.90±0.32b12.46±0.09b7.18±0.08c4.66±0.46b3.14±0.09c7.39±0.10a3.43±0.01c14.49±0.03a3.41±0.08b3.15±0.04cND 6.16±0.02a3.11 ±0.09b3.11 ±0.62b3.27±0.98b山柰酚 ND 7.30±0.21b7.09±0.02b7.06±0.04b7.15±0.09b13.12±0.07aND ND ND 6.99±0.05b7.31±0.08aND 14.07±0.09a7.04 ±0.06b7.16±0.64bND芦丁 14.24±0.67a12.66±0.39b9.24±0.10c3.90±0.08d7.78±0.03bND 8.59±0.03aND 7.06±0.08c8.29±0.12b9.84±0.05aND 16.55±0.11a8.25 ±0.05b7.59±0.83cND总黄酮 93.06±1.58a65.54±1.47b52.09±0.02c49.32±0.12d81.9±0.61b105.20±0.14c85.24±0.06a23.92±0.12d115.16±0.32a42.39±0.04c50.10±0.04b3.20±0.17d93.71±0.22a58.80±0.07b59.20±2.08b3.27±0.98c总酚类化合物 464.25±2.64a225.14±5.30b178.34±0.16d170.51±0.46c219.08±1.21a203.22±1.35b171.43±0.47c101.52±0.43d268.30±0.47a105.22±0.46c120.29±0.33b59.39±0.32d178.58±0.39a125.72±0.33b110.40±0.17c23.11±2.51d
2.2 提取溶剂对青稞中不同形态多酚组成及含量的影响
2.2.1 提取溶剂对青稞中游离酚类化合物组成及含量的影响
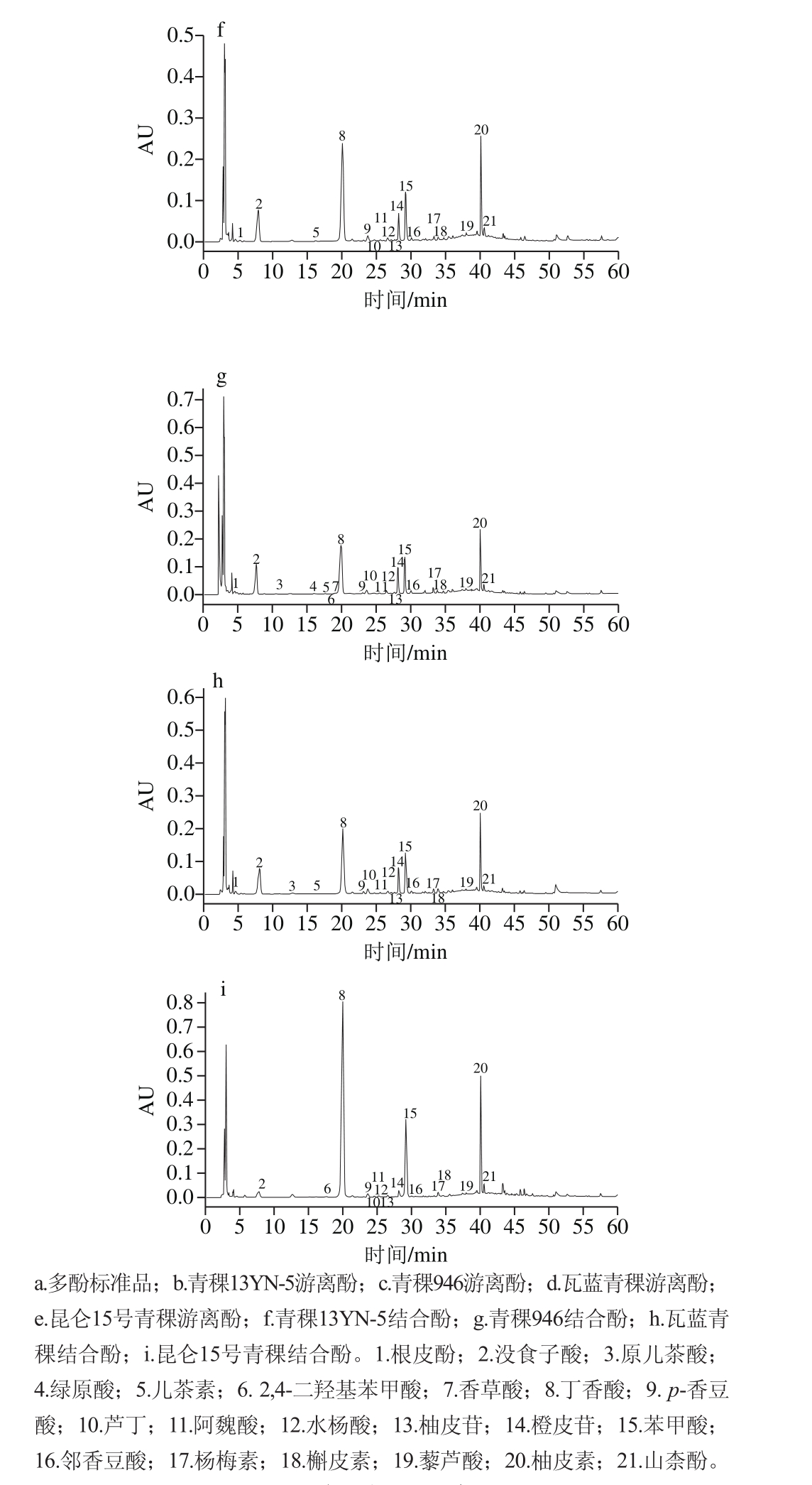
不同溶剂提取的不同品种青稞中游离酚、黄酮的组成及含量如图1、表3所示。由表3可知,参试青稞的80%丙酮溶液提取物中检测到酚类物质的组成种类最多为8~18 种,其次为80%甲醇溶液提取物(8~15 种)、80%乙醇溶液提取物(7~13 种),最后为纯水提取物(4~13 种),说明有色青稞具有更为丰富的酚类化合物组成,与前人报道[28-29]一致。且参试青稞的80%丙酮溶液提取物中总酚类化合物含量最高,显著高于(P<0.05)其他提取溶剂提取液,分别是80%甲醇溶液、80%乙醇溶液与纯水提取物的1.08~2.55、1.28~2.60 倍和2.16~4.52 倍。
利用高效液相色谱检测到4 种溶剂提取的参试青稞13 种酚酸和8 种黄酮。由表4可知,根皮酚、2,4-二羟基苯甲酸仅在80%丙酮溶液提取物及80%甲醇溶液提取物中检出,没食子酸仅在80%丙酮溶液提取物中检出,杨梅素在80%丙酮溶液提取物中未检出,丁香酸和槲皮素在纯水提取物中未检出。儿茶素在80%丙酮溶液、80%甲醇溶液及80%乙醇溶液中平均含量分别为37.39、38.51、30.24 µg/g,提示这3 种溶剂体系对儿茶素的提取能力相当,分别为水提物的3.9、4.0、3.2 倍;绿原酸在80%丙酮溶液及80%乙醇溶液提取物中含量无显著差异(P>0.05),揭示这2 种溶剂体系对绿原酸的提取能力相当。苯甲酸、藜芦酸、柚皮素、橙皮苷、槲皮素、芦丁在80%丙酮溶液提取物中含量显著高于其他溶剂(P<0.05),说明80%丙酮溶液更容易富集青稞中黄烷酮、黄烷醇类物质;2,4-二羟基苯甲酸、香草酸、丁香酸、p-香豆酸与山柰酚含量在80%甲醇溶液提取物中显著高于其他溶剂(P<0.05),说明80%甲醇溶液提取更容易富集羟基苯甲酸类、羟基肉桂酸类及黄酮醇类物质;杨梅素在80%乙醇溶液提取物显著高于其他溶剂(P<0.05),而纯水中的水杨酸平均含量(11.07 µg/g)显著高于其他溶剂(P<0.05)。不同提取溶剂对不同种类单体酚的富集及提取效率不同,80%丙酮溶液能更多地提取出不同品种青稞中的游离酚类化合物,是一种高效提取青稞中游离酚类化合物的溶剂。该结果与前人报道[19-20]的丙酮溶液提取植物中游离态多酚的能力强于甲醇溶液与乙醇溶液相一致。此外,研究发现与其他酚类化合物相比,阿魏酸、邻香豆酸、香草酸、丁香酸、水杨酸、柚皮苷、橙皮苷、杨梅素在参试青稞游离态提取物中具有较低的含量。
表4 溶剂提取4 种青稞游离酚的平均含量
Table 4 Average contents of free phenolics extracted from 4 varieties of hulless barley with different solvents µg/g
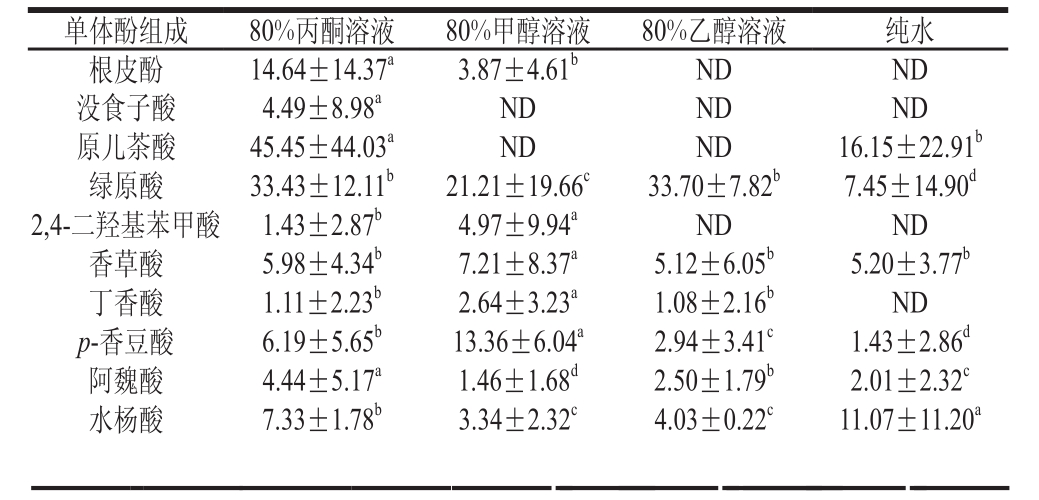
单体酚组成 80%丙酮溶液 80%甲醇溶液 80%乙醇溶液 纯水根皮酚 14.64±14.37a3.87±4.61bND ND没食子酸 4.49±8.98aND ND ND原儿茶酸 45.45±44.03aND ND 16.15±22.91b绿原酸 33.43±12.11b21.21±19.66c33.70±7.82b7.45±14.90d2,4-二羟基苯甲酸 1.43±2.87b4.97±9.94aND ND香草酸 5.98±4.34b7.21±8.37a5.12±6.05b5.20±3.77b丁香酸 1.11±2.23b2.64±3.23a1.08±2.16bND p-香豆酸 6.19±5.65b13.36±6.04a2.94±3.41c1.43±2.86d阿魏酸 4.44±5.17a1.46±1.68d2.50±1.79b2.01±2.32c水杨酸 7.33±1.78b3.34±2.32c4.03±0.22c11.07±11.20a
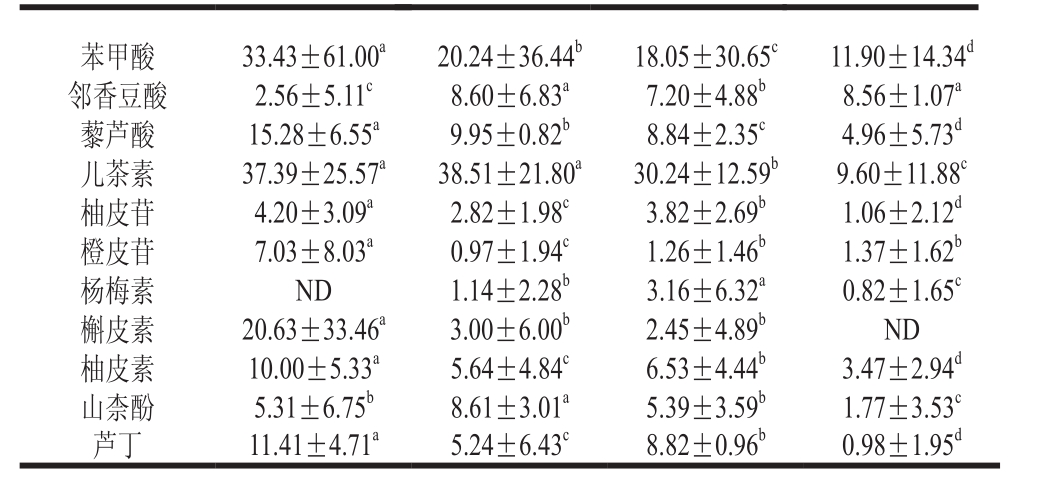
苯甲酸 33.43±61.00a20.24±36.44b18.05±30.65c11.90±14.34d邻香豆酸 2.56±5.11c8.60±6.83a7.20±4.88b8.56±1.07a藜芦酸 15.28±6.55a9.95±0.82b8.84±2.35c4.96±5.73d儿茶素 37.39±25.57a38.51±21.80a30.24±12.59b9.60±11.88c柚皮苷 4.20±3.09a2.82±1.98c3.82±2.69b1.06±2.12d橙皮苷 7.03±8.03a0.97±1.94c1.26±1.46b1.37±1.62b杨梅素 ND 1.14±2.28b3.16±6.32a0.82±1.65c槲皮素 20.63±33.46a3.00±6.00b2.45±4.89bND柚皮素 10.00±5.33a5.64±4.84c6.53±4.44b3.47±2.94d山柰酚 5.31±6.75b8.61±3.01a5.39±3.59b1.77±3.53c芦丁 11.41±4.71a5.24±6.43c8.82±0.96b0.98±1.95d
2.2.2 提取方法对青稞结合酚类化合物组成及含量的影响
表5 青稞结合酚的组成及含量
Table 5 Bound phenolic composition and content of hulless barleyµg/g

酚酸根皮酚 ND 25.10±0.05aND 13.27±0.06aND 21.42±0.04aND ND没食子酸 ND 906.93±2.15aND 1 057.71±9.96aND 1 004.61±4.22aND 333.65±1.95a原儿茶酸 ND ND ND 20.32±0.06aND 15.70±0.05aND ND绿原酸 ND ND ND ND ND ND ND ND 2,4-二羟基苯甲酸 ND ND 4.04±0.06b9.58±0.03a4.12±0.02aND 4.05±0.03b14.58±0.10a香草酸 4.66±0.15aND 6.47±0.09b8.95±0.32aND ND 31.24±0.09aND丁香酸 9.01±0.09b364.95±4.19a10.87±0.25a9.78±0.33b23.22±0.05b297.11±1.48aND 1 169.01±2.90ap-香豆酸 5.00±0.02b122.46±0.76a9.11±0.07b123.07±1.38a10.14±0.03b133.94±1.35aND 141.00±0.02a阿魏酸 12.02±0.07a6.55±0.09b4.11±0.06b7.82±0.09a21.16±0.10a6.64±0.07b4.11±0.06b10.80±0.03a水杨酸 422.38±1.46a16.39±0.10b490.15±1.51a8.11±0.08b703.91±2.17a16.33±0.07b461.34±4.32a14.83±0.03b苯甲酸 34.80±0.78b383.53±0.58a36.91±0.04b378.21±1.33a39.24±0.07b432.17±1.47a36.02±0.64b1 408.98±4.85a邻香豆酸 8.66±0.08b16.18 ±0.12a9.62±0.05b16.87±0.09a9.20±0.03b18.30±0.04a11.04±0.07b22.67±0.09a藜芦酸 32.35±0.82b120.74±1.35a41.71±0.06b115.01±3.60a54.86 ±0.59b94.04±0.06a47.38±0.80b80.55±0.65a总酚酸 528.88±1.73b1 962.83±2.83a613.00±1.97b1 768.69±6.54a811.86±1.72b2 040.26±1.82a595.19±5.93b3 196.06±8.79a黄酮儿茶素 14.16±0.12b29.83±0.03aND 44.02±0.70a27.50±0.04b29.26±0.67a18.03±0.05aND柚皮苷 5.56±0.06b9.65±0.01a221.60±3.57a7.30±0.04b6.61±0.04b16.47±0.01a263.07± 3.50a9.93± 0.01b橙皮苷 137.80±5.03b168.87±3.54a9.75±0.01b239.50±2.09a10.25±0.05b196.98±2.21a10.31 ±0.05b80.66±1.32a杨梅素 3.46±0.01b8.15±0.01a3.58±0.05b11.20±0.08a4.16±0.02b8.76±0.05a3.99±0.08b7.04 ±0.04a槲皮素 33.24±0.68a32.30±0.67b31.26±0.17b145.60 ±2.08a54.83±0.88a29.79±0.75b24.51±0.18b38.51±0.06a柚皮素 7.95±0.06b42.40±0.71a15.35±0.03b42.08±0.75a17.67±0.08b33.76±0.03a12.27±0.18b47.28±0.84a山柰酚 9.00±0.03b35.56±0.29a16.58±0.61b35.96±0.83a11.32±0.02b32.59±0.61a10.19±0.22b26.02±0.64a芦丁 ND 12.74±0.01a126.50±2.75a14.97±0.08bND 12.11±0.11a216.25±4.20a37.69±0.20b总黄酮 197.02±4.51b309.66±3.29a424.63±0.32b496.61±3.89a104.85±0.99b330.47±2.55a540.60±7.58a247.14±0.46b总酚类化合物 740.05±6.24b2 302.32±0.46a1 037.63±2.28b2 309.33±2.65a998.21±2.71b2 399.99±0.73a1 153.82±1.65b3 443.19±8.33a
由表5可知,参试青稞的酸法水解物中结合总酚化合物含量为2 302.32~3 443.19 µg/g,是碱法的2.23~3.11 倍。根皮酚、没食子酸、原儿茶酸、绿原酸在参试青稞的碱法提取物中均未检出,绿原酸在所有参试青稞的酸法提取物中也未检出。参试4 种青稞中水杨酸在碱法提取物中的含量为422.38~703.91 µg/g,是酸法提取物的25.77~60.44 倍。13YN-5和瓦蓝青稞中的阿魏酸,946、昆仑15号青稞中的芦丁,946中的柚皮苷在碱法中显著高于酸法(P<0.05),其余大部分结合态单体酚在酸法水解物中的含量均显著高于碱法(P<0.05)。由此可见酸法更有利于释放出更多酚类物质,是水解青稞结合酚的有效方法。单体酚含量分析发现,水杨酸是碱法水解参试青稞的主要结合酚种类,没食子酸、p-香豆酸、丁香酸、苯甲酸、藜芦酸、橙皮苷是酸法水解青稞的主要结合酚种类。所有酚类化合物中,根皮酚、2,4-二羟基苯甲酸、原儿茶素、邻香豆酸、阿魏酸、杨梅素、柚皮素、山柰酚在参试青稞的碱法及酸法提取物中均具有相对较少的含量。
2.3 青稞不同形态多酚抗氧化活性比较
2.3.1 提取溶剂对青稞游离酚抗氧化活性的影响
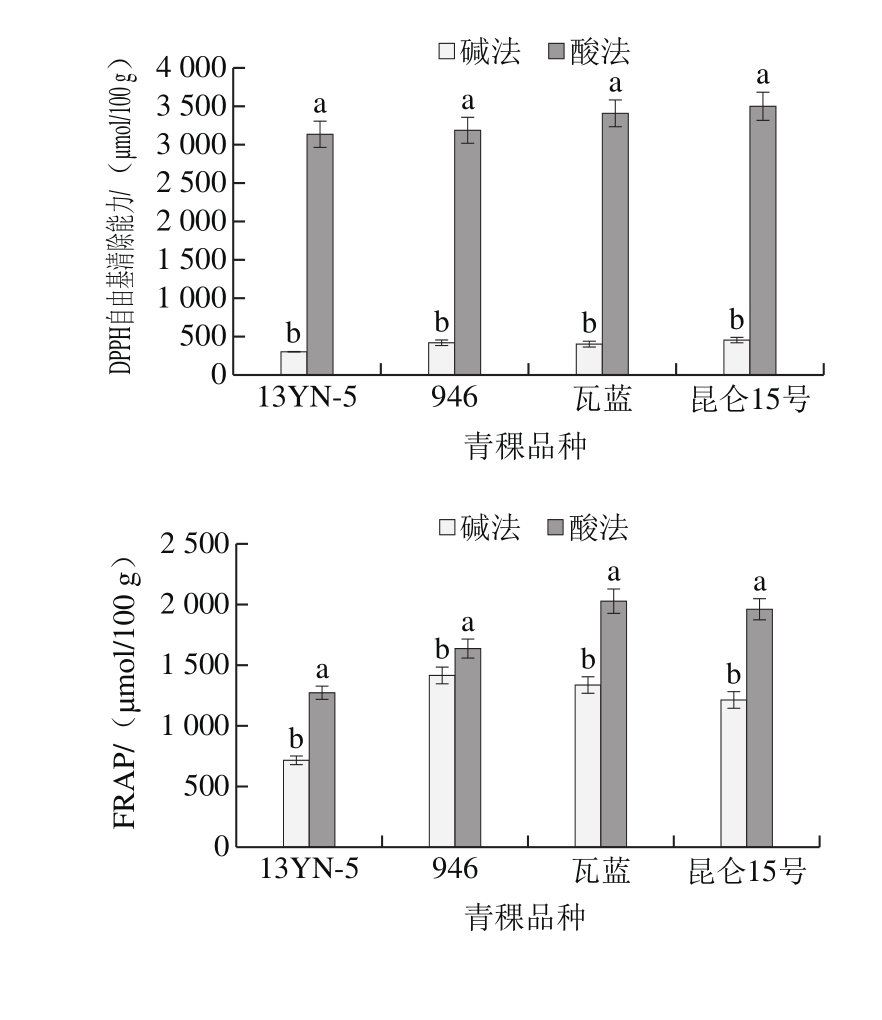
如图2所示,4 个青稞的80%丙酮溶液提取物DPPH自由基清除能力为852.56~1 484.18 μmol/100 g,其次为80%乙醇溶液提取物(266.15~603.19 μmol/100 g),80%甲醇溶液提取物(407.09~550.91 μmol/100 g),纯水提取物清除DPPH自由基的能力最弱(56.60~216.24 μmol/100 g);不同溶剂提取物的FRAP与清除DPPH自由基的规律一致,均为80%丙酮溶液提取物的抗氧化能力最强,显著高于其他溶剂(P<0.05),其次为80%乙醇溶液提取物,80%甲醇溶液提取物和纯水提取物。其中80%丙酮溶液提取物FRAP为1 250.55~2 041.16 μmol/100 g,清除ABTS+•能力为358.93~518.09 μmol/100 g。此结果与部分学者研究报道[19]的结果一致。
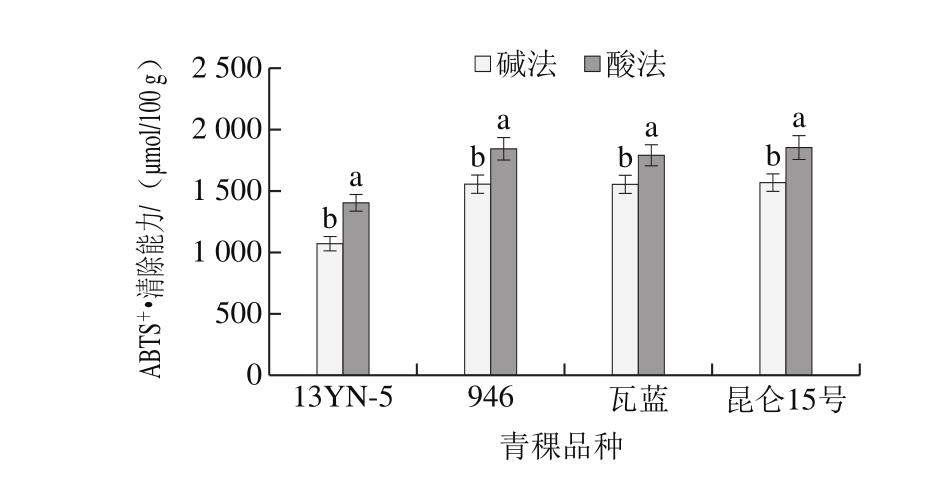
此外,同一溶剂提取(除水提外)的不同品种青稞清除DPPH自由基能力均表现出青稞946为最高,瓦蓝、昆仑15号次之,13YN-5最低;80%丙酮溶液和纯水提取4 个不同品种青稞游离酚的FRAP表现为13YN-5最高,瓦蓝青稞最低,80%甲醇溶液和80%乙醇溶液提取物的FRAP表现为昆仑15号最高,13YN-5最低。不同品种青稞的抗氧化活性在不同溶剂提取中的差异,一定程度上是不同品种青稞中酚类物质组成及含量差异所致。其中青稞946、瓦蓝、昆仑15号的80%丙酮溶液、80%甲醇溶液、80%乙醇溶液提取物清除ABTS+·能力溶剂间差异不显著(P>0.05),究其原因与3 种青稞在不同溶剂中的多酚组成及含量有关,青稞946的80%丙酮溶液、80%甲醇溶液和80%乙醇溶液中均检测到含量相当的槲皮素与柚皮苷,瓦蓝青稞在3 种溶剂中均检测到含量相当的绿原酸、藜芦酸和柚皮苷,昆仑15号中均检测到相当含量的绿原酸,因此可以初步推断绿原酸、槲皮素、藜芦酸、柚皮苷是不同溶剂提取物中清除ABTS+·能力的主要贡献者。以清除DPPH自由基、FRAP、清除ABTS+·能力为衡量指标,80%丙酮溶液更适合作为不同品种青稞中游离酚的提取溶剂,此结果与提取溶剂对青稞游离酚含量的影响结果相一致,说明多酚类化合物含量与天然植物提取物抗氧化活性有一定的相关性[30]。
2.3.2 碱法及酸法水解对青稞结合酚抗氧化活性的影响
如图3所示,酸法水解物抗氧化活性显著高于碱法(P<0.05)。酸法水解不同品种青稞13YN-5、946、瓦蓝、昆仑15号结合酚DPPH自由基清除能力、FRAP、ABTS+·清除能力分别为3 142.77~3 505.11、1 266.52~2 021.45、1 401.13~1 850.43 μmol/100 g,是碱法水解的7.6~10.3、1.2~1.8 倍和1.1~1.3 倍。这与酸法水解物含有丰富的酚类化合物有关。因此,以清除DPPH自由基能力、FRAP、清除ABTS+·能力为衡量指标,酸法水解更适合作为青稞中结合酚的提取溶剂。
3 讨 论
3.1 提取溶剂对青稞不同形态多酚提取效果及抗氧化活性的影响
由于不同植物的化学组成差异会导致不同植物中多酚的最适提取溶剂不同[12-13],因此选取合适的溶剂从植物材料中提取酚类物质是非常重要的,因为不同溶剂对不同酚类物质提取能力不同,因此其提取效率差异较大。本研究发现80%丙酮溶液较其他3 种溶剂具有较好的提取青稞全谷物中游离态总酚、总黄酮的能力,其提取液中含有较多的游离态单体多酚。此研究结果与Zhao Haifeng[19]、陆健[14]等的研究结果一致,其比较丙酮溶液、甲醇溶液、乙醇溶液及纯水提取不同品种皮大麦中总酚、总黄酮等酚类物质,发现丙酮溶液提取效果最好,且具有较强的DPPH自由基、ABTS+•、羟自由基、超氧阴离子自由基清除能力。然而申迎宾等[4]考察了水、60%乙醇溶液、60%甲醇溶液、60%丙酮溶液、60%乙醇溶液、100%甲醇、100%丙酮对不同品种青稞中总酚、总黄酮含量及抗氧化活性的影响,发现95%乙醇溶液和60%丙酮溶液更有利于青稞多酚的提取,且不同青稞品种中多酚含量及抗氧化活性对溶剂的选择具有差异,60%乙醇溶液的提取液清除DPPH自由基能力最强,60%丙酮溶液提取液具有最强的ABTS+•清除能力。分析原因可能是一方面由于不同浓度溶剂的极性不同,另一方面实验所选青稞的生长环境及其品种的基因型影响其所含酚类物质的含量,进而影响其抗氧化活性。因此,不同提取溶剂对青稞中不同酚类物质提取效率不同。
可食植物中天然存在的大部分多酚都是以游离或结合(与多糖或蛋白通过酯键和醚键)的形式存在[22],长期以来对谷物酚类化合物的研究多停留在游离酚层面,现在研究通过对谷物样品进行酸解、碱解、酶解等处理,可提取出其结合型酚类化合物,研究发现谷物中总酚含量与果蔬相当或更高[1,31],其中碱水解法被广泛应用于水解谷物等材料中的结合酚[20,32]。然而本研究发现酸法水解青稞全谷物中结合酚的总酚、总黄酮含量及抗氧化活性均显著高于碱法水解物。这与徐菲等[18]报道的酸法更有利于释放出青稞中的多酚类化合物的结果相一致。说明酸法相对于碱法具有更强的提取青稞中结合态多酚的效果。
3.2 提取溶剂对青稞不同形态多酚单体组成的影响
不同提取溶剂体系影响青稞全谷物中游离酚及结合酚的组成与含量。本研究中参试青稞的80%丙酮溶液提取物中检测到酚类物质的组成种类明显高于其他溶剂体系,且其提取液中总酚类化合物含量也最高,这与Zhao Haifeng等[19]报道的80%丙酮溶液提取的皮大麦中的总酚类物质含量最高的结果相一致,但是报道中只检测到9 个多酚单体化合物,儿茶素是皮大麦中主要的游离态多酚物质。而本研究在丙酮溶液提取物中检测到8~18 种多酚单体,明显高于其报道的皮大麦中的多酚种类及含量,绿原酸与儿茶素是本实验青稞中游离酚的主要单体物质,这与阿魏酸是大麦中主要的多酚物质的报道也不同[29]。因此,青稞作为青藏高原的裸大麦,其多酚组成及含量与皮大麦存在显著的差异。此外,已有报道比较了不同溶剂对荔枝果肉[20]、草莓[33]等提取物游离酚组成的影响,发现丙酮水提取物中酚类物质种类最多,含量也较其他溶剂高。因此,本实验中80%丙酮溶液是一种高效提取青稞中游离酚类化合物的溶剂。
本实验中青稞结合酚酸法提取液中检测到的单体酚类化合物种类(16~20)及含量明显高于碱法提取液。没食子酸、p-香豆酸、丁香酸、苯甲酸、藜芦酸、橙皮苷是酸法水解青稞的主要结合酚种类。Nordkvist等[34]报道了大麦中结合态多酚主要为阿魏酸与p-香豆酸,而本实验中阿魏酸在青稞结合态提取物中的含量甚微,但同样含有较高含量的p-香豆酸。这说明p-香豆酸是皮大麦和裸大麦中共同含有的酚酸,而阿魏酸在皮大麦与青稞中含量差异较大。此外,已有报道称荔枝果肉酸法水解的主要结合酚是表儿茶素和4-甲基儿茶酚[20],说明相同方法处理条件下的不同植物来源其结合酚种类不同。本实验中酸水解法较碱水解法有利于释放出更多酚类物质,但是酸法水解由于高温也会损失一些羟基酸[20]。
4 结 论
提取溶剂的极性对青稞中不同形态多酚含量和抗氧化活性有显著影响,且不同品种间存在差异。在4 种不同极性溶剂体系中,80%丙酮溶液提取青稞全谷物中游离态总酚、总黄酮含量最高,其抗氧化活性最强;酸水解法较碱水解法提取青稞中结合酚的提取效率高,抗氧化活性好。
不同溶剂对青稞中不同种类单体酚的富集及提取效果不同。80%丙酮溶液提取的青稞游离酚类物质种类最多,不同溶剂对青稞中多酚组成的类别具有选择性;酸法更有利于释放出更多酚类物质,是水解青稞结合酚的有效方法。
单体酚含量分析发现,绿原酸、苯甲酸、儿茶素、槲皮素、芦丁是80%丙酮溶液提取青稞的主要游离态多酚种类,没食子酸、p-香豆酸、丁香酸、苯甲酸、藜芦酸、橙皮苷、丁香酸是酸法水解青稞的主要结合酚种类。阿魏酸、邻香豆酸和杨梅素在青稞的游离态及结合态不同溶剂提取物中均具有相对较低的含量。选择合适的提取溶剂对于评价青稞样品的多酚含量和抗氧化能力非常重要,该结果为进一步研究青稞全谷物中酚类物质提供了一定的理论基础,对青稞中活性成分的开发与利用具有参考意义。
参考文献:
[1] LIU R H. Whole grain phytochemicals and health[J]. Journal of Cereal Science, 2007, 46(3): 207-219. DOI:10.1016/j.jcs.2007.06.010.
[2] KRISTENSEN M, TOUBRO S, JENSEN M G, et al. Wholegrain compared with refined wheat decreases the percentage of body fat following a 12-week, energy restricted dietary intervention in postmenopausal women[J]. Journal of Nutrition, 2012, 142(4): 710-716. DOI10.3945/jn.111.142315.
[3] BORNEO R, LEON A E. Whole grain cereals: function components and health benefits[J]. Food & Function, 2013, 3(2): 110-119.DOI:10.1039/c1fo10165j.
[4] 申迎宾, 张友维, 黄才欢, 等. 提取溶剂对青稞提取物总酚、黄酮含量及其抗氧化活性的影响[J]. 食品与机械, 2016, 32(11): 133-136.DOI:10.13652/j.issn.1003-5788.2016.11.030.
[5] DYKES L, ROONEY L W. Phenolic compounds in cereal grains and their health benefits[J]. Cereal Foods World, 2007, 52(3): 105-111.DOI:10.1094/CFW-52-3-0105.
[6] OKARTER N, LIU R H. Health benefits of whole grain phytochemicals[J]. Critical Reviews in Food Science and Nutrition,2010, 50(3): 193-208. DOI:10.1080/10408390802248734.
[7] 郭本兆. 青海经济植物志[M]. 西宁: 青海人民出版社, 1987: 701.
[8] LIU Z F, YAO Z J, YU C Q, et al. Assessing crop water demand and deficit for the growth of spring highland barley in Tibet China[J]. Journal of Integrative Agriculture, 2013, 12(3): 541-551. DOI:10.1016/S2095-3119(13)60255-5.
[9] GONG L X, JIN C, WU L J, et al. Tibetan hullless barley (Hordeum vulgare L.) as a potential source of antioxidants[J]. Cereal Chemistry,2012, 89(6): 290-295. DOI:10.1094/CCHEM-03-12-0029-R.
[10] BENDELOW V M, LABERGE D E. Relationship among barley malt and beer phenolics[J]. Journal of the American Society of Brewing Chemists, 1979, 37: 89-90. DOI:10.1094/ASBCJ-37-0089.
[11] KIM M J, HYUN J N, KIM J A, et al. Relationship between phenolic compounds, anthocyanins content and antioxidant activity in colored barley germplasm[J]. Journal of Agricultural and Food Chemistry, 2007,55(12): 4802-4809. DOI:10.1021/jf0701943.
[12] PEREZ J J, TORRES J L. Analysis of nonextractable phenolic compounds in foods: the current state of the art[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 12713-12724. DOI:10.1021/jf203372w.
[13] KLEPACKA J, GUJSKA E, MICHALAK J. Phenolic compounds as cultivar and variety distinguishing factors in some plant products[J]. Plant Foods for Human Nutrition, 2011, 66: 64-69. DOI:10.1007/s11130-010-0205-1.
[14] 陆健, 樊伟, 孔维宝, 等. 大麦总多酚不同溶剂提取物对DPPH自由基清除能力的影响[J]. 食品与生物技术学报, 2008, 27(1): 57-61.
[15] SU D X, ZHANG R F, HOU F L, et al. Comparison of the free and bound henolic profiles and cellular antioxidant activities of litchi pulp extracts from different solvents[J]. BMC Complementary and Alternative Medicine, 2014, 14(1): 9.
[16] 涂宗财, 傅志丰, 王辉, 等. 红薯叶不同溶剂提取物抗氧化性研究及活性成分鉴定[J]. 2015, 36(17): 1-9. DOI:10.7506/spkx1002-6630-201517001.
[17] SINGH M, JHA A, KUMAR A, et al. Influence of the solvents on the extraction of major phenolic compounds (punicalagin, ellagic acid and gallic acid) and their antioxidant activities in pomegranate aril[J].Journal of Food Science and Technology, 2014, 51(9): 2070-2077.DOI:10.1007/s13197-014-1267-0.
[18] 徐菲, 杨希娟, 党斌, 等. 酸法提取青稞麸皮结合酚工艺优化[J]. 农业工程学报, 2016, 32(17): 301-308. DOI:10.11975/j.issn.1002-6819.2016.17.040.
[19] ZHAO H F, DONG J J, LU J, et al. Effects of extraction solvent mixtures on antioxidant activity evaluation and their extraction capacity and selectivity for free phenolic compounds in barley (Hordeum vulgare L.)[J].Journal of Agricultural and Food Chemistry, 2006, 54: 7277-7286.DOI:10.1021/jf061087w.
[20] 苏东晓. 荔枝果肉的分离鉴定既起到调节脂质代谢作用机制[D].武汉: 华中农业大学, 2014.
[21] 杨希娟, 党斌, 徐菲, 等. 不同粒色青稞酚类化合物含量与抗氧化活性的差异及评价[J]. 中国粮油学报, 2017, 32(9): 34-42.
[22] SUN J, CHU Y F, WU X, et al. Antioxidant and antiproliferative activities of common fruits[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7449-7454. DOI:10.1021/jf0207530.
[23] LIVANA-PATHIRANA C M, SHAHIDI F. Importance of insoluble bound phenolics to antioxidant properties of wheat[J]. Journal of Agricultural and Food Chemistry, 2006, 54(4): 1256-1264. DOI:10.1021/jf052556h.
[24] MADHUJITH T, SHAHIDI F. Antioxidant potential of barley as affected by alkaline hydrolysis and release of insoluble-bound phenolics[J]. Food Chemistry, 2009, 117(4): 615-620. DOI:10.1016/j.foodchem.2009.04.055.
[25] ZHANG R Q, ZENG Y, DENG M, et al. Phenolic profiles and antioxidant activity of litchi pulp of different cultivars cultivated in Southern China[J]. Food Chemistry, 2013, 136(3): 1169-1176.DOI:10.1016/j.foodchem.2012.09.085.
[26] ARRANZ S F, SAURACALIXTO S, SHAHA S, et al. High contents of nonextractable polyphenols in fruits suggest that polyphenol contents of plant foods have been underestimated[J]. Journal of Agricultural and Food Chemistry, 2009, 57(16): 7298-7303. DOI:10.1021/jf9016652.
[27] BONOLI M V, VERTARDO E, MARCONI F, et al. Antioxidant phenols in barley (Hordeum vulgare L.) flour: comparative spectrophotometric study among extraction methods of free and bound phenolic compounds[J]. Journal of Agricultural and Food Chemistry,2004, 52(16): 5195-5200. DOI:10.1021/jf040075c.
[28] BELLIDO G G, BETA T. Anthocyanin composition and oxygen radical scavenging capacity (ORAC) of milled and pearled purple, black, and common barley[J]. Journal of Agricultural and Food Chemistry, 2009,57(3): 1022-1028. DOI:10.1021/jf802846x.
[29] ABDEL-AAL E M, CHOO T M, DHILLON S, et al. Free and bound phenolic acids and total phenolics in black, blue, and yellow barley and their contribution to free radical scavenging capacity[J]. Cereal Chemistry, 2012, 89(4): 198-204. DOI:10.1094/CCHEM-10-11-0116.
[30] SOCHA R, JUSZCZAK L, PIETRZYK S, et al. Antioxidant activity and phenolic composition of herbhoneys[J]. Food Chemistry, 2009,113(2): 568-574. DOI:10.1016/j.foodchem.2008.08.029.
[31] 李富华, 郭晓晖, 夏春燕, 等. 全谷物酚类化合物抗氧化活性研究进展[J]. 食品科学, 2012, 33(13): 299-304.
[32] ADOM K K, LIU R H. Antioxidant activity of grains[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 6182-6187. DOI:10.1021/jf0205099.
[33] KAJDZANOSKA M, PETRESKA J, STEFOVA M. Comparison of different extraction solvent mixtures for characterization of phenolic compounds in strawberries[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 5272-5278. DOI:10.1021/jf2007826.
[34] NORDKVIST E, SALOMONSSON A C, ÅMAN P. Distribution of insoluble bound phenolic acids in barley grain[J]. Journal of the Science of Food & Agriculture, 1984, 35(6): 657-661.
Effect of Different Extraction Solvents on Phenolic Profiles and Antioxidant Activities of Hulless Barley
YANG Xijuan1,2, DANG Bin1,2, FAN Mingtao1,*
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China;2. Tibetan Plateau Key Laboratory of Agric-Product Processing in Qinghai, Qinghai University, Xining 810016, China)
Abstract:This study aimed to investigate the effects of solvents with different polarities on the compositions and contents of free and bound phenolics as well as antioxidant activities in hulless barley grains. In the present study, four different solvent mixtures were used to extract free phenolic compounds from 4 varieties of hulless barley. Alkaline and acidic hydrolysis methods were compared for the hydrolysis of bound phenolic compounds from hulless barley. The phenolic compositions of the free and bound fractions were identified by high performance liquid chromatography (HPLC). The antioxidant activities were determined by 1,1-diphenyl-2- picrylhydrazyl (DPPH) and 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate (ABTS)radical scavenging capacity and ferric ion reducing antioxidant power (FRAP) assays. The results showed that 80% aqueous acetone extracted the largest amount of total free phenolic compounds (139.79–235.96 mg/100 g) and total free flavonoids(9.88–15.52 mg/100 g) from hulless barley of the solvents tested. The acidic hydrolysis method released 1.9–3.1 and 1.3–2.9 times more bound phenolics and flavonoids than the alkaline method. Eight to eighteen phenolic compounds were detected in the aqueous acetone extract of hulless barley, and its phenolic content was significantly higher than three other extracts.Chlorogenic acid, benzoic acid, catechin, quercetin, and rutin were identified as main free phenolic compounds. The types and amounts of bound phenolic compounds released by the acid hydrolysis method were higher than those achieved by the alkaline hydrolysis method. Gallic acid, p-coumaric, syringic acid, benzoic acid, 3, 4-dimethoxybenzoic acid, and hesperidin were found to be main bound phenolic compounds. The 80% aqueous acetone extract showed the highest DPPH (852.56–1 484.18 μmol/100 g) and ABTS+· (358.93–518.09 μmol/100 g) scavenging capacity and the highest FRAP value(1 250.55–2 041.16 μmol/100 g) of the four extracts tested. The DPPH scavenging capacity, FRAP values and ABTS+·scavenging capacity of the bound phenolic compounds obtained by acid hydrolysis were 7.6–10.3, 1.2–1.8, 1.1–1.3 folds higher than those obtained using the alkaline hydrolysis method. The free and bound phenolic contents and profiles and antioxidant activities of the extracts were found to be dependent on the extraction solvent used. Conclusively, 80% aqueous acetone and the acid hydrolysis method were suitable for extraction of free and bound phenolic compounds from hulless barley.Hulless barley exhibited high antioxidant activity and could be a potential natural source of antioxidants.
Keywords:hulless barley; extraction solvents; phenolic composition; antioxidant activity
YANG Xijuan, DANG Bin, FAN Mingtao. Effect of different extraction solvents on phenolic profiles and antioxidant activities of hulless barley[J]. Food Science, 2018, 39(24): 239-248. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201824036. http://www.spkx.net.cn
杨希娟, 党斌, 樊明涛. 溶剂提取对青稞中不同形态多酚组成及抗氧化活性的影响[J]. 食品科学, 2018, 39(24): 239-248.DOI:10.7506/spkx1002-6630-201824036. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)24-0239-10
文献标志码:A
中图分类号:TQ210
DOI:10.7506/spkx1002-6630-201824036
*通信作者简介:樊明涛(1963—),男,教授,博士,研究方向为食品功能化学及生物技术。E-mail:fanmt@nwsuaf.edu.cn
第一作者简介:杨希娟(1980—),女,副研究员,博士研究生,研究方向为食品功能化学与营养。E-mail:156044169@qq.com
基金项目:青海省科技厅应用基础项目(2016-ZJ-711);青海省“高端创新人才千人计划”项目;青海省“135”高层次人才培养计划项目
收稿日期:2017-12-22