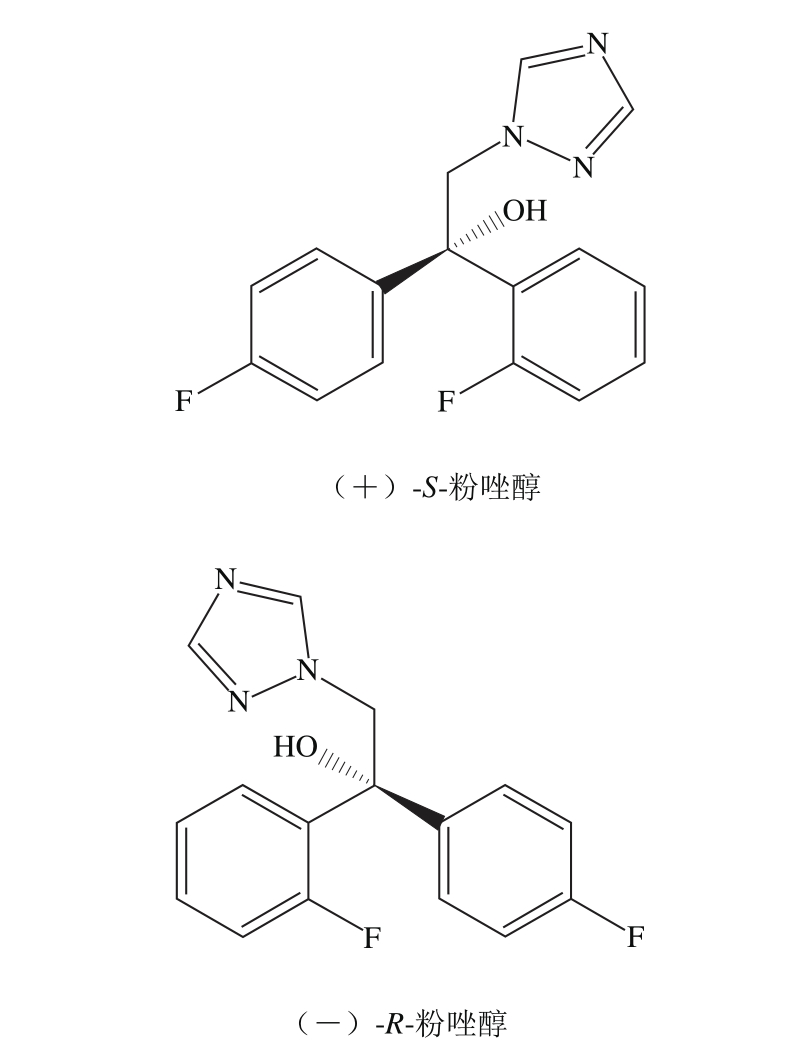
图1 粉唑醇对映体结构
Fig. 1 Chemical structures of flutriafol enantiomers
草莓,被誉为“水果皇后”,不仅味道酸甜可口,水果芳香浓郁,而且还含有大量的营养价值及VC,是人们最喜爱的水果之一。除了直接食用外,目前以草莓为原料还有许多副产品,如草莓酱、草莓酒等。经过加工后的草莓酒,其氨基酸、糖、维生素和矿物质等含量较为丰富[1-3]。因此,草莓酒也受到了人们越来越多的喜爱。然而,草莓在生长季节中容易受到病原菌的侵害,草莓白粉病是草莓重要病害之一,发病严重时,病叶率在45%以上,病果率在50%以上,严重影响了草莓的产量及品质[4]。粉唑醇作为三唑类杀菌剂之一,具有广谱杀菌活性,较强内吸性,在植物体内可由根部向顶部传导,是防治草莓白粉病的特效药剂之一[5]。然而,有研究表明粉唑醇对小鼠具有致畸性,对兔子的发育也具有阻碍性导致骨化延迟[6]。因此,有必要研究粉唑醇在草莓及其副产品草莓酒上的环境降解行为。

图1 粉唑醇对映体结构
Fig. 1 Chemical structures of flutriafol enantiomers
粉唑醇(图1)是手性化合物,具有一个手性C原子中心,含有两个对映体。目前市面上销售的粉唑醇试剂是外消旋体,因此人们把它当成一个化合物去研究,主要集中研究外消旋体粉唑醇的残留分析方法及其环境行为,然而Shen Zhigang等[7]研究发现在不同性别的兔子体内,R-粉唑醇和S-粉唑醇出现了选择性消解行为。Zhang Qing等[8]研究表明在葡萄植株内是(-)-R-粉唑醇优先降解,而(+)-S-粉唑醇相对累积,存在较明显的对映体选择性降解现象。同时,Zhang Qing等[9]发现(-)-R-粉唑醇对蚯蚓和斜生栅藻的毒性是(+)-S-粉唑醇的2.17~3.52 倍。传统的手性农药安全风险评估通常不区分对映体之间的差异,往往导致手性农药的风险评估结果不可靠,给人类健康和环境安全带来了诸多隐患。然而手性农药在进入生态环境后,不同对映体之间对靶标生物的生物活性、非靶标生物的生态毒性以及在动物和植物的富集行为往往存在显著的差异[10]。因此,从对映体角度来研究粉唑醇在设施草莓中的对映体选择性消解及草莓酒加工过程中的降解行为至关重要。本研究利用超高效合相色谱-串联质谱(ultra performance convergence chromatography-tandem mass spectrometry,UPCC-MS/MS)对粉唑醇进行手性拆分,从田间到餐桌,对草莓样品进行加工并分析两个对映体的残留量变化。研究结果阐明手性农药粉唑醇在草莓上的残留动态、对映体降解和代谢规律,明确手性农药高毒对映体在草莓加工过程中的变化规律,提出手性农药在草莓加工过程中风险控制关键点,为企业优化加工工艺、生产更为健康的食品提供科学基础。
外消旋体粉唑醇(纯度98.2%,其中两种光学异构体单体比例均为1∶1) 上海市农药研究所有限公司;12.5%粉唑醇悬浮剂 美兴农药业中国有限公司;分散净化剂N-丙基乙二胺(primary secondary amine,PSA,40 μm)、石墨化炭黑(graphitized carbon black,GCB)天津博纳艾杰尔科技有限公司;甲醇、乙腈、乙醇、异丙醇、正丁醇(均为色谱纯) 美国Thermo Fisher International公司;乙腈、氯化钠、无水硫酸镁(均为分析纯) 国药集团化学试剂有限公司;超纯水由美国Milli-Q纯水器制备。
超高效合相色谱系统(配有ACQUITY UPCC二元溶剂管理器、柱温箱管理器、合相管理器、样品管理器及Waters 515 补偿泵)、三重四极杆Xevo®-TQD质谱检测器 美国Waters公司;手性色谱柱Chiralpak IA-3(4.6 mm×150 mm,3 μm) 日本Daicel公司;CO2、N2(纯度均不小于99.999%) 北京海科元昌实用气体有限责任公司;G501A型电子天平 江苏常熟衡器厂;TG16-WS台式高速离心机 长沙湘仪离心机仪器有限公司;XW-80A旋涡混合器 上海恒勤仪器设备有限公司;RE-2000旋转蒸发器 上海亚荣生化仪器厂;Filter Unit滤膜(0.22 µm) 天津博纳艾杰尔科技有限公司;医用无菌注射器 上海治宇医疗器械有限公司。
1.3.1 标准溶液配制
外消旋标准溶液配制:用色谱纯乙腈配成100 mg/L,在逐级稀释至0.01、0.05、0.1、0.5、1.0、5.0 mg/L的标准工作液,置4 ℃贮存备用。
1.3.2 样品前处理
将草莓样品打碎,称取10.0 g(草莓酒10 mL)置于50 mL离心管中,加入10.0 mL分析纯乙腈,涡旋3 min,加入1 g NaCl,4 g无水MgSO4,再涡旋1 min,然后离心5 min,取上清液1.5 mL加入到2.5 mL离心管中(内含40 mg PSA+10 mg GCB+150 mg 无水硫酸镁),再涡旋1 min,然后离心5 min,上清液过0.22 μm有机系滤膜至进样小瓶待测。
1.3.3 粉唑醇在草莓上的添加回收实验
称取10.0 g草莓空白样品(10 mL草莓酒空白样品)置于50 mL离心管中,各加入一定量的粉唑醇外消旋体标准溶液,添加量为0.01、0.11 mg/kg和1 mg/kg。同时设置空白对照,每个水平5 个重复,连续3 d做重复实验。计算回收率及相对标准偏差。
1.3.4 仪器测定条件
色谱条件:利用Chiralpak IA-3手性柱,柱温30 ℃,CO2-甲醇(91∶9,V/V)作为流动相,流速为2.2 mL/min,515补偿泵的流速为0.45 mL/min,背压为2 200 psi。
质谱条件:电喷雾离子源(electrospray ionization,ESI),采用ESI+多重反应监测(multiple reaction mode,MRM)模式,毛细管电压为3.5 kV,离子源温度为150 ℃。以高纯氮(纯度99.999%)作为锥孔气和去溶剂气,去溶剂温度500 ℃,锥孔气流速50 L/h,去溶剂气流速900 L/h,碰撞气为高纯氩气(纯度99.999%),T检测池内碰撞气压力为2×10-3mbar;锥孔电压为24 V,母离子为m/z 302.2,定量离子为m/z 70.05,定性离子为m/z 123.04,碰撞电压分别为27 V和35 V。
1.3.5 粉唑醇对映体洗脱顺序的确定
利用制备色谱串联旋光检测器获得粉唑醇的两个光学纯单体,即(-)-粉唑醇和(+)-粉唑醇。然后把单体用1.3.4节分离条件进UPCC-MS/MS检测,得出2个峰。结合参考文献报道的粉唑醇对映体的绝对构型与旋光性的关系[11]。
1.3.6 EF值计算
手性化合物对映体之间的选择性变化指标通常用对映体分数(enantiomeric fraction,EF)值表示[12],计算公式为:
EF值的大小在0~1之间,EF为0.5说明两个对映体降解速率相同,没有对映体之间的选择性。当EF小于0.5时,表明(+)-S-粉唑醇的对映体优先降解,(-)-R-粉唑醇的残留量高;当EF大于0.5时,表明(-)-R-粉唑醇的对映体优先降解,(+)-S-粉唑醇的残留量高。样品中化合物对映体的EF值偏离外消旋体标样的EF值越远,表明该化合物的对映体在样品中立体选择性行为越明显。
1.3.7 田间实验及加工设计
草莓上农药残留消解动态实验:选取沈阳农业大学设施温室大棚栽培草莓,设置空白实验区,消解实验区,每小区设施药面积30 m2,3 次重复。在草莓生长至一半大小时开始施药,施药剂量90 mL/亩(最高推荐剂量60 mL/亩的1.5 倍),施药1 次,分别间隔2 h和1、3、5、7、10、15、21、28 d取样。
草莓上农药残留加工实验:每小区设施药面积30 m2,3 次重复。在草莓距成熟采摘期前3 d开始施药,施药剂量300 mL/亩(最高推荐剂量60 mL/亩的5 倍),施药1 次,3 d后取样,回实验室立即加工[13]。
草莓酒加工流程[14-15]:草莓鲜果→ 清洗;未清洗→匀浆→加入果胶酶、偏重亚硫酸钾及酵母→扣盖发酵,每天搅拌2 次,并取样(第8天时停止搅拌)→第10天时澄清,将酒渣过滤,澄清液接出,换瓶装→草莓酒成品,静置,每天取样。
所有实验均至少设置3 个重复。仪器数据采集及分析使用Masslynx NT v.4.1 SCN 882软件。数据用SPSS 20.0软件进行单因素方差分析,邓肯氏新复极差法进行半衰期之间的差异比较。用一级动力学方程求粉唑醇各对映体的降解半衰期,计算公式为:
式中:CT为时间T时的粉唑醇对映体的农药残留量/(mg/kg);C0为施药后的原始沉积量/(mg/kg);K为消解系数;T为施药后时间/d。
半衰期(T1/2)计算如下:
2.1.1 标准曲线和基质效应
在1.3.4节条件下对粉唑醇进行手性拆分,色谱图见图2。高效液相色谱技术的优势在于高分离度、高灵敏度、高分析速度和低成本。超临界流体色谱技术以超临界CO2为主要的流动相,具有黏度低、传质性能好、分离效率高、绿色环保的优势。因此UPCC技术集合了两者的优势,使得该技术在仪器的可操控性能、重复性、精密度等方面有很大进步。它比液相色谱所使用的液体流动相以及气相色谱所使用的载气有更多突出的优点,例如:CO2单独使用或与少量共溶剂共同使用作为流动相,流体黏度小,比高效液相色谱中所使用的液体流动相扩散率更高、更有利于传质[16-19];与气相色谱相比,CO2单独作流动相可在更低的温度下实现分离。因此,在5 min内完成了粉唑醇的手性拆分。

图2 粉唑醇手性拆分色谱图
Fig. 2 Chromatogram showing chiral resolution of flutriafol enantiomers
粉唑醇外消旋标准溶液质量浓度为0.01、0.05、0.1、0.5、1.0 mg/L和5.0 mg/L,对应各个对映体的标准溶液质量浓度为0.005、0.025、0.05、0.25、0.5 mg/L和2.5 mg/L。在1.3.4节条件下进行测定,以标准溶液质量浓度为横坐标,以峰面积为纵坐标作标准曲线,结果见表1。(+)-S-粉唑醇标样线性方程为:Y=243 651X-251.02,R2=0.999 3;(-)-R-粉唑醇标样线性方程为:Y=243 141X-317.05,R2=0.999 1。
表1 在0.005~2.5 mg/L水平下的粉唑醇各对映体溶剂及基质标准曲线
Table 1 Comparison of matrix-matched calibration and solvent calibration in the range at 0.005-2.5 mg/L for each enantiomer

化合物 基质 回归方程 R2基质效应/%(-)-R-粉唑醇乙腈 Y=243 141X-317.05 0.999 1草莓 Y=304 432X-287.02 1.000 0 25.2草莓酒 Y=426 956X+3 548.1 0.999 8 75.6(+)-S-粉唑醇乙腈 Y=243 651X-251.02 0.999 3草莓 Y=305 129X-4 842.4 0.999 9 25.2草莓酒 Y=420 252X+2 505.2 0.999 9 72.5
欧盟农药残留分析质量控制规程中把基质效应定义为样品中的非待测组分对待测物浓度或质量测定准确度的影响[20]。基质效应的计算方法为:
基质效应具有高变异性,很难被完全消除或者预测[21-22]。本实验中,粉唑醇的两个对映体在草莓及草莓酒中有明显的基质增强效应。一般来说,基质减弱或者增强效应源自内生化合物的不完全去除,如磷脂质、糖类、脂肪酸、酚类等[23]。因此,用外标法基质标曲线校准定量样品质量浓度更为准确。各对映体在草莓及草莓酒中的基质标曲线方程的相关系数R2均大于0.993 3。
2.1.2 准确度、精密度和灵敏度测定结果
分别在空白草莓和草莓酒样品中添加0.01、0.1 mg/kg和1 mg/kg的粉唑醇外消旋标准溶液,每个对映体的添加量即为0.005、0.05 mg/kg和0.5 mg/kg,每档重复5 次,用上述分析方法测定回收率,(-)-R-粉唑醇和(+)-S-粉唑醇在草莓中的平均回收率为86.21%~94.35%,变异系数为1.3%~3.2%(表2)。(-)-R-粉唑醇和(+)-S-粉唑醇在草莓酒中的平均回收率为87.61%~96.19%,变异系数为1.5%~3.5%。本实验中,(-)-R-粉唑醇和(+)-S-粉唑醇在草莓及草莓酒中的最低检出限为0.005 mg/kg。
表2 粉唑醇各对映体的添加回收率
Table 2 Mean recoveries of flutriafol enantiomers from spiked samples
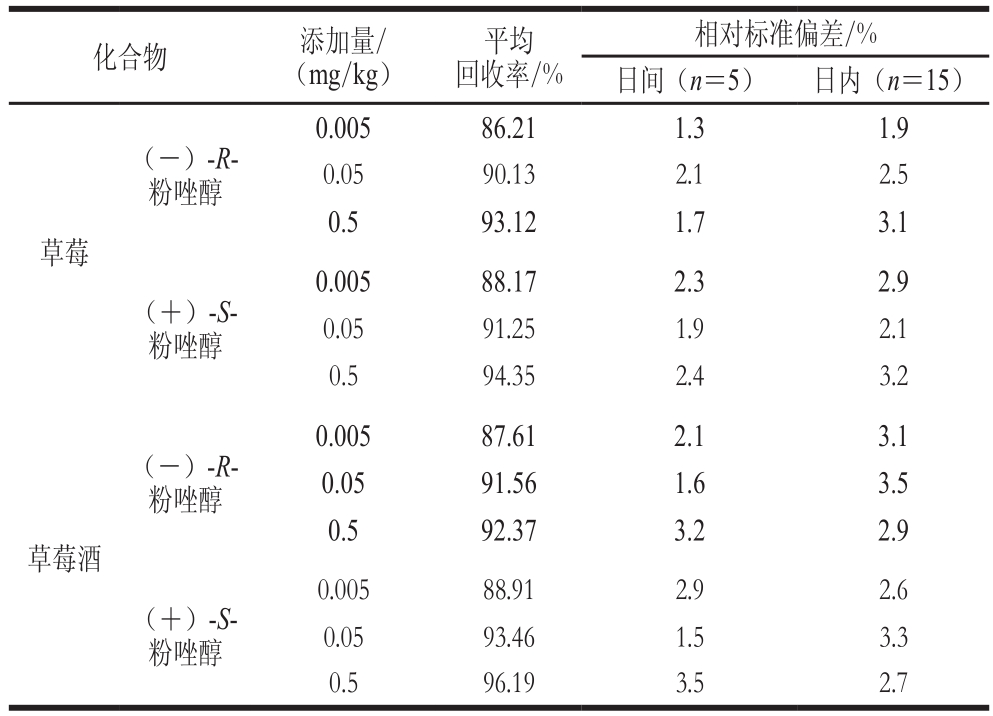
化合物 添加量/(mg/kg)平均回收率/%相对标准偏差/%日间(n=5) 日内(n=15)(-)-R-粉唑醇0.005 86.21 1.3 1.9 0.05 90.13 2.1 2.5 0.5 93.12 1.7 3.1草莓(+)-S-粉唑醇0.005 88.17 2.3 2.9 0.05 91.25 1.9 2.1 0.5 94.35 2.4 3.2(-)-R-粉唑醇0.005 87.61 2.1 3.1 0.05 91.56 1.6 3.5 0.5 92.37 3.2 2.9草莓酒(+)-S-粉唑醇0.005 88.91 2.9 2.6 0.05 93.46 1.5 3.3 0.5 96.19 3.5 2.7
表3 粉唑醇对映体在草莓上的消解动态
Table 3 Dissipation dynamics of flutriafol enantiomers in strawberry
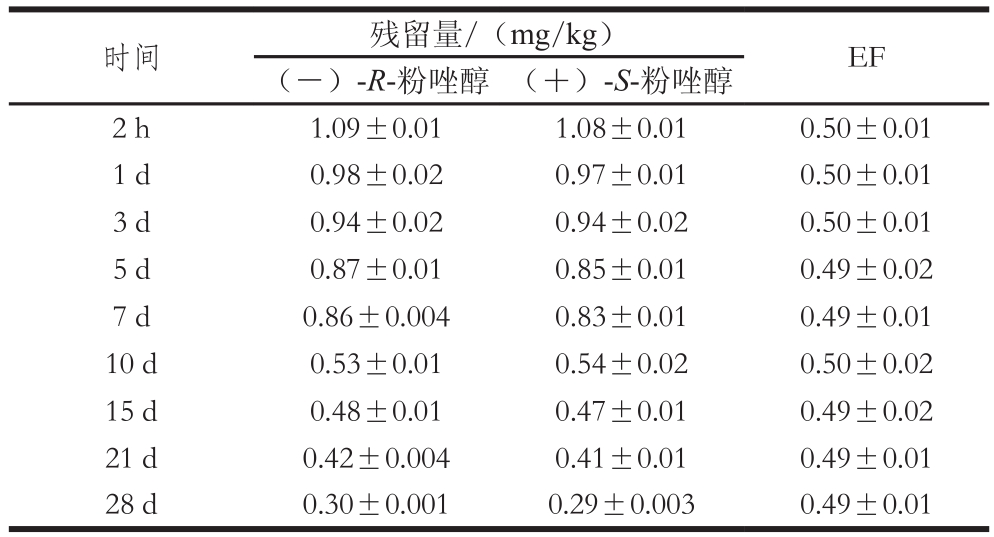
注:数据均以 ±s表示,表4同。
时间 残留量/(mg/kg) EF(-)-R-粉唑醇 (+)-S-粉唑醇2 h 1.09±0.01 1.08±0.01 0.50±0.01 1 d 0.98±0.02 0.97±0.01 0.50±0.01 3 d 0.94±0.02 0.94±0.02 0.50±0.01 5 d 0.87±0.01 0.85±0.01 0.49±0.02 7 d 0.86±0.004 0.83±0.01 0.49±0.01 10 d 0.53±0.01 0.54±0.02 0.50±0.02 15 d 0.48±0.01 0.47±0.01 0.49±0.02 21 d 0.42±0.004 0.41±0.01 0.49±0.01 28 d 0.30±0.001 0.29±0.003 0.49±0.01
粉唑醇在草莓上的田间消解动态实验结果(表3)表明,两个对映体在草莓上的消解均符合一级动力方程。(-)-R-粉唑醇在草莓上的消解方程为y=1.09e-0.05023x,R2=0.949 63;(+)-S-粉唑醇在草莓上的消解方程为y=1.08e-0.05095x,R2=0.962 06。(-)-R-粉唑醇在草莓上的半衰期为13.80 d,(+)-S-粉唑醇在草莓上的半衰期为13.60 d。通过显著性差异分析半衰
期表明,粉唑醇两个对映体在草莓生长过程中选择性降解行为不显著(P>0.05)。同时通过EF表明,两个对映体在设施草莓上没有选择性消解行为。植物体内的酶并没有影响粉唑醇两个对映体有选择性降解。手性化合物对映体之间选择性降解取决于手性环境、植物体内酶等条件的影响[24]。Zhang Hu等[25]研究发现三唑类同类杀菌剂四氟醚唑在草莓上也没有选择性降解行为。
表4 粉唑醇对映体在草莓酒中的降解
Table 4 Degradation of flutriafol enantiomers in strawberry wine
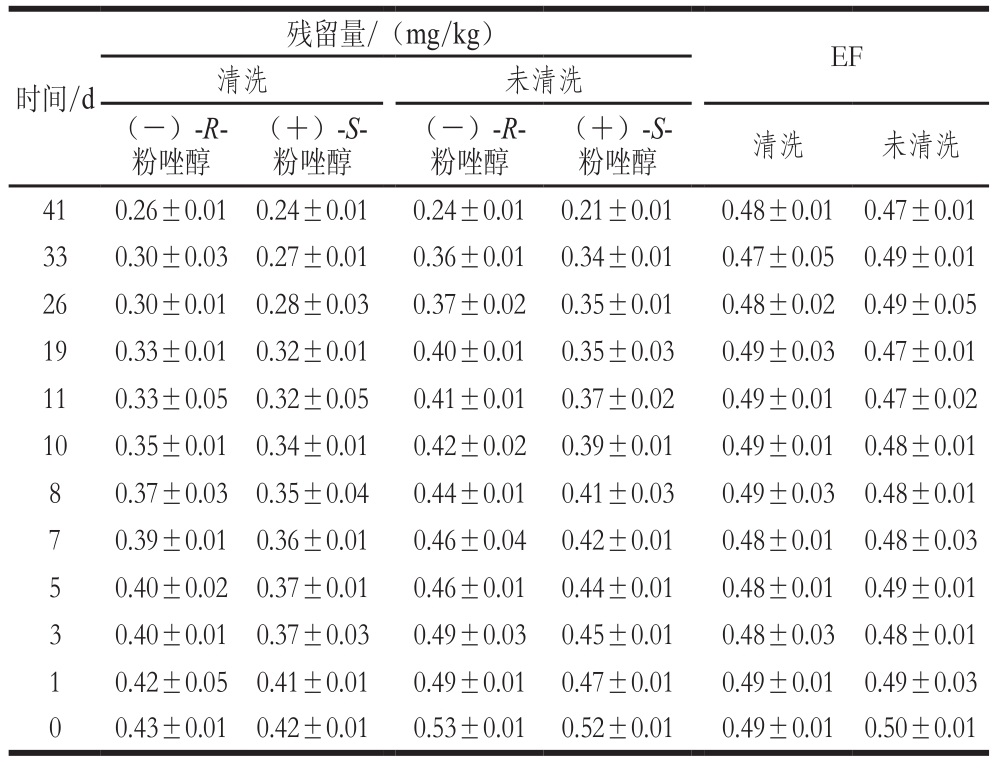
时间/d残留量/(mg/kg) EF清洗 未清洗(-)-R-粉唑醇(+)-S-粉唑醇(-)-R-粉唑醇(+)-S-粉唑醇 清洗 未清洗41 0.26±0.01 0.24±0.01 0.24±0.01 0.21±0.01 0.48±0.01 0.47±0.01 33 0.30±0.03 0.27±0.01 0.36±0.01 0.34±0.01 0.47±0.05 0.49±0.01 26 0.30±0.01 0.28±0.03 0.37±0.02 0.35±0.01 0.48±0.02 0.49±0.05 19 0.33±0.01 0.32±0.01 0.40±0.01 0.35±0.03 0.49±0.03 0.47±0.01 11 0.33±0.05 0.32±0.05 0.41±0.01 0.37±0.02 0.49±0.01 0.47±0.02 10 0.35±0.01 0.34±0.01 0.42±0.02 0.39±0.01 0.49±0.01 0.48±0.01 8 0.37±0.03 0.35±0.04 0.44±0.01 0.41±0.03 0.49±0.03 0.48±0.01 7 0.39±0.01 0.36±0.01 0.46±0.04 0.42±0.01 0.48±0.01 0.48±0.03 5 0.40±0.02 0.37±0.01 0.46±0.01 0.44±0.01 0.48±0.01 0.49±0.01 3 0.40±0.01 0.37±0.03 0.49±0.03 0.45±0.01 0.48±0.03 0.48±0.01 1 0.42±0.05 0.41±0.01 0.49±0.01 0.47±0.01 0.49±0.01 0.49±0.03 0 0.43±0.01 0.42±0.01 0.53±0.01 0.52±0.01 0.49±0.01 0.50±0.01
表5 粉唑醇对映体在草莓酒发酵过程中的消解方程和半衰期
Table 5 Dissipation kinetics and half-lives of flutriafol enantiomers during strawberry wine fermentation process

操作 化合物 方程 R2半衰期/d清洗处理组(-)-R-粉唑醇 y=0.43e-0.01821x0.930 75 38.06(+)-S-粉唑醇 y=0.42e-0.02318x0.897 81 29.90未清洗处理组(-)-R-粉唑醇 y=0.53e-0.02364x0.897 81 29.31(+)-S-粉唑醇 y=0.52e-0.03130x0.833 74 22.14
粉唑醇两个对映体在草莓酒中的降解结果(表4)表明,(+)-S-粉唑醇的残留量低于(-)-R-粉唑醇,(+)-S-粉唑醇优先降解。草莓酒发酵的过程是10 d。在草莓酒发酵过程(10 d)中,两个对映体的降解均符合一级动力学方程,降解结果见表5。清洗处理后(-)-R-粉唑醇在草莓酒发酵中的半衰期为38.06 d,(+)-S-粉唑醇的半衰期为29.90 d。未清洗处理,(-)-R-粉唑醇在草莓酒发酵中的半衰期为29.31 d,(+)-S-粉唑醇半衰期为22.14 d。
通过显著性差异分析半衰期表明,粉唑醇两个对映体在草莓酒发酵过程中选择性降解行为显著(P<0.05)。草莓酒发酵是一个复杂的过程,有研究表明在主发酵期酵母菌为优势菌群,主发酵结束后酵母菌逐渐衰亡,其他微生物开始生长,总酚和总黄酮含量在发酵前期逐渐上升,后期逐渐下降[26]。因此在草莓酒的发酵过程中,由于有酵母菌的存在,酵母菌会选择性代谢,对手性化合物产生了选择性降解行为。Pan Xinglu等[27]研究也发现苯酰菌胺在葡萄酒发酵过程中也存在显著性选择性降解行为,R-苯酰菌胺在发酵中优先降解。同时EF值小于0.5也表明(-)-R-粉唑醇残留量高于(+)-S-粉唑醇,且(+)-S-粉唑醇优先降解。
未清洗处理的草莓酒中,平均残留量也高于清洗处理时各对映体的浓度。两个对映体在未清洗处理后草莓酒发酵过程中,降解半衰期要比清洗处理后半衰期短。可能是因为微生物利用农药作为N源,农药浓度大促进了微生物繁殖,从而促进了农药的降解,因此未清洗处理中农药降解快。虽然两个对映体在草莓酒中的降解速率比在草莓中的慢,但是在草莓酒残留量符合我国对粉唑醇在草莓上的最大残留限量规定(1 mg/kg)[28]。Lu Yuele等[29]也研究发现苯霜灵在葡萄酒中的降解要比在葡萄上的降解慢很多,苯霜灵残留能在葡萄酒中维持很长时间。农药喷施植物一般都直接接触表皮,所以清洗对去除农药残留至关重要。清洗能适当减少农药在植物体中的残留[30-31]。
本实验研究了粉唑醇在草莓中的对映体选择性消解及草莓酒加工过程中的降解行为,结果表明粉唑醇对映体在草莓生长中没有明显的选择性降解行为,(-)-R-粉唑醇在草莓上的半衰期为13.80 d,(+)-S-粉唑醇在草莓上的半衰期为13.60 d。而在草莓酒的发酵过程中存在明显的选择性降解行为,(+)-S-粉唑醇优先降解。在草莓酒发酵过程中,清洗后(-)-R-粉唑醇在草莓酒中的半衰期为38.06 d,(+)-S-粉唑醇的半衰期为29.90 d。未清洗(-)-R-粉唑醇在草莓酒发酵中的半衰期为29.31 d,(+)-S-粉唑醇半衰期为22.14 d。研究结果为未来更准确地对草莓进行风险评估提供了参考依据,提示检验、监督等部门在未来食品风险评估中,也应关注从对映体的角度评价手性农药的安全性。
[1] 孙海燕. 响应面法优化草莓中花青素提取工艺参数[J]. 食品工业科技, 2013, 34(10): 243-246.
[2] 刘国明, 石景财, 陆云, 等. 草莓酒发酵菌种的筛选及工艺优化[J]. 中国酿造, 2016, 35(9): 150-153. DOI:10.11882/j.issn.0254-5071.2016.09.034.
[3] 李亚辉, 马艳弘, 张宏志, 等. 草莓发酵酒澄清稳定处理技术[J].食品与生物技术学报, 2016, 35(8): 864-870. DOI:10.3969/j.issn.1673-1689.2016.08.012.
[4] 董辉, 杨雷, 史晓红, 等. 草莓白粉病的发生规律与防治措施[J]. 中国园艺文摘, 2017, 33(2): 199-200. DOI:10.3969/j.issn.1672-0873.2017.02.075.
[5] 杨凤丽, 陆永连, 蔡炳祥. 粉唑醇对草莓白粉病田间防效简报[J]. 中国植保导刊, 2016(3): 72-73. DOI:10.3969/j.issn.1672-6820.2016.03.017.
[6] PINTORE M, PICLIN N, BENFENATI E, et al. Database mining with adaptive fuzzy partition: application to the prediction of pesticide toxicity on rats[J]. Environmental Toxicology and Chemistry, 2003,22(5): 983-991. DOI:10.1002/etc.5620220505.
[7] SHEN Z G, ZHANG P, XU X Y, et al. Gender-related differences in stereoselective degradation of flutriafol in rabbits[J]. Journal of Agricultural and Food Chemistry, 2011, 59(18): 10071-10077.DOI:10.1021/jf201784r.
[8] ZHANG Q, HUA X D, YANG Y, et al. Stereoselective degradation of flutriafol and tebuconazole in grape[J]. Environmental Science and Pollution Research, 2015, 22(6): 4350-4358. DOI:10.1007/s11356-014-3673-2.
[9] ZHANG Q, SHI H Y, LIU J, et al. Enantioselective bioactivity, acute toxicity and dissipation in vegetables of the chiral triazole fungicide flutriafol[J]. Journal of Hazardous Materials, 2015, 284: 65-72.DOI:10.1016/j.jhazmat.2014.10.033.
[10] YE J, ZHAO M R, LIU J, et al. Enantioselectivity in environmental risk assessment of modern chiral pesticides[J]. Environmental Pollution,2010, 158(7): 2371-2383. DOI:10.1016/j.envpol.2010.03.014.
[11] CHANG M, KIM T H, KIM H D. Stereoselective synthesis of(+)-flutriafol[J]. Tetrahedron: Asymmetry, 2008, 19: 1504-1508.DOI:10.1016/j.tetasy.2008.06.007.
[12] HARNER T, WIBERG K, NORSTROM R. Enantiomer fractions are preferred to enantiomer ratios for describing chiral signatures in environmental analysis[J]. Environmental Science & Technology,2000, 34(1): 218-220. DOI:10.1021/es9906958.
[13] OECD-Organisation for Economic Co-operation and Development. Test No. 508: magnitude of the pesticide residues in processed commodities[J].OECD Guidelines for the Testing of Chemicals, 2007, 1: 1-15.
[14] 刘文慧, 王颉. 草莓酒酿造工艺及香气成分分析研究[J]. 酿酒科技,2006(12): 93-96. DOI:10.13746/j.njkj.2006.12.032.
[15] 马子骏, 林瑛影, 王阳光, 等. 草莓酿酒特性和人工加糖发酵工艺的研究[J]. 食品科学, 2003, 24(5): 102-106. DOI:10.3969/j.is sn.1001-9286.2006.12.024.
[16] CHENG Y P, ZHENG Y Q, DONG F S, et al. Stereoselective analysis and dissipation of propiconazole in wheat, grapes, and soil by supercritical fluid chromatography tandem mass spectrometry[J].Journal of Agricultural & Food Chemistry, 2017, 65(1): 234-243.DOI:10.1021/acs.jafc.6b04623.
[17] PAN X L, DONG F S, XU J, et al. Stereoselective analysis of novel chiral fungicide pyrisoxazole in cucumber, tomato and soil under different application methods with supercritical fluid chromatography/tandem mass spectrometry[J]. Journal of Hazardous Materials, 2016,311: 115-124. DOI:10.1016/j.jhazmat.2016.03.005.
[18] LIU N, DONG F S, XU J, et al. Enantioselective separation and pharmacokinetic dissipation of cyflumetofen in field soil by ultraperformance convergence chromatography with tandem mass spectrometry[J]. Journal of Separation Science, 2016, 39(7): 1363.DOI:10.1002/jssc.201501123.
[19] CHEN X X, DONG F S, XU J, et al. Enantioseparation and determination of isofenphos-methyl enantiomers in wheat, corn,peanut and soil with supercritical fluid chromatography/tandem mass spectrometric method[J]. Journal of Chromatography B, 2016,1015/1016: 13-21. DOI:10.1016/j.jchromb.2016.02.003.
[20] CHAMBERS E, WAGROWSKIDIEHL D M, LU Z, et al. Systematic and comprehensive strategy for reducing matrix effects in LC/MS/MS analyses[J]. Journal of Chromatography B, 2007, 852(1): 22-34.DOI:10.1016/j.jchromb.2006.12.030.
[21] LI R N, DONG F S, XU J, et al. Enantioseparation of imazalil and monitoring of its enantioselective degradation in apples and soils using ultrahigh-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2017,65(16): 3259-3267. DOI:10.1021/acs.jafc.7b00258.
[22] LIU N, DONG F S, XU J, et al. Stereoselective determination of tebuconazole in water and zebrafish by supercritical fluid chromatography tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2015, 63(28): 6297-6303. DOI:10.1021/acs.jafc.5b02450.
[23] LI M M, LIU X G, DONG F S, et al. Simultaneous determination of cyflumetofen and its main metabolite residues in samples of plant and animal origin using multi-walled carbon nanotubes in dispersive solidphase extraction and ultrahigh performance liquid chromatographytandem mass spectrometry[J]. Journal of Chromatography A, 2013,1300: 95-103. DOI:10.1016/j.chroma.2013.05.052.
[24] 刘维屏, 叶璟, 张安平, 等. 植物与手性化合物的对映体选择性相互作用[J]. 应用生态学报, 2008, 19(2): 441-448.
[25] ZHANG H, QIAN M R, WANG X Q, et al. Analysis of tebuconazole and tetraconazole enantiomers by chiral HPLC-MS/MS and application to measure enantioselective degradation in strawberries[J].Food Analytical Methods, 2012, 5(6): 1342-1348. DOI:10.1007/s12161-012-9375-9.
[26] 程诗韔, 孙倩, 王林, 等. 草莓酒发酵过程中组分和抗氧化性的变化[J]. 农业工程技术, 2017, 37(20): 19-22. DOI:10.16815/j.cnki.11-5436/s.2017.20.017.
[27] PAN X L, DONG F S, LIU N, et al. The fate and enantioselective behavior of zoxamide during wine-making process[J]. Food Chemistry,2018, 248: 14-20. DOI:10.1016/j.foodchem.2017.12.052.
[28] 吴声敢, 关文碧, 柳新菊, 等. 草莓中农药最大残留限量标准比较[J]. 浙江农业学报, 2017, 29(3): 460-468. DOI:10.3969/j.issn.1004-1524.2017.03.16.
[29] LU Y L, SHAO Y H, DAI S J, et al. Stereoselective behavior of the fungicide benalaxyl during grape growth and the wine-making process[J]. Chirality, 2016, 28(5): 394-398. DOI:10.1002/chir.22589.
[30] LIU N, DONG F S, LIU X G, et al. Effect of household canning on the distribution and reduction of thiophanate-methyl and its metabolite carbendazim residues in tomato[J]. Food Control, 2014, 43: 115-120.DOI:10.1016/j.foodcont.2014.03.003.
[31] LIU N, DONG F S, CHEN Z L, et al. Distribution behaviour of acaricide cyflumetofen in tomato during home canning[J]. Food Additives& Contaminants: Part A, 2016, 33(5): 824-830. DOI:10.1080/19440049.2 016.1171913.
Stereoselective Behavior of Flutriafol during Strawberry Growth and Winemaking