荞麦属蓼科(Polygonaceae)荞麦属(Fagopyrum),起源于我国[1]。其农业种植的两个重要品种分别是甜荞麦(F. esculentum Moench)和苦荞麦(F. tataricum(L.)Gaertn.)。甜荞麦在世界分布广泛,苦荞麦为我国独有农作物[2]。我国的苦荞种植面积和产量均居世界第一位[3]。荞麦作为一种药食同源的天然绿色食品资源,含有较多的生物黄酮类物质。黄酮类物质通过抗氧化、抑制α-葡萄糖苷酶活性、拟胰岛素作用、抗炎、抑制醛糖还原酶和抑制蛋白糖基化等多种途径来防治糖尿病,同时通过抵抗血小板凝集、微血管病变等作用改善糖尿病并发症[4]。传统治疗糖尿病的药物都具有不同程度的副作用,因此在天然产物中寻找α-葡萄糖苷酶抑制剂、蛋白质糖基化终末产物(advanced glycosylation end products,AGEs)抑制剂成为糖尿病治疗领域研究的热门方向。
荞麦壳是荞麦生产加工中的副产物,且产量大、价格低廉。其药理作用和有效化学成分与荞麦具有相似之处,但目前对其药理研究和开发利用较少[5]。近几年研究表明荞麦成分对慢性疾病治疗有突出的效果,因此倍受食品科学家的重视[6]。很多文献证实荞麦提取物具有降血糖、抑制AGEs形成的功效[7-8]。本课题组前期研究结果表明,荞麦壳黄酮提取物可显著降低链脲佐菌素诱导的2型糖尿病大鼠空腹血糖含量,同时证实其还具有修复胰岛细胞功能,且具有量效关系[9]。为了深入研究荞麦壳黄酮类物质成分及其与抗糖尿病活性的关系,本实验对荞麦壳提取物(buckwheat hull extract,BHE)进一步分离纯化后,研究各组分体外抗糖尿病生物活性并对活性最优组分进行成分分析,为荞麦壳活性及成分鉴定提供有效依据。
1 材料与方法
1.1 材料与试剂
甜荞麦壳购于内蒙古赤峰市;BHEs制取参照朴春红等[10]的方法。
芦丁(纯度≥98%) 美国Bellancom Life Science公司;α-葡萄糖苷酶(>10 000 U) 北京Solarbio公司;葡萄糖氧化酶试剂盒 上海恒远试剂公司;D101大孔树脂、AB-8大孔树脂 东鸿化工有限公司;葡萄糖北京化工厂;D-果糖、牛血清白蛋白(bovine albumin,BSA)、丙酮醛(methylglyoxal,MGO) 美国Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;RE52CS旋转蒸发仪 上海亚荣生化仪器厂;iFD-1P-50冷冻干燥机 北京博医康实验仪器有限公司;infinite M200酶标仪 瑞士Tecan公司;3K15离心机 美国Sigma公司;SYNERGYHT多功能酶标仪美国伯腾仪器有限公司;DHP/20恒温培养箱 上海实验仪器厂有限公司;LCMS2020型高效液相色谱-质谱(high performance liquid chromatograph-mass spectrometer,HPLC-MS)联用仪 日本岛津公司。
1.3 方法
1.3.1 大孔树脂分离纯化
1.3.1.1 大孔树脂的预处理
参照胡月等[11]的方法并加以改进。分别将D101大孔树脂、AB-8大孔树脂用95%乙醇浸泡24 h,对其进行初步除杂。滤去乙醇,用蒸馏水洗至无味。依次用4% HCl和4% NaOH溶液浸泡24 h,每次浸泡结束后用蒸馏水洗至pH 7.0,最后浸泡于95%乙醇中,保存备用。
1.3.1.2 D101大孔树脂一次纯化
处理好的D101大孔树脂湿法装柱,待柱料平稳后,以2 mL/min流速加入BHE溶液100 mL,待BHE吸附后,蒸馏水以4 BV/h流速洗去未吸附的BHE样品,最后用70%乙醇以2 BV/h流速洗脱至流出液无颜色,洗脱液冷冻干燥后获得D101大孔树脂精制物(purified buckwheat hull extract,PBHE)备用。
1.3.1.3 AB-8大孔树脂二次纯化
处理好的AB-8型大孔树脂湿法装柱,待柱料平稳后,以0.5 BV/h流速加入20 mL PBHE样品,2 BV/h流速洗脱。洗脱剂依次为纯水2 BV(BHE-M1)、纯水3 BV(BHE-M2)、10%乙醇4 BV(BHE-M3)、40%乙醇11 BV(BHE-M4)、95%乙醇4 BV(BHE-M5)。分别收集洗脱液,减压浓缩,冷冻干燥后得到AB-8大孔树脂纯化组分(BHE-M)备用。
1.3.2 总黄酮含量测定
利用NaNO2-Al(NO3)3比色法来检测各分离纯化组分总黄酮含量[12]。500 μL待测样品液与1.0 mL体积分数95%乙醇混合后加入250 μL质量分数4% NaNO2溶液,静置反应6 min,加250 μL质量分数10% Al(NO3)3溶液于上述反应液中再静置反应6 min,最后加入1.5 mL质量分数4% NaOH溶液混匀。分别取出200 μL加至96 孔板中,利用酶标仪在510 nm波长处检测其吸光度。参照上述方法制备芦丁标准曲线,取0.2 mg/mL芦丁标准溶液0.05、0.10、0.20、0.30、0.40、0.50、1.00、1.50 mL作为样品,510 nm波长处测其吸光度,以芦丁质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线;得到线性回归方程为Y=0.297 6X+0.052 2,R2=0.999 4,根据芦丁标准曲线计算出各总黄酮含量。
1.3.3 α-葡萄糖苷酶活力抑制率测定
以麦芽糖为底物,α-葡萄糖苷酶活力抑制率测定方法参照范文娅[13]、韩淑英[14]等的报道并加以改良。依次取60 μL乙酸-乙酸钠缓冲液,40 μL α-葡萄糖苷酶(5 mg/mL),80 μL麦芽糖(20 mmol/L)于1.5 mL EP管中混匀,加入20 μL待测样品溶液(1.25、2.50、10.00 mg/mL),40 ℃温育40 min后沸水加热5 min终止反应。离心2 min(4 ℃、1 000 r/min),取上清液10 μL于1.5 mL EP管中,加入葡萄糖氧化酶试剂盒中R1、R2混合液1 000 μL,37 ℃温育15 min,取200 μL至96 孔板中,505 nm波长处测吸光度。计算公式如式(1)所示。
式中:A空白为不加样品的吸光度;A样品为各质量浓度样品孔的吸光度;A颜色对照为颜色对照孔的吸光度。
1.3.4 AGEs抑制率测定
1.3.4.1 葡萄糖-BSA、果糖-BSA体系制备
参照Wang Xuan等[15]的方法进行并略作改动:分别用磷酸盐缓冲液(200 mmol/L、pH 7.4)配制10 mg/mL的BSA溶液、500 mmol/L的葡萄糖溶液和果糖溶液、不同质量浓度的实验样品(BHE、PBHE、BHE-M)。1.5 mL EP管中依次加入120 μL葡萄糖溶液(果糖溶液)、240 μL BSA溶液、反应终质量浓度为0.025、0.050、0.200 mg/mL的实验样品。密封好EP管,80 ℃避光条件下培养6 h后分别取200 μL至黑色酶标板中测定AGEs生成量。实验分组如下:空白对照组(不含还原糖和抑制剂)、对照组(不含抑制剂)、实验组(抑制剂为实验样品)、阳性对照组(抑制剂为胺基胍(amino guanidine,AG))。
1.3.4.2 MGO-BSA体系制备
MGO-BSA体系制备参照Harsha[16]和Pokkaew[17]等的方法略有改动:1 mL MGO(20 mmol/L)加到20 mL BSA(20 mg/mL)溶液中,取上述MGO-BSA混合液280 μL至黑色酶标板中,对应加入20 μL实验样品(BHE、PBHE、BHE-M),反应中所用溶剂皆为磷酸盐缓冲液(100 mmol/L、pH 7.4)。充分混匀后50 ℃避光条件下培养24 h后测定AGEs生成量。实验分组为:空白对照组(不含MGO和抑制剂)、对照组(不含抑制剂)、实验组(抑制剂为实验样品)、阳性对照组(抑制剂为AG)。
1.3.4.3 AGEs抑制率检测
利用荧光酶标仪在激发波长360 nm和发射波长460 nm,增益50的条件下,检测其荧光强度,计算公式如式(2)所示。
式中:FLs为实验组的荧光强度;FLb为空白组的荧光强度;FLc为对照组的荧光强度。
1.3.5 BHE-M4中黄酮类物质成分分析
1.3.5.1 样品的准备
精密称取BHE-M4样品100 mg,置于50 mL锥形瓶中,加入25 mL甲醇后密封瓶口,超声处理1 h(40 kHz、250 W),冷却后过滤,少量甲醇洗涤滤渣并将洗涤液与滤液合并,减压加热干燥。
干燥后的样品用90%甲醇水溶液溶解,过C18固相萃取小柱,90%甲醇水溶液为洗脱液,弃去前1 mL洗脱液,接收中间3 mL洗脱液,真空干燥后备用。
1.3.5.2 HPLC-MS分析条件
取1.3.5.1节干燥样品以甲醇溶解后经0.45 μm微孔滤膜过滤,取10 μL样品进样分析。使用LCMS2020型HPLC-MS联用仪,扫描速率为15 000 D/s,正负极性切换时间为15 ms。乙腈为流动相A,水为流动相B,洗脱条件:0~40 min,流动相A:5%~90%;40~45 min,流动相A:90%;45~50 min,流动相A:90%~5%。流速:1 mL/min。
1.4 数据统计分析
本实验数据为 ,采用Excel 2010软件处理数据,用GraphPad Prism 5.0软件绘制结果图,组间比较采用单因素方差分析(One-way ANOVA),P<0.05具有显著性差异。
,采用Excel 2010软件处理数据,用GraphPad Prism 5.0软件绘制结果图,组间比较采用单因素方差分析(One-way ANOVA),P<0.05具有显著性差异。
2 结果与分析
2.1 各组分总黄酮含量

图1 大孔树脂纯化组分中总黄酮含量
Fig. 1 Total ぼavonoid contents of BHE and its fractions
BHE经两种不同型号大孔树脂纯化后,各组分总黄酮含量测定结果见图1。BHE总黄酮含量为30.8 g/100 g,经D101大孔树脂一次纯化后总黄酮含量升高约一倍,为65.3 g/100 g。经AB-8大孔树脂二次纯化后黄酮类化合物基本集中在BHE-M4和BHE-M5两个组分,其中BHE-M4组分总黄酮含量为89.2 g/100 g。杨喆等[18]以D101大孔树脂分纯化山杏核壳总黄酮,总黄酮含量达到51.63%;杨芙莲等[19]以AB-8大孔树脂甜荞麦壳类总黄酮含量由27.9%提高到59.5%;陈晶等[20]用AB-8大孔树脂分离纯化枇杷花总黄酮,纯化后样品总黄酮含量达74.82%。本实验中BHE依次经D101大孔树脂、AB-8大孔树脂两次纯化后,总黄酮含量与已有文献结果相似,结果表明荞麦壳黄酮经大孔树脂两次纯化后总黄酮含量有显著提高,便于进行后续成分分析及活性实验。
2.2 纯化组分α-葡萄糖苷酶活力抑制率

图2 大孔树脂纯化前后荞麦壳提取物抑制α-葡萄糖苷酶的活性
Fig. 2 Inhibitory activity of BHE and its fractions against α-glucoside
大写字母不同表示同质量浓度下样品组间差异显著(P<0.05)。图3~5同。
α-葡萄糖苷酶又称α-D-葡萄糖苷水解酶,是一类低聚糖水解酶,也是机体内碳水化合物消化的关键酶,同时参与机体内糖蛋白、糖脂和糖肽的合成。通过降解机体内多糖,裂解α-1、α-4糖苷键释放葡萄糖使机体血糖浓度升高。α-葡萄糖苷酶抑制剂虽不刺激胰岛β细胞分泌胰岛素,但可通过抑制这一系列反应,降低餐后血糖水平,是比较成熟的治疗糖尿病药物,现已广泛应用于临床。李鹏程等[9]研究表明BHE具有良好的抑制α-葡萄糖苷酶活力的作用,尤其对α-葡萄糖苷酶-麦芽糖体系的降解作用高于α-葡萄糖苷酶-硝基苯-α-D-葡萄糖吡喃苷。因此本实验采用α-葡萄糖苷酶-麦芽糖体系进行实验。由图2可知,除BHE-M1组分外,其他组分对α-葡萄糖苷酶活力有明显的抑制,且呈剂量依赖关系。BHE-M4组分对α-葡萄糖苷酶活力的抑制效果最强,在1.000 mg/mL时抑制率最高为28.23%,而同等质量浓度下BHE的抑制率为16.03%。阳性对照组阿拉伯糖5 mg/mL时抑制率仅为2.94%(图中未标注)。朱丽艳等[21]研究表明荞麦花总黄酮对α-葡萄糖苷酶活力抑制率分别为35.79%~54.74%,结果略高于本研究中的BHE-M4组分,而荞麦麸皮黄酮类物质及小叶薜荔根茎黄酮类物质在低质量浓度下抑制效果不明显[22-23]。张海凤等[24]分别用大鼠小肠黏膜α-葡萄糖苷酶提取液和市售α-葡萄糖苷酶建立α-葡萄糖苷酶抑制剂模型,发现不同来源α-葡萄糖苷酶活力有一定差异。而本实验样品与已发表文献中荞麦相关黄酮的α-葡萄糖苷酶活力抑制率相比较低,这可能与荞麦产地、提取部位以及α-葡萄糖苷酶的来源有关。但仍然可以证明BHE分离纯化后,大部分组分对α-葡萄糖苷酶的抑制活性均有不同程度的提升。
2.3 纯化组分抑制AGEs活性
2.3.1 纯化组分在葡萄糖-BSA、果糖-BSA体系中的AGEs抑制率

图3 葡萄糖-BSA体系中抑制AGEs活性
Fig. 3 Inhibitory effect of BHE and its fractions on AGEs formation in glucose-BSA system
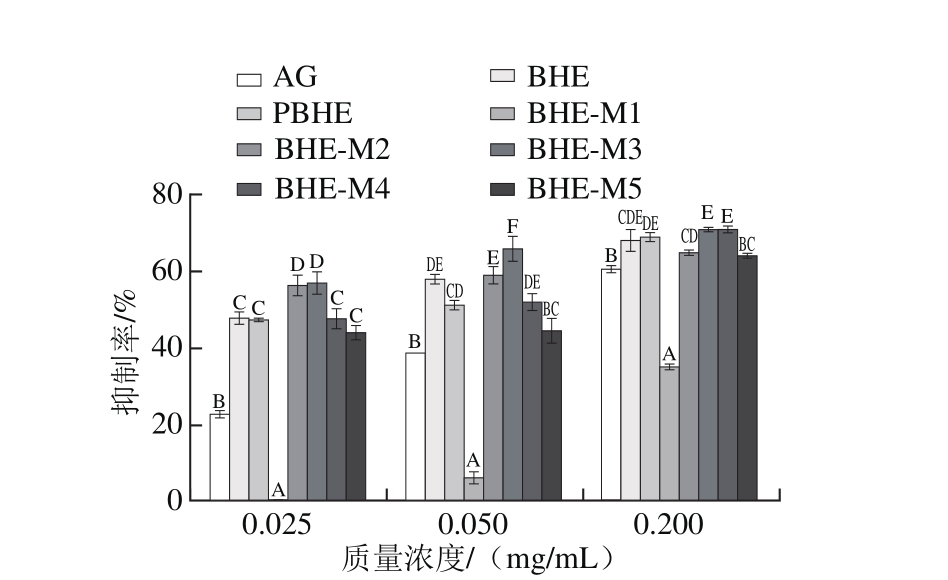
图4 果糖-BSA体系中抑制AGEs活性
Fig. 4 Inhibitory effect of BHE and its fractions on AGEs formation in fructose-BSA system
BSA与人血清白蛋白具有相似性,常用于评价体内非酶糖基化反应。分离纯化组分在不同还原糖-BSA体系中抑制AGEs生成结果见图3(葡萄糖-BSA)和图4(果糖-BSA),BHE经大孔树脂两次纯化后除BHE-M1组分外,其他组分在葡萄糖-BSA、果糖-BSA两个体系中显示出极强的抑制AGEs活性,其中BHE-M4抑制活性最高。当质量浓度分别为0.025、0.050、0.200 mg/mL时BHE-M4抑制率分别为55.48%、57.16%、69.92%,分别高于同体系AG的抑制率22.85%、34.15%、60.40%;在果糖-BSA体系中各组分抗AGEs生成活性与葡萄糖-BSA体系中的趋势一致,BHE-M4组分仍然显示出较高的抑制活性,当质量浓度为0.025、0.050、0.200 mg/mL时抑制率分别为47.23%、51.94%、72.33%,而同质量浓度AG的抑制率分别为22.51%、38.42%、60.39%(图4)。
常见天然植物的黄酮对蛋白非酶糖基化反应普遍存在抑制作用[25-27],如芦荟的抑制率达到95%以上。荞麦花总黄酮也能抑制体内外蛋白质非酶糖基化终产物的形成[28]。本实验结果表明,BHE和PBHE及BHE-M组分均对蛋白质非酶糖基化生成有较强的抑制作用,比AG更为显著。
2.3.2 纯化组分在MGO-BSA体系中的AGEs抑制率

图5 MGO-BSA体系中抑制AGEs生成的活性
Fig. 5 Inhibitory effect of BHE and its fractions on AGEs formation in MGO-BSA system
除最常见的还原糖-BSA体系外,直接利用已知非酶糖基化反应中生成的中间体,如MGO、乙二醛(glyoxal,GO)试剂作为提供羰基的试剂而建立的体系与葡萄糖或果糖的还原糖体系比较,该体系反应时间更短,效率更高。研究表明芦丁[29]、槲皮素[30]具有抑制MGO-BSA、GO-BSA、还原糖-BSA体系中AGEs形成的作用。本实验以MGO作为提供羰基的试剂。质量浓度为0.025 mg/mL和0.050 mg/mL时,各组分对AGEs生成的抑制率分别在18.04%~23.34%和22.97%~32.47%范围内;当质量浓度为0.200 mg/mL时,除BHE-M1、BHE-M5组分外其余组分显示出较高的抑制AGEs生成活性,且与BHE-M1、BHE-M5组分有显著性差异(图5),其中质量浓度0.200 mg/mL时BHE、BHE-M2、BHE-M3、BHE-M4组分抑制率分别达到53.64%、57.2%、57.38%、59.13%,较同质量浓度AG分别高出4.89%、8.45%、8.63%、10.38%。
糖尿病的危害主要在于其高糖高脂引发的糖尿病并发症。大量研究证实,引发糖尿病并发症的根本物质是AGEs。研究表明,AGEs在糖尿病及其并发症如糖尿病肾病[31]、动脉粥样硬化[32]、糖尿病视网膜病变、阿尔茨海默症[33]等疾病的发生以及发展过程中起着主要作用。已经有报道证实,高AGEs饲料可促进糖尿病鼠和正常鼠的肾功能恶化[34],而苦荞提取物具有抑制大鼠体内蛋白非酶糖基化反应的作用[35]。本实验采用的3 个蛋白糖基化体系中除BHE-M1组分外,各组分均显示出较强的抑制AGEs活性,其中BHE-M4组分活性最高,该组分也是黄酮类物质富集的组分(图1)。
2.4 BHE-M4组分黄酮类物质分析
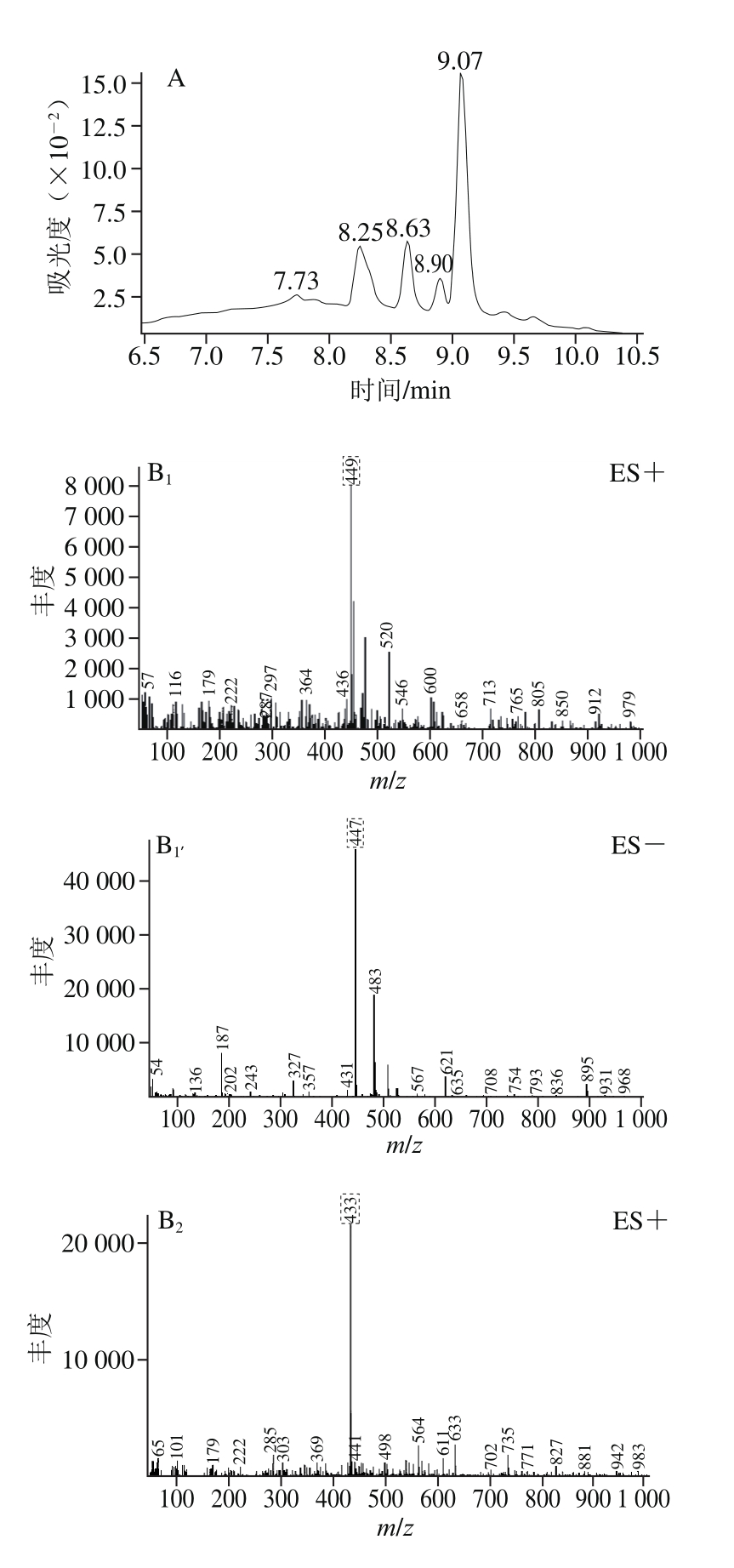
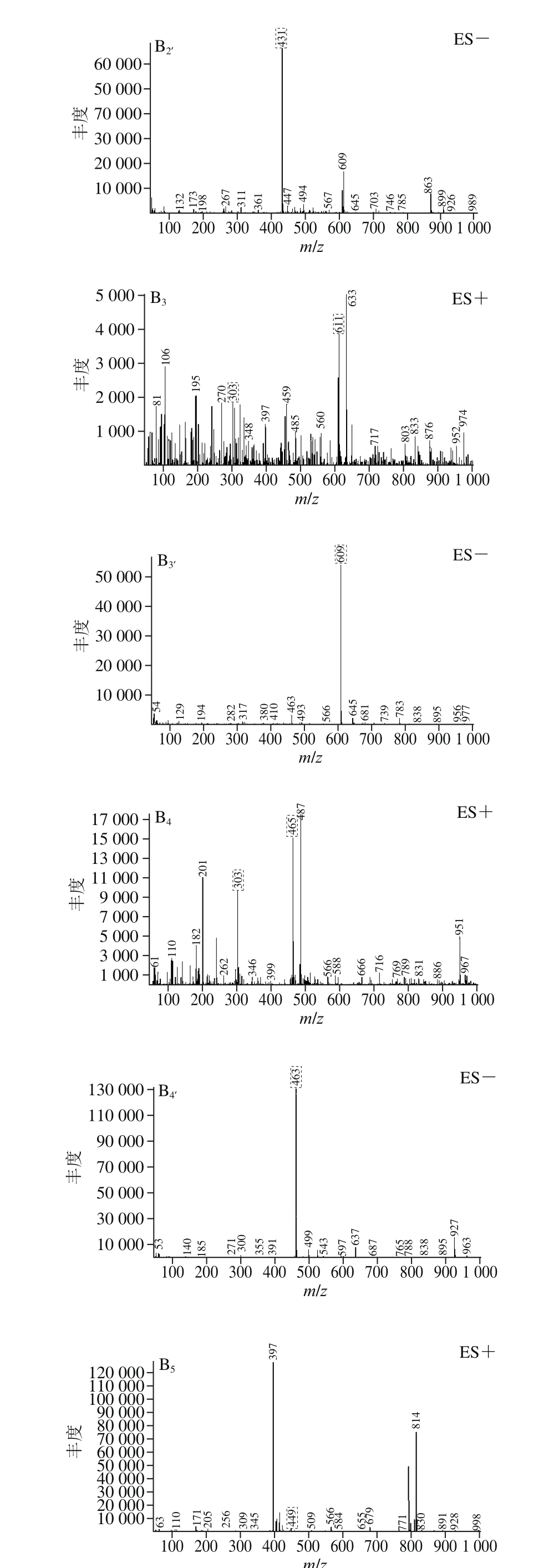
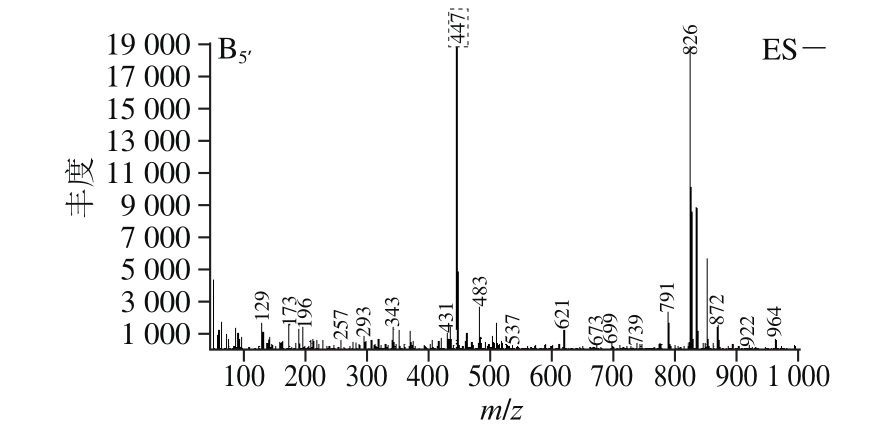
图6 BHE-M4组分的总离子流图(A)及化合物的正负离子质谱图(B)
Fig. 6 Total ion chromatogram of BHE-M4 (A) and mass chromatograms of the compounds separated from it in positive and negative ion modes (B)
ES+、ES-.分别代表正负离子质谱图;下标1~5.分别表示化合物1~5。
α-葡萄糖苷酶活力和抗蛋白质糖基化终末产物抑制率测定实验结果显示,黄酮含量高的组分即BHE-M4组其生物活性最高,因此采用HPLC-MS技术对BHE-M4组进行成分分析。通过总离子流图(图6A)、正负离子质谱图(图6B)共得到5 个化合物,对5 个化合物进行推断。化合物1:正负离子出峰m/z分别为449和447,推测分子质量为448,m/z 287为[山奈酚+H]+,推测苷元为山奈酚,结构中含有1 个半乳糖或者1 个葡萄糖。根据文献[36]推断该化合物为山奈酚-3-O-β-D-葡萄糖苷或山奈酚-3-O-β-D-半乳糖苷;化合物2:正负离子出峰m/z分别为433和431,推测该分子质量为432,根据文献[37]推断该化合物为牡荆素。化合物3:正负离子出峰m/z分别为611和609,推测分子质量为610,m/z 303为[槲皮素+H]+,推测苷元为槲皮素,结构中含有1 个葡萄糖和1个鼠李糖,推测为芸香糖(芦丁糖)。根据文献[36]推断该化合物为芦丁。化合物4:正负离子出峰m/z分别为465和463,推测分子质量为464,m/z 303为[槲皮素+H]+,推测苷元为槲皮素,结构中含有1 个葡萄糖和1 个半乳糖,根据文献[38]推断该化合物为异槲皮苷或金丝桃苷,异槲皮苷和金丝桃苷具有相同的苷元和相同分子质量的糖,且总分子质量相同,故暂时无法进一步推断。化合物5:正负离子出峰m/z分别为449和447,推测分子质量为448,根据文献[39]推断该化合物为槲皮苷。
综上,BHE-M4中主要黄酮类化合物可能为山奈酚-3-O-β-D-葡萄糖苷或山奈酚-3-O-β-D-半乳糖苷、牡荆素、芦丁、异槲皮苷或金丝桃苷、槲皮苷。
3 结 论
本研究将荞麦壳提取物经两种型号大孔树脂两次纯化后,分析各组分总黄酮含量、α-葡萄糖苷酶活力以及AGEs抑制率。得到的结论为高黄酮含量组分BHE-M4的α-葡萄糖苷酶活力抑制率以及AGEs抑制率最高。对BHE-M4组分继续通过HPLC-MS进行成分分析,共得到5 种可能的黄酮类化合物,分别为山奈酚-3-O-β-D-葡萄糖苷或山奈酚-3-O-β-D-半乳糖苷、牡荆素、芦丁、异槲皮苷或金丝桃苷、槲皮苷。对该组分进一步进行定性定量分析,确定其化学成分,将是未来的主要研究方向。
参考文献:
[1] 史建强, 李艳琴, 张宗文, 等. 荞麦及其野生种遗传多样性分析[J]. 植物遗传资源学报, 2015, 16(3): 443-450. DOI:10.13430/j.cnki.jpgr.2015.03.002.
[2] 张辉, 曲文祥, 李书田. 内蒙古特色作物[M]. 北京: 中国农业科学技术出版社, 2010: 303-307.
[3] 王炜, 欧巧明, 杨随庄. 苦荞麦化学成分及生物活性研究进展[J]. 杂粮作物, 2010, 30(6): 419-423. DOI:10.3969/j.issn.2095-0896.2010.06.015.
[4] 方芳. 黄酮类天然药物有效成分治疗糖尿病及其并发症研究进展[J].中山大学研究生学刊(自然科学、医学版), 2007, 28(1): 39-44.
[5] 路静静, 赵余庆. 荞麦皮的化学成分、生物活性及应用研究进展[J]. 食品研究与开发, 2016, 37(22): 210-213. DOI:10.3969/j.issn.1005-6521.2016.22.047.
[6] ZHANG Z L, ZHOU M L, TANG Y, et al. Bioactive compounds in functional buckwheat food[J]. Food Research International, 2012,49(1): 389-395. DOI:10.1016/j.foodres.2012.07.035.
[7] NIU F L, CHU J X, HAN S Y, et al. Inhibitory eあects of total ぼavones of buckwheat flower on the non-enzymatic glycation of proteins in vivo and in vitro[J]. Chinese Journal of Clinical Rehabilitation, 2006,10(43): 210-213. DOI:10.3321/j.issn:1673-8225.2006.43.048.
[8] 韩淑英, 陈晓玉, 王志路, 等. 荞麦花总黄酮对体内外蛋白质非酶糖基化的抑制作用[J]. 中国药理学通报, 2004, 20(11): 1242-1244.DOI:10.3321/j.issn:1001-1978.2004.11.013.
[9] 李鹏程, 朴春红, 张岚, 等. 荞麦壳黄酮提取物对2型糖尿病大鼠的血糖改善作用及机制[J]. 食品科学, 2017, 38(5): 244-250.DOI:10.7506/spkx1002-6630-201705040.
[10] 朴春红, 刘丽苹, 初琦, 等. 热水法提取荞麦壳黄酮工艺优化及抗氧化活性[J]. 吉林农业大学学报, 2014, 36(6): 719-722; 734.DOI:10.13327/j.jjlau.2014.2266.
[11] 胡月, 王鸿飞, 刘飞, 等. 费菜总黄酮分离纯化工艺的研究[J]. 食品工业科技, 2014, 35(17): 213-216; 221. DOI:10.13386/j.issn1002-0306.2014.17.038.
[12] GUO X D, WU C S, MA Y J, et al. Comparison of milling fractions of tartary buckwheat for their phenolics and antioxidant properties[J].Food Research International, 2012, 49(1): 53-59. DOI:10.1016/j.foodres.2012.07.019.
[13] 范文娅, 吴正钧, 季红, 等. 不同干酪乳杆菌菌株对α-葡萄糖苷酶抑制作用的比较[J]. 食品与发酵工业, 2012, 38(4): 29-33.DOI:10.13995/j.cnki.11-1802/ts.2012.04.003.
[14] 韩淑英, 李继安, 姜春花, 等. 10 味中药提取物对α-葡萄糖苷酶的抑制作用[J]. 中华中医药杂志, 2009, 24(8): 1035-1037.
[15] WANG Xuan, ZHANG Liangshuan, DONG Lulu. Inhibitory effect of polysaccharides from pumpkin on advanced glycation end-products formation and aldose reductase activity[J]. Food Chemistry, 2012,130(4): 821-825. DOI:10.1016/j.foodchem.2011.07.064.
[16] HARSHA P S C S, GARDANA C, SIMONETTI P, et al.Characterization of phenolics, in vitro reducing capacity and antiglycation activity of red grape skins recovered from winemaking by-products[J]. Bioresource Technology, 2013, 140(7): 263-268.DOI:10.1016/j.biortech.2013.04.092.
[17] POKKAEW R, WANG S H, LIU C D, et al. Properties and characterization of antioxidant and antiglycative activities for the multiple harvests of aquatic- and field-cultivated peanut leaves and stems[J]. Journal of Functional Foods, 2013, 5(1): 327-336.DOI:10.1016/j.jあ.2012.11.003.
[18] 杨喆, 万山, 张乔会, 等. 大孔树脂纯化山杏核壳总黄酮的工艺优化[J]. 食品科学, 2015, 36(10): 38-42. DOI:10.7506/spkx1002-6630-201510008.
[19] 杨芙莲, 夏银, 任蓓蕾. 大孔树脂对甜荞麦壳类黄酮的纯化研究[J]. 食品科技, 2009, 34(1): 135-139. DOI:10.13684/j.cnki.spkj.2009.01.006.
[20] 陈晶, 李琪, 黄春萍, 等. 枇杷花总黄酮、总三萜的大孔树脂制备工艺[J]. 食品科学, 2015, 36(18): 58-63. DOI:10.7506/spkx1002-6630-201518010.
[21] 朱丽艳, 郭兰, 王瑞雪, 等. 荞麦花总黄酮和槲皮素对α-葡萄糖苷酶活性的影响[J]. 时珍国医国药, 2010, 21(5): 1135-1136. DOI:10.3969/j.issn.1008-0805.2010.05.051.
[22] 李艳琴, 周凤超, 陕方, 等. 荞麦麸皮提取物对α-葡萄糖苷酶活性的影响[J]. 食品科学, 2010, 31(17): 10-13.
[23] 王娟, 覃景芳, 柳春艳, 等. 小叶薜荔根茎提取物抗α-葡萄糖苷酶及乙酰胆碱酯酶活性研究[J]. 广西师范大学学报(自然科学版), 2017,35(1): 69-74. DOI:10.16088/j.issn.1001-6600.2017.01.012.
[24] 张海凤, 董亚琳, 胡萨萨, 等. 五种中药对两种不同来源α-葡萄糖苷酶活性的抑制作用比较[J]. 中药材, 2008, 31(7): 1024-1027.DOI:10.3321/j.issn:1001-4454.2008.07.028.
[25] 李楠, 许文凤, 叶振南, 等. 9 种植物粗提总黄酮的体外降脂及抑制非酶糖基化的活性[J]. 江苏农业科学, 2014, 42(6): 291-293.DOI:10.3969/j.issn.1002-1302.2014.06.104.
[26] 房红娟, 李红姣, 张双凤, 等. 加工条件对BSA-Glucose模拟体系中晚期糖基化末端产物形成的影响[J]. 食品科学, 2012, 33(21): 6-10.
[27] 邓荣华, 陆敏, 夏秋琴, 等. 芦蒿秸秆黄酮类化合物对晚期蛋白质糖基化终末产物形成的抑制作用[J]. 食品科学, 2014, 35(9): 123-127.DOI:10.7506/spkx1002-6630-201409025.
[28] 牛凤玲, 储金秀, 韩淑英. 荞麦花总黄酮对体内外蛋白质非酶糖基化的抑制作用[J]. 中国临床康复, 2006, 10(43): 210-213.
[29] 李晓明, 邓荣华, 孔阳辉, 等. 芦丁抑制牛血清白蛋白糖基化[J]. 食品科学, 2014, 35(3): 85-89. DOI:10.7506/spkx1002-6630-201403018.[30] 陆敏, 李晓明, 卢永翎, 等. 槲皮素抑制蛋白糖基化及DNA损伤[J]. 食品科学, 2016, 37(1): 104-108. DOI:10.7506/spkx1002-6630-201601019.
[31] NAKAYAMA S, WATADA H. The impact of strict glycemiccontrol on diabetic microangiopathy[J]. Nihon Rinsho, 2010, 68(9): 131-136.
[32] GOLDIN A, BECKMAN J A, SCHMIDT A M, et al. Advanced glycation end products sparking the development of diabetic vascular injury[J]. Circulation, 2006, 114: 597-605.
[33] STEINHART H. The Maillard reaction: chemistry, biochemistry and implications[J]. Australian Journal of Chemistry, 2005, 58(10): 756-756.
[34] 张双凤, 苏亚儒, 李巨秀. 膳食中晚期糖基化终产物对大鼠肾脏的影响[J]. 食品科学, 2013, 34(21): 315-320. DOI:10.7506/spkx1002-6630-201321063.
[35] 刘洋, 柳春, 近藤隆一郎, 等. 苦荞麦对糖尿病大鼠血糖蛋白非酶糖基化反应的影响[J]. 辽宁中医药大学学报, 2009, 11(5): 195-197.DOI:10.13194/j.jlunivtcm.2009.05.197.liuy.094.
[36] 叶晓珂, 秦沛, 李伟, 等. 液相色谱-串联质谱分离鉴定树莓叶中黄酮类化合物[J]. 质谱学报, 2011, 32(5): 271-277.
[37] 吴燕红, 万林春, 吴良发, 等. 乳块消颗粒中极性和疏水性成分的LC-MS/MS法同时测定[J]. 药物分析杂志, 2016, 36(8): 1385-1391.DOI:10.16155/j.0254-1793.2016.08.10.
[38] 杨云舒, 李荣, 姜子涛, 等. 月桂叶中黄酮类成分的分析鉴定[J]. 现代食品科技, 2016, 32(7): 270-275. DOI:10.13982/j.mfst.1673-9078.2016.7.041.
[39] 覃小丽, 孙慧园, 杨武, 等. UPLC-ESI-Q-TOF-MS/MS分析槲皮苷在大鼠肠道菌群中的代谢[J]. 中国中药杂志, 2017, 42(2): 357-362.DOI:10.19540/j.cnki.cjcmm.20161222.018.