肌原纤维蛋白(myofibrillar protein,MP)属于盐溶性蛋白,是肌肉蛋白质的主要组分,其主要功能特性是能够热诱导形成凝胶,从而赋予肉制品尤其是肉糜制品良好的质地与口感。溶解度与MP的乳化凝胶特性紧密相关。在一定离子强度范围内,溶解度随离子强度的增加而增加,因此,在肉制品加工中通常加入NaCl以提高离子强度,同时通过斩拌和混合来提高MP的溶解度。有研究表明,一定离子强度范围内,随着离子强度的增加,猪肉MP的凝胶强度增大[1]。NaCl浓度为0.6 mol/L时,MP的溶解度较高,能够形成规则有序的三维凝胶网络结构,而在低浓度NaCl条件下,大部分MP处于未溶解状态,不能形成稳定的凝胶结构[2]。
香辛料是肉制品加工中的主要辅料,香辛料的使用一方面可以赋予产品一定的风味,另一方面还能起到抗氧化、抑菌等作用。目前,香辛料提取物在肉制品抑菌、抗氧化方面的研究报道较多。将迷迭香提取物和香蜂花提取物应用于熟猪肉糜制品,可以显著降低硫代巴比妥酸值和己醛含量,说明二者起到了抑制脂肪氧化的作用[3-4]。作为肉制品加工中两种主要的辅料,NaCl和香辛料都会对蛋白质的结构和功能特性产生一定的影响;但是,二者究竟如何协同影响MP的结构和功能特性,进而影响肉糜制品的品质,尚不完全清楚。本研究旨在制备含不同浓度NaCl的猪肉MP与迷迭香提取物的混合物,通过测定巯基含量、内源荧光强度、流变特性、凝胶强度、保水性,以探讨NaCl浓度和迷迭香提取物二者共同对MP结构和凝胶特性的影响。
1 材料与方法
1.1 材料与试剂
三元猪背最长肌购自锦州大润发超市;迷迭香购自当地药房。
氯化钠、磷酸二氢钠、磷酸氢二钠、乙醇、磷酸钠、氯化镁、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)等均为国产分析纯;Tris 美国Sigma公司。
1.2 仪器与设备
FW-200高速万能粉碎机 北京中兴伟业仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;THZ-100B恒温培养摇床 上海一恒科学仪器有限公司;ALPHA 1-2LD plus冷冻干燥机 德国Martin Christ公司;JYS-A900绞肉机 九阳股份有限公司;T25数显型均质机、RCT基本型磁力搅拌器 德国IKA集团;PL602-L电子天平 上海速展计量仪器有限公司;970CRT荧光分光光度计 上海精密科学仪器有限公司;UV-2550紫外-可见分光光度计 岛津仪器(苏州)有限公司;TGL-20M台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;TA-XT Plus型质构分析仪 英国Stable Micro Systems公司;DHR-1流变仪 美国TA仪器公司。
1.3 方法
1.3.1 迷迭香提取物的制备
参照Zhang Xue等[5]的方法并做适当修改。迷迭香洗净沥干,放置45 ℃干燥箱中烘干,用高速万能粉碎机粉碎,过40 目筛备用。取50 g粉末于1 000 mL带塞的锥形瓶中,加入体积分数为95%的乙醇400 mL,塞紧瓶塞,置于恒温培养摇床,55 ℃、110 r/min提取12 h,过滤,滤渣加入200 mL 95%的乙醇重提12 h后过滤,合并滤液,旋转蒸发仪真空浓缩2 h(55 ℃、0.08 MPa),浓缩液在-50 ℃条件下真空冷冻干燥,真空度为7 Pa。所得提取物在-20 ℃保存备用(迷迭香提取率21.28%、含水率5%)。
1.3.2 提取MP与制备样品
参照Liu Gang等[6]的方法并略作修改。称取约500 g左右的猪肉,破碎并加入4 倍体积的提取液(10 mmol/L Na3PO4、0.1 mol/L NaCl、2 mmol/L MgCl2和1 mmol/L EDTA,pH 7.0),匀浆60 s,3 500 r/min冷冻离心15 min,取沉淀重复上述步骤两次,最后所得沉淀加入4 倍体积0.1 mol/L NaCl溶液,按上述离心条件洗涤沉淀3 次,最后一次离心前用4 层纱布过滤,然后用0.1 mol/L HCl溶液调节pH值至6.0,所得MP于4 ℃冷藏备用。以牛血清白蛋白为标准品,利用双缩脲法测定MP含量。
配制质量浓度为5 mg/mL和40 mg/mL的MP溶液,分别加入0.01 g/g pro的迷迭香提取物,再向混合物中添加NaCl,使其终浓度分别为0.00、0.15、0.45、0.60 mol/L。配制好MP混合溶液于4 ℃冷藏过夜(12 h),同时以不添加迷迭香提取物的MP为对照,用于后续各项指标的测定。
1.3.3 巯基质量摩尔浓度的测定
参照di Simplicio等[7]的方法并略作改进,取上述5 mg/mL的MP溶液1 mL,加8 mL Tris-甘氨酸溶液溶解,均质后冷冻10 000 r/min离心15 min,除去不溶性蛋白并取上清液4.5 mL,加入0.5 mL 10 mmol/L Ellman试剂,摇匀静置30 min后,在412 nm波长处测吸光度,以磷酸盐缓冲溶液为对照。巯基质量摩尔浓度的计算采用摩尔消光系数法,所得巯基质量摩尔浓度以μmol/g pro表示,计算如式(1)所示。
式中:A为吸光度;ε为摩尔消光系数(13 600 L/(mol·cm));D为稀释倍数。
1.3.4 内源荧光强度的测定
依据李学鹏等[8]的方法并适当修改。准确量取0.5 mL 5 mg/mL的MP溶液,用pH 7.0的50 mmol/L磷酸盐缓冲液稀释至0.1 mg/mL,磁力搅拌2 h,10 000 r/min冷冻离心30 min,用荧光分光光度计测定。参数设置:激发波长为295 nm,波长扫描范围为300~400 nm,扫描速率为12 000 nm/min,激发和发射狭缝宽度均为2.5 nm,灵敏度为3。
1.3.5 MP凝胶的制备
取按照1.3.2节处理好的40 mg/mL的MP溶液15 mL,置于称量瓶中,密封,放置70 ℃恒温水浴锅中,持续水浴加热30 min,随后自来水冷却30 min,凝胶样品贮存在2~4 ℃的冰箱中备用。测定前将MP凝胶在室温下放置20 min。
1.3.6 凝胶强度的测定
采用TA-XT Plus型质构分析仪进行测定。将待测样品与称量瓶置于平台,测定参数为:探头型号选择P/0.5,下压距离为凝胶高度的50%,触发力为5 g,测试前速率2 mm/s,测试速率1 mm/s,测试后速率2 mm/s。
1.3.7 保水性的测定
参照Kocher等[9]的方法并适当修改。称取5 g凝胶样品,置于15 mL离心管中,称质量记为m2/g,随后于3 000×g冷冻离心15 min,除去水分后再次称质量,记为m1/g,离心管质量记为m0/g,保水性按式(2)进行计算。
1.3.8 动态流变特性的测定
取一定量制备好的MP溶液,采用流变仪测定,选用50 mm平板测试,将不同处理条件下的MP乳液均匀涂布于测试平台,消除气泡并涂膜硅油密封,测试参数如下:频率为0.1 Hz,应变2%,夹缝间距为0.5 mm,起始温度20 ℃,升温速率1 ℃/min,终止温度80 ℃,在该参数下测定储能模量(G’)。
1.4 数据统计分析
每个实验重复3 次,结果表示为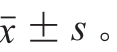 利用SPSS 19.0软件中的Linear Models程序进行数据统计分析,差异显著性分析采用LSD法,P<0.05为显著。使用SigmaPlot 12.0软件作图。
利用SPSS 19.0软件中的Linear Models程序进行数据统计分析,差异显著性分析采用LSD法,P<0.05为显著。使用SigmaPlot 12.0软件作图。
2 结果与分析
2.1 NaCl浓度和迷迭香提取物对MP结构的影响


图1 NaCl浓度对内源荧光强度的影响
Fig. 1 Effect of NaCl concentration and rosemary extract on intrinsicぼuorescence intensity of myoベbrillar proteins
A. MP+迷迭香;B. MP。图5同。
蛋白质在天然状态下有特定的空间结构,蛋白质中的色氨酸大量埋藏于内部的疏水环境,色氨酸内源荧光强度较高,荧光发射波长较短;但是,在部分解折叠情况下,蛋白质荧光强度降低,发射波长发生红移[10]。由图1可以看出,添加迷迭香提取物组与对照组的内源荧光强度随NaCl浓度的增加并未呈现规律性的变化,具体原因有待进一步研究;而当NaCl浓度为0.45 mol/L时,与对照组相比,添加迷迭香提取物组色氨酸发射波长由332 nm红移至334 nm,内源荧光强度下降。说明加入迷迭香提取物后MP中的部分色氨酸暴露于极性环境中,由此造成三级结构发生改变,其特定空间结构部分解折叠,色氨酸内源荧光强度下降有可能来自于肌球蛋白杆状尾部的部分解螺旋[11],也有可能来自于肌球蛋白头部的结构变化(杆状尾部对肌球蛋白分子荧光强度的贡献只占总量的27%)[12-13],迷迭香提取物引起的MP三级结构改变究竟来自于肌球蛋白的头部还是杆状尾部,需要进一步证实。此外,迷迭香提取物中的多酚、萜类[14]还有可能通过“屏蔽效应”影响MP的内源荧光强度,这种效应可以通过“手和手套”模型来解释(蛋白中部分疏水基团形成“手套”,而多酚通过氢键等与蛋白结合形成“手”,可能是这种屏蔽效应导致荧光强度下降[15]),该“屏蔽效应”还有可能体现在迷迭香提取物中的酚类物质等与蛋白结合,吸附于蛋白质表面,可能对蛋白质起一定保护作用,导致荧光强度降低[16]。
2.2 NaCl浓度和迷迭香提取物对巯基质量摩尔浓度的影响
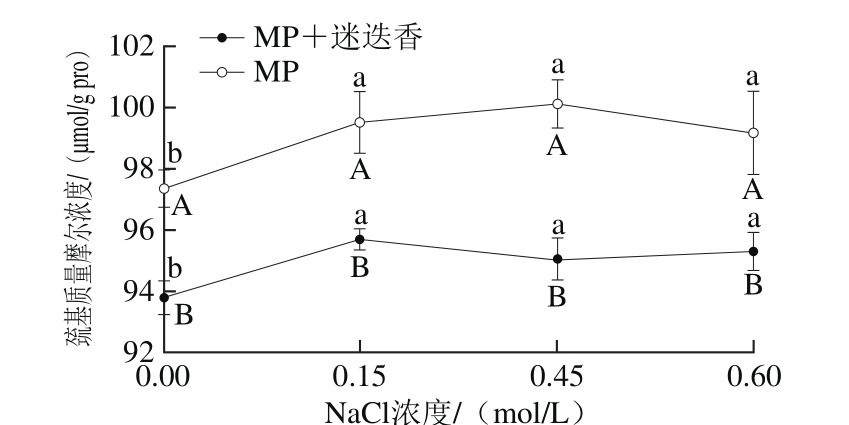
图2 NaCl浓度和迷迭香提取物对巯基质量摩尔浓度的影响
Fig. 2 Effect of NaCl concentration and rosemany extract on sulfhydryl group content
小写字母不同表示同组不同NaCl浓度间差异显著(P<0.05);大写字母不同表示相同NaCl浓度不同组间差异显著(P<0.05)。下同。
巯基是MP中重要的活性基团,易被氧化形成二硫键,引起蛋白质分子间交联、聚合,进而影响蛋白质的功能特性[17]。从图2可以看出,当NaCl浓度从0.15 mol/L增加至0.60 mol/L时,加或不加迷迭香提取物的MP的巯基质量摩尔浓度变化不显著(P>0.05),说明增加离子强度对MP巯基质量摩尔浓度无显著影响。当NaCl浓度一定时,与对照组相比,加入迷迭香提取物导致巯基质量摩尔浓度显著降低(P<0.05)。这可能是由于迷迭香提取物中主要成分为鼠尾草酚和鼠尾草酸,二者均含有一个能与巯基结合的位点,因此使得巯基含量下降[18-19]。Prodpran等[20]研究多酚对鱼肉MP总巯基含量的影响时,也得到了类似结果,即酚类化合物导致总巯基含量降低,可能是由于巯基和酚羟基之间相互作用形成更稳定的构象。此外,高浓度的绿茶多酚也能与MP巯基通过共价交联形成巯基-醌加成物,阻碍蛋白质之间形成稳定的二硫键[21]。
2.3 NaCl浓度和迷迭香提取物对凝胶强度的影响

图3 NaCl浓度和迷迭香提取物对凝胶强度的影响
Fig. 3 Effect of NaCl concentration and rosemary extract on gel strength
从图3可以看出,NaCl浓度在0.00~0.15 mol/L范围内,MP+迷迭香组和MP组的凝胶强度变化不显著(P>0.05),而当NaCl浓度从0.15 mol/L增加至0.60 mol/L时,两组的凝胶强度均显著增加(P<0.05)。这是由于一定范围内随着NaCl浓度的增加,MP与NaCl离子互作形成离子基团双电子层,降低MP分子之间的静电相互作用,增加MP分子之间的斥力,水化作用增强,从而改善凝胶特性[22-23]。此外,MP分子之间斥力的增加,导致MP膨胀,持水力增大,这与保水性的结果一致[24]。当NaCl浓度为0.00、0.15 mol/L时,MP+迷迭香组的凝胶强度与对照组无显著差异(P>0.05),其主要原因可能在于MP凝胶特性的充分发挥需要提供足够的溶解度,NaCl浓度较低时(0.00、0.15 mol/L),MP的溶解度较差。高溶解度状态下(0.45、0.60 mol/L)迷迭香提取物可以提高MP的凝胶强度,但在不同NaCl浓度条件下呈现出不同的结果,NaCl浓度为0.45 mol/L时,MP+迷迭香组的凝胶强度显著高于MP组(P<0.05),这可能是由于该条件下,迷迭香提取物中含有的多酚类物质很容易形成邻苯醌或邻苯半醌,该物质与蛋白中的巯基、氨基等基团发生亲核加成反应,使蛋白和酚之间形成C—N或C—S共价键[25-28]。NaCl浓度为0.60 mol/L时,MP+迷迭香组的凝胶强度高于MP组,但差异不显著(P>0.05),离子强度的增加可能阻碍了部分蛋白-多酚共价键的形成,可见,迷迭香提取物对凝胶强度的显著增效作用依赖于特定NaCl浓度,具体原因有待进一步研究。
2.4 NaCl浓度和迷迭香提取物对凝胶保水性的影响

图4 NaCl浓度和迷迭香提取物对保水性的影响
Fig. 4 Effect of NaCl concentration and rosemary extract on waterholding capacity
从图4可以看出,当NaCl浓度从0.00 mol/L增加至0.15 mol/L时,MP+迷迭香组和MP组的保水性没有显著变化(P>0.05);随着NaCl浓度继续增加至0.45 mol/L时,两组的保水性均呈显著增加趋势(P<0.05);当NaCl浓度继续增加至0.60 mol/L时,MP组的保水性依旧显著增加(P<0.05),而MP+迷迭香组增加不显著(P>0.05)。保留肉品内部的水分有两个必要条件,首先肉中含有水分存在的空间,其次含有维持水分的作用力。有研究证实,水分在肉中的存留,主要依赖于水分子和蛋白之间的相互作用,如氢键、毛细管作用力、色散力等[29]。MP作为肉中的结构蛋白质,为肉中的水分提供空间;蛋白所带的净负电荷形成强有力的吸附中心,为保留水分提供作用力。添加适量的NaCl可以显著提高离子强度,有效改善MP的凝胶能力,使其形成均匀的网状结构,同时随着离子强度增加,MP所带净负电荷增加;蛋白与蛋白分子之间以及蛋白与水之间的作用增强,使得蛋白空间内持水能力增加,保水性能增强[30-31]。MP+迷迭香组和对照组相比,NaCl浓度为0.45 mol/L时,MP+迷迭香组的保水性显著高于MP组(P<0.05),其他NaCl浓度下差异不显著(P>0.05)。一定离子强度下,添加一定量的迷迭香提取物能够与MP相互作用,影响蛋白分子间以及蛋白与水之间的作用,使凝胶形成能力增强,从而对持水能力起一定促进作用。此外,酚与蛋白之间的相互作用能够减小蛋白聚合物链间的空隙,从而使凝胶结构增强,持水能力增加[32]。
2.5 NaCl浓度和迷迭香提取物对MP凝胶流变特性的影响
流变特性作为MP凝胶的重要特性,能够反映凝胶的品质。储能模量(G’)反映MP凝胶的弹性特征,G’越高,表明形成凝胶的能力越强[2]。从图5可以看出,当NaCl浓度为0.00、0.15 mol/L时,MP+迷迭香组和MP组的G’均未呈现典型的“几”字形曲线,表明在该条件下,MP未能形成稳定的凝胶结构。这是由于低离子强度下,MP未能充分溶解,导致凝胶形成能力弱,G’较低。当NaCl浓度为0.45、0.60 mol/L时,G’从40 ℃开始逐渐增加,到46 ℃时达到峰值,这是由于该区间内肌球蛋白头部的α-螺旋结构开始解旋,头部交联,开始形成凝胶;随后G’从46 ℃开始下降,是由于肌球蛋白尾部变性展开,蛋白稳定性降低,黏弹性降低;从50 ℃开始,G’一直呈上升趋势,主要是因为大多数肌球蛋白分子可能已经展开,成为随机线圈结构,增强了蛋白质之间的交联,从而产生一个稳定且不可逆的凝胶结构[33-34]。一定NaCl浓度下,尤其当NaCl浓度为0.45 mol/L时,MP+迷迭香组的G’高于未加提取物的MP组,这可能是由于添加的迷迭香提取物与MP相互作用后产生更多结合位点,形成酰胺键,增大了蛋白与酚的交联密度,导致弹性和黏性增强[35-36]。

图5 NaCl浓度和迷迭香提取物对MP储能模量的影响
Fig. 5 Effect of NaCl concentration and rosemary extract on storage modulus of myoベbrillar proteins
3 结 论
依赖于特定NaCl浓度(0.45 mol/L),迷迭香提取物可以有效“弥补”减盐对MP凝胶特性的不利影响。提取物中含有的酚酸、萜类等组分改变了肌球蛋白的三级结构,这种有利的部分解螺旋状态可以在减盐条件下有效改善MP的凝胶网络结构,这是减盐后凝胶强度、储能模量和保水性没有显著下降的重要原因。研究结果可为寻找新型NaCl替代物提供一定的理论依据。
参考文献:
[1] JANG H S, CHIN K B. Emulsifing and gelling properties of pork myofibrillar protein as affected by various NaCl levels and pH values[J]. Korean Journal of Food Science and Animal Resources,2009, 81(3): 565-572. DOI:10.5851/kosfa.2011.31.5.727.
[2] 吴菊清, 魏朝贵, 韩敏义, 等. NaCl对猪肉肌原纤维蛋白乳化体系加工特性的影响[J]. 南京农业大学学报, 2014, 37(6): 83-88.DOI:10.7685/j.issn.1000-2030.2014.06.012.
[3] LARA M S, GUTIERREZ J I, TIMÓN M, et al. Evaluation of two natural extracts (Rosmarinusofficinalis L., and Melissa officinalis L.) as antioxidants in cooked pork parties packed in MAP[J]. Meat Science, 2011, 88(3): 481-488. DOI:10.1016/j.meatsci.2011.01.030.
[4] 贾娜, 郭倩, 宋立, 等. 迷迭香提取对鸡肉糜冷藏过程中品质特性的影响[J]. 食品与发酵科技, 2014, 50(1): 60-63; 91. DOI:10.3969/j.issn.1674-506X.2014.01-015.
[5] ZHANG Xue, KONG Baohua, XIONG Youling L., et al. Production of cured meat color in nitrite-free Harbin red sausage by Lactobacillus fermentum fermentation[J]. Meat Science, 2007, 77(4): 593-598.DOI:10.1016/j.meatsci.2007.05.010.
[6] LIU Gang, XIONG Youling L.. Contribution of lipid and protein oxidation to rheological differences between chicken white and red muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1996, 44(3): 779-784. DOI:10.1021/jf9506242.
[7] DI SIMPLICIO P, CHEESEMAN K, SLATER T. The reactivity of the SH group of bovine serum albumin with free radicals[J]. Free Radical Research, 1991, 14(4): 253-262. DOI:10.3109/10715769109088954.
[8] 李学鹏, 周凯, 王金厢, 等. 羟自由基对六线鱼肌原纤维蛋白的氧化规律[J]. 中国食品学报, 2014, 14(6): 19-27. DOI:10.16429/j.1009-7848.2014.06.017.
[9] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science,1993, 58(5): 1040-1046. DOI:10.1111/j.1365-2621.1993.tb06107.x.
[10] CAO Y G, TRUE A D, CHEN J, et al. Dual role (anti-and pro-oxidant)of gallic acid in mediating myofibrillar protein gelation and gel in vitro digestion[J]. Journal of Agricultural and Food Chemistry, 2016,64(15): 3054-3061. DOI:10.1021/acs.jafc.6b00314.
[11] IWASAKI T, YAMAMOTO K. Changes in rabbit skeletal myosin and its subfragments under high hydrostatic pressure[J]. International Journal of Biological Macromolecules, 2003, 33(4): 215-220.DOI:10.1016/j.ijbiomac.2003.08.005.
[12] KING L, LEHRER S S. Thermal unfolding of myosin rod and light meromyosin: circular dichroism and tryptophan fluorescence studies[J]. Biochemistry, 1989, 28(8): 3498-3502. DOI:10.1021/bi00434a052.
[13] RAGHAVAN S, KRISTINSSON H G. Conformational and rheological changes in catfish myosin during alkali-induced unfolding and refolding[J]. Food Chemistry, 2008, 107(1): 385-398. DOI:10.1016/j.foodchem.2007.08.037.
[14] JIANG Jiang, XIONG Youling L.. Natural antioxidants as food and feed additives to promote health beneベts and quality of meat products:a review[J]. Meat Science, 2016, 120: 107-117. DOI:10.1016/j.meatsci.2016.04.005.
[15] HASLAM E, LILLEY T H, CAI Y, et al. Traditional herbal medicines:the role of polyphenols[J]. Planta Medica, 1989, 55(1): 1-8.DOI:10.1055/s-2006-961764.
[16] VONSTASZEWSKI M, JARA F L, RUIZ A L T G, et al. Nanocomplex formation between β-lactoglobulin or caseino macropeptide and green tea polyphenols: impact on protein gelation and polyphenols antiproliferative activity[J]. Journal of Functional Foods, 2012, 4(4):800-809. DOI:10.1016/j.jあ.2012.05.008.
[17] 吴菊清, 邵俊花, 魏朝贵, 等. 离子强度对猪肉肌原纤维蛋白乳化特性和理化特性的影响[J]. 食品科学, 2014, 35(23): 14-19.DOI:10.7506/spkx1002-6630-201423003.
[18] JONGBERG S, TØRNGREN M A, GUNVIG A, et al. Eあect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J]. Meat Science, 2013, 93(3):538-546. DOI:10.1016/j.meatsci.2012.11.005.
[19] KATARZYNA W. Antioxidative activity of rosemary extract using connective tissue proteins as carriers[J]. International Journal of Food Science & Technology, 2008, 43(8): 1437-1442. DOI:10.1111/j.1365-2621.2007.01686.x.
[20] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782. DOI:10.1016/j.ijbiomac.2012.07.010.
[21] JONGBERG S, TERKELSEN L S, MIKLOS R, et al. Green tea extract impairs meat emulsion properties by disturbing protein disulベde cross-linking[J]. Meat Science, 2015, 100: 2-9. DOI:10.1016/j.meatsci.2014.09.003.
[22] THAWOMCLIINSOMBUT S. Biochemical and gelation properties of fish protein isolate prepared under various pH and ionic strength conditions[D]. Corvallis: Oregon State University, 2004: 9-10.
[23] 周佺, 郭善广, 蒋爱民, 等. 肌肉盐溶蛋白热诱导凝胶特性研究进展[J]. 食品与机械, 2009, 25(3): 129-131. DOI:10.13652/j.issn.1003-5788.2009.03.031.
[24] 贾娜, 芦嘉莹, 刘登勇, 等. NaCl浓度对肌原纤维蛋白-食用胶混合物功能特性的影响[J]. 食品工业科技, 2014, 35(11): 83-86; 92.DOI:10.13386/j.issn1002-0306.2014.11.010.
[25] DE FREITAS V A P, GLORIES Y, LAGUERRE M. Incidence of molecular structure in oxidation of grape seed procyanidins[J]. Food Chemistry, 1998, 46(2): 376-382. DOI:10.1021/jf970468u.
[26] PETER M G. Chemical modifications of biopolymers by quinones andquinone methides[J]. Angewandte Chemie International Edition,1989, 28(5): 555-570. DOI:10.1002/chin.198933368.
[27] CHEYNIER V F, TROUSDALE E K, SINGLETON V L, et al.Characterization of 2-S-glutathionylcaftaric acid and its hydrolysis inrelation to grape wines[J]. Journal of Agricultural and Food Chemistry, 1986, 34(2): 217-221. DOI:10.1021/jf00068a016.
[28] CAO N, FU Y H, HE J H. Mechanical properties of gelatin films cross-linked, respectively, by ferulic acid and tannin acid[J].Food Hydrocolloids, 2007, 21(4): 575-584. DOI:10.1016/j.foodhyd.2006.07.001.
[29] WHITING R C. Influence of various salts and water solube compounds on the water and fat extudation and gel strength of meat batters[J]. Food Science, 1987, 52(5): 1130-1132. DOI:10.1111/j.1365-2621.1987.tb14025.x.
[30] 周茹, 倪渠峰, 林伟伟, 等. 肌原纤维蛋白溶解度对盐离子浓度的依赖性[J]. 中国食品学报, 2015, 15(3): 32-39. DOI:10.16429/j.1009-7848.2015.03.005.
[31] 陈立德. 肌原纤维蛋白凝胶作用力影响因素的研究[D]. 重庆: 西南大学, 2010: 2. DOI:10.7666/d.y1670862.
[32] NIE X H, GONG Y D, WANG N N, et al. Preparation and characterization of edible myoベbrillar protein-based ベlm incorporated with grape seed procyanidins and green tea polyphenol[J]. LWTFood Science and Technology, 2015, 64(2): 1042-1046. DOI:10.1016/j.lwt.2015.07.006.
[33] TASKAYA L, CHEN Y C, JACZYNSK I. Color improvement by titanjum dioxide and its effect on gelation and texture of proteins recovered from whole fish using isoelectric solubilization/precipitation[J]. LWT-Food Science and Technology, 2010, 43(3): 401-408. DOI:10.1016/j.lwt.2009.08.021.
[34] EGELANDSDAL B, FRETHEIM K, SAMEJIMA K. Dynamic rheological measurements on heat-induced myosin gels: eあect of ionic strength, protein concentration and addition of adenosine triphosphate or pyrophosphate[J]. Journal of the Science of Food and Agriculture,1986, 37(9): 915-926. DOI:10.1002/jsfa.2740370914.
[35] YAN M Y, LI B F, ZHAO X, et al. Physicochemical properties of gelatin gels from walleye pollock (Theragra chalcogramma) skin cross-linked by gallic acid and rutin[J]. Food Hydrocolloids, 2011,25(5): 907-914. DOI:10.1016/j.foodhyd.2010.08.019.
[36] SAITO H, TAGUCHI T, AOKI H, et al. pH-Responsive swelling behavior of collagen gels prepared by novel crosslinkers based on naturally derived di-or tricarboxylic acids[J]. Acta Biomaterialia, 2007,3(1): 89-94. DOI:10.1016/j.actbio.2006.08.003.