花生是我国主要的油料作物、经济作物,也是我国的优势出口农作物,我国花生现种植面积约占世界总种植面积的20%;年产量约有1 500万 t,占世界总产量的40%,居世界首位[1]。花生在食品行业中有广泛的应用,但是花生同时也是八大过敏性食物之一[2],其致敏性也得到了广泛的关注[3-4],2010年,在加拿大的一个全国性调查中,花生过敏症的患病率为0.61%[5]。法国的一项调查结果显示,花生过敏患者占食物过敏患者总人数的28%[6]。据中国协和医科大学变态反应科调查,北京地区约有4%的食物过敏患者对花生过敏[7]。花生过敏会产生严重的变态反应,而且通常是终身的,只有10%左右的过敏儿童会随年龄增长产生耐受性[8]。截止2016年,国际免疫学会联合会已经确认了Ara h 1、Ara h 2、Ara h 3/4等17 种花生中的过敏原蛋白[9-11]。其中Ara h 1、Ara h 2、Ara h 3/4、Ara h 6属于主要过敏原,可被高达90%的花生过敏患者识别[12]。
花生富含蛋白质和油脂,在高水分和新陈代谢较强的情况下,很容易变质,由于花生种子后熟期较长,酶活性很强,呼吸过程中放出较多的水汽和热量,导致花生在种植、收获、贮藏、生产各个过程中极易受不同生物的侵染。在我国,花生受黄曲霉菌及其毒素的污染尤为严重[13-14]。黄曲霉毒素是由黄曲霉等真菌产生的一类具有生物活性的次生代谢产物,是强致癌物,对人类及牲畜健康危害极大,黄曲霉毒素污染严重威胁着花生相关食品产业的安全,甚至影响了我国花生产业的发展[15]。干燥作为花生产品加工的重要环节之一,是保证花生品质,防止其霉变的必要手段。花生干燥的方法一般有自然晒干法和机械烘干法。
干燥过程中,花生会发生一系列的生理生化过程,影响过敏原蛋白的组成、结构和性质。已有报道显示,机械烘干过程中,花生随着水分的减少,不仅会发生颜色的变化,花生中可溶性蛋白和糖的含量也会减少[16]。在高温烘烤过程中,花生过敏原蛋白的结构会变得松散,致敏性增强[17]。农户食用花生则以晒干为主,即直接将收获的花生荚果摊开晾晒,利用太阳照射和空气流动减少荚果中的水分,直至花生荚果含水量达到安全贮藏标准[18-19],晒干后花生中过敏原蛋白含量和组成的变化鲜见报道。
本研究分别从新鲜和晒干处理后的花生籽仁中分离提取花生蛋白,分析花生中的主要过敏原蛋白的数量、结构和性质的变化,探索晒干处理对花生主要过敏原蛋白潜在致敏性的影响,以期为低致敏花生制品的生产提供理论指导。
1 材料与方法
1.1 材料与试剂
鲜花生购自江西省南昌市青山湖市场。
实验所用人血清购自重庆曼纽艾克科技有限公司,利用来源于10 名花生过敏患者的血清构建了血清池,其特异性免疫球蛋白(immunoglobulin,Ig)E水平约为70 IU/mL。
β-巯基乙醇 上海生工生物有限公司;R250、牛血清白蛋白(bovine serum albumin,BSA) 天津大茂试剂公司;预染蛋白Marker 德国Fermentas公司;二喹啉甲酸(bimcincheninic acid,BCA)蛋白质定量试剂盒 北京天根生化科技有限公司;96孔酶标板美国Corning公司;标记羊抗人IgG二抗、邻苯二胺 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PB-10型pH计 德国Sartorius公司;FDV型超细粉碎机 北京兴时利和科技发展有限公司;RH basic 2 S25型磁力搅拌器 德国IKA公司;Allegra 64R高速冷冻离心机 美国Beckman公司;BR680型酶标仪、PowerPac3000迷你蛋白电泳仪 美国Bio-Rad公司;SQ-GS800扫描仪 北京宇艾奇科技有限公司;J-810型圆二色光谱(circular dichroism,CD)仪 日本JASCO公司;UV WinLab V6紫外-可见分光光度仪 美国Perkin Elmer公司。
1.3 方法
1.3.1 花生晒干处理
选择成熟度相同、无明显病虫害和外观损伤的新鲜带壳花生,分别进行去壳晒干和带壳晒干处理。选择白天平均温度为35.0 ℃,平均相对湿度为63.6%的晴朗天气,参照一般国内花生晒干的方法[19]将花生摊成薄层,在开阔通风的地方暴晒,夜间收回摊凉,连续5 d,花生失水减少质量约37%。
1.3.2 花生样品脱脂
参照周宁菱[20]的方法进行,将沉淀与上清液的分离方法由离心改为抽滤,具体操作如下:将不处理的新鲜花生和进行不同晒干处理的花生分别剥壳去种皮,采用超细粉碎机在液氮作用下将其粉碎成约100 目的细粉。将花生粉末利用丙酮脱脂(1∶5,m/V;含体积分数为0.07%的β-巯基乙醇),于4 ℃条件下磁力搅拌脱脂2 h,再利用抽滤装置在通风橱中抽干,弃滤液,重复脱脂2 次,最后将沉淀置于通风橱中自然风干得花生脱脂粉,-20 ℃下冻存备用。
1.3.3 花生样品中蛋白质的定量与定性
1.3.3.1 花生样品中粗蛋白含量测定
参照GB/T 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[21],采用凯氏定氮法测定不同花生样品脱脂粉中粗蛋白含量,将脱脂粉0.1 g、硫酸铜0.5 g、硫酸钾3.0 g和硫酸一起加热,进行消化,并用0.1 mol/mL盐酸标准液滴定。每个样品做3 次平行,花生的蛋白质转化系数为5.46[21-22],将结果折算成新鲜花生中粗蛋白的含量。
1.3.3.2 花生蛋白的提取
参照周宁菱[20]的方法进行。将花生脱脂粉0.8 g与50 mmol/L Tris-HCl缓冲液(pH 7.2)按1∶5(m/V)比例混合,于4 ℃条件下磁力搅拌提取10 h。提取结束后,于4 ℃、9 000 r/min离心15 min,所得上清液即为第1次提取液,将沉淀按照以上步骤重复浸提2 次,获得第2次和第3次的蛋白提取液,均冻存于-20 ℃保存备用。
1.3.3.3 BCA法测定花生提取液中蛋白质量浓度
参照BCA蛋白质定量试剂盒的说明书,测定花生样品脱脂粉经3 次提取后所得提取液中蛋白质量浓度,选用标准溶液为2 000 μg/mL BSA溶液,配制一系列质量浓度的标准溶液,质量浓度梯度设置3 个复孔,工作液显色,在562 nm波长处测定吸光度,绘制标准曲线。
花生样品蛋白提取液进行适当稀释,使质量浓度落于标准曲线范围内。计算出花生样品蛋白提取液中花生蛋白的质量浓度,计算脱脂粉中可提取蛋白质量浓度,可提取蛋白质量浓度在总蛋白中所占比值即为蛋白质的提取率。
1.3.3.4 SDS-PAGE定性分析
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)法分析不同蛋白提取液中蛋白组分的变化。花生样品蛋白提取液中花生蛋白质量浓度为1 mg/mL,上样量为10 μL。Marker上样量为4 μL,选用质量分数为15%分离胶、4%浓缩胶。设定电泳条件分别为恒流12 mA和24 mA,时间分别为30 min和1.5 h。电泳结束后,进行剥胶、染色、脱色等工序。采用SQ-GS800光密度扫描仪,对蛋白电泳凝胶进行图象采集并进行定性和定量分析。灰度扫描结果为该条带占该泳道总灰度的百分比,用此百分比和可提取蛋白的含量计算得出花生中该过敏原蛋白的质量浓度。
1.3.4 蛋白质的结构分析
1.3.4.1 蛋白质二级结构分析
为表征蛋白的二级结构变化,参照李坤等[23]的方法,分别对3 种不同处理的蛋白样品进行色谱检测,扫描波长范围为150~250 nm。将得到的数据导入到CD分析网站(http://dichroweb.cryst.bbk.ac.uk/html/home.stml)中进行分析,得到各样品蛋白二级结构成分的含量,获知不同处理前后α-螺旋、β-折叠、β-转角以及无规卷曲结构的含量变化。
1.3.4.2 蛋白质三级结构分析
将不同处理的花生蛋白样品用紫外-可见分光光度仪进行紫外检测,扫描波长范围为250~350 nm,光谱间隔1 nm。
1.3.5 花生过敏原蛋白潜在致敏性分析
参照Meng Xuanyi等[24]的方法采用间接竞争酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测不同晒干处理后花生过敏原蛋白与IgE的结合能力,并做如下改动:包被蛋白质量浓度10 mg/mL,人血清稀释倍数为1∶80,二抗稀释倍数1∶5 000,亲和素稀释倍数为1∶100。按下式计算IgE抑制率。
式中:B为不同晒干处理后竞争蛋白的OD值;B0为无竞争蛋白时的OD值。
1.4 数据统计分析
每次实验做3 次平行,数据分析采用SPSS统计分析软件,数据作图采用Origin软件。统计显著性分析用单因素方差分析,以P<0.05表明具有显著性差异,以P<0.01表明具有极显著性差异。
2 结果与分析
2.1 不同晒干处理对花生样品中粗蛋白含量及可提取性蛋白含量的影响
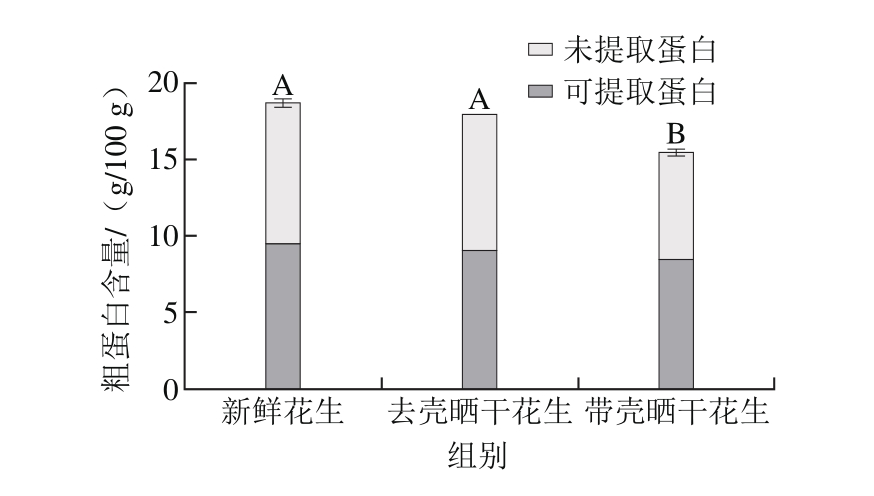
图1 晒干处理对新鲜花生中粗蛋白以及可提取性蛋白含量的影响
Fig. 1 Effect of sun-drying on the contents of crude protein and extractable protein in fresh peanut
不同大写字母表示差异极显著(P<0.01)。
由图1可知,去壳晒干处理后花生中粗蛋白含量约为17.94 g/100 g,带壳晒干处理后花生中粗蛋白含量约为15.43 g/100 g,可知新鲜花生经过去壳晒干处理后,粗蛋白含量略有下降,但与去壳晒干相比没有显著性差异,而新鲜花生经带壳晒干处理后,其中粗蛋白含量有极显著性下降(P<0.01),去壳晒干的花生中粗蛋白含量多于带壳晒干的花生。其原因为,在相同条件晒干时,进行去壳晒干处理的花生干燥失水的速度更快,后熟期更短,影响到植物体内细胞和酶的作用,使其代谢所消耗的蛋白质等营养物质更少,粗蛋白的含量相对带壳晒干花生更高[25]。这一结论与关于豆科牧草的相关研究结果[26-28]一致,机械加工联合干燥处理可以加快脱水,减少营养成分的消耗和损失,所以进行去壳晒干处理的花生中粗蛋白含量多于带壳晒干的花生。
由图1可以看出,新鲜花生中可提取性蛋白的量最多,晒干处理后的花生中可提取性蛋白的量有减少但变化不大。虽然提取前、后蛋白质含量的检测方法不同,但凯氏定氮法与BCA法均能准确测定蛋白质含量,两者的结果是可比的[29-30]。分析蛋白质变化的原因,可能是带壳晒干花生在后熟期内主要消耗转移的是非可溶性蛋白。通过计算,求得晒干花生中可溶性蛋白质占总蛋白的百分比增加,其中以带壳晒干的最高,由于可溶性蛋白质本身能体现代谢的活跃程度[31],由此可知,带壳晒干的花生在后熟期内代谢活动更剧烈。
另外,花生蛋白的提取次数对花生蛋白含量的影响研究中发现[32],在3 次浸提后,大部分蛋白质能被提取出来,再继续浸提,不仅浪费试剂,而且所用的Tris-HCl提取液有可能造成蛋白质的水解变性[33],综合来说浸提次数为3 次效果最好。综合3 次提取的结果,可以看出花生中蛋白质的提取率均达到了50%,而利用其他方法分离花生蛋白的提取率可高达70%[34],这是由于研究中为保证花生中的过敏原蛋白不受破坏,采用了较为温和的Tris-HCl作为浸提液。
2.2 花生提取液中过敏原的组成
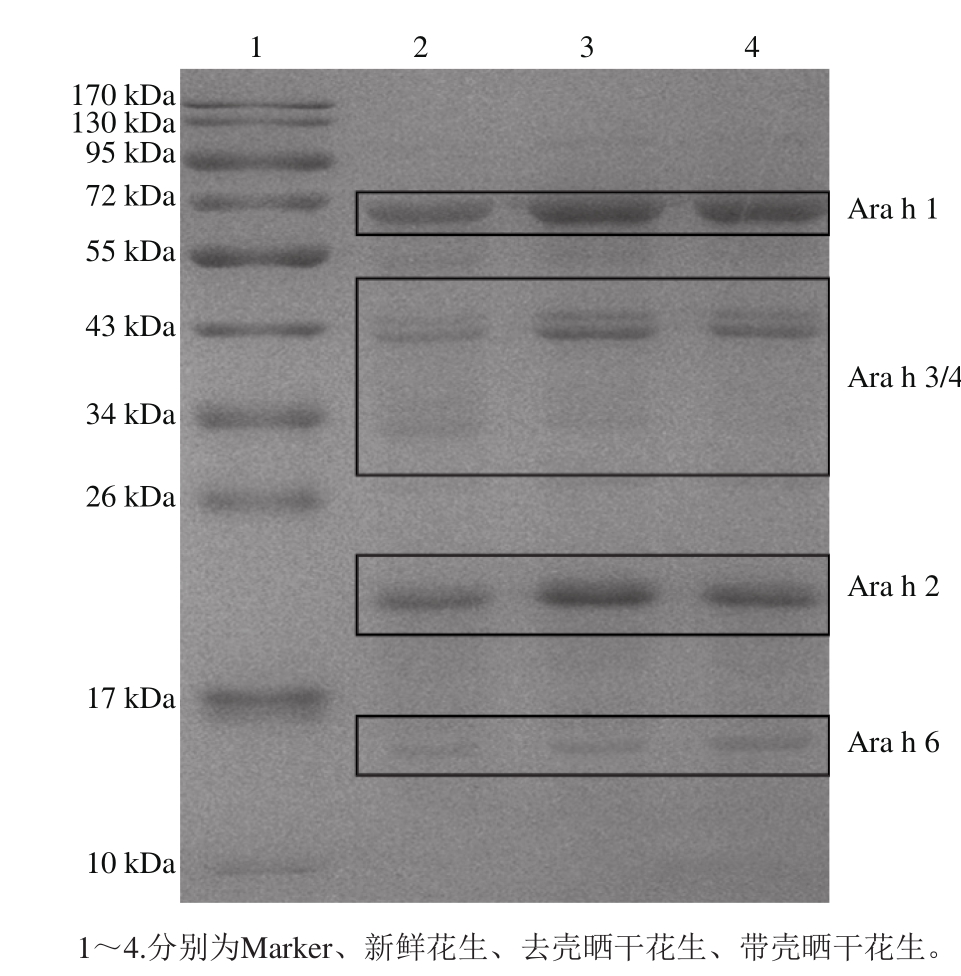
图2 不同晒干处理后花生蛋白SDS-PAGE分析
Fig. 2 SDS-PAGE patterns of peanut proteins extracted after different drying treatments
由图2可知,主要过敏原为Ara h 1、Ara h 2、Ara h 3/4、Ara h 6。由图3可知,晒干处理前、后,主要过敏原的含量均发生了变化。其中过敏原Ara h 1含量在晒干处理后极显著升高,且带壳晒干后过敏原Ara h 1的含量有显著性优势;过敏原Ara h 2、Ara h 3/4在晒干处理后极显著增加,但不同晒干处理方法之间没有显著性差异;过敏原Ara h 6在花生中含量很少,不同处理之间含量虽有变化,但没有显著性差异。可以看出花生在晒干过程中后熟作用剧烈[35],蛋白质仍在不断合成中,主要过敏原含量有所增加,其中带壳晒干的花生中过敏原Ara h 1的合成作用比去壳晒干的花生更强。
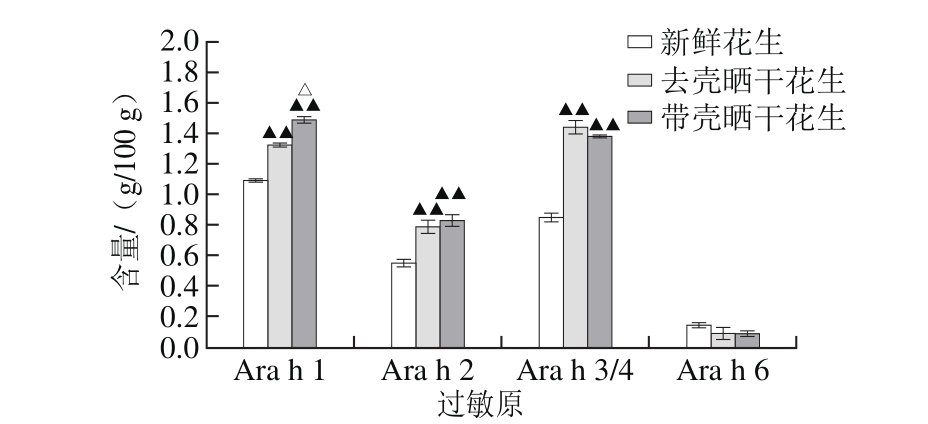
图3 晒干处理对花生主要过敏原蛋白含量的影响
Fig. 3 Effect of sun-drying on the contents of major allergen proteins in peanut
△.不同晒干处理之间的过敏原含量相比差异显著(P<0.05);
▲▲.与新鲜花生中的过敏原含量相比差异极显著(P<0.01)。
2.3 晒干处理对花生蛋白结构的影响

图4 晒干处理对花生蛋白结构的影响
Fig. 4 Effect of sun-drying treatment on the structure of peanut proteins
A.花生蛋白CD光谱;B.花生蛋白紫外吸收光谱。
表1 花生蛋白二级结构经不同晒干处理后各构象单元含量变化
Table 1 Secondary structure contents of peanut proteins extracted after different drying treatments

蛋白质的CD光谱反映了蛋白质二级结构的信息,由图4A可以看出,新鲜花生的蛋白CD谱图在193 nm波长处有一正峰,212 nm波长处有一个负峰,说明新鲜未处理的花生蛋白存在α-螺旋结构,含量为6.1%。去壳晒干处理后,α-螺旋含量增加了109.8%,达到12.8%,而其他3 种构象单元的含量均相应降低,说明去壳晒干处理后花生蛋白变得更加有序。但带壳晒干处理后,α-螺旋、β-折叠和β-转角含量都有所降低,而无规卷曲含量有所增加,说明带壳晒干后花生蛋白变得更加无序。结果表明,不同晒干方式会对花生蛋白的二级结构造成不同的影响。
图4B显示了蛋白质分子中色氨酸、酪氨酸和苯丙氨酸等残基的紫外吸收,吸收峰约在250~280 nm处[36-37]。经去壳晒干处理后,花生蛋白在250~285 nm波段内紫外吸收强度低于新鲜花生,但在285~350 nm波段内与新鲜花生的紫外吸收强度相差不大;而经带壳晒干处理后,花生蛋白在250~325 nm波段内比新鲜花生的紫外吸收强度低,在325~350 nm波段内比新鲜花生的紫外吸收强度高。结果表明晒干处理后,蛋白质三级结构都变紧凑,且去壳晒干花生结构更为紧凑。
2.4 晒干处理对花生过敏原蛋白潜在致敏性的影响

图5 晒干处理对花生过敏原蛋白的IgE结合能力的影响
Fig. 5 Effect of sun-drying treatment on IgE-binding capacity of major allergen proteins in peanut
不同小写字母表示差异显著(P<0.05)。
血清IgE结合能力常用于比较花生蛋白的潜在致敏性[36]。竞争抑制率越低,竞争抗原与过敏患者血清的结合能力越弱,即潜在致敏性越低。不同晒干处理后花生蛋白IgE结合能力如图5所示。经晒干处理后,花生的潜在致敏性显著增强,而带壳晒干的花生潜在致敏性最强,其半抑制浓度(half maximal inhibitory concentration,IC50)值(0.9 mg/mL)仅为新鲜花生IC50值(3.6 mg/mL)的25%。与烘烤花生的研究结果一致[16],干燥处理会使花生过敏原蛋白的潜在致敏性增强[17]。这也与过敏原蛋白的数量有关,晒干过程中,主要过敏原蛋白含量显著增加,花生过敏原蛋白潜在致敏性就相应增强;而去壳晒干的花生结构较带壳晒干的花生更紧凑,这可能导致其IgE结合能力弱于带壳晒干的花生。
3 结 论
晒干处理后,花生总蛋白含量减少,其中去壳晒干花生蛋白减少了0.74 g/100 g,带壳晒干花生减少了3.25 g/100 g。花生中可提取蛋白的总量基本不变,但提取获得的过敏原蛋白含量明显增加,特别是Ara h 3/4,在去壳晒干花生中的含量增长了69.97%,带壳晒干花生中增长了62.60%,这会导致花生潜在致敏性的增强。带壳晒干和去壳晒干2 种方式对花生蛋白结构的影响也不同,去壳晒干花生中提取到的蛋白中,α-螺旋结构的含量增长了109.8%,二级结构更为有序,三级结构更为紧凑,这导致其潜在致敏性弱于带壳晒干的花生。
参考文献:
[1] 张毅, 华福平, 童燕, 等. 花生黄曲霉毒素的危害及预防[J]. 现代农业科技, 2010(1): 340-343. DOI:10.3969/j.issn.1007-5739.2010.01.243.
[2] Food and Agriculture Organization. Report of the FAO technical consultation on food allergies[R]. Rome: FAO, 1995: 13-14.
[3] SHEWRY P R, NAPIER J A, TATHAM A S, et al. Seed storage proteins: structures and biosynthesis[J]. The Plant Cell, 1995, 7(7):945-956. DOI:10.1105/tpc.7.7.945.
[4] HUSAIN Z, SCHWARTZ R A. Peanut allergy: an increasingly common life-threatening disorder[J]. Journal of the American Academy of Dermatology, 2012, 66(1): 136-143. DOI:10.1016/j.jaad.2011.02.031.
[5] BEN-SHOSHAN M, HARRINGTON D W, SOLLER L, et al. A population-based study on peanut, treenut, fish, shellfish and sesame allergy prevalence in Canada[J]. Journal of Allergy and Clinical Immunology, 2010, 125(6): 1327-1335. DOI:10.1016/j.jaci.2010.03.015.
[6] LI X M. Beyond allergen avoidance: update on developing therapies for peanut allergy[J]. Current Opinion in Allergy and Clinical Immunology, 2005, 5(3): 287-292. DOI:10.1097/01.all.0000168796.20324.bd.
[7] 李宏. 花生变应原研究[D]. 北京: 中国协和医科大学, 2000: 4.
[8] 陈红兵, 高金燕. 食物过敏反应及其机制[J]. 营养学报, 2007, 29(2):105-109. DOI:10.3321/j.issn:0512-7955.2007.02.001.
[9] The World Health Organization, International Union of Immunological Societies Allergen Nomenclature Sub-committee. Allergen nomenclature[OL]. (2016-10-11)[2017-5-28]. http://www.allergen.org/search.php?allergensource=peanut&searchsource=Search.
[10] IQBAL A, SHAH F, HAMAYUN M, et al. Allergens of Arachis hypogaea and the effect of processing on their detection by ELISA[J]. Food and Nutrition Research, 2016, 60: 28945. DOI:10.3402/fnr.v60.28945.
[11] 董慧, 梁秉绍, 黄艳梅, 等. 花生主要变应原Ara h 2的克隆及原核表达[J]. 现代生物医学进展, 2017, 17(4): 624-627. DOI:10.13241/j.cnki.pmb.2017.04.006.
[12] 隗啸南, 高金燕, 李欣, 等. 花生过敏原蛋白分离纯化方法研究进展[J].食品科学, 2011, 32(17): 371-375.
[13] 付英. 原料花生贮藏技术研究综述[J]. 江苏农业科学, 2014, 42(11):312-314. DOI:10.15889/j.issn.1002-1302.2014.11.111.
[14] 刘永顺. 花生贮藏保鲜新技术[J]. 中国园艺文摘, 2011, 27(10): 179-180. DOI:10.3969/j.issn.1672-0873.2011.10.086.
[15] 李宁. 贮藏与加工过程对花生黄曲霉毒素含量影响研究进展[C]//第二届全国农产品产地初加工学术研讨会论文集. 北京: 农业工程学报编辑委员会, 2016: 52-58.
[16] SHI X L, DAVIS J P, XIA Z T, et al. Characterization of peanuts after dry roasting, oil roasting, and blisterfrying[J]. LWT-Food Science and Technology, 2017, 75: 520-528. DOI:10.1016/j.lwt.2016.09.030.
[17] RAO H, TIAN Y, TAO S, et al. Key factors affecting the immunoreactivity of roasted and boiled peanuts: temperature and water[J]. LWT-Food Science and Technology, 2016, 72: 492-500.DOI:10.1016/j.lwt.2016.05.014.
[18] 刘丽, 王强, 刘红芝. 花生干燥贮藏方法的应用及研究现状[J].农产品加工(创新版), 2011(8): 49-52. DOI:10.3969/issn.1671-9646(C).2011.08.002.
[19] 颜建春, 吴努, 胡志超, 等. 花生干燥技术概况与发展[J]. 中国农机化, 2012(2): 10-13; 20. DOI:10.3969/j.issn.1006-7205.2012.02.002.
[20] 周宁菱. 花生过敏原蛋白组成模式的解析及致敏性评价[D]. 南昌:南昌大学, 2014: 15-16.
[21] 卫生部. 食品安全国家标准 食品中蛋白质的测定: GB/T 5009.5—2016[S]. 北京: 中国标准出版社, 2016: 7.
[22] ZHOU N L, LI W Y, WU Z H, et al. Sequential extractions: a new way for protein quantification-data from peanut allergens[J]. Analytical Biochemistry, 2015, 484: 31-36. DOI:10.1016/j.ab.2015.05.013.
[23] 李坤, 连君, 朱瑾, 等. 还原协同加热处理对花生过敏原Ara h 2结构及抗原性的影响[J]. 食品科学, 2017, 38(11): 89-94. DOI:10.7506/spkx1002-6630-201711015.
[24] MENG Xuanyi, LI Xin, WANG Xinkang, et al. Potential allergenicity response to structuralmodification of irradiated bovine α-lactalbumin[J]. Food Function, 2016, 7(7): 3102-3110.DOI:10.1039/c6fo00400h.
[25] 赵光伟, 艾尼瓦尔•艾山, 于山江. 不同干燥方法对不同生育期新疆小芦苇营养成分的影响[J]. 饲料工业, 2008, 29(3): 49-52.DOI:10.3969/j.issn.1001-991X.2008.03.015.
[26] 单贵莲, 薛世明, 郭盼, 等. 刈割时期和调制方法对紫花苜蓿干草质量的影响[J]. 中国草地学报, 2012, 34(3): 28-33. DOI:10.3969/j.issn.1673-5021.2012.03.005.
[27] 单贵莲, 薛世明, 徐柱, 等. 不同调制方法紫花苜蓿干燥特性及干草质量的研究[J]. 草业学报, 2008, 17(4): 102-109. DOI:10.3321/j.issn:1004-5759.2008.04.014.
[28] SHEAFFER C C, MARTIN N P, LAMB J F S, et al. Leaf and stem properties of alfalfa entries[J]. Agronomy Journal, 2000, 92(4): 733-739. DOI:10.2134/agronj2000.924733x.
[29] CHEN X Y, RU Y, CHEN F L, et al. FTIR spectroscopic characterization of soy proteins obtained through AOT reverse micelles[J]. Food Hydrocolloids, 2013, 31(2): 435-437. DOI:10.1016/j.foodhyd.2012.11.017.
[30] ARROYO-MAYA I J, HEÁNANDEZ-SÁNCHEZ H, JINÉNEZCRUZ E, et al. α-Lactalbumin nanoparticles prepared by desolvation and cross-linking: structure and stability of the assembled protein[J]. Biophysical Chemistry, 2014, 193: 27-34. DOI:10.1016/j.bpc.2014.07.003.
[31] 董建华, 陈定光, 王秉忠. 植物激素对花生种子活力指数、过氧化物酶及可溶性蛋白质的影响[J]. 热带作物学报, 2000, 21(2): 23-29.DOI:10.3969/j.issn.1000-2561.2000.02.005.
[32] 马铁铮. 花生浓缩蛋白的制备及其溶解性研究[D]. 北京: 中国农业科学院, 2009: 15.
[33] 曾广娟, 李春敏, 张新忠, 等. 适于SDS-PAGE分析的苹果叶片蛋白质提取方法[J]. 华北农学报, 2009, 24(2): 75-78.
[34] 矫丽媛, 吕敬军, 陆丰升, 等. 花生分离蛋白提取工艺优化研究[J].食品科学, 2010, 31(20): 196-201.
[35] 陈士林, 杨新亭, 刘永录, 等. 花生高产配套措施[J]. 河南农业,1995(4): 14.
[36] HU C Q, CHEN H B, GAO J Y, et al. High-pressure microぼuidisationinduced changes in the antigenicity and conformation of allergen Ara h 2 puriベed from Chinese peanut[J]. Journal of the Science of Food and Agriculture, 2011, 91(7): 1304-1309. DOI:10.1002/jsfa.4318.
[37] 黄汉昌, 姜招峰, 朱宏吉. 紫外圆二色光谱预测蛋白质结构的研究方法[J]. 化学通报, 2007(7): 501-506. DOI:10.14159/j.cnki.0441-3776.2007.07.004.