红树莓(Rubus ideaus L.)为蔷薇科浆果,因其富含各种基本营养成分和功能活性成分,在世界上享有“黄金水果”的声誉[1-2]。大量研究表明,红树莓中的多酚类化合物如黄酮、酚酸、花色苷、鞣花酸等物质与其抗氧化、抗肿瘤、降血脂、预防心血管疾病等生物学功能密切相关[3-5]。
目前,国内外对红树莓酚类物质中花色苷的结构研究比较多。Patras等[3]研究结果表明,树莓中花色苷主要是由花青素-3-葡萄糖苷、花葵素-3-葡萄糖苷和花葵素-3-芸香糖苷组成。Kula等[6]研究结果表明矢车菊素-3-槐糖苷是红树莓花色苷中的主要组成成分。李蕊等[7]在野生红树莓花色苷中鉴定出了9 种花色苷,包括矢车菊-3,5-双葡萄糖苷、矢车菊-3-双半乳糖苷、矢车菊-3-葡萄糖苷、矢车菊-3-芸香糖苷、矢车菊-3-阿拉伯糖苷等。但对于其酚类物质的组成研究较少。
脂质过氧化反应是生物体内多不饱和脂肪酸常见的氧化反应,过量的氧化产物会攻击生物大分子如蛋白质、脂类、核酸等,造成分子、细胞和器官的损伤,从而诱发心血管病、心脏病、癌症等疾病[8]。由于天然多酚化合物分子结构中含有多个具有生物活性的基团如羟基,使其具有预防心血管疾病、调节脂类代谢、降血脂等生理功能[9-10]。目前对红树莓中活性成分的功能性研究主要集中在清除自由基、抗增殖、抑菌等功能上,而对其抗脂质过氧化功能的研究报道较少。
本研究主要通过采用紫外分光光度法、红外光谱法和高效液相色谱(high performance liquid chromatography,HPLC)法,分析了‘菲尔杜德’红树莓多酚粗提液和纯化液的组成成分,同时采用3 个体外抗脂质过氧化指标研究了其抗脂质过氧化活性,为开发、应用红树莓中的活性物质提供重要的理论依据。
1 材料与方法
1.1 动物、材料与试剂
清洁级Wistar雄性大鼠2 只,周龄8 周,体质量分别为162.5 g和167.5 g,购自黑龙江中医药大学实验动物中心,动物合格证号:SCXK-(黑)2015-003,动物使用许可证号:黑动字第P00700619。
‘菲尔杜德’红树莓采自黑龙江省尚志市,速冻处理后运回东北林业大学食品科学与工程实验室冻藏。
标准品没食子酸、原花青素B2、芦丁、水杨酸、鞣花酸、茶多酚、没食子酸、阿魏酸、表儿茶素、绿原酸、树莓酮、儿茶素、槲皮素(色谱级,纯度≥98%)上海源叶生物科技有限公司;甲醇(色谱纯) 美国Thermo Fisher公司;溴化钾、过氧化氢、硫代巴比妥酸、三氯乙酸、抗坏血酸等 天津市天力化学试剂有限公司;三氯化铁、硫酸亚铁 天津市东丽区天大化学试剂厂。
1.2 仪器与设备
SHZ-C型水浴恒温振荡器 上海博远实业有限公司医疗设备厂;ALC-1104电子天平 北京赛多利斯仪器系统有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;FW-4粉末压片机 天津市拓普仪器有限公司;Nicolet iS5傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy,FT-IR)美国Thermo Fisher公司;1260 HPLC仪 安捷伦科技有限公司;722S可见分光光度计 上海精密科学仪器有限公司。
1.3 方法
1.3.1 红树莓多酚粗提液的制备
按照参考文献[11]中的最佳工艺参数提取红树莓多酚。提取条件为:乙醇体积分数70%(pH 6)、提取温度45 ℃、料液比1∶6(m/V)、提取时间3.5 h、提取2 次,在此条件下多酚提取量为(373.78±4.08)mg/100 g。得到的多酚提取液减压浓缩(0.1 MPa,45 ℃),冷藏备用,多酚纯度为(3.94±0.28)%。
1.3.2 红树莓多酚纯化液的制备
参考文献[12]方法,先用无水乙醇将1.3.1节中得到红树莓多酚粗提液进行除杂实验(无水乙醇-多酚粗提液体积比1∶1,4 ℃条件下静置24 h,离心,上清液于45 ℃、0.1 MPa减压浓缩,冷藏后备用),再通过实验确定较佳的优化工艺为:选择X-5大孔树脂用来纯化红树莓多酚粗提液;采用径高比1∶14、上样质量浓度1.4 mg/mL、上样量100 mL、样液pH 3、流速0.5 BV/h的条件进行动态吸附24 h;吸附饱和平衡后,先用500 mL蒸馏水洗杂,再用200 mL pH 6的70%乙醇溶液以1.0 BV/h的流速进行动态洗脱。收集第30~50 mL的多酚洗脱液,45 ℃、0.1 MPa减压浓缩,冷藏备用,多酚纯度为(35.79±2.17)%。
1.3.3 多酚含量的测定
参考Pantelidis等[13]方法,采用福林-酚法,以没食子酸标准溶液质量浓度为横坐标,溶液吸光度为纵坐标,得到标准曲线为y=9.917 7x+0.036 0(R2=0.998 7)。
1.3.4 红树莓多酚的紫外光谱分析
分别将红树莓多酚的粗提液、纯化液用甲醇稀释成多酚质量浓度为0.4 mg/mL(以没食子酸计)溶液,在190~700 nm波长范围内进行紫外-可见光扫描,得到红树莓多酚的紫外光谱图。
1.3.5 红树莓多酚的FT-IR分析
分别将红树莓多酚的粗提液、纯化液放入烘箱中干燥8 h(65 ℃)。取1~2 mg多酚样品与200 mg烘干后的溴化钾混合均匀,研磨至粒度小于2 μm的混合粉末。将粉末放入压片机内压制成均匀透明的薄片,再将压片放入样品槽中,用红外光谱仪于波长400 0~400 cm-1范围内扫描,得到FT-IR图[14]。
1.3.6 红树莓多酚的HPLC分析
将红树莓多酚粗提液和纯化液分别用甲醇稀释成多酚质量浓度为0.4 mg/mL(以没食子酸计)溶液,用0.45 μm微孔滤膜过滤后用于HPLC分析[15]。将原花青素B2、芦丁、鞣花酸、水杨酸标准品用甲醇稀释成0.1 mg/mL溶液。
色谱条件[15]:5TC-C18柱:250 mm×4.6 mm;流动相采用甲醇(A)-纯水(B)进行梯度洗脱:0~10 min:26% A、74% B;10.1~25.0 min:50% A、50% B;流速为1 mL/min;柱温:25 ℃;检测波长:280 nm;每次进样量:10 μL。
1.3.7 红树莓多酚的抗脂质过氧化活性分析
1.3.7.1 对Fe2+诱导卵黄脂蛋白脂质过氧化的抑制作用
以Fe2+诱发卵黄磷脂C2位上的极低密度脂蛋白(very low density lipoprotein,VLDL)、低密度脂蛋白(low density lipoprotein,LDL)、过不饱和脂肪酸(polyunsaturated fatty acid,PUFA)的过氧化模型,参考文献[16]方法并略作改进,用硫代巴比妥酸(thiobarbituric acid,TBA)比色法测定样品中丙二醛(malonaldehyde,MDA)含量(代表脂质过氧化反应程度)。卵黄悬液:新鲜鸡蛋去除蛋清,卵黄用等体积pH 7.45,0.l mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)配成1∶1(m/m)悬液,磁力搅拌10 min,再用PBS稀释成1∶25(m/m)的悬液,冷藏备用。
测定方法:在离心管中依次加入0.4 mL卵黄悬液,0.1 mL不同质量浓度样品溶液,0.4 mL 25 mmol/L FeSO4,3.1 mL PBS(0.1 mol/L,pH 7.45),混匀于37 ℃恒温振荡15 min,取出后加入l mL质量分数为20%的三氯乙酸(trichloroacetic acid,TCA)溶液和l mL质量分数为0.8%的TBA溶液,沸水浴15 min,冷却后,3 500 r/min离心10 min,吸取上清液,于532 nm波长处测定MDA-TBA复合物吸光度,按照式(1)计算抑制率。
式中:A1为0.1 mL PBS缓冲液的吸光度;A样为样品的吸光度。以VC和茶多酚做阳性对照。
1.3.7.2 对H2O2诱导大鼠红细胞氧化溶血的影响
H2O2会引起红细胞膜发生脂质过氧化作用而导致溶血。参考文献[17]方法并略作改进,测定MDA含量来研究其脂质过氧化反应程度。红细胞悬浮液:大鼠禁食(自由饮水)12 h后眼眶取血,肝素抗凝,4 ℃、3 000 r/min离心得到红细胞,冷生理盐水洗3 次,用生理盐水制成质量分数为0.5%的红细胞悬浮液。
测定方法:在试管中依次加入0.5%红细胞悬浮液1 mL,不同质量浓度样品溶液0.2 mL,100 mmol/L的H2O20.1 mL混匀启动反应,37 ℃水浴中反应l h后,用生理盐水稀释6 倍,3 000 r/min离心5 min,取上清液于415 nm波长处测定吸光度,按照式(2)计算抑制率。
式中:A2为生理盐水的吸光度;A样为样品的吸光度。以VC和茶多酚为阳性对照。
1.3.7.3 对大鼠肝组织匀浆自发脂质过氧化的抑制作用
通过测定MDA含量高低直接反映肝细胞受自由基攻击的程度,参考文献[18]方法并略作改进。大鼠肝脏匀浆:大鼠禁食(自由饮水)12 h后颈椎脱臼法处死,迅速取出肝脏,置于4 ℃生理盐水中反复漂洗去除血液,剔除脂肪及结缔组织,用滤纸吸干水分,称质量。然后剪碎,在冰浴条件下将已剥离处理好的脏器定量置于匀浆器中,用生理盐水制成质量分数为10%的组织匀浆。以3 000 r/min在4 ℃离心5 min,取上清液备用(用时以生理盐水稀释)。
测定方法:分别取1 mL 5%新鲜肝组织匀浆液,加入1 mL不同质量浓度的样品溶液,置于37 ℃水浴1 h,取出后加入1 mL 质量分数为20%的TCA终止反应,再加入 l mL 0.5% TBA,摇匀。加塞放入沸水浴中煮沸30 min,迅速冷却后,3 500 r/min离心10 min,吸取上清液于532 nm波长处测定MDA-TBA复合物的吸光度,按照式(3)计算抑制率。
式中:A3为以生理盐水代替样品的吸光度;A样为样品的吸光度。以VC和茶多酚为阳性对照。
1.4 数据统计分析
每个实验3 次重复,数据以 表示,数据采用Excel软件进行分析处理并作图。
表示,数据采用Excel软件进行分析处理并作图。
2 结果与分析
2.1 红树莓多酚的紫外-可见光谱
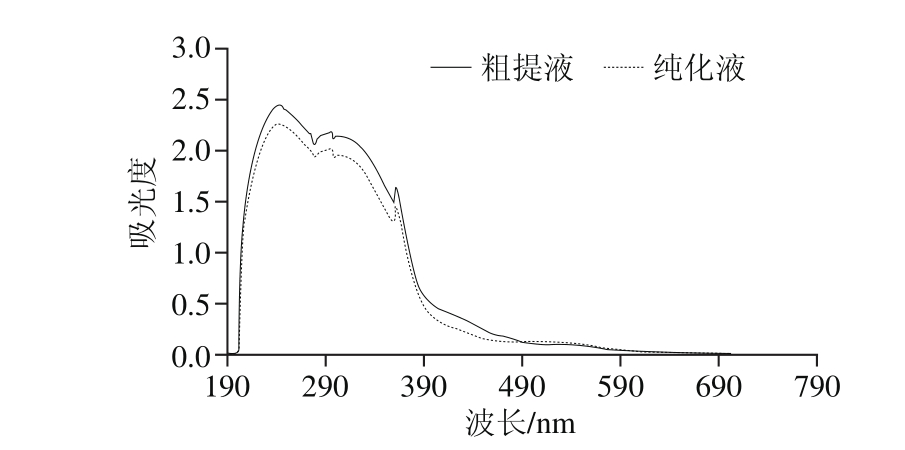
图1 红树莓多酚粗提液和纯化液的紫外-可见光谱图
Fig. 1 Ultraviolet-visible spectra of crude and puriベed polyphenols from red raspberry
由图1可知,红树莓多酚粗提液和纯化液的紫外-可见光谱图均有2 个吸收峰:一个在200~300 nm波长区域内(分别为244、242 nm),为黄酮、花色苷物质的特征吸收峰;另一个在500~600 nm波长区域内的吸收峰,为花色苷的特征吸收峰[19],但在此处的吸收峰较弱。初步判断红树莓多酚提取液中含有黄酮、花色苷物质。在多酚浓度相同时,红树莓多酚粗提液比纯化液在200~300 nm波长区域内的吸收峰更强,而在500~600 nm波长区域内吸收峰相对较弱,说明在相同浓度下,粗提液中含有较多的黄酮类物质,而纯化液中含有更多的花色苷物质。
2.2 红树莓多酚的FT-IR谱图
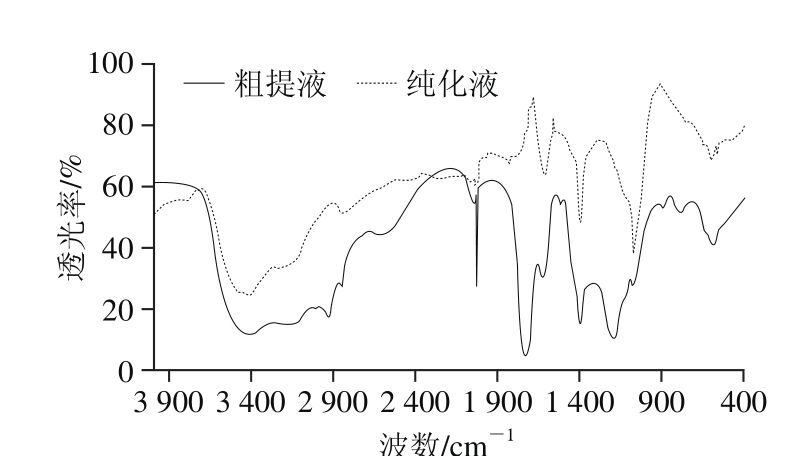
图2 红树莓多酚粗提液和纯化液的FT-IR谱图
Fig. 2 FT-IR spectra of crude and puriベed polyphenols from red raspberry
由图2可知,红树莓多酚粗提液在1 720 cm-1处有明显的吸收峰,为羰基C═O伸缩振动吸收峰,其吸收峰可能归属于黄酮类物质[20];粗提物和纯化液分别在1 622、1 620 cm-1处有吸收峰,可能同时包含共轭羰基C═O的伸缩振动、C-H的弯曲振动、C-N的伸缩振动吸收峰以及芳香族环的骨架振动吸收,其吸收峰可能主要归属于黄酮类[21]。多酚粗提物和纯化液在1 450~1 400 cm-1附近都有明显的吸收峰,可能主要归属于糖苷类物质,且经过X-5大孔树脂纯化后,能除去部分糖苷类物质;而在900~650 cm-1附近的多个吸收峰表明其可能含有苯环,且苯环上可能含有多个取代结构[21]。
2.3 红树莓多酚的HPLC分析
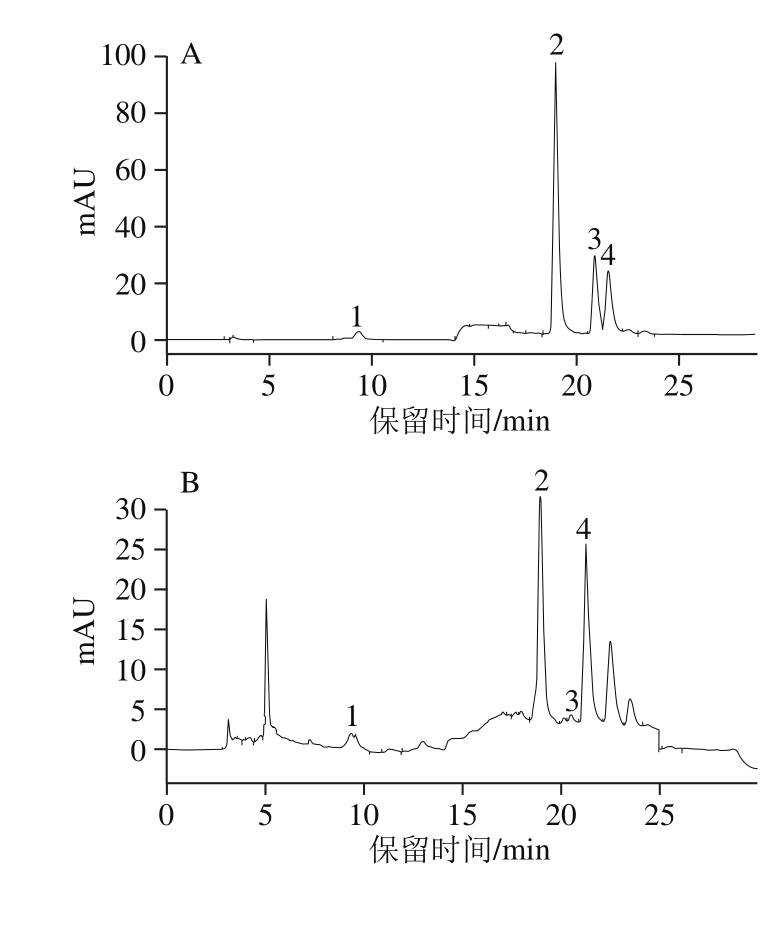

图3 多酚标准品(A)、红树莓多酚粗提液(B)和红树莓多酚
纯化液(C)的HPLC色谱图
Fig. 3 HPLC proベles of four phenolic standards (A), crude polyphenols (B)and puriベed polyphenols (C) from red raspberry
1.原花青素B2;2.芦丁;3.水杨酸;4.鞣花酸。
如图3所示,通过与标准品的HPLC色谱图对比,红树莓多酚粗提物和纯化物中主要含有原花青素B2(峰1)、芦丁(峰2)、水杨酸(峰3)和鞣花酸(峰4),其中芦丁和鞣花酸的含量相对较高,水杨酸的含量相对较少(图3B和图3C)。与粗提物相比,红树莓多酚纯化液中原花青素B2的吸收峰明显增大,其他3 种物质的吸收峰变化不大。在红树莓多酚粗提液HPLC图中,当保留时间为5.045 min时,出现一个峰面积为188.779 mAU•s的未知峰;经过大孔树脂纯化后,其保留时间为5.051 min,峰面积下降至7.663 mAU•s。在红树莓多酚粗提液的HPLC图中,当保留时间分别为22.499 min和23.503 min时,均有一个未知物质,吸收峰明显;且经过纯化后,该2 处吸收峰的保留时间略提前,峰面积均变小。通过与其他标准品(没食子酸、阿魏酸、表儿茶素、绿原酸、树莓酮、儿茶素和槲皮素)在此条件下的出峰时间对比,均未与这3 个未知物质峰匹配成功,仍需改变梯度洗脱条件、优化提取和纯化方法、采用灵敏度更高的方法进一步鉴定分析红树莓多酚的未知组成成分。红树莓多酚的HPLC分析结果表明红树莓多酚的液相色谱图出峰较多,说明其组成成分复杂。
2.4 红树莓多酚的抗脂质过氧化活性
2.4.1 对Fe2+诱导卵黄脂蛋白脂质过氧化的抑制作用
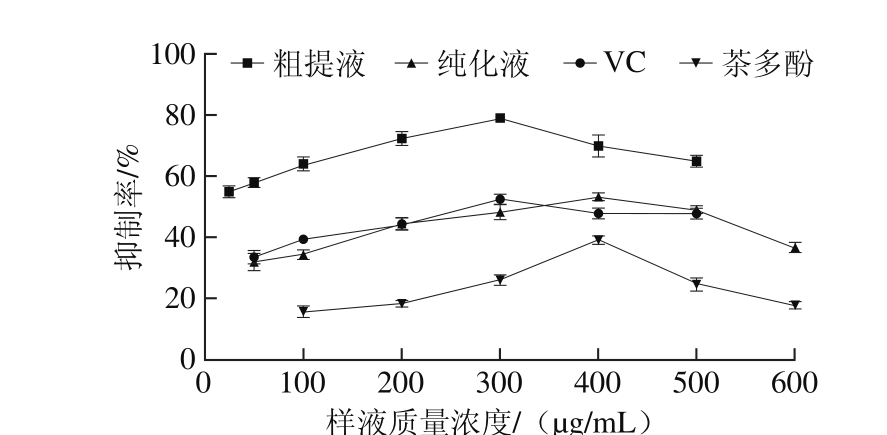
图4 红树莓多酚对Fe2+诱导卵黄脂蛋白脂质过氧化的抑制作用
Fig. 4 Inhibitory effects of red raspberry polyphenols on Fe2+-induced lipid peroxidation in yolk lipoprotein
由图4可知,红树莓多酚对Fe2+诱导卵黄脂蛋白脂质过氧化的抑制率与多酚质量浓度在一定范围内成正比,超过一定质量浓度后,成反比关系。在相同条件下,红树莓多酚粗提液对Fe2+诱导卵黄脂蛋白脂质过氧化的抑制率大于纯化液,当多酚质量浓度为25 µg/mL时,粗提液对其抑制率已达到(54.87±1.95)%;当质量浓度增大到300 µg/mL时,抑制率达到最大值(78.83±1.35)%,显著高于其他实验组。当红树莓多酚纯化液质量浓度为400 µg/mL时,其对Fe2+诱导卵黄脂蛋白脂质过氧化的抑制率也达到最大值,为(53.33±1.17)%。VC对Fe2+诱导卵黄脂蛋白脂质过氧化的抑制作用与纯化液相似,当质量浓度为300 µg/mL时,抑制率最大值为(52.48±1.58)%,超过此质量浓度时,抑制率随着质量浓度的增大而下降。而茶多酚对其抑制作用相对较弱,当质量浓度高达400 µg/mL时,其抑制率达到最大值,仅为(39.10±1.40)%。
2.4.2 对H2O2诱导大鼠红细胞氧化溶血的抑制作用
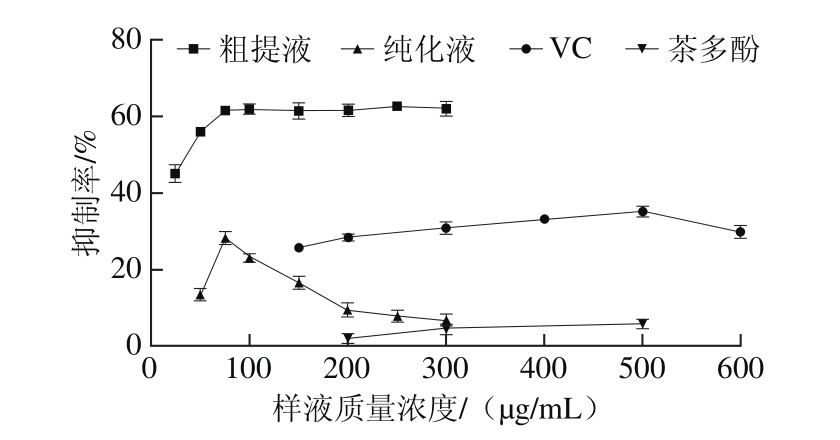
图5 红树莓多酚对H2O2诱导大鼠红细胞氧化溶血的抑制作用
Fig. 5 Inhibitory effects of red raspberry polyphenols on H2O2-induced hemolysis of rat red blood cells
由图5可知,红树莓多酚粗提液对H2O2诱导大鼠红细胞氧化溶血的抑制作用最显著,当多酚质量浓度为25 µg/mL时,其抑制率已达到(44.98±2.24)%,当多酚质量浓度继续增大时,其抑制率随着质量浓度的增大而增大,但当质量浓度达到75 µg/mL时,其抑制率保持平稳,高达(61.49±1.13)%。多酚纯化液对H2O2诱导大鼠红细胞氧化溶血的抑制作用较弱,当质量浓度为7 5 µg/m L时,其抑制率达到最大值,仅为(28.32±1.68)%,而后随着质量浓度继续增大,其抑制率反而下降。VC对H2O2诱导大鼠红细胞氧化溶血的抑制作用在高质量浓度时较明显,当VC质量浓度在150~500 µg/mL时,其抑制率随着质量浓度的增大而平缓增大;当质量浓度为500 µg/mL时,其抑制率达到最大值(35.22±1.46)%。而茶多酚对H2O2诱导大鼠红细胞氧化溶血的抑制作用相对最弱。
2.4.3 对大鼠肝组织匀浆自发脂质过氧化的抑制作用
由图6可知,红树莓多酚对大鼠肝组织匀浆自发脂质过氧化的抑制率与多酚质量浓度在一定范围内成正比;超过一定质量浓度后,成反比关系。在所有实验组中,茶多酚对大鼠肝组织匀浆自发脂质过氧化的抑制作用最为明显,当质量浓度达到300 µg/mL时,其抑制率达到最大值(83.63±0.66)%,明显高于其他实验组。红树莓多酚粗提液对大鼠肝组织匀浆自发脂质过氧化的抑制作用略强于纯化液,当质量浓度达到100 µg/mL时,其抑制率都达到最大值,分别为(65.48±1.46)%、(59.68±0.22)%。VC对大鼠肝组织匀浆自发脂质过氧化的抑制作用相对较弱,当质量浓度高达1 500 µg/mL时,其抑制率最高,仅为(48.67±1.09)%(相关数据未在图中体现)。当红树莓多酚粗提液和纯化液质量浓度从50 µg/mL升高到100 µg/mL时,两者对大鼠肝组织匀浆自发脂质过氧化的抑制率均随着质量浓度的增大而增大;红树莓多酚对大鼠肝组织匀浆自发脂质过氧化的抑制作用在低质量浓度时(<100 µg/mL)效果明显,且呈现一定剂量依赖关系,国内有类似的报道。孙静[22]研究表明木犀草素具有较强的抗脂质过氧化能力,当质量浓度在10~30 µg/mL时,其对H2O2诱导的小鼠红细胞溶血的抑制作用与质量浓度成正比;同时,当质量浓度在10~45 µg/mL时,其对脑匀浆脂质过氧化反应的抑制作用与质量浓度也成正比。尹学哲等[23]研究发现大豆皂醇在低质量浓度时(0.17~1.00 mg/L)与H2O2诱导的小鼠肝组织脂质过氧化抑制作用成正比,并呈现良好的量效关系。
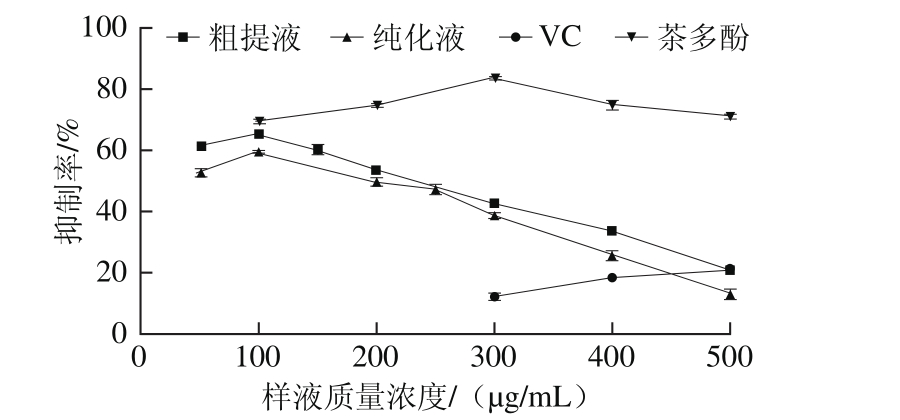
图6 红树莓多酚对大鼠肝组织匀浆自发脂质过氧化的抑制作用
Fig. 6 Inhibitory effects of red raspberry polyphenols on spontaneous lipid peroxidation in hepatic tissue homogenate of rats
3 讨 论
本实验通过采用紫外-可见光谱、FT-IR光谱、HPLC法分析红树莓多酚的组成,目前只鉴定出红树莓多酚中含有原花青素B2、芦丁、水杨酸和鞣花酸这4 种酚类物质,国内外有类似的报道,但本研究中鉴定出来的多酚组分相对较少。孟实等[24]以辽宁沈阳产地的红树莓果实冻干粉和河南封丘县产地的黑树莓冻干粉为研究对象,采用95 %乙醇超声波方法提取其多酚物质,采用HPLC法(用Kromasil C18色谱柱分析,流动相采用色谱纯乙腈(A)-含0.1%磷酸水溶液(B)梯度洗脱,检测波长为280 nm)分析其多酚物质并对红树莓和黑树莓中的活性成分进行了鉴定,结果发现在红树莓中检测到了没食子酸、原儿茶酸、儿茶素、表儿茶素、原花青素B2、矢车菊素、鞣花酸、树莓酮、白藜芦醇及水杨酸,其中儿茶素高达4.81 µg/g(以干质量计,下同)、原花青素B2为1.94 µg/g,但白藜芦醇和水杨酸含量很少,仅分别为0.02 µg/g、0.07 µg/g;而黑树莓中除了不含有白藜芦醇和水杨酸外,其余8 种酚类物质均存在,且儿茶素高达11.76 µg/g、没食子酸1.02 µg/g,但表儿茶素含量仅为0.05 µg/g。张成涛等[1]以辽宁新大地种植的红树莓果实为研究对象,红树莓中树莓酮采用氯仿加热回流提取3 次,采用HPLC法(用CAPCELL PAK C18色谱柱分析,流动相采用甲醇-水(体积比30∶70)洗脱,检测波长为271 nm)检测其树莓酮含量,结果发现其树莓酮平均含量分别为3.32 µg/g(以鲜质量计)。Kula等[6]以波兰Brzezna地区产地的11 种红树莓冻干粉为研究对象,采用甲醇为溶剂,超声波法提取其多酚物质,采用HPLC-二极管阵列检测器连用电喷雾电离质谱检测法(用Discovery HS C18色谱柱分析,流动相乙腈(A)(0.1%三氟乙酸水溶液-乙腈为50∶50,V∶V)-含0.1% TFA水溶液(B)梯度洗脱,检测波长为280 nm)测定其多酚物质,结果发现不同品种红树莓中花色苷含量存在显著差异,且矢车菊素-3-槐糖苷是其花色苷的主要组成成分;黑树莓中花色苷含量是红树莓的4~11 倍,且主要由矢车菊素-3-芸香糖苷和矢车菊素-3-O-木糖鼠李糖苷组成;且两者中鞣花酸主要由单宁Sanguiin H-6组成,同时首次在黑树莓中检测到了原花青素B1和原花青素B2。在这些研究中可能由于所采用的红树莓品种、检测方法、洗脱条件、样品处理方法、仪器设备等条件的差异而导致实验结果存在差异。通过改变检测设备和洗脱条件、优化提取纯化条件、提高样品纯度等方法可能会在本研究中鉴定出更多的多酚物质组成成分。
在研究红树莓多酚的抗脂质过氧化活性中发现红树莓多酚抑制脂质过氧化的能力与多酚质量浓度在一定范围内成正比;超过一定质量浓度后,其抑制率呈反比例关系,国内外也有类似的报道。孙静[22]研究发现金合欢苷对红细胞溶血的抑制作用在一定浓度范围内呈现良好的剂量效应关系,当其浓度为0.67 mmol/L时抑制率为38.31%,但继续加大浓度抑制率反而下降。代斌[25]研究表明五倍子提取物能抑制线粒体脂质过氧化反应,对大鼠肝线粒体膜有较好的保护作用;在0.01~0.10 mg/mL范围内,其对脂质过氧化的抑制率为在(56.62±2.4)%~(71.37±3.7)%之间,呈现一定的剂量依赖关系;当质量浓度继续增大时,抑制作用基本无变化,同时在更高质量浓度(>1 mg/mL)和更低质量浓度(<0.005 mg/mL)时无法测定出结果。Costa等[26]研究了薰衣草提取物抗脂质过氧化作用,结果表明其对Fe2+诱导的白鼠大脑匀浆脂质氧化具有抑制作用,在提取物质量浓度为0.0~1.0 mg/mL范围内时,抑制率与质量浓度呈现良好的剂量关系;但当质量浓度继续增大时,其抑制率随着质量浓度的增大而保持平缓。天然活性成分提取物的抗脂质过氧化能力在一定浓度范围内呈现剂量依赖关系,出现此现象的原因可能与样液质量浓度过高时引起反应体系不稳定、副反应增多、杂质干扰、底物浓度有限等因素有关[27],但具体原因仍需进一步研究。
酚类成分与红树莓果实的生物活性密切相关,主要是通过调节氧化作用的机制体现[28]。前期体内和体外实验研究证明,红树莓提取物中的活性成分,如酚酸、黄酮类化合物、花色苷、鞣花酸等酚类物质具有良好的抗氧化活性、抗脂质过氧化活性[29-30]。本研究表明,红树莓多酚提取物对氧化活性基团诱导的脂质过氧化和自发脂质过氧化均有抑制作用,这可能与其含有的多酚物质密切相关,但其作用机制和途径仍需进一步研究。
4 结 论
组分分析结果表明红树莓多酚中可能含有黄酮类、花色苷、糖苷类物质,HPLC法初步鉴定出红树莓多酚中含有原花青素B2、芦丁、水杨酸和鞣花酸4 种酚类物质,且红树莓多酚粗提液和纯化液中多酚组成具有差异性,但其他多酚组成如没食子酸、阿魏酸、表儿茶素、绿原酸、树莓酮、儿茶素和槲皮素等仍需进一步定性、定量分析。抗脂质过氧化活性结果表明在一定质量浓度范围内,红树莓多酚具有抗脂质过氧化活性。红树莓多酚对Fe2+诱导卵黄脂蛋白脂质过氧化具有抑制作用,当多酚粗提液质量浓度为300 µg/mL时,抑制率达到最大值(78.83±1.35)%;VC对其抑制作用与多酚纯化液接近。红树莓多酚粗提液对H2O2诱导大鼠红细胞氧化溶血作用强于VC和茶多酚,当多酚质量浓度达到75 µg/mL时,抑制率最大(61.49±1.13)%,在此质量浓度条件下多酚纯化液对其抑制率也达到最大值,但仅为(28.32±1.68)%。茶多酚对大鼠肝组织匀浆自发脂质过氧化的抑制作用最为明显,其抑制率最高可达(83.63±0.66)%(质量浓度为300 µg/mL);红树莓多酚粗提液和纯化液对大鼠肝组织匀浆自发脂质过氧化具有抑制作用,且强于VC,当质量浓度达到1 0 0 µg/m L时,其抑制率均最高,分别为(65.48±1.46)%、(59.68±0.22)%。结果表明红树莓多酚粗提液的抗脂质过氧化活性强于纯化液,但红树莓多酚的抗脂质过氧化作用机制和途径仍需进一步研究。
参考文献:
[1] 张成涛, 万国盛, 赵余庆, 等. 红树莓果实中鞣花酸和树莓酮的含量测定[J]. 中国实验方剂学杂志, 2013, 19(19): 140-143.
[2] GOD J, TATE P L, LARCOM L L. Red raspberries have antioxidant effects that play a minor role in the killing of stomach and colon cancer cells[J]. Nutrition Research, 2010, 30(11): 777-782. DOI:10.1016/j.nutres.2010.10.004.
[3] PATRAS A, BRUNTON N P, O’DONNELL C, et al. Effect of thermal processing on anthocyan stability in foods; mechanisms and kinetics of degradation[J]. Trends in Food Science & Technology,2010, 21(1): 3-11. DOI:10.1016/j.tifs.2009.07.004.
[4] LUDWIG I A, MENA P, CALANI L, et al. New insights into the bioavailability of red raspberry anthocyanins and ellagitannins[J].Free Radical Biology and Medicine, 2015, 89: 758-769. DOI:10.1016/j.freeradbiomed.2015.10.400.
[5] PAVLOVIĆ A V, PAPETTI A, ZAGORAC D Č D, et al. Phenolics composition of leaf extracts of raspberry and blackberry cultivars grown in Serbia[J]. Industrial Crops and Products, 2016, 87: 304-314.DOI:10.1016/j.indcrop.2016.04.052.
[6] KULA M, MAJDAN M, GŁÓD D, et al. Phenolic composition of fruits from different cultivars of red and black raspberries grown in Poland[J]. Journal of Food Composition and Analysis, 2016, 52: 74-82. DOI:10.1016/j.jfca.2016.08.003.
[7] 李蕊, 王萍, 王振宇, 等. 野生红树莓花色苷的提取分离及成分鉴定[J]. 食品与发酵工业, 2010, 36(10): 203-207. DOI:10.13995/j.cnki.11-1802/ts.2010.10.007.
[8] RITHIDECH K N, TUNGJAI M, WHORTON E B. Protective effect of apigenin on radiation-induced chromosomal damage in human lymphocytes[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2005, 585(1/2): 96-104. DOI:10.1016/j.mrgentox.2005.04.003.
[9] CHEN W, SU H, XU Y, et al. Protective effect of wild raspberry(Rubus hirsutus Thunb.) extract against acrylamide-induced oxidative damage is potentiated after simulated gastrointestinal digestion[J]. Food Chemistry, 2016, 196: 943-952. DOI:10.1016/j.foodchem.2015.10.024.
[10] CHOU C H, LIU C W, YANG D J, et al. Amino acid, mineral, and polyphenolic profiles of black vinegar, and its lipid lowering and antioxidant effects in vivo[J]. Food Chemistry, 2015, 168: 63-69.DOI:10.1016/j.foodchem.2014.07.035.
[11] 旷慧, 迟超, 吕长山, 等. 红树莓多酚的醇法提取工艺优化[J]. 食品科学, 2016, 37(10): 88-93. DOI:10.7506/spkx1002-6630-201610015.
[12] 陶莎, 黄英, 康玉凡, 等. 大孔吸附树脂分离纯化红小豆多酚工艺及效果[J]. 农业工程学报, 2013, 29(23): 276-285. DOI:10.3969/j.issn.1002-6819.2013.23.038.
[13] PANTELIDIS G E, VASILAKAKIS M, MANGANARIS G A, et al.Antioxidant capacity, phenol, anthocyanin and ascorbic acid contentsin raspberries, blackberries, red currants, gooseberries and Cornelian cherries[J]. Food Chemistry, 2007, 102(3): 777-783. DOI:10.1016/j.foodchem.2006.06.021.
[14] 郝敏, 白雁, 谢彩侠, 等. 近红外光谱法快速测定不同连翘饮片中连翘酯苷A的含量[J]. 中国实验方剂学杂志, 2016(8): 78- 82.DOI:10.13422/j.cnki.syfjx.2016080078.
[15] 陈晨, 胡文忠, 姜波, 等. HPLC法测定鲜切富士苹果中多酚类物质的研究[J]. 食品安全质量检测学报, 2015, 6(7): 2470-2474.
[16] 曹炜, 宋纪蓉, 陈卫军. 蜂胶对脂质过氧化的抑制作用[J]. 食品科学,2004, 25(1): 34-36. DOI:10.3321/j.issn:1002-6630.2004.01.002.
[17] 梅光明, 张小军, 郝强, 等. 酸提香菇多糖的抗氧化活性研究[J]. 浙江海洋学院学报(自然科学版), 2014, 33(5): 406-413. DOI:10.3969/j.issn.1008-830X.2014.05.004.
[18] 梁俊, 李建科, 赵伟, 等. 石榴皮多酚体外抗脂质过氧化作用研究[J]. 食品与生物技术学报, 2012, 31(2): 159-165. DOI:10.3969/j.issn.1673-1689.2012.02.007.
[19] HOLLMAN P C H, HERTOG M G L, KATAN M B. Analysis and health effects of ぼavonoids[J]. Food Chemistry, 1996, 57(1): 43-46.DOI:10.1016/0308-8146(96)00065-9.
[20] 张迪文, 白雁, 谢彩侠, 等. 近红外光谱法快速测定女贞子药材中女贞苷的含量[J]. 中国药房, 2016, 27(36): 5140-5143. DOI:10.6039/j.issn.1001-0408.2016.36.32.
[21] 贝玉祥, 郭英, 何超, 等. 诃子多酚的提取分离、结构鉴定及抗氧化活性的研究[J]. 食品研究与开发, 2009, 30(11): 6-9. DOI:10.3969/j.issn.1005-6521.2009.11.002.
[22] 孙静. 河北香菊中黄酮类化合物抗氧化活性研究[D]. 石家庄: 河北医科大学, 2010: 52.
[23] 尹学哲, 李天, 汪霞. 大豆皂醇抗脂质过氧化作用的研究[J]. 食品工业科技, 2010, 31(7): 143-145. DOI:10.13386/j.issn1002-0306.2010.07.101.[24] 孟实, 张晓书, 赵余庆. 树莓与蓝莓中多酚类成分的HPLC测定[J]. 食品研究与开发, 2014, 35(3): 81-84. DOI:10.3969/j.issn.1005-6521.2014.03.022.
[25] 代斌. 五倍子提取物的体外抗氧化作用研究[D]. 西安: 陕西师范大学, 2009: 27-28.
[26] COSTA P, GONÇALVES S, ANDRADE P B, et al. Inhibitory effect of Lavandulaviridis on Fe2+-induced lipid peroxidation, antioxidant and anti-cholinesterase properties[J]. Food Chemistry, 2011, 126(4):1779-1786. DOI:10.1016/j.foodchem.2010.12.085.
[27] VELU P, VIJAYALAKSHMI A, IYAPPAN P, et al. Evaluation of antioxidant and stabilizing lipid peroxidation nature of Solanum xanthocarpum leaves in experimentally diethylnitrosamine induced hepatocellular carcinogenesis[J]. Biomedicine & Pharmacotherapy,2016, 84: 430-437. DOI:10.1016/j.biopha.2016.09.060.
[28] FU Y, ZHOU X Z, CHEN S G, et al. Chemical composition and antioxidant activity of Chinese wild raspberry (Rubus hirsutus Thunb.)[J]. LWT-Food Science and Technology, 2015, 60(2): 1262-1268. DOI:10.1016/j.lwt.2014.09.002.
[29] DE SOUZA V R, PEREIRA P A P, SILVAN T L T, et al.Determination of the bioactive compounds, antioxidant activity and chemical composition of Brazilian blackberry, red raspberry,strawberry, blueberry and sweet cherry fruits[J]. Food Chemistry,2014, 156: 362-368. DOI:10.1016/j.foodchem.2014.01.125.
[30] GRIS, E F, MATTIVI F, FERREIRA E A, et al. Phenolic profile and effect of regular consumption of Brazilian red wines on in vivo antioxidant activity[J]. Journal of Food Composition and Analysis,2013, 31(1): 31-40. DOI:10.1016/j.jfca.2013.03.002.