肌球蛋白是肌肉蛋白的重要组成部分[1],同时也是具有重要生物学功能的盐溶性蛋白质[2-3]。通常认为肌球蛋白只在高离子强度条件下溶解,在体外高盐溶液(如600 mmol/L KCl)中,分子间静电相互作用被破坏,分子以单体或可溶性寡聚体形式存在,溶解度较高,而在体外低盐溶液(<200 mmol/L)中,肌球蛋白聚集成纤丝,呈不溶状态,由此限制了肌球蛋白的加工特性[4-5]。研究发现氨基酸处理可以改善肌球蛋白的溶解度[6]。早在1994年,Stefansson等[7]就证明了90%的肌球蛋白可溶于含有组氨酸的低离子溶液中。随后有学者发现使用含有组氨酸的缓冲液可以显著提高低离子强度条件下鸡胸肉肌球蛋白的溶解度[8]。在猪肌球蛋白增溶作用的研究中发现,50 mmol/L的精氨酸处理对其溶解度的影响较大且对分子的二级结构没有影响[9],精氨酸可以提高溶菌酶等蛋白质的复性率,并使猪肌球蛋白在低盐离子强度下溶解。近些年研究发现赖氨酸还可以显著提高猪肉肌球蛋白的溶解性[5,10],肌球蛋白经赖氨酸处理后,其表面疏水性和活性巯基含量显著增大,α-螺旋含量降低,而β-折叠、β-转角和无规卷曲含量增加,赖氨酸破坏了肌球蛋白的二级结构[11],肌球蛋白的溶解度增加可能是由结构的改变而引起。但Takai等[9]的研究表明,赖氨酸在增大蛋白溶解度的同时不会影响肌球蛋白的二级结构。赖氨酸是碱性氨基酸,可能是通过静电作用达到增溶效果,由于电荷的作用扰乱了肌球蛋白分子内部的作用,低离子强度下肌球蛋白丝状体解离,进而蛋白溶解度增加。然而,目前有关赖氨酸增溶的机理还未完全明了[12]。因此,以罗非鱼肌球蛋白为原料,在不同离子强度(1~150 mmol/L KCl)条件下,研究赖氨酸对肌球蛋白体系浊度、溶解度、分子结构和形态的影响,探讨赖氨酸诱导肌球蛋白的增溶效果及机理,从而为罗非鱼资源的深加工提供理论依据,进而扩大水产蛋白的应用范围。
1 材料与方法
1.1 材料与试剂
鲜活的罗非鱼购买于湛江市工农市场,体长30 cm,体质量1 kg,立即带回实验室,宰杀取其白肉部分切小块搅碎,并于4 ℃冰箱中保存备用。
三羟基甲基氨基甲烷(tris-(hydroxymethyl)-aminomethane,Tris) 广州化学试剂厂;马来酸(maleic acid,MA) 广州齐云生物科技有限公司;其他均为分析纯。
1.2 仪器与设备
Avanti J-26sxp高速冷冻离心机 美国Beckman公司;UV757紫外-可见分光光度计 上海精科实业有限公司;Chirascan圆二色谱(circular dichroism,CD)仪英国应用光物理公司;JEM-1400透射电子显微镜(transmission electron microscope,TEM) 日本电子公司;Nano-2s MPT-2纳米粒度分析仪 英国马尔文仪器有限公司;RF-5301P荧光分光光度计 日本岛津公司。
1.3 方法
1.3.1 肌球蛋白的提取
肌球蛋白的提取主要参照Stafford等[13]的方法并稍加改动,在4 ℃条件下进行实验,实验中所使用的溶液均为4 ℃。取新鲜搅碎的鱼肉500 g,按质量添加5 倍体积缓冲液A(20 mmol/L pH 7.0磷酸盐缓冲液(phosphate buffered saline,PBS)),20 000 r/min高速匀浆30 s,浸提15 min后离心(5 500×g,10 min),取沉淀重复上述过程2 次。向所得沉淀中按质量加入3倍体积溶液B(0.45 mol/L KCl、5 mmol/L 5-腺苷三磷酸二钠盐(adenosine 5’-triphosphate disodium salt,5’-ATP)、7.5 mmol/L MgCl2、0.15 mmol/L二硫苏糖醇(dithiothreitol,DTT),pH 6.4),搅拌15 min后离心(10 000×g,15 min)。上清液用4 层纱布过滤,滤液用9 倍体积4 ℃蒸馏水稀释,静置10 min后离心(10 000×g,10 min)得沉淀。向沉淀中按质量加入1/5体积缓冲液C(0.12 mol/L Tris-MA、3 mol/L KCl、0.6 mmol/L DTT,pH 7.5),混匀后放置2 h,混合体系中按质量加入1/10体积溶液D(0.11 mol/L ATP、55 mmol/L MgCl2、5.5 mmol/L乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol-bis-(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA),pH 7.5)溶液后,搅拌1 h。加入硫酸铵至饱和度为40%时离心(10 000×g,15 min)取上清液,继续加硫酸铵至饱和度为45%时离心(10 000×g,15 min)取沉淀。沉淀溶于透析液E(20 mmol/L Tris-HCl、0.6 mol/L KCl、0.1 mmol/L DTT,pH 7.0)中透析至无SO42-检出,然后离心(50 000×g,60 min),所得上清液即为肌球蛋白溶液。
采用Lowry法[14]检测上清液蛋白质含量,以牛血清白蛋白(bovine serum albumin,BSA)为标准物,测定波长为750 nm。
1.3.2 样品的制备
提取所得肌球蛋白用不同离子强度的缓冲液(20 mmol/L Tris-HCl,KCl浓度分别为1、20、40、60、100、150、600 mmol/L,pH 7.0)透析24 h,然后测定蛋白质量浓度,用对应缓冲液将其稀释至2.0 mg/mL,所得即为不同离子强度下肌球蛋白溶液。
不同离子强度的蛋白溶液分成3 份,分别进行以下处理:1)对照组:未经处理组;2)赖氨酸处理组:将稀释好的蛋白溶液取出50 mL,用5 mmol/L赖氨酸透析24 h,所有的操作都在4 ℃下进行。透析后取出,4 ℃保存备用;3)酸碱处理组:将不同离子强度下的肌球蛋白pH值调节至同赖氨酸处理后肌球蛋白相同的pH值。KCl浓度为1、20、40、60、100、150、600 mmol/L时,相对应溶液的pH值分别为7.73、7.79、7.82、7.85、7.86、7.90。
1.3.3 浊度的测定
浊度的测定参Liu Ru等[15]的方法并稍加修改,取适量处理后的样液(2.0 mg/mL),放置于室温,用紫外-可见分光光度计,在波长200~800 nm处进行扫描,取370 nm波长处蛋白质溶液的吸光度为蛋白质样品的浊度,用A370nm表示。每个样品测定3 次。
1.3.4 溶解度的测定
将处理后的肌球蛋白溶液离心(50 000×g,15 min,4 ℃)取上清液,采用Lowry法[14]测定其蛋白质的质量浓度。肌球蛋白的溶解度按式(1)计算。每个样品重复3 次。
1.3.5 表面疏水性的测定
采用8-苯胺基萘-1-磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)荧光探针法[16]检测可溶性蛋白表面疏水性。将离心后的可溶性肌球蛋白溶液梯度稀释(0.500 0、0.250 0、0.125 0、0.0 625 mg/mL),取不同质量浓度的溶液各4 mL,加入20 μL的ANS溶液(8.0 mmol/L ANS、0.01 mol/L Tris-HCl,pH 7.0),振荡混匀,静置10 min(避光),使用荧光分光光度计测定样品的荧光强度。本实验中,所用的激发波长和发射波长分别为374 nm和485 nm,狭缝宽为5 nm。将添加探针的样品荧光强度值减去对应样品的内源荧光强度值即为蛋白质的相对荧光强度。以相对荧光强度对蛋白质含量作图,其初始段的斜率作为蛋白质的表面疏水性。每个样品重复3 次。
1.3.6 二级结构的分析
CD的测定参照Ogawa等[17]的方法,取处理后的肌球蛋白溶液,用对应缓冲液稀释至100 μg/mL,进行CD扫描。波长扫描范围为190~260 nm,样品池光径为1 mm,上样量为0.3 mL,测量温度为4 ℃,测定分辨率为0.5 mm,扫描速率为100 nm/min,灵敏度为20 mdeg,响应时间为0.25 s,以缓冲液做空白,实验值为3 次扫描的平均值,α-螺旋结构含量的计算如式(2)、(3)所示。

式中:[θ]222为2 2 2 n m波长处的摩尔椭圆率/(deg·cm2/dmol);[θ]obs为222 nm波长处的椭圆率/mdeg;Mw为肌球蛋白的平均残基分子质量,取115 g/mol[18];ρ为肌球蛋白质量浓度/(mg/mL);L为比色皿光程长度/mm。
1.3.7 Zeta-电位的测定
Zeta-电位的测定参考施小迪等[19]的方法,采用纳米粒度分析仪,利用动态光散射技术,He-Ne激光在633 nm波长处对热处理前后罗非鱼肌球蛋白溶液(1 mg/mL)的电位进行测定,采用90°散射角对样品进行除尘。经过处理的样品注入毛细血管样品池中,在室温下稳定120 s后进行测试。每个样品重复3 次。
1.3.8 TEM分析
样品处理方法参考Hayakawa等[20]的方法,将经过处理的肌球蛋白溶液稀释至0.25 mg/mL,滴1 滴于铜网格上固定,吸附后冲洗数次,再以体积分数0.5%~1.0%醋酸双氧铀染色。烘干后即可观察样品。
1.4 统计分析
利用JMP 7.0软件进行方差分析,差异显著性分析使用多重比较,P<0.05表示存在显著性差异。采用Origin 7.5软件对各指标的变化趋势进行作图。
2 结果与分析
2.1 赖氨酸对低离子强度下肌球蛋白体系浊度和溶解度的影响
赖氨酸对肌球蛋白体系浊度和溶解度的影响见图1,未经氨基酸透析处理及未经酸碱处理组,随着离子强度的增大,体系浊度降低,表明溶解度增大。这是因为高盐浓度下肌球蛋白以单体或寡聚体的形式存在,处于可溶状态,溶解度高,浊度较小;在低盐(KCl浓度不大于150 mmol/L)条件下,肌球蛋白分子聚集成纤丝,体系浊度较大,随着盐浓度的增大,静电相互作用增强可能导致肌球蛋白丝状体解离[8],体系浊度显著减小(P<0.05),溶解度增大。经赖氨酸透析处理后,肌球蛋白体系浊度显著降低,溶解度升高(P<0.05),说明赖氨酸增溶效果明显。研究发现组氨酸能诱导低离子强度(1 mmol/L KCl)下的肌球蛋白丝状体发生解体,体系浊度降低,溶解度升高;而在生理离子强度(150 mmol/L KCl)下,肌球蛋白丝状体依然存在[8],因而浊度和溶解度均未发生显著变化。赖氨酸是碱性氨基酸,诱导体系pH值改变,肌球蛋白分子间的静电相互作用增强,溶解度增大。赖氨酸的添加可以拉长轻链肌球蛋白的头部区域,造成肌球蛋白纤丝弱化,使肌球蛋白在低离子强度溶液中解离[10]。但与对应酸碱(0~20 mmol/L KCl)调节组比较,赖氨酸处理组增溶效果更明显,由此表明赖氨酸诱导低离子强度下肌球蛋白体系增溶的机理不仅与静电相互作用有关,可能还与肌球蛋白分子结构变化等有关。KCl浓度为40 mmol/L及以上时,随着离子强度增大,赖氨酸处理组肌球蛋白的溶解度变化不显著,这与Takai等[9]的研究结果基本一致。

图1 低离子强度下赖氨酸对罗非鱼肌球蛋白体系浊度(A)和溶解度(B)的影响
Fig. 1 Effect of L-lysine on turbidity (A) and solubility (B) of tilapia myosin dispersion under low ionic strength conditions
大写字母不同表示同一处理方式不同离子强度条件下差异显著(P<0.05);小写字母不同表示同一离子强度下不同处理组差异显著(P<0.05)。下同。
2.2 赖氨酸诱导低离子强度下肌球蛋白Zeta-电位的变化
电位的重要意义在于其数值与体系分散的稳定性相关,通常用来表征粒子在溶液中的表面性质,是对颗粒之间相互排斥或吸引度的度量,分子分散粒子越小电位(正或负)越高,体系越稳定[21],当吸引力超过排斥力时,就会发生凝结或聚集。如图2所示,未经赖氨基酸处理及酸碱处理时,KCl浓度在1~150 mmol/L范围内,随着离子强度的增加,肌球蛋白Zeta-电位的绝对值越小,这是由于离子强度的增加会产生对蛋白分子表面扩散双电子层的压缩作用,使得蛋白的Zeta-电位增加[22]。赖氨酸处理后,体系KCl浓度为1 mmol/L时,与对照组相比,处理后肌球蛋白体系的Zeta-电位的绝对值较大,说明了赖氨酸的加入改变了蛋白分子间的相互作用,使得蛋白的溶解度增加,Zeta-电位的绝对值减小。也说明了赖氨酸诱导肌球蛋白增溶的效果明显,体系更为分散。研究发现在包含His的蛋白溶液中,肌球蛋白Zeta-电位的绝对值增大,蛋白的溶解度增加[22]。不同离子强度下,赖氨酸处理组和酸碱处理组Zeta-电位的绝对值与对照组相比均出现了增大的趋势,这说明了表面Zeta-电位的增加可以增大粒子间的静电斥力,破坏蛋白聚合物以及抑制蛋白聚集体的形成。也说明了两种不同的处理方式都增强了蛋白分子内部的静电斥力,使其溶解度变大。赖氨酸处理可以诱导肌球蛋白形成较小的微粒,比如肌球蛋白单体具有较高的Zeta-电位,因此溶解度增加。但Zeta-电位的结果只能是定性判断赖氨酸对肌球蛋白的作用,具体是否会对肌球蛋白的高级结构有影响以及其他相互作用的参数还要借助荧光、CD仪等其他手段进行研究。
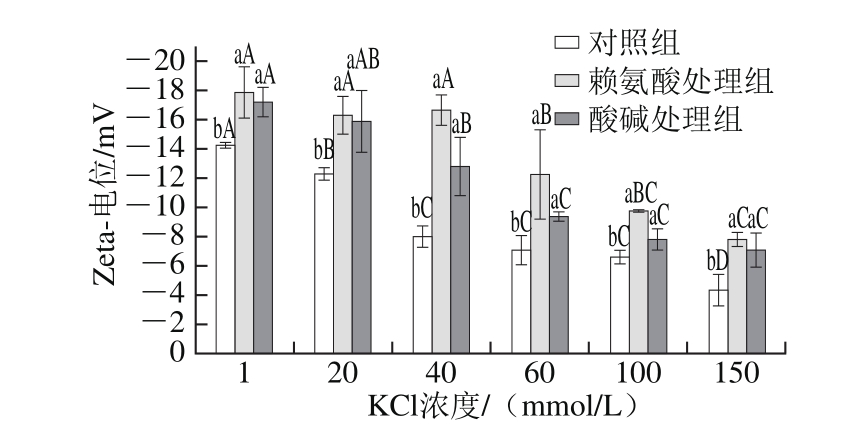
图2 低离子强度下赖氨酸对罗非鱼肌球蛋白体系Zeta-电位的影响
Fig. 2 Effect of L-lysine on zeta potential of tilapia myosin under low ionic strength conditions
2.3 赖氨酸诱导低离子强度下肌球蛋白表面疏水性的变化
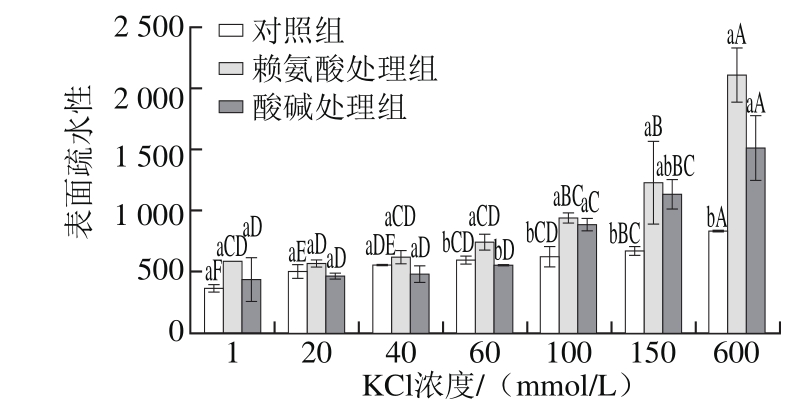
图3 低离子强度下赖氨酸对罗非鱼肌球蛋白体系表面疏水性的影响
Fig. 3 Effect of L-lysine on surface hydrophobicity of tilapia myosin under low ionic strength conditions
表面疏水性可以表征肌球蛋白疏水基团和极性环境的结合数目,是维持蛋白三级结构的主要作用力,而疏水基团与极性环境的结合数目可以用来衡量分子间相互作用的强弱[23]。因此通过分析表面疏水性的变化,可以了解蛋白质分子间及蛋白质与其他分子间的相互作用、蛋白质结构的变化等。由图3可知,在KCl浓度为1 mmol/L时,肌球蛋白的表面疏水性最小,这是因为此时肌球蛋白的溶解度较小,分子主要以粗丝状态存在;随着离子强度升高,表面疏水性逐渐增大,这是因为随着离子强度的升高,肌球蛋白的溶解度逐渐变大,分子由粗丝状态逐渐变为单体状态,暴露出更多的疏水基团,与ANS充分结合,使得表面疏水性增大。KCl浓度为60 mmol/L及以上时,经赖氨酸处理后,肌球蛋白的溶解度增大,体系中有更多的肌球蛋白单体存在,使得更多的疏水基团暴露,促使其表面疏水性显著增大(P<0.05)。在较低离子强度下(1~40 mmol/L KCl),与对照组相比,赖氨酸处理组表面疏水性增幅不显著也说明了低离子强度下溶解度的增加不仅仅是由电荷的改变引起的。在未经处理的肌球蛋白中,许多非极性基团(疏水基团)被包埋在分子内部[24],因而疏水性较低,然而赖氨酸的添加使得肌球蛋白的分子结构展开,溶解性增加,芳香族氨基酸分子的侧链基团逐渐暴露于水溶液中,其所处环境极性增强,导致其表面疏水性增大[25]。但不同pH值条件下的肌球蛋白的表面疏水性也不同,酸碱处理组的肌球蛋白在同一种离子强度下的表面疏水性较对照组都有增大的趋势,这是由于在碱性条件下,电荷的影响同样会促使蛋白分子结构展开,疏水基团分布发生改变,表面疏水性增大。并且Huang Weining等[26]研究发现添加剂与蛋白分子之间首先通过两者之间所带电荷发生静电结合;然后小分子的碳氢键尾部渗透到蛋白质的极性区域,小分子的疏水键与蛋白分子的疏水侧链结合,导致疏水作用发生变化。对比酸碱处理组和赖氨酸处理组发现二者的表面疏水性没有明显差别(P<0.05),这就说明了表面疏水性的增加主要是由电荷改变引起的。
2.4 赖氨酸诱导低离子强度下肌球蛋白α-螺旋含量的变化

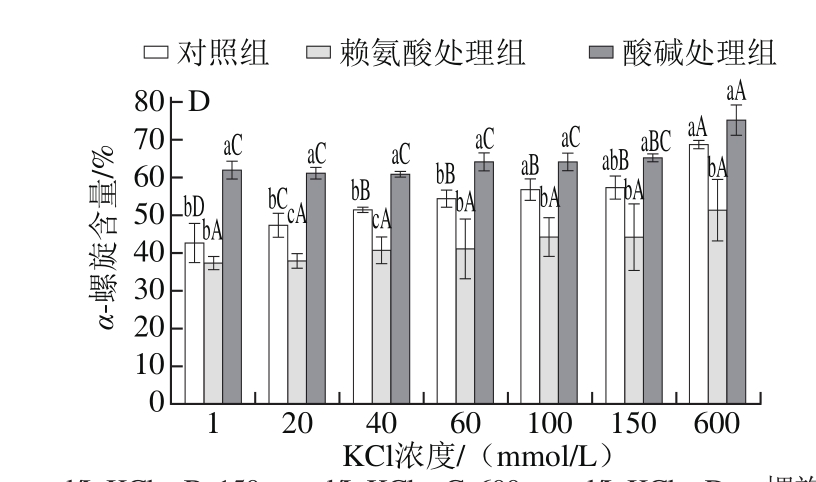
图4 低离子强度下赖氨酸对罗非鱼肌球蛋白CD图谱及α-螺旋含量的影响
Fig. 4 Effect of L-lysine on CD spectrum and α-helix content of tilapia myosin under low ionic strength conditions
A. 1 mmol/L KCl;B. 150 mmol/L KCl;C. 600 mmol/L KCl;D. α-螺旋含量。
赖氨酸处理后肌球蛋白二级结构的变化用CD表征。
α-螺旋主要靠多肽链上羰基(—CO)和氨基(—NH)之间的氢键维持,此外静电相互作用也有影响[15,27],CD光谱在208 nm和222 nm波长处的两个负峰是α-螺旋的特征峰。由图4可以看出,当KCl浓度为1 mmol/L时,肌球蛋白呈粗丝状态,溶解度较低,α-螺旋含量最低,随着盐浓度的增大,可溶性肌球蛋白α-螺旋含量增加,可能是因为肌球蛋白是盐溶性蛋白,随着离子强度的增强肌球蛋白分子表面的电荷增加,增加了肌球蛋白与水分子的相互作用,使得肌球蛋白的溶解度增大,分子结构展开。赖氨酸处理后,肌球蛋白的溶解度增加,但是其α-螺旋含量却是降低的。当KCl浓度为1、150、600 mmol/L时,赖氨酸处理组均被发现肌球蛋白的CD图谱丢失一个肩峰,这是由于赖氨酸处理可以增加蛋白的溶解度,使得蛋白分子结构展开,二级结构发生重排,导致肌球蛋白杆状尾部发生解螺旋,α-螺旋结构逐渐向无规卷曲状态转变。不同离子强度下,肌球蛋白的α-螺旋含量与对照组相比均有下降,这说明了肌球蛋白的二级结构受到破坏,这与Takai等[9]关于赖氨酸诱导猪肌球蛋白增溶但不破坏其二级结构的研究结果不同。对应酸碱处理后发现,肌球蛋白的α-螺旋含量随着离子强度的增加呈现逐渐增大的趋势,且酸碱处理组α-螺旋含量大于其他处理组,这说明了酸碱处理后,蛋白受到电荷的影响,溶解度增加,有更多的单体出现,使得α-螺旋含量有所升高。从CD图谱中可以发现赖氨酸处理组在208 nm和222 nm波长处的椭圆率较对照组有下降趋势[28],说明α-螺旋结构的丢失[15,29]。在600 mmol/L KCl下,与赖氨酸处理组相比,pH值对肌球蛋白α-螺旋含量影响明显较小,可能是由于离子中和了蛋白表面电荷,减弱了电荷对氢键影响[30]。
2.5 赖氨酸诱导低离子强度下肌球蛋白分子形态的变化


图5 3 种离子强度下对照组、赖氨酸处理组和酸碱处理组罗非鱼肌球蛋白体系TEM图
Fig. 5 TEM images of tilapia myosin from control group, lysine treatment group and acid-base treatment group under three different ionic strength conditions
A、a.对照组;B、b.赖氨酸处理组;C、c.酸碱处理组;下标1~3分别表示1、150、600 mmol/L的KCl。
赖氨酸处理后肌球蛋白分子形态的变化见图5,未经氨基酸处理时,低离子强度下(1 mmol/L KCl)肌球蛋白分子呈分散的细丝状态,分子间相互交联,随着离子强度的增加肌球蛋白丝状体逐渐拉长形成粗丝;在生理离子强度下(150 mmol/L KCl),肌球蛋白分子逐渐解离,部分以丝状聚合物的形式存在,在KCl浓度为600 mmol/L时,丝状体已全部消失,呈现单体或二聚体状态,这可能是因为高离子强度能够改变氨基酸残基解离状态,增加蛋白与蛋白间的相互作用从而使粗肌丝解体[31]。经过赖氨酸处理后肌球蛋白丝状体发生了解离,蛋白逐渐分散形成了可溶性的单体结构。当KCl浓度为1 mmol/L时,与未处理的体系比较,肌球蛋白变粗、拉长并弯曲,分子结构更为杂乱;KCl浓度为150 mmol/L时,肌球蛋白呈分散的单体状,与KCl浓度为600 mmol/L时形态极为相似,可能是赖氨酸的作用对肌球蛋白分子形态的影响比中性盐更大。KCl浓度为600 mmol/L时,赖氨酸对肌球蛋白基本无影响,TEM下观察基本无变化,溶解性较好,蛋白呈分散的单体或寡聚体。酸碱调节处理后发现,肌球蛋白在弱碱条件下微观结构发生了变化,在低离子强度(1 mmol/L KCl)下变化较为明显,丝状体头部与尾部有聚集交联的状态存在。比较赖氨酸处理组和酸碱处理组发现,相同KCl浓度下,赖氨酸处理组更为分散,这同溶解度及结构的变化相照应,同时结合溶解度的变化说明赖氨酸比酸碱处理增溶效果更好。这充分说明了赖氨酸的增溶机理不只和体系电荷的改变有关,还有可能与赖氨酸与肌球蛋白分子的特异性结合有关。
随着KCl浓度的增大,肌球蛋白丝状体逐渐解离,研究结果同组氨酸对低离子强度(1~50 mmol/L KCl)条件下鸡胸肉肌球蛋白影响的图像分析结果相似[22]。结合以上肌球蛋白二、三级结构的变化,赖氨酸的增溶机理也可能与干扰肌球蛋白分子间的静电相互作用而导致纤丝解离有关。
3 结 论
实验范围内,5 mmol/L赖氨酸能显著提高低离子强度下肌球蛋白的溶解度,并使浊度变小;赖氨酸处理后低离子强度下肌球蛋白的表面疏水性显著增加,α-螺旋含量减小,说明了疏水相互作用是赖氨酸增溶的原因;赖氨酸处理后,肌球蛋白Zeta-电位的绝对值增大,说明了赖氨酸的加入增大了蛋白之间的静电斥力;TEM的结果显示,赖氨酸处理后,肌球蛋白的微观结构发生了很大的变化,随着离子强度的增加蛋白细丝状逐渐拉长解离为单体,蛋白的溶解度升高。高离子强度下,肌球蛋白的微观结构几乎没有变化。对应酸碱处理后体系的浊度降低,溶解度明显提高,这说明了pH值的变化也可以提高肌球蛋白溶解度;由于电荷的影响,肌球蛋白Zeta-
电位绝对值显著增大,这同溶解度的变化一致;酸碱处理后肌球蛋白体系的表面疏水性增加,α-螺旋含量增大,这说明了赖氨酸处理组和酸碱处理组的增溶机制并不完全相同;酸碱处理后,低离子强度下出现肌球蛋白丝状头部与尾部聚集交联的状态,结果与赖氨酸处理组不尽相同。综上表明赖氨酸的增溶效果可能是由于静电相互作用和疏水相互作用引起的,但也不能排除赖氨酸能够与肌球蛋白分子内部结合,通过改变肌球蛋白分子结构而引起增溶。
参考文献:
[1] MASATO S, EISUKE T, DAISUKE E, et al. Heat-induced formation of myosin oligomer-soluble ベlament complex in high-salt solution[J].International Journal of Biological Macromolecules, 2015, 73: 17-22.DOI:10.1016/j.ijbiomac.2014.11.055.
[2] WESTPHALEN A D, BRIGGS J L, LONERGAN S M, et al. Inぼuence of muscle type on rheological properties of porcine myoベbrillar protein during heat-induced gelation[J]. Meat Science, 2006, 72(4): 697-703.DOI:10.1016/j.meatsci.2005.09.021.
[3] REED Z H, GUILFORD W, PARK J W. Thermal denaturation of Tilapia myosin and its subunits as affected by constantly increasing temperature[J]. Journal of Food Science, 2011, 76(7): 1018-1024.DOI:10.1111/j.1750-3841.2011.02326.x.
[4] 赵晓阳, 李可, 邹玉峰, 等. 组氨酸与氯化钾混合液对兔肉肌球蛋白特性的影响[J]. 食品科学, 2014, 35(9): 6-10. DOI:10.7506/spkx1002-6630-201409002.
[5] LESIOW T, XIONG Y L. Chicken muscle homogenate gelation properties: effect of pH and muscle ベber type[J]. Meat Science, 2003,64(4): 399-403. DOI:10.1016/S0309-1704(02)00206-1.
[6] CHEN X, LI Y, ZHOU R Y, et al. L-histidine improves water retention of heat-induced gel of chicken breast myofibrillar proteins in low ionic strengeh solution[J]. International Journal of Food Science and Technology, 2016, 51(5): 1195-1203. DOI:10.1111/ijfs.13086.
[7] STEFANSSON G, HULTIN H O. On the solubility of cod muscle proteins in water[J]. Journal of Agricultural and Food Chemistry,1994, 42(12): 2656-2664. DOI:10.1021/jf00048a002.
[8] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin is solubilized in a neutral and low ionic strength solution containing L-histidine[J]. Meat Science, 2009, 82(2): 151-154. DOI:10.1016/j.meatsci.2009.01.002.
[9] TAKAI E, YOSHIZAWAS, EJIMA D, et al. Synergistic solubilization of porcine myosin in physiological salt solution by arginine[J].International Journal of Biological Macromolecules, 2013, 62(11):647-651. DOI:10.1016/j.ijbiomac.2013.09.035.
[10] GUO X Y, PENG Z Q, ZHANG Y W, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015, 170:212-217. DOI:10.1016/j.foodchem.2014.08.045.
[11] 陶慰孙, 李惟, 姜涌明. 蛋白质分子基础[M]. 北京: 高等教育出版社,2003: 1-8.
[12] ISHIBASHI M, TSUMOTO K, TOKUNAGA M, et al. Is arginine a protein-denaturant[J]. Protein Expression and Purification, 2005,42(1): 1-6. DOI:10.1016/j. pep.2005.03.028.
[13] STAFFORD W F, SZENTKIRALYI E M, SZENT-GYÖRGYI A G.Regulatory properties of single-headed fragments of scallop myosin[J].Biochemistry, 1979, 18(24): 5273-5280. DOI:0006-2960/79/0418-5273501.00/0.
[14] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275. DOI:10.1515/bchm2.1951.286.1-6.270.
[15] LIU Ru, ZHAO Singming, YANG Hong, et al. Comparative study on the stability of ベsh actomyosin and pork actomyosin[J]. Meat Science,2011, 88(2): 234-240. DOI:10.1016/j.meatsci.2010.12.026.
[16] ZHANG Z Y, YANG Y L, TANG X Z, et al. Chemical forces and water holding capacity study of heat-induced myoベbrillar protein gel as affected by high pressure[J]. Food Chemistry, 2015, 188: 111-118.DOI:10.1016/jfoodchem.2015.04.129.
[17] OGAWA M, KANAMARU J, MIYASHITA H, et al. Alpha-helical structure of fish actomyosin: changes during setting[J]. Journal of Food Science, 1995, 60(2): 297-299. DOI:10.1111/j.1365-2621.1995.tb05659.x.
[18] VISESSANGUAN W, OGAWA M, NAKAI S, et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtoothぼounder myosin[J]. Journal of Agricultural and Food Chemistry, 2000,48(4): 1016-1023. DOI:10.1021/jf9900332.
[19] 施小迪, 郭顺堂. 稀释介质种类对豆乳蛋白胶体粒子zeta电位测定效果的影响[J]. 农业工程学报, 2016, 32(7): 270-275. DOI:10.11975/j.issn.1002-6819.2016.07.038.
[20] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin filament depolymerizes in a low ionic strength solution containing L-histidine[J].Meat Science, 2010, 84(4): 742-746. DOI:10.1016/j.meatsci.2009.010.
[21] 陈平, 赵佳, 吴振玉, 等. AgNO3/KI配比对电泳法测定AgI胶体Zeta电势的影响及实验现象探讨[J]. 池州学院学报, 2015, 29(3): 138-140. DOI:10.13420/j.cnki.jczu.2015.03.045.
[22] CHEN X, ZOU Y F, HAN M Y, et al. Solubilisation of myosin in a solution of low ionic strength L-histidine: signiベcance of the imidazole ring[J]. Food Chemistry, 2016, 196(3): 42-49. DOI:10.1016/j.foodchem.2015.09.039.
[23] 王中江, 江连洲, 魏冬旭, 等. pH值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51. DOI:10.7506/spkx.1002-6630(2012)11-0047-05.
[24] 胡爱军, 卢秀丽, 郑捷, 等. 超声处理对鲢鱼鱼肉蛋白结构的影响[J]. 现代食品科技, 2012, 28(8): 894-897. DOI:10.13982/j.mfst.1673-9078.2012.08.030.
[25] 尹燕霞, 向本琼, 佟丽. 荧光光谱法在蛋白质研究中的应用[J]. 实验技术与管理, 2010, 27(2): 33-36. DOI:10.16791/j.cnki.sjg.2010.02.011.
[26] HUANG Weining, SUN Xiuzhi. Adhesive properties of soy proteins modified by sodium dodecyl sulfate and sodium dodecylbenzene sulfonate[J]. Journal of the American Oil Chemists’ Society, 2000,77(7): 705-708. DOI:10.1007/s11746-000-0113-6.
[27] 朱东宏, 兰冬梅, 郑惠娜, 等. 不同种类酸诱导罗非鱼肌球蛋白去折叠行为的研究[J]. 广东农业科学, 2015, 42(12): 135-140.DOI:10.16768/j.issn.1004 -874x.2015.12.005.
[28] 周茹, 倪渠峰, 林伟伟, 等. 肌原纤维蛋白溶解度对盐离子浓度的依赖性[J]. 中国食品学报, 2015, 15(3): 32-39. DOI:10.16429/j.1009-7848.2015.03.005.
[29] 洪伟. pH值调节诱导鳄蛇鲻肌球蛋白分子展开/折叠行为的研究[D].湛江: 广东海洋大学, 2014: 17-18.
[30] 费英, 韩敏义, 杨凌寒, 等. pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170.DOI:10.3864/j.issn.0578-1752.2010.01.019.
[31] THAWORNCHINSOMBUT S, PARK J W. Role of ionic strength in biochemical properties of soluble fish proteins isolated from cryoprotected Paciベc whiting mince[J]. Journal of Food Biochemistry,2005, 29(2): 132-151. DOI:10.1111/j.1745-4514.2005.00005.x.