大肠杆菌O157:H7是最常见的食源性致病菌之一,在世界范围内普遍存在,广泛分布于水、土壤和食物中,肉类、蔬菜、水果等均可成为传染源[1-3],目前已被WHO列为食品中四大食源性致病菌之一。我国食源性疾病监测网近年的资料显示,我国在生肉、熟肉、蔬菜中均受到大肠杆菌O157:H7不同程度的污染,尤其是在生牛肉中感染几率尤其高[4-5],大肠杆菌O157:H7感染存有爆发的可能性,应引起高度重视[6-7]。
大肠杆菌O157:H7属于革兰氏阴性短杆菌,兼性厌氧,菌体两端钝圆,无芽孢,有周鞭毛,大多数菌株有荚膜;培养18~24 h后,菌落呈圆形凸起,边缘齐整,直径为1~15 mm,是肠出血性大肠杆菌的主要病原血清型,同时也是一种重要的人畜共患病原菌[8]。
流式细胞术(flow cytometry,FCM)可以对被荧光染色的单个细胞或生物颗粒进行多参数、快速定量分析,可以通过检测荧光信号监测细胞膜完整性、细胞生理代谢活动、细胞凋亡周期、膜电位等细胞特性并分选出特定状态的细胞群体[9]。荧光染料碘化丙啶(propidium iodide,PI)是一种可对DNA染色的细胞核染色试剂,是一种溴化乙啶的类似物,在嵌入双链DNA后释放红色荧光,不能通过完整的细胞膜,但能穿过破损的细胞膜而对核染色。PI-DNA复合物的激发和发射波长分别为535 nm和615 nm。SYBR Green Ⅰ是一种可以透过完整细胞膜结合于所有DNA双螺旋小沟区域的绿色荧光染料。在游离状态下,SYBR Green Ⅰ发出微弱的荧光,与双链DNA结合后,荧光大大增强,SYBR Green Ⅰ的激发波长和发射波长分别为497 nm和520 nm[10-12]。
超高压(high hydrostatic pressure,HHP)处理可有效抑制食品中的腐败菌和致病菌,是目前食品工业运用最广泛的非热加工技术之一,其杀菌机制主要与细菌细胞膜破坏、核酸结构变化、胞内蛋白质变性、关键酶活性降低等有关[13-15]。超高压处理后的微生物细胞存在3 种不同生理状态:即正常细胞、处于损伤状态的细胞(亚致死细胞)和死亡细胞[16-17]。1951年Hartsell最先将亚致死菌定义为一种在营养丰富的非选择性培养基上能生长出正常菌落,而在选择性培养基上无法生长出可见菌落的微生物的存在状态,非选择性培养基和选择性培养基之间菌落数的差值,即为亚致死状态菌的数目[18]。在超高压处理过程中部分大肠杆菌O157:H7会处于亚致死状态,流式细胞仪可以将不同生理状态的细菌有效检出,避免传统培养方法在检测亚致死菌过程中容易出现假阴性、造成漏检、错检的情况,本研究采用PI和SYBR Green Ⅰ双染色法结合流式细胞术对超高压处理后大肠杆菌O157:H7菌体细胞不同的存活状态及细胞膜完整性进行分析研究,以此评估通过单纯超高压杀菌处理是否可以有效避免大肠杆菌O157:H7带来的食品安全隐患,并在此基础上进一步证实超高压处理后菌体细胞死亡机制。
1 材料与方法
1.1 菌株、材料与试剂
大肠杆菌O157:H7由中国工业微生物菌种保藏中心提供(编号CICC 21530)。
胰蛋白胨大豆肉汤(trypticase soy broth,TSB)、胰酪胨大豆酵母浸膏琼脂(tryptic soy agar with yeast extract,TSA-YE)、山梨醇麦康凯琼脂(CT-sorbitol MacConkey agar base,CT-SMAC) 北京陆桥技术有限责任公司;磷酸二氢钠、磷酸氢二钠 南京化学试剂有限公司;PI、SYBR GreenⅠ 美国Sigma公司;聚乙烯耐高压包装袋(240 mm×190 mm) 南京圣比澳生物科技有限公司。
1.2 仪器与设备
UHPF/2L/600 MPa食品超高压处理设备 包头高新技术食品机械公司;绝对计数荧光微球 上海甄准生物科技有限公司;FACSCalibur型全自动流式细胞仪 美国BD公司;FR-300手压式塑料薄膜袋封口机 特力包装机械有限公司;2-16KL 高速冷冻离心机 美国Sigma公司;WGZ-2XJ细菌浊度计 上海昕瑞仪器仪表有限公司;DHP-9052型电热恒温培养箱 上海一恒科技有限公司;ZQTY-70台式振荡培养箱 上海知楚仪器有限公司;JSM-5610LV型扫描电子显微镜(scanning electron microscope,SEM) 日本电子株式会社;H-7650透射电子显微镜(transmission electron microscope,TEM)日本日立公司。
1.3 方法
1.3.1 菌悬液制备
取10 mL新鲜已灭菌的胰蛋白胨大豆肉汤,将大肠杆菌O157:H7单菌落接种于其上,37 ℃、150 r/min振荡培养24 h,再取活化好的菌悬液1 mL接种于50 mL已灭菌的新鲜的胰蛋白胨大豆肉汤中,37℃、150 r/min振荡培养菌种18 h至稳定期,4 ℃、8 000×g离心5 min,弃上清液,用已灭菌的pH 7.0磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤菌体3 次,并将菌体重悬,用细菌浊度计调整菌悬液浓度至106CFU/mL,装入无菌聚乙烯耐高压包装袋中,4 ℃冰箱保存备用。
1.3.2 超高压处理
菌悬液样品于25 ℃条件下超高压(200、400、500 MPa)处理5 min(加压处理时间不包括升、卸压所用时间),处理介质为水。超高压处理后的样品立即于冰上保存。
1.3.3 流式细胞仪对健康菌和热致死菌存活状态的检测
梯度混合健康菌和热致死菌(1 0 0 ℃、30 min),混合后的活菌率为0%、25%、50%、75%、100%。向各组混合菌悬液中分别加入50 μL PI和1 μL SYBR GreenⅠ[19-20],摇匀,37 ℃放置30 min。染色过程在避光条件下进行,染色结束后,4 ℃、8 000×g离心5 min,用PBS洗涤2 次,去除多余的染色剂,重新悬浮,加入绝对计数荧光微球用流式细胞仪检测计数。细胞采集数为104,流速为600 个/秒,FL1通道收集SYBR GreenⅠ荧光,FL3通道收集PI荧光,作计数结果与梯度配比热处理细胞的相关性分析,以验证实验方法的精确度。
1.3.4 超高压处理后大肠杆菌O157:H7存活状态的检测
经200、400、500 MPa超高压处理的菌悬液中分别加入50 μL PI和1 μL SYBR GreenⅠ,摇匀,37 ℃放置30 min。染色过程在避光条件下进行,染色结束后,4 ℃、8 000×g离心5 min,用PBS洗涤2 次,去除多余的染色剂,重新悬浮,加入绝对计数荧光微球[21-23]用流式细胞仪检测计数。细胞采集数为104,流速为600 个/秒,FL1通道收集SYBR GreenⅠ荧光,FL3通道收集PI荧光,采用Cell-Quest软件采集数据。
1.3.5 超高压处理后大肠杆菌O157:H7菌落总数测定
无菌操作条件下各超高压处理组样品各1 mL用已灭菌的pH 7.0 PBS进行梯度稀释,选择合适的稀释度分别用TSA-YE和CT-SMAC[24-25]进行平板涂布计数。平板计数操作按照GB 4789.2—2003《食品卫生微生物学检验 菌落总数测定》进行。阳性对照组为未经超高压处理的菌悬液样品,阴性对照组为100 ℃沸水浴30 min,热灭活的菌悬液样品。
1.3.6 超高压处理后大肠杆菌O157:H7微观形态变化
1.3.6.1 SEM观察
收集未经超高压处理以及分别经200、400、500 MPa超高压处理后大肠杆菌O157:H7菌悬液80 mL,4 ℃、8 000×g离心5 min,收集菌体,加入预冷的2.5%戊二酸溶液4 ℃固定4 h,用无菌PBS(pH 7.4)漂洗3 次,经50%、70%、80%、90%的乙醇顺序梯度脱水各15 min,再用100%乙醇脱水3 次,每次20 min。脱水后样品用乙酸异戊酯置换3 次,每次20 min,置换后的样品进行冷冻干燥,离子溅射仪镀金(厚度约10 nm),样品处理好后于JSM-5610LV型SEM观察菌体结构变化[18,26]。
1.3.6.2 TEM观察
收集未经超高压处理以及分别经200、400、500 MPa超高压处理后大肠杆菌O157:H7菌悬液80 mL,4 ℃、8 000×g离心5 min,收集菌体,加入预冷的2.5%戊二酸溶液4 ℃固定4 h,2%琼脂预包埋,用无菌PBS(pH 7.4)漂洗2 次,2%锇酸固定1 h,用无菌PBS(pH 7.4)漂洗3 次,经30%、50%、70%、90%、无水乙醇梯度脱水各1次,每次15 min,再用无水丙酮脱水2次,环氧树脂Epon812包埋,梯度烘干,采用超薄切片机切成厚度为70 nm的样品,用醋酸铀和柠檬酸铅双染于H-7650 TEM下观察菌体内部的结构变化[18,26]。
1.4 数据统计分析
数据采用SPSS 17.0进行进行单因素方差分析及Duncan’s多重比较检验(P<0.05),对流式细胞仪数据用Flowjo 7.6.1进行分析处理。
2 结果与分析
2.1 双染色法精确度实验
SYBR GreenⅠ可以透过完整细胞膜能进入活菌的胞内与核酸物质结合,PI不能透过完整细胞膜只能透过破损的细胞膜进入死菌胞内与核酸物质结合。但PI与核酸物质的亲和性优于SYBR GreenⅠ,一旦进入胞内可以取代SYBR GreenⅠ的结合位点;SYBR GreenⅠ的发射波长与PI的激发波长相近,当两种荧光物质同时存在时,在荧光共振能量转移作用下会使绿色荧光减弱,红色荧光增强[10,27],在这两种作用下使得死菌只显示红色荧光,而活菌显示绿色荧光。通过流式细胞仪分选不同荧光信号的细胞并对其计数,计算活菌/死菌比例与梯度配比做相关性验证。
实验结果表明SYBR GreenⅠ与PI双染色法能够将活菌/死菌梯度配比溶液中的活菌和死菌有效区分开。在梯度配比溶液中加入绝对计数微球后能精确对显示不同荧光颜色的细胞计数,按计数结果计算显示绿色荧光的细胞(FL1通道收集的细胞)占总细胞(FL1通道与FL3通道收集的细胞之和)的比例(y),其结果与梯度配比中健康菌所占比例(x)几乎一致,(y=0.994 7x,R2=0.997 9),表明流式细胞仪双染色法能够准确鉴别大肠杆菌O157:H7的死活状态并对死、活菌分别精确计数。
2.2 超高压处理后大肠杆菌O157:H7存活状态检测结果
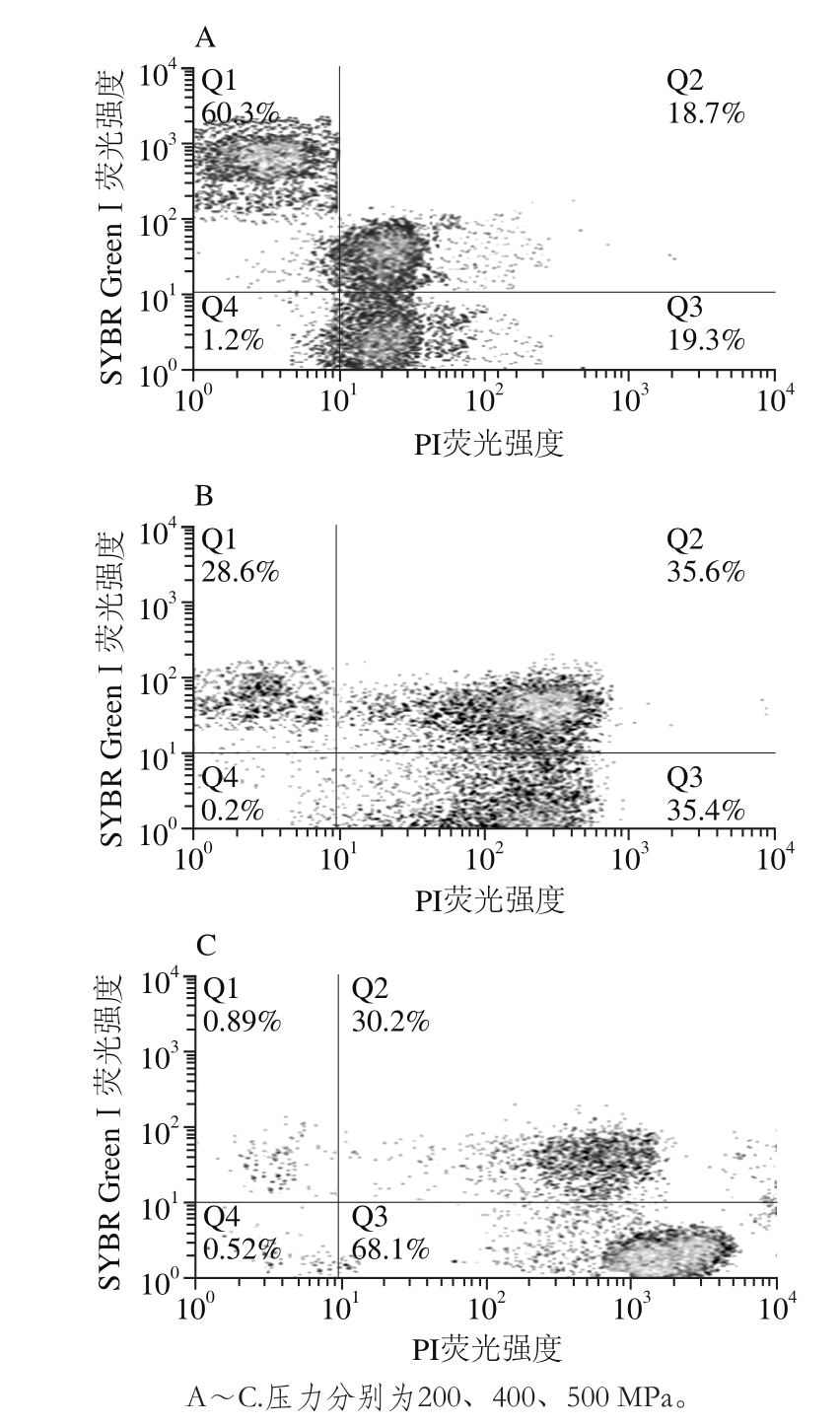
图1 超高压处理后大肠杆菌O157:H7双染后流式细胞二维点图
Fig. 1 Flow cytrometric ぼuorescence dot plots for E. coli O157:H7 subjected ti different pressure treatments
经超高压处理后大肠杆菌O157:H7流式细胞仪双染色结果如图1所示。门Q1内的菌显示绿色荧光是只能被SYBR GreenⅠ染色的存活菌具有完整的细胞膜。门Q2内的菌同时显示绿色荧光和红色荧光(图中未能显示,后同)为损伤菌,损伤菌能同时显示绿色荧光和红色荧光是因为这部分菌细胞膜出现损伤使一部分PI进入胞内,但由于细胞膜只是部分损伤进入胞内的PI量较少,不足以完全取代SYBR GreenⅠ与核酸物质结合,所以使这部分细胞同时显示绿色荧光与红色荧光[10]。门Q3内的菌是被PI染色显示红色荧光的死亡菌。门Q4内的菌是少量没有被染色剂染色的菌,没有荧光信号或信号很弱。
经200 MPa处理后60.3%的菌在门Q1内,18.7%的菌在门Q2内,19.3%的菌在门Q3内,1.2%的菌在门Q4内,结果表明经200 MPa处理60.3%的菌具有完整细胞膜不能被PI染色,18.7%的菌细胞膜出现破损同时被PI与SYBR GreenⅠ染色,19.3%的菌细胞膜的选择透过性完全丧失,使大量PI透过细胞膜进入胞内而使细胞显示红色荧光,这部分菌通常被认为是死亡菌[10,27-28]。
经400 MPa处理后28.6%的菌在门Q1内,35.6%的菌在门Q2内,35.4%的菌在门Q3内,0.2%的菌在门Q4内,结果表明经400 MPa处理28.6%的菌具有完整细胞膜不能被PI染色,35.6%的菌细胞膜出现破损同时被PI与SYBR GreenⅠ染色,35.4%的菌是死亡菌。
经500 MPa处理后0.89%的菌在门Q1内,30.2%的菌在门Q2内,68.1%的菌在门Q3内,0.52%的菌在门Q4内,结果表明经500 MPa处理0.89%的菌具有完整细胞膜不能被PI染色,30.2%的菌细胞膜出现破损同时被PI与SYBR GreenⅠ染色,68.1%的菌是死亡菌。
2.3 超高压处理后大肠杆菌O157:H7传统培养计数结果
经不同压力处理后的大肠杆菌O157:H7采用传统培养方法进行菌落计数。将各组菌液进行梯度稀释,选择3 个合适的稀释度,分别吸取100 μL经选择性培养基(CT-SMAC)和非选择性培养基(TSA-YE)进行平板涂布培养,结果如表1所示。
表1 不同压力处理后TSA-YE和CT-SMAC对大肠杆菌O157:H7平板涂布计数结果
Table 1 Counts of E. coli O157:H7 undergoing different pressure treatments determined using TSA-YE and CT-SMAC
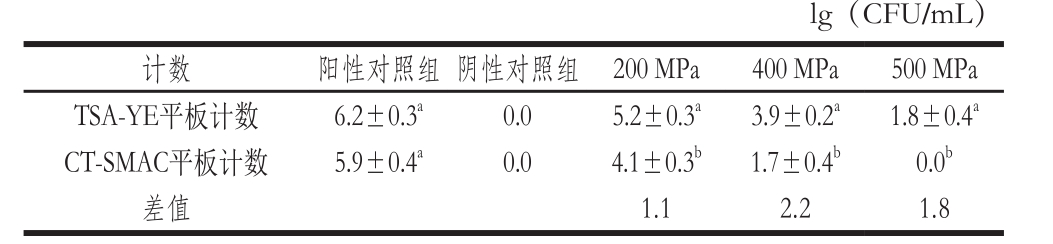
注:同列肩标字母不同表示差异显著(P<0.05)。
健康菌和损伤菌均能在非选择性平板TSA-YE上培养,而选择性平板CT-SMAC上只有健康菌可以生长,因此非选择性平板上菌落数与选择性平板上菌落数的差值可以反映损伤菌的菌体数量。不同压力处理,2 种平板计数结果的差值不同,表明不同压力水平处理产生的损伤状态的菌体数量不同。超高压处理后大肠杆菌O157:H7传统计数结果可以验证流式细胞仪双染色法对超高压处理后大肠杆菌O157:H7存活状态检测结果的准确性。
超高压处理后大肠杆菌O157:H7传统计数结果如表1所示。阳性对照组两种培养基平板涂布计数结果无显著差异,阴性对照组两种培养基上都没有检出菌落。200 MPa下TSA-YE平板计数结果为5.2 lg(CFU/mL),CTSMAC平板计数结果为4.1 lg(CFU/mL),两者差值表示亚损伤状态菌的数量级,其差值为1.1 lg(CFU/mL);400 MPa下TSA-YE平板计数结果为3.9 lg(CFU/mL),CT-SMAC平板计数结果为1.7 lg(CFU/mL),2 种平板计数结果的差值为2.2 lg(CFU/mL);500 MPa下TSA-YE平板计数结果为1.8 lg(CFU/mL),CT-SMAC平板没有检出菌落,2 种平板计数结果的差值为1.8 lg(CFU/mL)。平板涂布计数结果与流式细胞仪双染色法检测结果相比,经超高压处理后大肠杆菌O157:H7存活菌、亚损伤菌与死亡菌数量级分布是一致的。
2.4 SEM观察超高压处理后大肠杆菌O157:H7形态学变化

图2 超高压处理后大肠杆菌O157:H7 SEM图
Fig. 2 Scanning electron microscopic images of E. coli O157:H7 treated with high hydrostatic pressure processing
A.未处理;B~D.压力分别为200、400、500 MPa。
由图2可知,未经超高压处理组细胞具有典型的杆状外形,细胞体表面规整,边缘光滑,细胞壁、细胞膜完整,细胞形态结构正常。经200 MPa处理后少量菌体出现表面凹陷,大部分菌体形态结构正常,菌体饱满表面光滑。400 MPa处理后部分菌体出现表面凹陷,菌体表面出现褶皱,边缘粗糙。500 MPa处理后大部分菌体外观有显著变化,菌体表面出现褶皱,边缘粗糙,有内容物外泄。
2.5 TEM观察超高压处理后大肠杆菌O157:H7形态学变化


图3 超高压处理后大肠杆菌O157:H7 TEM图
Fig. 3 Transmission electron microscopic images of E. coli O157:H7 treated with high hydrostatic pressure processing
A.局部图;B.纵切面图;C.横切面图;1.未处理;2~4.压力分别为200、400、500 MPa。
由图3可知,未处理组大肠杆菌O157:H7菌体细胞结构完整、清晰。细胞壁边缘整齐光滑,细胞壁与细胞质膜之间无明显间隙,细胞质分布均匀,菌体呈较规则的杆状,无明显褶皱。200 MPa处理后的大肠杆菌O157:H7部分菌体开始出现细胞壁和细胞质膜局部分离,细胞中心出现大面积光透明区,电子密度较低的阴影区从中心向细胞质膜靠近,但大部分菌体依然呈较规则的杆状,细胞质均匀分布。经400 MPa处理的大肠杆菌O157:H7,大部分菌体细胞严重变形,细胞壁和细胞质膜分离,层次不清,部分菌体细胞内部结构发生明显变化,光透明区出现丝状物。经500 MPa处理的大肠杆菌O157:H7,菌体细胞严重变形,菌体细胞壁和细胞质膜严重分离,且层次不清,电子密度较低的阴影区从中心向细胞质膜靠近,并凝集成块,个别菌体细胞壁模糊不清,细胞膜破裂。菌体内部结构发生更明显变化,光透明区出现大量辐射丝状物,核糖体变的清晰可见。
本实验采用SEM、TEM观察和分析超高压处理对大肠杆菌O157:H7形态结构的影响,结果表明,超高压可导致大肠杆菌O157:H7外部形态、内部结构的显著变化,对菌体细胞壁和细胞膜有显著的破坏作用,且这种破坏作用随压力升高而增大,当压力达到500 MPa时,细菌细胞壁、细胞膜几乎被完全破坏,细胞严重变形。
3 讨 论
对超高压等外力作用后微生物菌体细胞的生理状态研究能够使我们更好地理解微生物世界。运用流式细胞术研究微生物细胞的死亡、存活和损伤状态近年来得到学者的广泛认可和关注,关于损伤菌的研究近几年也日趋增多。本研究选择SYBR-GreenⅠ、PI两种生物学染料对超高压处理后的食源性致病菌大肠杆菌O157:H7进行染色、流式细胞仪分析,并结合传统培养方法和电子显微镜技术,有效揭示出超高压对菌体细胞的破坏作用及其不同的生理生化特性。首先,通过健康菌/死菌梯度配比实验验证了SYBR GreenⅠ、PI双染色流式细胞术对大肠杆菌O157:H7死活菌检测计数的精确度,实验结果表明双染色流式细胞术能够准确区分梯度配比混合菌液中的活菌和死菌,并对活菌和死菌能够实现准确计数。其次,采用SYBR GreenⅠ、PI双染色流式细胞术对经200、400、500 MPa超高压处理的菌悬液进行流式细胞学检测,分析不同压力处理后菌体细胞的存活状态。结果表明超高压对大肠杆菌O157:H7有明显的致死效果,并能使大肠杆菌O157:H7细胞膜出现明显损伤,这一研究结果与Ananta等[29]关于Lactobacillus rhamnosus ATCC 53103压力致死机制的研究结果是一致的。在实验压力范围内,随压力升高,大肠杆菌O157:H7细胞膜损伤程度增加,细菌细胞死亡率增加,在400 MPa下处于亚损伤状态的细菌细胞最多,占细菌细胞总数的35.6%,在500 MPa压力处理下也依然有30.2%的细菌细胞处于亚损伤状态。同时对经200、400、500 MPa超高压处理的菌悬液进行选择性培养基(CT-SMAC)和非选择性培养基(TSA-YE)平板涂布培养,结果与SYBR GreenⅠ、PI双染色流式细胞术检测结果一致,即使在500 MPa压力处理下依然有一部分菌处于亚损伤状态,这部分菌不能在CT-SMAC平板上生长,但可以在TSA-YE平板上生长。这一结果与Mariana[30]、Maresca[31]等的研究所揭示的结果相同。最后,通过SEM和TEM对经200、400、500 MPa超高压处理的菌悬液进行形态学观察,结果表明超高压使大肠杆菌O157:H7细菌细胞变形,细菌细胞壁、细胞膜破裂,内部形态改变,这与前文流式细胞术的分析结果和陆海霞等[13]的研究在一定程度上所揭示的情况是一致的。
综上所述,400 MPa以上的超高压对大肠杆菌O157:H7有较好的致死作用,当处理压力达到500 MPa时几乎多有菌体都受到损伤或死亡,超高压对细菌细胞膜的破坏作用很可能是其主要致死机制之一。即使在500 MPa压力处理下依然有30.2%的菌处于亚致死状态,这部分菌是否会在食品货架期内带来安全隐患尚需进一步评估。
参考文献:
[1] JUNEJA V K, SOFOS J N. Pathogens and toxins in food: challenges and interventions[M]. Washington D.C.: ASM Press, 2010: 71-94.
[2] ÖLMEZ H, Food hygiene and toxicology in ready-to-eat foods[M].London: Nikki Levy, 2016: 151-166.
[3] 山珊, 赖卫华, 陈明慧, 等. 农产品中大肠杆菌O157:H7的来源及分布研究进展[J]. 食品科学, 2014, 35(1): 289-293. DOI:10.7506/spkx1002-6630-201401057.
[4] 王燕, 谢贵林, 杜琳. 大肠杆菌O157:H7感染流行概况[J]. 微生物学免疫学进展, 2008, 36(1): 51-58.
[5] 宫春波, 王朝霞, 董峰光. 烟台海域海产品中食源性致病菌污染状况调查及膳食风险分析[J]. 中国食品卫生杂志, 2016, 28(1): 103-106.DOI:10.13590/j.cjfh.2016.01.023.
[6] BERGER C N, SODHA S V, SHAW R K, et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens[J].Environmental Microbiology, 2010, 12: 2385-2397.
[7] AHMED A M, SHIMAMOTO T. Isolation and molecular characterization of Salmonella enterica, Escherichia coli O157:H7 and Shigella spp. from meat and dairy products in Egypt[J]. International Journal of Food Microbiology, 2014, 168/169(3): 57-62.
[8] 周志江, 黄上媛, 朱平, 等. 肠道出血性大肠杆菌O157[M]. 北京: 军事医学出版社, 2002: 1-2.
[9] 王书奎, 周振英. 实用流式细胞术彩色图谱[M]. 上海: 第二军医大学出版社, 2004: 9-10.
[10] SUBIRES A, YUSTE J, CAPELLAS M. Flow cytometry immunodetection and membrane integrity assessment of Escherichia coli O157:H7 in ready-to-eat pasta salad during refrigerated storage[J].International Journal of Food Microbiology, 2014, 168/169: 47-56.
[11] 陈凤花, 李一荣, 王琳, 等. 敲减BMI-1表达诱导HeLa细胞G1期阻滞[J]. 中国生物化学与分子生物学报, 2010, 26(2): 134-139.DOI:10.13865/j.cnki.cjbmb.2010.02.004.
[12] 申鹏, 蒋廷旺, 陆慧琦, 等. 聚肌苷酸胞苷酸对人肝癌细胞的增殖抑制和凋亡诱导作用[J]. 南方医科大学学报, 2009, 29(3):525-527; 537.
[13] 陆海霞, 黄小鸣, 朱军莉. 超高压对单增李斯特菌细胞膜的损伤和致死机理[J]. 微生物学报, 2014, 54(7): 746-753. DOI:10.13343/j.cnki.wsxb.2014.07.004.
[14] CHUNG Y W, HSIAO W H, YUAN T S. Inactivation and morphological damage of Vibrio parahaemolyticus treated with high hydrostatic pressure[J]. Food Control, 2013, 32: 348-353. DOI:10.1016/j.foodcont.2012.12.023.
[15] BRUSCHIA C, KOMORA N, CASTROA S M, et al. High hydrostatic pressure effects on Listeria monocytogenes and L. innocua: evidence for variability in inactivation behaviour and in resistance to pediocin bacHA-6111-2[J]. Food Microbiology, 2017, 64(6): 226-231. DOI:10.1016/j.fm.2017.01.011.
[16] KIMURA K, MORIMATSU K, INAOKA T, et al. Injury and recovery of Escherichia coli ATCC 25922 cells treated by high hydrostatic pressure at 400-600 MPa[J]. Journal of Bioscience and Bioengineering,2017, 123(6): 698-706. DOI:10.1016/j.jbiosc.2017.01.007.
[17] 段学辉, 魏斌, 傅奇, 等. 食品微生物检验中损伤大肠杆菌的修复研究[J]. 食品工业, 2011, 32(6): 89-91.
[18] 付勇. 超高压致大肠杆菌O157:H7损伤机制的研究[D]. 南京: 南京师范大学, 2015: 26-31.
[19] 叶雷, 陈庆森, 阎亚丽, 等. 流式细胞术快速检测直投式发酵剂菌体活力[J]. 食品科学, 2014, 35(10): 139-144. DOI:10.7506/spkx1002-6630-201410025.
[20] 李萍, 温平威, 许恒毅, 等. 流式细胞术在食源致病菌检测中应用的研究进展[J]. 食品工业科技, 2013, 34(14): 375-379. DOI:10.13386/j.issn1002-0306.2013.14.084.
[21] LONGIN C, PETITGONNETL C, GUILLOUX-BENATIER M, et al.Application of flow cytometry to wine microorganisms[J]. Food Microbiology, 2017, 62(4): 221-231. DOI:10.1016/j.fm.2016.10.023.
[22] CORONEL-LEONA J, LOPEZA A, ESPUNYA M J, et al. Assessment of antimicrobial activity of Nα-lauroyl arginate ethylester (LAE®) against Yersinia enterocolitica and Lactobacillus plantarum by ぼow cytometry and transmission electron microscopy[J]. Food Control, 2016, 63(5): 1-10.DOI:10.1016/j.foodcont.2015.10.050.
[23] BUZATUA D A, COOPERA W M, SUMMAGE-WEST C, et al.Photobleaching with phloxine B sensitizer to reduce food matrix interference for detection of Escherichia coli serotype O157:H7 in fresh spinach by ぼow cytometry[J]. Food Microbiology, 2013, 36(2): 416-425.DOI:10.1016/j.fm.2013.07.007.
[24] 王虎虎, 董洋, 闫振国, 等. 冰鲜鸡肉中3 种主要致病菌的共修复-增菌条件研究[J]. 食品科学, 2012, 33(9): 182-187.
[25] GUNER A, ÇEVIK E, ŞENEL M, et al. An electrochemical immunosensor for sensitive detection of Escherichia coli O157:H7 by using chitosan, MWCNT, polypyrrole with gold nanoparticles hybrid sensing platform[J]. Food Chemistry, 2017, 229(8): 358-365.DOI:10.1016/j.foodchem.2017.02.083.
[26] 韩衍青. 应用超高压技术延长低温火腿的货架期[D]. 南京: 南京农业大学, 2011: 72-82.
[27] PATAKOVA P, LINHOVA M, VYKYDALOVA P, et al. Use of fluorescent staining and flow cytometry for monitoring physiological changes in solventogenic clostridia[J]. Anaerobe, 2014, 29(10): 113-117.DOI:10.1016/j.anaerobe.2013.10.006.
[28] LONGIN C, PETITGONNET C, BENATIER M G, et al. Application of ぼow cytometry to wine microorganisms[J]. Food Microbiology, 2017,62(4): 221-231. DOI:10.1016/j.fm.2016.10.023.
[29] ANANTA E, KNORR D. Comparison of inactivation pathways of thermal or high pressure inactivated Lactobacillus rhamnosus ATCC 53103 by flow cytometry analysis[J]. Food Microbiology, 2009, 26(5):542-546. DOI:10.1016/j.fm.2009.01.008.
[30] MARIANA F, SANDRA G. Impact of a combined processing technology involving ultrasound and pulsed light on structural and physiological changes of Saccharomyces cerevisiae KE 162 in apple juice[J]. Food Microbiology,2017, 65(2): 83-94. DOI:10.1016/j.fm.2017.01.012.
[31] MARESCA P, FERRARI G. Modeling of the microbial inactivation by high hydrostatic pressure freezing[J]. Food Control, 2017, 73(3): 8-17.DOI:10.1016/j.foodcont.2016.05.047.