随着生活水平不断提高,肉及肉制品的消费量在不断增加,肉类消费结构也发生了很大的变化。目前,猪肉在我国消费量居于首位,但近年来其比例呈下降趋势,而牛羊肉及禽肉的消费比例逐渐增加[1-3]。在肉类消费结构变化的同时,生肉市场的肉类形式也在不断变化,其中由于具有质地柔软、营养价值高等优点,越来越多的消费者开始选择冷鲜肉[4]。虽然冷鲜肉在整个生产流通环节始终处于低温环境,一定程度上控制了微生物的生长,但一些耐冷性微生物,如沙门氏菌和单核细胞性李斯特菌等,依然能够正常的生长繁殖,危害肉品品质和安全,使其货架期缩短,引发食物中毒等问题。货架期短成为了制约冷鲜肉发展的瓶颈,同时也是肉品企业和相关科研人员亟待解决的问题[5]。
本实验室利用物理保鲜手段——辐照保鲜技术,对冷鲜肉的货架期和微生物问题进行了长期的研究与探索[4-8]。前期研究发现电子束和γ射线均具有良好杀菌效果,而电子束由于具有一定的还原性,其引起的冷鲜肉氧化效应更小,此研究结果与众多学者一致[9-11]。而关于辐照剂量率对肉及肉制品的影响研究甚少, 因此,本实验室关于辐照剂量率对冷鲜肉品质及相关特性的影响进行了全面的研究探索[4,8]。
蛋白质作为肉品的主要成分之一,在加工过程中对肉品的营养和感官品质起关键作用,而其功能特性对食品在加工中的理化性质有着很大的影响,也常被用来评价食品的质量特性[12-13]。蛋白质的结构是蛋白质行使其功能的物质基础,蛋白质的各种功能又是其结构的表现[14]。电子束处理在延长冷鲜肉货架期、确保冷鲜肉安全性的同时,对其蛋白质相互作用力及结构的影响研究较少,基于以上认识,本研究探讨了不同电子束辐照剂量率对冷鲜牛肉蛋白结构和理化性质的影响,为电子束辐照在冷鲜牛肉保鲜贮藏过程的应用提供参考。
1 材料与方法
1.1 材料与试剂
采用4 ℃条件冷却、排酸3 d的肉,取黄牛背最长肌(外脊),由北京市卓宸畜牧有限公司商业化屠宰。
一次性气调包装盒(179 mm×117.5 mm×33 mm,厚度0.8 mm,透氧率≤0.01 cc/(p·kg·d);聚乙烯封孔膜(厚度0.15 mm,透氧率≤0.21 cc/(cm3·m2·24 h),透水率≤0.54 g/(m2·24 h)) 无锡中央化学有限公司。
标准蛋白Marker、Pierce®BCA Protein Assay Kit美国Thermo Fisher Scientific有限公司;乙二醇-双-(2-氨基乙醚)四乙酸(ethylene glycol bis (2-aminoethyl)tetraacetic acid,EGTA) 美国Sigma公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 上海Aladdin公司;丙烯酰胺、过硫酸铵(ammonium persulfate,APS) 美国Amersco公司;牛血清白蛋白(bovine serum albumin,BSA) 北京拜尔迪生物技术有限公司;溴化钾(光谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
BS224S-电子天平 德国Sartorius公司;ET-90-气调包装机 澳大利亚Super Sealer公司;FYL-YS-12低温保存箱 北京福意联电器有限公司;FZ-10/15型高能电子加速器 中国原子能科学研究院;QL901涡旋混匀器 江苏省金坛市荣华仪器制造有限公司;T25均质机 德国IKA公司;FE-20实验室pH计 梅特勒-托利多仪器(上海)有限公司;CR22GⅡ高速冷冻离心机日本Hitachi公司;T6-新世纪紫外-可见分光光度计北京普析通用仪器有限责任公司;TENSOR27傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy,FT-IR) 德国Bruker公司;DYY-6C型垂直电泳仪 北京六一生物科技有限公司;FluorChemFC2凝胶成像系统 美国Alpha公司;DSC-Q200差示扫描量热仪(differential scanning calorimeter,DSC) 美国TA仪器公司。
1.3 方法
1.3.1 样品处理
取6 条冷鲜牛背最长肌,剔除可视脂肪、筋膜和筋键,分割为5 cm×4 cm×1 cm的样品以确保电子束处理的均一性,100% N2包装,置于4 ℃低温冰箱,第2天进行辐照。样品于北京原子高科股份有限公司进行辐照处理,电子加速器能量为10 MeV,辐照剂量2.5 kGy,辐照组的剂量率分别为30、150、300 kGy/min,以0 kGy/min的剂量率作为对照组。样品置于铺有碎冰的托盘之上,每个处理跟踪3 支重铬酸银剂量计。辐照后样品置于4 ℃自制恒温梯度箱(温度波动范围小于0.5 ℃)中贮藏,辐照后的第2天定为贮藏第0天,贮藏期第0、5、10、15、20、25天取样测定相关指标。
1.3.2 肌原纤维蛋白的提取
参考Park等[14]的方法从牛背最长肌中分离提取肌原纤维蛋白,将5 g样品切碎后置于50 mL离心管(插入碎冰),加入20 mL(4 倍体积)预先4 ℃冷却的分离缓冲液(0.1 mol/L NaCl、10 mmol/L Na3PO4、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0)混合,在冰水中以13 000 r/min匀浆30 s,然后在4 ℃条件下2 000×g离心15 min,弃去上清液,所得沉淀再重复以上条件,洗涤离心2 次。随后沉淀用20 mL 0.1 mol/L NaCl溶液洗涤离心2 次,并在最后一次离心前用4 层纱布过滤,用0.1 mol/L HCl溶液将滤液pH值调节至6.0,离心得到蛋白膏即为肌原纤维蛋白。将肌原纤维蛋白保存于制冰机的碎冰中,48 h内用完。
1.3.3 肌原纤维蛋白质量浓度的测定
用Pierce®BCA Protein Assay Kit测定肌原纤维蛋白溶液的质量浓度。
1.3.4 表面巯基质量摩尔浓度的测定
参考Beveridge等[15]的Ellman试剂分析方法并稍加改动。Ellman试剂配制:将4 mg 5,5-二硫代双(2-硝基苯甲酸)(5,5-dithiobis-2-nitrobenzoic acid,DTNB)溶于1 mL的三羟甲基氨基甲烷(Tris)-甘氨酸缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、4 mmol/L EDTA,pH 8.0)。取1 mL 5 mg/mL肌原纤维蛋白溶液悬浮于4 mL Tris-甘氨酸缓冲液,漩涡振荡充分混合,加入50 μL Ellman试剂,剧烈振荡后置于25 ℃水浴中保温1 h,12 000×g离心10 min,以不加DTNB组为对照,取上清液在412 nm波长处测定吸光度,按照式(1)计算表面巯基质量摩尔浓度。
式中:A为样品在412 nm波长处吸光度;ρ为样品的蛋白质量浓度/(mg/mL);ε为巯基摩尔吸光系数(1.36×104L·mol-1·cm-1);b为吸光池光程(1 cm)。
1.3.5 蛋白表面疏水性的测定
参考Chelh等[16]的测定方法并略作改动。将肌原纤维蛋白悬浮于20 mmol/L pH 6.0的磷酸盐缓冲液中,将样品蛋白质量浓度调节为2 mg/mL。取1 mL样品蛋白溶液,加入40 μL 1 mg/mL的溴酚蓝(bromophenol blue,BPB)溶液,漩涡振荡混匀10 min,在4 ℃条件下4 000×g离心15 min,取上清液,在595 nm波长处测定稀释液吸光度,磷酸盐缓冲液为空白进行调零。用结合态的疏水性BPB结合量(总BPB与游离BPB的差值)作为样品蛋白的表面疏水性指数,按照公式(2)计算。
式中:Ac、As分别为空白、样品蛋白在595 nm波长处吸光度;40为系数/μg。
1.3.6 蛋白溶解度的测定
参考Xiong Youling L.等[17]的测定方法并略作改动。将肌原纤维蛋白悬浮于0.6 mol/L NaCl溶液中,调节质量浓度到5 mg/mL,将混合液振荡,使蛋白质颗粒均匀分散,然后将悬浮液在4 ℃的冰箱中静置2 h,在4 ℃条件下以1 500×g离心10 min,取上清液。分别测定离心前样品和离心后上清液中蛋白质量浓度ρ1、ρ2。根据公式(3)计算蛋白质溶解度。
1.3.7 肌原纤维蛋白二级结构的测定
参考Byler等[18]的测定方法并稍作改动。将提取的肌原纤维蛋白真空冷冻干燥成粉末状,采用FT-IR分析其二级结构的变化情况。将适量的蛋白质粉末和溴化钾置于干燥的玛瑙研钵中,充分研磨均匀,压制成透明薄片,采用FT-IR对薄片进行全波段(4 000~400 cm-1)扫描64 次。使用OMNIC 9.0软件对测得的图谱进行分析,利用PeakFit 4.12软件进行二阶导数拟合。根据各子峰的积分面积及其指认关系计算蛋白质二级结构的相对含量。
1.3.8 肌原纤维蛋白SDS-PAGE分析
参考Laemmli等[19]的方法进行十二烷基硫酸钠-聚丙烯凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。将肌原纤维蛋白悬浮于磷酸盐缓冲液(pH 6.0)中,调节质量浓度为2 mg/mL。将样品蛋白溶液与上样缓冲液(含质量分数4% SDS、100 mmol/L pH 6.8 Tris-HCl、0.2% BPB、20%甘油、200 mmol/L β-巯基乙醇)按体积比1∶1充分混合,将混合液置于沸水浴中3 min,冷却后在4 ℃条件下以8 000×g离心2 min,取上清液上样,上样量为30 μL。电泳条件:分离胶质量分数12%、浓缩胶质量分数4%、初始电压70 V,当样品进入分离胶后将电压调至120 V,至电泳结束。电泳结束后从电泳槽中取下凝胶,除去浓缩胶,将分离胶用考马斯亮蓝R-250染色液过夜染色,最后脱色至背景清晰。使用FluorChemFC2凝胶成像系统拍照,分析肌原纤维蛋白聚集与降解变化。
1.3.9 全肌肉热稳定性分析测定
参考Deng等[20]的测定方法,通过DSC测定肉样的蛋白质结构稳定性。准确称取10~16 mg肉样,立即封装于DSC专用铝盒中,放入DSC仪器中进行测定,空白铝盒为对照。测定条件为:样品于20 ℃平衡2 min,再以3 ℃ /min升温至100 ℃。采用Universal Analysis 2000软件进行数据记录和处理得到的DSC曲线,峰值点为变性温度,曲线与基线间的面积为总焓值。
1.4 数据统计分析
实验数据采用SPSS 19.0软件,邓肯检验进行差异性分析,采用Origin 7.5软件进行作图,实验结果表示为 。各项指标重复3 次,取其平均值。
。各项指标重复3 次,取其平均值。
2 结果与分析
2.1 电子束剂量率对肌原纤维蛋白表面巯基质量摩尔浓度的影响
肌原纤维蛋白主要由肌球蛋白(50%~55%)和肌动蛋白(20%)组成[22],SH1和SH2类活性巯基(40 个)主要分布在肌球蛋白头部,SHa类活性巯基(12 个)主要分布于肌动蛋白[23]。作为肌原纤维蛋白中最具反应活性的功能性基团,活性巯基(—SH)极易被氧化形成二硫键(—S—S—),因此活性巯基作为蛋白质氧化的一个重要指标,在稳定肌原纤维蛋白空间结构方面起着重要意义。活性巯基含量的变化在一定程度上反映了蛋白质结构的变化[24]。
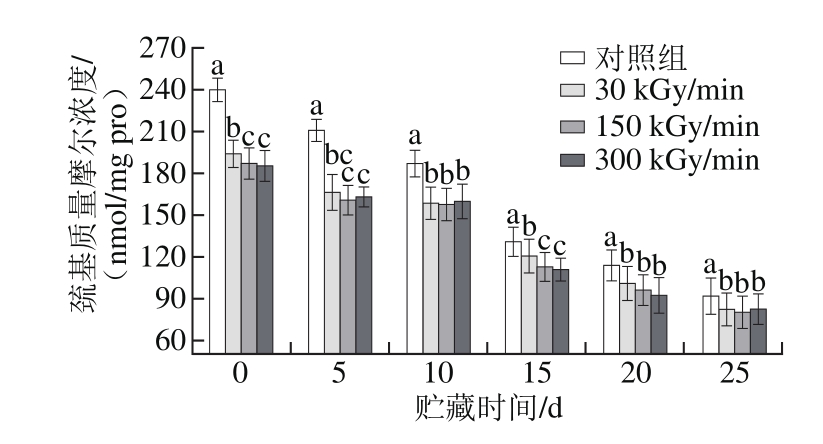
图1 剂量率和贮藏时间对巯基质量摩尔浓度的影响
Fig. 1 Effect of electron beam dose rate and storage time on sulfhydryl content
同一贮藏期小写字母不同表示不同处理方式之间存在显著性差异(P<0.05)。
由图1可以看出,电子束处理显著降低了肌原纤维蛋白表面的活性巯基质量摩尔浓度(P<0.05)。在贮藏第0天,未经电子束处理的对照组活性巯基质量摩尔浓度为(239.22±8.32)nmoL/mg pro,而3 组处理组的活性巯基质量摩尔浓度分别下降了19.05%、22.00%和22.60%,电子束处理过程中产生的自由基(1O2、HOO·、·OH、ROO、ROOH、e-aq等)攻击蛋白质分子[25-26],激发蛋白质的氧化链式反应,从而使肌原纤维蛋白表面的活性巯基质量摩尔浓度下降。不同电子束剂量率对活性巯基的质量摩尔浓度影响总体上并不显著(P>0.05),低剂量率处理组的蛋白氧化程度相对较低。随着贮藏时间的延长,活性巯基的质量摩尔浓度呈显著下降趋势(P<0.05),主要是由于肌原纤维蛋白的分子构象发生了变化,使活性巯基暴露而被氧化成二硫键、磺酸类或其他氧化产物。Lund等[26]研究指出气调包装的冷鲜猪背最长肌随着贮藏时间的延长,其活性巯基的含量同样呈下降的趋势,其认为巯基含量的降低在一定程度上代表了蛋白质氧化的程度。
2.2 电子束剂量率对肌原纤维蛋白表面疏水性的影响
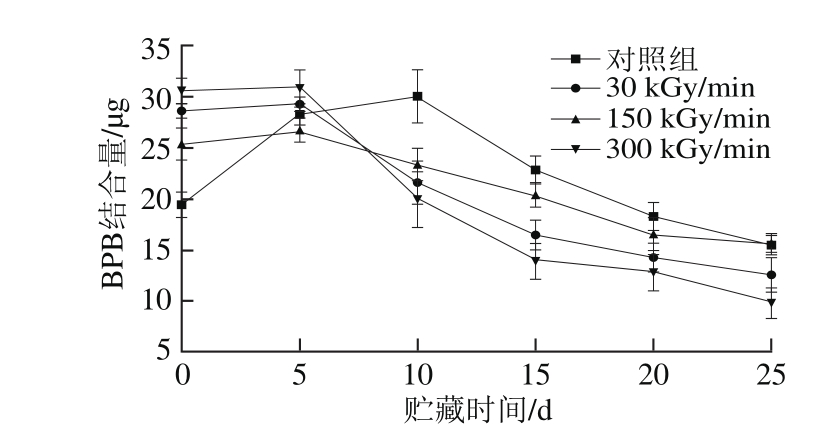
图2 剂量率和贮藏时间对肌原纤维蛋白表面疏水性的影响
Fig. 2 Effect of electron beam dose rate and storage time on surface hydrophobicity
肌原纤维蛋白表面疏水性的变化在一定程度上反映了其氧化变性程度与空间结构(三、四级结构)的改变,因此蛋白质表面的疏水作用力在维持蛋白质构象和功能特性方面起着重要作用。BPB与疏水性基团具有良好的结合作用,蛋白质表面疏水性通常以BPB结合的蛋白表面疏水性氨基酸残基的量来表示。肌原纤维蛋白结合的BPB质量越大,其表面疏水性越强,表明其空间构象的改变越大,变性程度越大[17]。
由图2可以看出,在贮藏的第0天,电子束处理组的肌原纤维蛋白表面疏水性显著高于对照组(P<0.05),电子束处理使肌原纤维蛋白多肽链的空间构象发生了改变,使原先分子内部的一些疏水性氨基酸残基(苯丙氨酸、色氨酸残基等)暴露于分子表面,从而导致处理组肌原纤维蛋白的疏水性增加。常海霞等[27]研究指出超声处理同样会使草鱼肌原纤维蛋白疏水性增加,这与胡爱军等[13]的研究一致,超声辐射使蛋白质折叠的链展开,分子内部的疏水性基团暴露,表面疏水性增加。随着贮藏时间的延长,肌原纤维蛋白的表面疏水性均呈现先上升后下降的趋势,处理组样品的表面疏水性在贮藏第5天时达到最大,而对照组在贮藏第10天达到最大值,而后下降。贮藏后期,对照组肌原纤维蛋白的BPB结合量高于电子束处理组。对此进行分析认为,在贮藏前期,蛋白质的表面疏水性增加主要是由于蛋白质多肽链的展开,疏水性基团的暴露,而在贮藏后期蛋白质发生氧化降解,表面巯基形成二硫键使小分子蛋白质发生了重新折叠或聚合。
不同剂量率处理的肌原纤维蛋白,其表面疏水性也具有显著差异(P<0.05),在贮藏前期,300 kGy/min处理组的表面疏水性最大,而贮藏后期其表面疏水性最小,分析原因认为300 kGy/min处理组贮藏前期蛋白质空间结构破坏较为严重,疏水性基团暴露较多,而贮藏后期蛋白质氧化降解,聚集交联现象较为严重。肌原纤维蛋白表面疏水性的高低主要取决于空间结构的伸展程度和蛋白质氧化降解聚集交联程度。实验研究结果与部分学者一致[22,29],在冷藏过程中,肌原纤维蛋白的表面疏水性先增加后减少,而王瑛等[29]研究碎冰冷藏罗非鱼肉时发现,其肌原纤维蛋白的表面疏水性随冷藏时间的延长一直上升,可能与实验样品和表面疏水性的检测方法有关。
2.3 电子束剂量率对肌原纤维蛋白溶解度的影响

图3 剂量率和贮藏时间对肌原纤维蛋白溶解度的影响
Fig. 3 Effect of electron beam dose rate and storage time on protein solubility
溶解性是蛋白质变性程度的一个重要参数,优质肌肉蛋白具有良好的溶解性。电子束处理使肌原纤维蛋白发生氧化,进而导致蛋白质非分子空间构象改变,蛋白质聚集使其溶解度降低。氧化程度不同,蛋白质表现的溶解度不同[31]。由图3可以看出,对照组肌原纤维蛋白的溶解度为80.6%,3 组不同电子束剂量率处理组的蛋白质溶解度分别下降了5.8%、2.9%和9.6%,由此推测150 kGy/min处理组肌原纤维蛋白的氧化程度相对较小。随着贮藏时间的延长,冷鲜牛肉肌原纤维蛋白的溶解度呈显著下降的趋势,对照组的溶解度降低到48.5%,下降程度达39.8%,肌肉蛋白的品质受到很大影响,因此长时间的贮藏在一定程度上会使肉的品质下降,此研究结果与Gomez-Guillen[31]、Hultmann[32]等研究结论一致。影响蛋白质溶解度的因素很多,既有内部因素也有外部因素。内部因素有蛋白质的氨基酸组成、分子结构、亲/疏水性和带电性等;外部因素有温度、离子强度和离子对种类等[31]。多肽链内侧的一些疏水性基团暴露使蛋白质表面的有效电荷降低,影响了蛋白质的亲水性,进而在很大程度上降低了其溶解性;肌原纤维蛋白氧化交联聚合也会降低蛋白质溶解性。
2.4 电子束剂量率对肌原纤维蛋白二级结构的影响
表1 剂量率对肌原纤维蛋白二级结构的影响
Table 1 Effect of electron beam dose rate on the secondary structure of myoベbrillar proteins
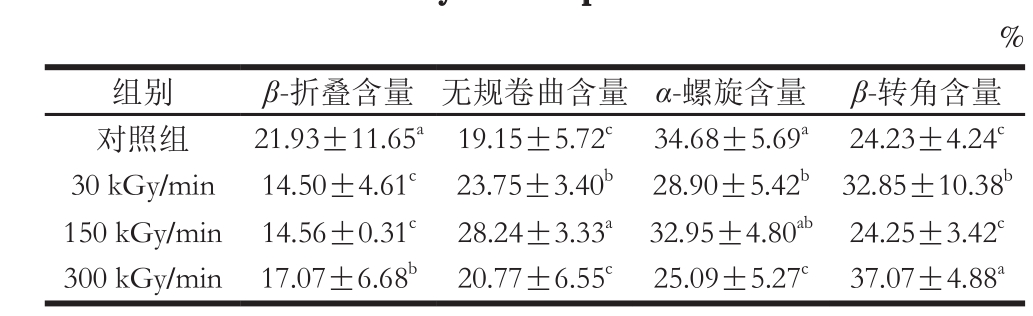
注:同列肩标小写字母不同表示差异显著(P<0.05)。
FT-IR是研究蛋白质二级结构的有效手段。一般蛋白质和多肽的肽键有几个振动模式,其中由蛋白质多肽骨架C=O伸缩振动引起的特征吸收峰位于酰胺Ⅰ区(1 700~1 600 cm-1),此区为蛋白质二级结构变化的敏感区域,常被用来定量分析获得各种二级结构的相对含量[33-35]。
α-螺旋结构是蛋白质分子内的有序排列,主要由多肽链上的羰基(—CO)和氨基(—NH)之间的分子内氢键稳定[36],β-折叠是蛋白质分子间的有序排列,通过分子间的氢键维持。由表1中的数据可以看出,电子束处理使维持α-螺旋和β-折叠结构的氢键作用减弱,蛋白质分子展开程度增加,肌原纤维蛋白中的α-螺旋和β-折叠含量下降,其中30 kGy/min和300 kGy/min处理组的α-螺旋含量相对于对照组显著下降,说明这两个剂量率的电子束处理对分子内的氢键破坏作用更强,分子内氢键的稳定性变化将导致α-螺旋的丢失[36]。伴随着α-螺旋和β-折叠结构含量的减少,无规卷曲和β-转角结构含量增加,即蛋白质的无序程度增加。
2.5 电子束剂量率对肌原纤维蛋白SDS-PAGE的影响

图4 牛肉肌原纤维蛋白的SDS-PAGE图谱
Fig. 4 SDS-PAGE pattern of beef myoベbrillar proteins
MHC.肌球蛋白重链;actin.肌动蛋白;M. Marker;1~2.对照组;3~4.30 kGy/min处理组;5~6. 150 kGy/min处理组;7~8. 300 kGy/min处理组。
肌原纤维蛋白主要包括肌球蛋白、肌动蛋白和原肌球蛋白,分子质量分别约为480、43、33~36 kDa,肌球蛋白由2 条分子质量为220 kDa重链和4 条分子质量为10.0~27.5 kDa轻链组成[28]。不同剂量率电子束处理后的肌原纤维蛋白经SDS-PAGE分析,结果如图4所示。肌球蛋白重链和肌动蛋白的谱带宽且明显,佐证了肌原纤维蛋白主要由肌球蛋白和肌动蛋白组成的观点。通常情况下,蛋白质氧化的主要形式就是蛋白质聚集或降解成片段,由图4可以看出,电子束处理组的肌球蛋白重链出现降解,条带变窄,15~25 kDa之间出现一些新的谱带,可能为肌球蛋白的降解产物,肌动蛋白相对稳定,不同剂量率处理组之间的差异不是很明显。
2.6 电子束剂量率对肌肉稳定性的影响

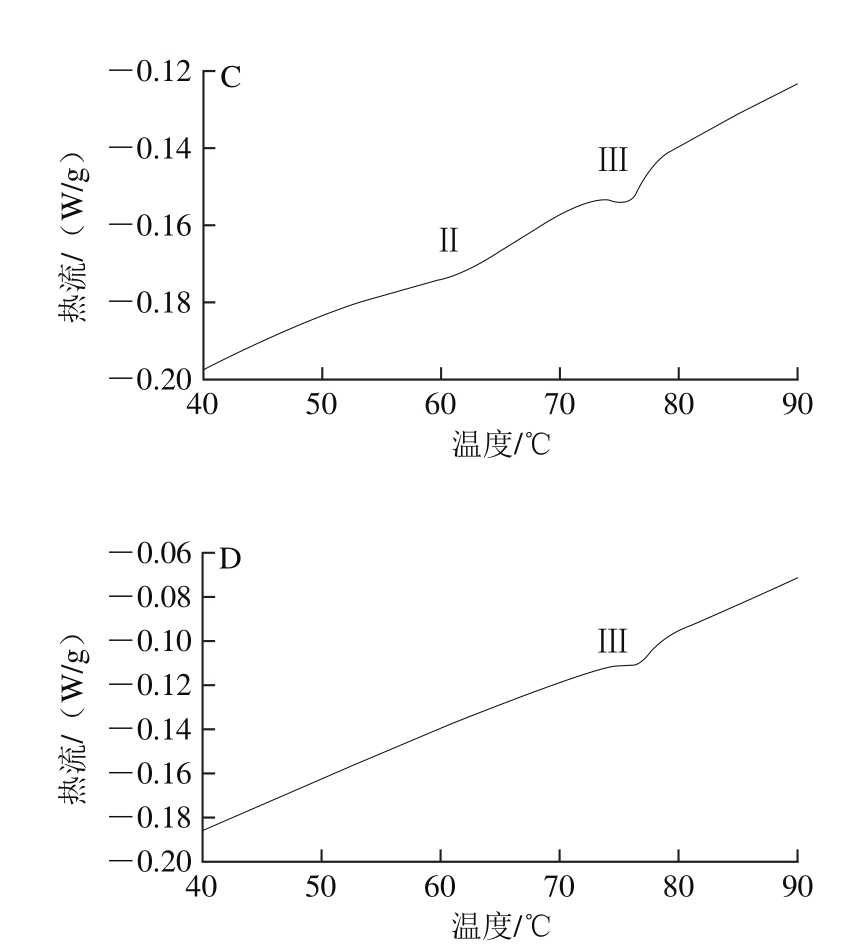
图5 牛肉肌肉蛋白热流分析
Fig. 5 Thermal analysis of beef myoベbrillar proteins
A~D.分别为空白对照组、30 kGy/min组、150 kGy/min组、300 kGy/min组。
电子束处理对冷鲜牛肉热稳定性的影响如图5所示。新鲜未经处理的冷鲜牛肉肌肉蛋白DSC图谱有3 个峰,即3 个主要的热转变温度(图5A)。峰Ⅰ代表肌球蛋白头部变性引起的热流变化;峰Ⅱ代表肌球蛋白尾部和肌浆蛋白变性引起的热流变化;峰Ⅲ代表肌动蛋白变性引起的热流变化[21]。利用Universal Analysis 2000软件分析电子束处理组和空白对照组冷鲜牛肉肌肉蛋白DSC图谱各峰变性温度Tmax,结果如表2所示。
表2 牛肉肌原纤维蛋白热转变温度的变化
Table 2 Change in thermal transition temperatures (Tmax) of beef myoベbrillar proteins with electron beam dose rate
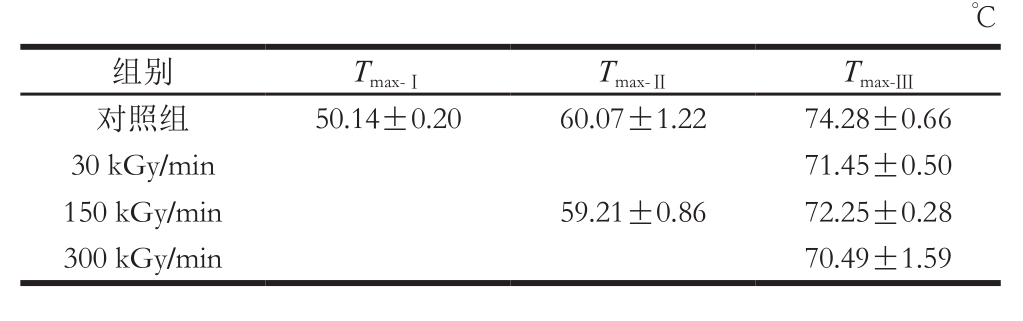
由DSC图(图5)和肌原纤维蛋白热转变温度变化表(表2)分析可以看出,电子束处理使肌球蛋白头部对应的峰Ⅰ氧化变性消失,同时30 kGy/min和300 kGy/min处理组的肌球蛋白尾部和肌浆蛋白对应的峰Ⅱ都已消失,由此说明电子束处理会导致牛肉蛋白质的变性,而30 kGy/min和300 kGy/min处理组的牛肉肌原纤维蛋白变性程度较大,尤其是肌球蛋白和肌浆蛋白几乎全部变性。肌动蛋白的结构较为稳定,电子束处理未使其变性,但其热转变温度降低,原因在于其结构发生轻微变化。由此可见,150 kGy/min处理的冷鲜牛肉蛋白质结构相对更加稳定,对热也更加稳定。
3 结 论
电子束处理会引起牛肉肌原纤维蛋白氧化,使表面活性巯基质量摩尔浓度降低,肌球蛋白结构降解发生改变,进而影响其表面疏水性、溶解度和热稳定性,同时对肌原纤维蛋白二级结构相对含量产生影响,α-螺旋和β-折叠含量降低,无规卷曲和β-转角含量增加。剂量率的高低对牛肉肌原纤维蛋白的二级结构及其热稳定性有一定的影响,150 kGy/min处理的冷鲜牛肉肌原纤维蛋白α-螺旋含量与对照组相接近,结构相对更加稳定,对热也更加稳定。冷鲜肉贮藏时间的延长会使肌原纤维蛋白表面活性巯基质量摩尔浓度、蛋白质疏水性和溶解度显著性下降(P<0.05),牛肉品质下降。
参考文献:
[1] 国家统计局. 中华人民共和国2013年国民经济和社会发展统计公报[EB]. (2014-02-24) [2016-11-20]. http://www.stats.gov.cn/tjsj/zxfb/201402/t20140224_514970.html.
[2] 国家统计局. 中华人民共和国2014年国民经济和社会发展统计公报[EB]. (2015-02-26) [2016-11-20]. http://www.stats.gov.cn/tjsj/zxfb/201502/t20150226_685799.html.
[3] 国家统计局. 中华人民共和国2015年国民经济和社会发展统计公报[EB]. (2016-02-29) [2016-11-20]. www.stats.gov.cn/tjsj/zxfb/201602/t20160229_1323991.html.
[4] 王宁, 王晓拓, 王志东, 等. 电子束辐照剂量率对真空包装冷鲜牛肉品质的影响[J]. 现代食品科技, 2015, 31(7): 241-248. DOI:10.13982/j.mfst.1673-9078.2015.7.038.
[5] 程述震, 张春晖, 张洁, 等. 电子束辐照对充氮包装冷鲜牛肉品质的影响[J].食品科学, 2016, 37(18): 230-235. DOI:10.7506/spkx1002-6630-201618037.
[6] 冯晓琳, 王晓拓, 王丽芳, 等. 电子束辐照对真空包装冷鲜猪肉品质的影响[J]. 中国食品学报, 2015, 15(2): 126-131. DOI:10.16429/j.1009-7848.2015.02.019.
[7] 尚颐斌, 高美须, 李淑荣, 等. 电子束辐照对冷鲜猪肉品质的影响[J].核农学报, 2013, 27(4): 437-442.
[8] 王宁, 王晓拓, 丁武, 等. 辐照剂量率对牛肉脂肪和蛋白氧化及蛋白特性的影响[J]. 现代食品科技, 2015, 31(8): 122-128; 191.DOI:10.13982/j.mfst.1673-9078.2015.8.021.
[9] PARK J G, YOON Y, PARK J N, et al. Effects of gamma irradiation and electron beam irradiation on quality, sensory, and bacterial populations in beef sausage patties[J]. Meat Science, 2010, 85(2): 368-372. DOI:10.1016/j.meatsci.2010.01.014.
[10] KWON J H, KWON Y J, NAM K C, et al. Effect of electron-beam irradiation before and after cooking on the chemical properties of beef,pork, and chicken[J]. Meat Science, 2008, 80(3): 903-909. DOI:10.1016/j.meatsci.2008.04.009.
[11] LACROIX M, SMORAGIEWICZ W, JOBIN M, et al. Protein quality and microbiological changes in aerobically- or vacuum-packaged,irradiated fresh pork loins[J]. Meat Science, 2000, 56(1): 31-39.DOI:10.1016/S0309-1740(00)00016-4.
[12] XIONG Youling L.. Myofibrillar protein from different muscle fiber types: implications of biochemical and functionalproperties in meat processing[J]. Critical Reviews in Food Science and Nutrition, 1994,34(3): 293-320. DOI:10.1080/10408399409527665.
[13] 胡爱军, 卢秀丽, 郑捷, 等. 不同频率超声对鲢鱼肌原纤维蛋白结构的影响[J]. 现代食品科技, 2014, 30(3): 23-27. DOI:10.13982/j.mfst.1673-9078.2014.03.016.
[14] PARK D, XIONG Youling L.. Oxidative modiベcation of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2007, 103(2): 607-616. DOI:10.1016/j.foodchem.2006.09.004.
[15] BEVERIDGE T, TOMA S J, NAKAI S. Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J]. Journal of Food Science, 1974, 39: 49-51. DOI:10.1111/j.1365-2621.1974.tb00984.x.
[16] CHELH I, GATELLIER P, SANTTÉ-LHOUTELLER V.Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[17] XIONG Youling L., BLANCHARD S P. Myoベbrillar protein gelation:viscoelastic changes related to heating procedures[J]. Journal of Food Science, 1994, 59(4): 734-738. DOI:10.1111/j.1365-2621.1994.tb08115.x.[18] BYLER D M, SUSI H. Examination of the secondary structure of proteins by deconvolved FTIR spectra[J]. Biopolymers, 1986, 25(3): 469-487. DOI:10.1002/bip.360250307.
[19] LAEMMLI U K. Cleavage of structural proteins during the assembly ofthe head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.DOI:10.1038/227680a0.
[20] DENG Y, ROSENVOLD K, KARLSSON A H, et al. Relationship between thermal denaturation of porcine muscle proteins and waterholding capacity[J]. Journal of Food Science, 2002, 67(5): 1642-1647.DOI:10.1111/j.1365-2621.2002.tb08698.x.
[21] 闫利国, 唐善虎, 王柳, 等. 冷冻贮藏过程中氧化诱导牦牛肉肌原纤维蛋白结构的变化[J]. 食品科学, 2015, 36(24): 337-342. DOI:10.7506/spkx 1002-6630-201524062.
[22] 丁一, 黄莉, 夏秀芳, 等. 冻藏对肌原纤维蛋白结构特性与功能特性的影响[J]. 包装与食品机械, 2013, 31(4): 55-59.
[23] 李向红, 王发祥, 张付兰, 等. 冷藏过程中草鱼肌原纤维蛋白结构的变化[J]. 食品与发酵工业, 2015, 41(10): 177-181. DOI:10.13995/j.cnki.11-1802/ts.201510033.
[24] BREWER S. Irradiation effects on meat color: a review[J]. Meat Science,2004, 68(1): 1-17. DOI:10.1016/j.meatsci.2004.02.007.
[25] BREWER M S. Irradiation effects on meat flavor: a review[J]. Meat Science, 2009, 81(1): 1-14. DOI:10.1016/j.meatsci.2008.07.011.
[26] LUND M N, LAMETSCH R, HVIID M S, et al. High-oxygen packaging atmosphere influences protein oxidation and tenderness of porcine longinessimus dorsi during chill storage[J]. Meat Science, 2007, 77(3):295-303.
[27] 常海霞, 石燕, 王辉, 等. 超声波对草鱼肌肉肌原纤维蛋白溶液理化特性的影响[J]. 食品科学, 2015, 36(5): 56-60. DOI:10.7506/spkx1002-6630-201505011.
[28] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al.Comparative study on physicochemical changes of muscle proteins from some tropical ベsh during frozen storage[J]. Food Research International,2003, 36(8): 787-795. DOI:10.1016/S0963-9969(03)00073-5.
[29] 王瑛, 周春霞, 洪鹏志, 等. 碎冰冷藏对罗非鱼肌原纤维蛋白理化特性的影响[J]. 食品工业科技, 2013, 34(10): 120-123. DOI:10.13386/j.issn1002-0306.2013.10.038.
[30] 李艳青, 孔保华, 杨赫鸿, 等. 自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J]. 食品科学, 2012, 33(13): 70-74.
[31] GOMEZ-GUILLEN M C, MONTERO P, HURTADO O, et al.Biological characteristics affect the quality of farmed Atlantic salmon and smoked muscle[J]. Journal of Food Science, 2000, 65(1): 53-60.
[32] HULTMANN L, RØRÅ A M B, STEINSLAND I, et al. Proteolytic activity and properties of proteins in smoked salmon (Salmo salar):effects of smoking temperature[J]. Food Chemistry, 2004, 85(3):377-387. DOI:10.1016/j.foodchem.2003.07.014.
[33] 郭丽萍, 熊双丽, 黄业传. 超高压结合热处理对猪肉蛋白质相互作用力及结构的影响[J]. 现代食品科技, 2016, 32(2): 196-204.DOI:10.13982/j.mfst.1673-9078.2016.2.030.
[34] 汪兰, 吴文锦, 乔宇, 等. 冻藏条件下魔芋葡甘聚糖降解产物对肌原纤维蛋白结构的影响[J]. 食品科学, 2015, 36(22): 244-249.DOI:10.7506/spkx1002-6630-201522046.
[35] SANO T, OHNO T, OTSUKA-FUCHINO H, et al. Carp natural actomyosin: themal denaturation mechanism[J]. Journal of Food Science,2010, 59(5): 1002-1008. DOI:10.1111/j.1365-2621.1994.tb08177.x.
[36] LIU R, ZHAO S M, XIONG S B, et al. Role of secondary structures in the gelation of porcine myosin at different pH value[J]. Meat Science,2008, 80(3): 632-639. DOI:10.1016/j.meatsci.2008.02.014.