我国是世界淡水渔业第一大国,2014年我国淡水鱼类产量2 770.32万 t,占我国鱼类总产量的68.4%、占淡水水产品总产量的87.5%。白鲢因其肉质鲜嫩,含有丰富的蛋白质、氨基酸以及多不饱和脂肪酸等人体必需营养成分,并且具有生长周期短、抗病能力强、产量高等特点,是著名的四大家鱼之一[1-3]。
土腥味是制约鲢鱼工业化发展的重要因素,土腥味增强原因主要有两个方面,一是由于白鲢鱼体内丰富的多不饱和脂肪酸严重氧化生成的小分子醛、酮、醇挥发性成分;二是来源于白鲢鱼养殖环境中物质在体内的堆积,导致白鲢鱼腥味加重主要源于白鲢鱼体内的脂肪氧合酶(lipoxygenase,LOX)催化降解不饱和脂肪酸产生的各种挥发性物质引起的[4-6]。LOX是种氧化还原酶,能专一催化含顺,顺-1,4-戊二烯结构的多不饱和脂肪酸,生成具有共轭双键的不饱和脂酸的氢过氧化物,再经过催化氧化,裂解成挥发性醛、酮、醇类小分子化合物,对食品风味形成起到关键作用[7-9]。
白鲢鱼肌肉LOX氧化会造成不饱和脂肪酸含量下降,鱼腥味加重,同时传统的化学和热处理脱腥方法也会严重破坏鱼肉品质和营养价值[10-11]。而非热物理加工方法近年来在食品加工过程中逐渐占居主导地位,其中超声波(ultrasonic wave,UW)和超高压(ultra high pressure,UHP)逐渐受到广大研究者的关注[12]。超声波具有独特的声化学效应,作用于液体时,强大的拉应力把液体“撕开”成空洞,随周围介质的振动而破灭,破灭时周围液体突然冲入气泡而产生高温、高压,同时产生激波,使分子结构发生了改变,可广泛应用于食品加工业[13-15]。超高压能够钝化食品内源酶是因为高压状态下,生物体高分子立体结构中的氢键结合、疏水结合、离子结合等非共有结合发生变化,内源酶的生物大分子构象会改变,导致蛋白质结构改变与变形,使酶失活[16-19]。为研发新型脱腥工艺,保持白鲢鱼贮藏、加工过程中的品质和营养价值,本研究以白鲢鱼肉为原料,从中提取LOX,初步探究超声波、超高压新型非热物理加工方法对白鲢鱼肌肉LOX构象、活力的影响,为白鲢的土腥味控制和精深加工提供新型技术和实验数据支持。
1 材料与方法
1.1 材料与试剂
鲜活白鲢鱼购于合肥市马鞍山路家乐福超市,每条质量(1 100±200)g。
磷酸二氢钾、磷酸氢二钾、氢氧化钠、二硫苏糖醇(dithiothreitol,DTT)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、硫酸铵、亚油酸、硼酸、硼砂、吐温20等均为分析纯试剂。
1.2 仪器与设备
JJ-2型组织捣碎机 江苏省金坛市城西峥嵘实验仪器厂;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;T6新世纪紫外-可见光分光光度计北京普析通用仪器有限责任公司;超声波清洗器上海杰理科技有限公司;YCB630/2.5 1L超高压设备兵器工业第五二研究所;810 CD圆二色谱(circular dichroism,CD)仪 日本JASCO公司;RF-5301PC荧光分光光度计 日本岛津公司。
1.3 方法
1.3.1 白鲢鱼肌肉LOX提取
参照Gata等[20]方法稍加修改,将鲜活白鲢鱼宰杀,置于冰袋中带回实验室,然后置于装满冰的冰盒中去头、尾和内脏,用冷水洗净,去脊骨和鱼皮,手工采集背部白色肌肉;将新鲜肌肉置于组织捣碎机中,添加4 倍体积的50 mmol/L、pH 7.8磷酸盐缓冲液(含2 mmol/L DTT、2 mmol/L EDTA,4 ℃),12 000 r/min匀浆1.5 min;匀浆后缓冲液进行冷冻离心(10 000×g,60 min),上清液按质量体积比13.4∶100加入研碎无水硫酸铵,溶解后离心(10 000×g,30 min),收集上清液并按质量体积比13.4∶100加入研碎无水硫酸铵,充分溶解后离心(10 000×g,30 min),收集20%~40%饱和组分,沉淀等量溶于磷酸盐缓冲液(50 mmol/L,pH 7.4)中,即粗酶液。
1.3.2 白鲢鱼肌肉LOX活力、质量浓度测定
参照付湘晋[21]的方法采用紫外分光光度法测定酶活力:用吐温20(最终添加量0.1 mL/100 mL)作为乳化剂,将亚油酸(终浓度10 mmol/L)分散在10 mmol/L硼酸缓冲液(pH 9.0)中,置于4 ℃冰箱中备用。250 μL上述底物和50 μL LOX粗酶液添加到1.7 mL磷酸盐缓冲液(50 mmol/L,pH 7.8)中,立刻计时,测定其在234 nm波长处吸光度的增加量。吸光度每分钟增加0.001定义为一个酶活力单位。
酶液质量浓度采用考马斯亮蓝法测定,标准品选用牛血清白蛋白。
1.3.3 白鲢鱼肌肉LOX的CD检测
CD光谱法可以有效分析蛋白质肽键中α-螺旋和β-折叠等二级结构含量,显示蛋白质在不同条件下二级结构的整体变化,是分析蛋白质二级结构最常用的方法[22]。本研究采用Feng Liping等[15]方法稍加修改:以磷酸盐缓冲液(50 mmol/L,pH 7.8)作为空白对照,先将LOX粗酶液稀释至0.1~0.2 mg/mL,CD光谱扫描范围190~250 nm,样品池光程1 mm,扫描速率100 nm/min,常温(25 ℃)下重复扫描4 次,得到LOX粗酶液CD光谱,用平均摩尔椭圆率[θ]表示圆二色性,单位deg·cm2/mol。
1.3.4 白鲢鱼肌肉LOX荧光光谱检测
蛋白质中的芳香族氨基酸基团具有内源荧光性,在外加光源激发情况下会发射内源荧光,并且荧光光谱会随着芳香族氨基酸基团位置和微环境的变化而发生改变,通过荧光光谱的变化可以用来分析蛋白三级结构的变化趋势[23]。
以磷酸盐缓冲液(50 mmol/L,pH 7.8)作为空白对照,先将LOX粗酶液稀释至0.01~0.05 mg/mL,用荧光光谱仪进行扫描,激发波长为295 nm,扫描波长为220~700 nm,速率240 nm/min,常温(25 ℃)条件下重复扫描3 次。
1.3.5 白鲢鱼肌肉LOX超声波处理
量取1.5 mL白鲢鱼肌肉LOX粗酶液在2 mL离心管中,分别在180、210、240、270、300 W超声波条件下处理3 h;在300 W超声波下分别处理1、2、3、4、5 h,温度(20±5)℃,测定其酶活力、CD光谱、荧光光谱,研究白鲢鱼肌肉LOX在不同超声波条件下酶活力、二级结构、三级结构变化。
1.3.6 白鲢鱼肌肉LOX超高压处理
量取10 mL白鲢鱼肌肉LOX粗酶液在聚乙烯袋中密封,分别在150、200、250、300、350、400 MPa超高压条件下处理15 min;在300 MPa超高压条件下分别处理5、10、15、20、25、30 min,温度4 ℃,测定其酶活力、CD光谱、荧光光谱,研究白鲢鱼肌肉LOX在不同超高压条件下酶活力、二级结构、三级结构变化。
1.4 数据统计与分析
每组实验进行3 组平行实验,所有数据采用Excel软件进行整理分析,测定结果以 表示,采用SPSS软件的单因素方差分析法进行显著性分析,CD图和荧光光谱图采用Origin 9.0作图软件绘制。
表示,采用SPSS软件的单因素方差分析法进行显著性分析,CD图和荧光光谱图采用Origin 9.0作图软件绘制。
2 结果与分析
2.1 超声波处理对白鲢鱼肌肉LOX的影响
2.1.1 超声波功率对白鲢鱼肌肉LOX的影响
分别用180、210、240、270、300 W超声波处理白鲢鱼肌肉LOX 3 h后,LOX活力、CD光谱图、荧光光谱图分别如图1~3所示。

图1 超声功率对白鲢鱼肌肉LOX活力的影响
Fig. 1 Effect of ultrasonic power on LOX activity in silver carp muscle
小写字母不同表示差异显著(P<0.05)。下同。
由图1可知,随着超声波功率增加,LOX活力逐渐下降,功率大于210 W时,酶活力下降较为显著;当LOX经180、210、240、270、300 W超声波处理3 h后,酶活力分别下降5.36%、16.07%、26.79%、50.00%、62.50%。
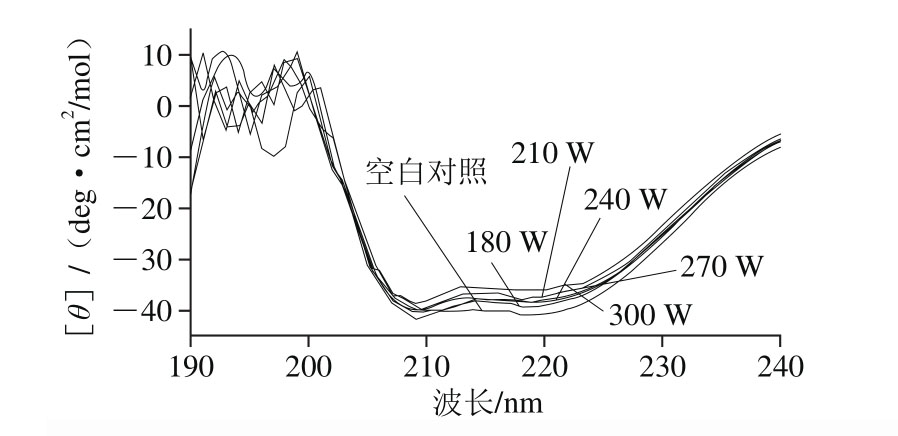
图2 超声功率对白鲢鱼肌肉LOX二级结构构象的影响
Fig. 2 Effect of ultrasonic power on the secondary conformation of LOX in silver carp muscle
光学活性物质如蛋白质对组成平面偏振光的左旋和右旋圆偏振光的吸收系数(ε)是不相等的,吸收率不同,圆偏振光变成椭圆偏振光,其光吸收的差值ΔA称为该物质的圆二色性[24]。蛋白质二级结构中主要的光活性基团是肽链骨架中的肽键,其吸收峰分布在蛋白质CD色谱的远紫外区段(190~240 nm),一般认为α-螺旋特征吸收峰在208 nm和222 nm左右,有两处负峰,在208 nm波长处椭圆率能够反映蛋白质α-螺旋结构变化,估计蛋白质α-螺旋含量;典型β-折叠在214 nm左右有一特征吸收负峰;无规卷曲在220 nm左右有一小而宽的正峰[25-26]。图2为白鲢鱼肌肉LOX经不同功率超声波处理后CD光谱图。随着超声波功率增加,LOX在208、214 nm和222 nm波长处特征吸收峰强度逐渐下降,说明超声波对LOX内α-螺旋、β-折叠等二级结构产生了一定影响,使LOX二级结构发生改变,功率越大,二级结构改变越明显。
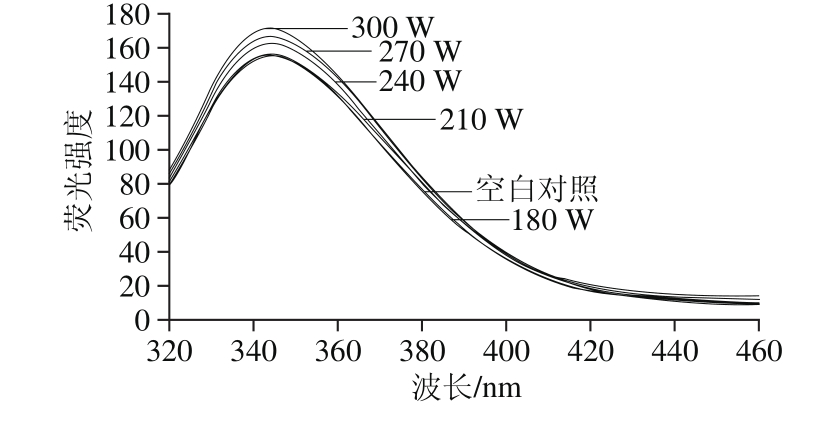
图3 超声功率对白鲢鱼肌肉LOX三级结构构象的影响
Fig. 3 Effect of ultrasonic power on the tertiary conformation of LOX in silver carp muscle
含有芳香族氨基酸残基如色氨酸(tryptophan,Tr p)、酪氨酸(t y r o s i n e,Ty r)和苯丙氨酸(phenylalanine,Phe)残基的蛋白质在一定激发波长照射下会产生荧光,称为内源荧光[27]。Trp、Tyr和Phe的荧光峰位波长分别是344、303、282 nm,蛋白质的内源荧光主要是由Trp和Tyr残基形成的,其中Trp的荧光强度最强;在同时含有Trp和Tyr的蛋白质中,由于其分子发生了从Tyr残基到Trp残基的能量转移,从而导致Tyr残基的荧光猝灭和Trp残基的荧光强度增加,因而内源荧光分析的主要对象为Trp,常被用来研究蛋白质的三级结构变化[28-29]。
图3为白鲢鱼肌肉LOX经不同功率超声波处理后荧光光谱图。超声波功率小于210 W时,LOX在344 nm波长处荧光强度变化较小,LOX三级结构相对稳定;当超声波功率大于210 W时,说明随着超声波功率增加,LOX在344 nm波长处荧光强度明显增强,说明LOX分子中Trp不断由分子内非极性环境中暴露在外部极性环境中,LOX三级结构发生改变,且超声波功率越大,三级结构变化越显著。因此,白鲢鱼肌肉LOX活性与LOX分子结构有着极为密切的联系,增加超声波功率、延长超声时间能够使白鲢鱼肌肉LOX分子内的二级结构、三级结构发生变化,进而使LOX活性降低。
2.1.2 超声处理时间对白鲢鱼肌肉LOX的影响
用300 W超声波分别处理白鲢鱼肌肉LOX 1、2、3、4、5 h后,LOX活力、CD光谱图、荧光光谱图分别如图4~6所示。
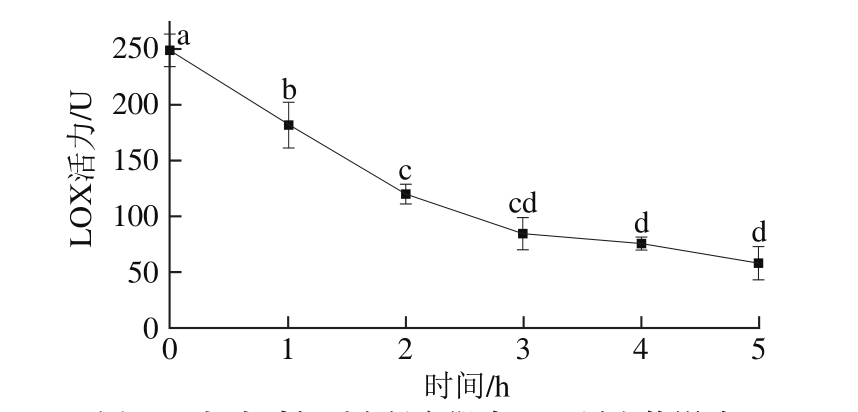
图4 超声时间对白鲢鱼肌肉LOX活力的影响
Fig. 4 Effect of ultrasonic irradiation time on LOX activity in silver carp muscle
由图4可知,随着超声时间延长,LOX活力呈下降趋势,说明LOX逐渐失活;时间短于3 h时,随着超声时间酶活力下降较为明显,大于3 h后趋于平缓。用300 W超声波分别处理白鲢鱼肌肉LOX 1、2、3、4、5 h后,酶活力分别下降26.79%、51.79%、66.07%、69.64%、76.79%。
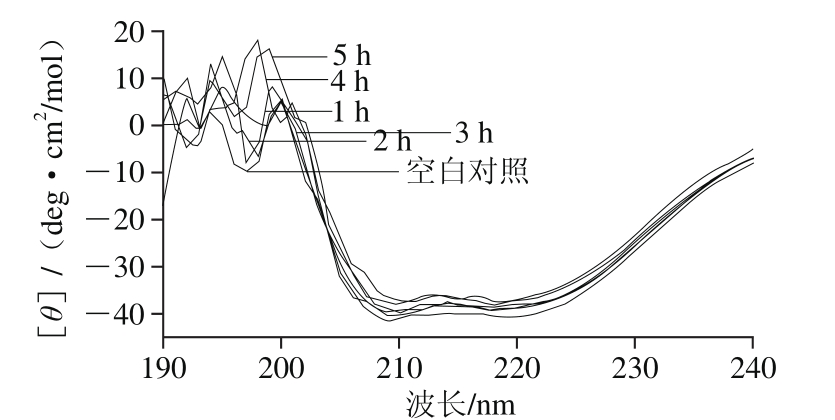
图5 超声时间对白鲢鱼肌肉LOX二级结构构象的影响
Fig. 5 Effect of ultrasonic irradiation time on the secondary conformation of LOX in silver carp muscle
图5为白鲢鱼肌肉LOX经300 W超声波处理不同时间后CD光谱图。随着超声时间延长,LOX在208、214 nm和222 nm波长处特征吸收峰强度逐渐下降,说明LOX内α-螺旋、β-折叠含量降低,二级结构发生变化,且随着时间延长,二级结构变化越明显。
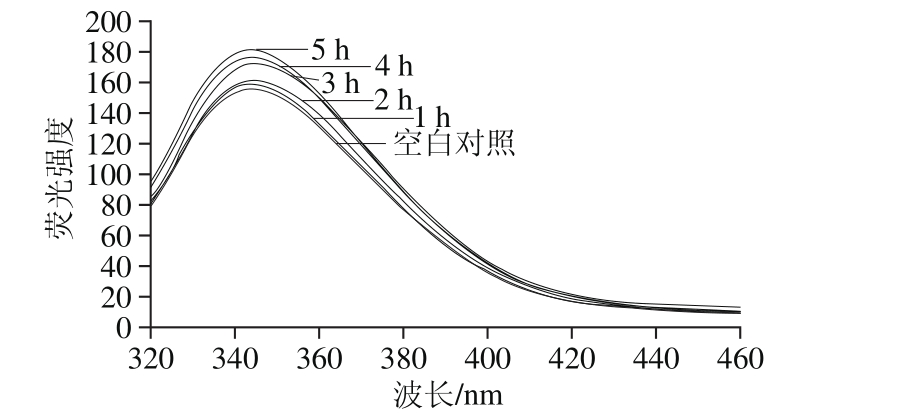
图6 超声时间对白鲢鱼肌肉LOX三级结构构象的影响
Fig. 6 The effect of ultrasonic irradiation time on the tertiary conformation of LOX in silver carp muscle
图6为白鲢鱼肌肉LOX经300 W超声波处理不同时间后荧光光谱图。随着超声时间延长,LOX在344 nm波长处荧光强度逐渐增强,超声时间短于3 h时,LOX在344 nm波长处荧光强度变化趋势相对平缓,大于3 h时,LOX在344 nm波长处荧光强度明显增强,说明LOX分子中Trp不断由分子内非极性环境中暴露在外部极性环境中,LOX三级结构发生改变,且超声时间越长,三级结构变化越明显。因此随着超声时间延长,白鲢鱼LOX的二级、三级结构不断改变,进而使LOX活力不断降低。
2.2 超高压处理对白鲢鱼肌肉LOX的影响
2.2.1 超高压压力对白鲢鱼肌肉LOX的影响
分别用150、200、250、300、350、400 MPa超高压处理白鲢鱼肌肉LOX 15 min后,LOX活力、CD光谱图、荧光光谱图分别如图7~9所示。
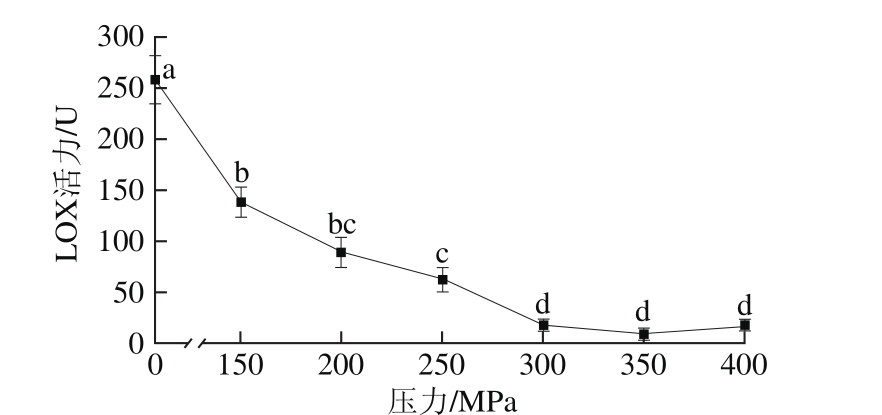
图7 超高压压力对白鲢鱼肌肉LOX活力的影响
Fig. 7 Effect of UHP pressure on LOX activity in silver carp muscle
如7图所示,随着超高压压力增加,LOX活力整体呈下降趋势,在0~300 MPa之间,随着压力增加,酶活力下降显著,压力大于300 MPa时,酶活力趋于稳定,此时LOX已基本失活;用150、200、250、300、350、400 MPa超高压处理白鲢鱼肌肉LOX 15 min后,LOX活力分别下降46.55%、65.52%、75.86%、93.10%、96.55%、93.10%。
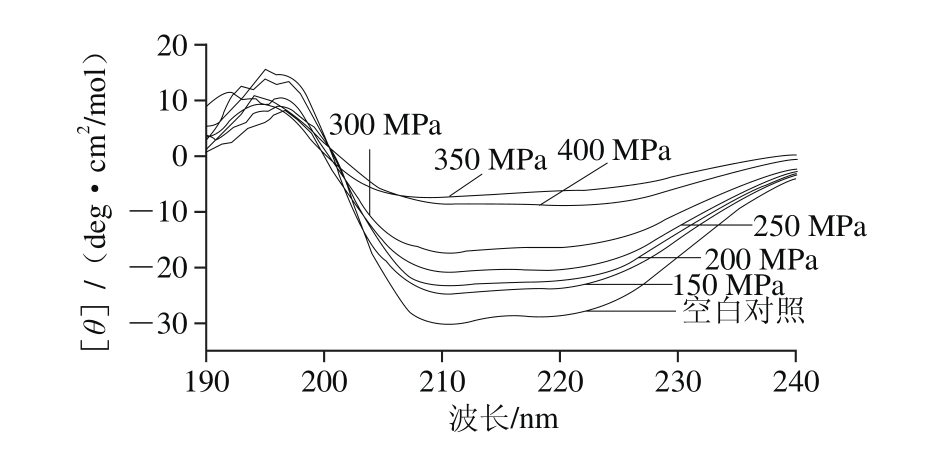
图8 超高压压力对白鲢鱼肌肉LOX二级结构构象的影响
Fig. 8 Effect of UHP pressure on the secondary conformation of LOX in silver carp muscle
图8为白鲢鱼肌肉LOX经不同压力超高压处理15 min后CD图。随着超高压压力增大,LOX在208、214 nm和222 nm波长处特征吸收峰强度明显下降,说明LOX内α-螺旋、β-折叠含量明显下降,且随着超高压压力增大,二级结构变化越显著。
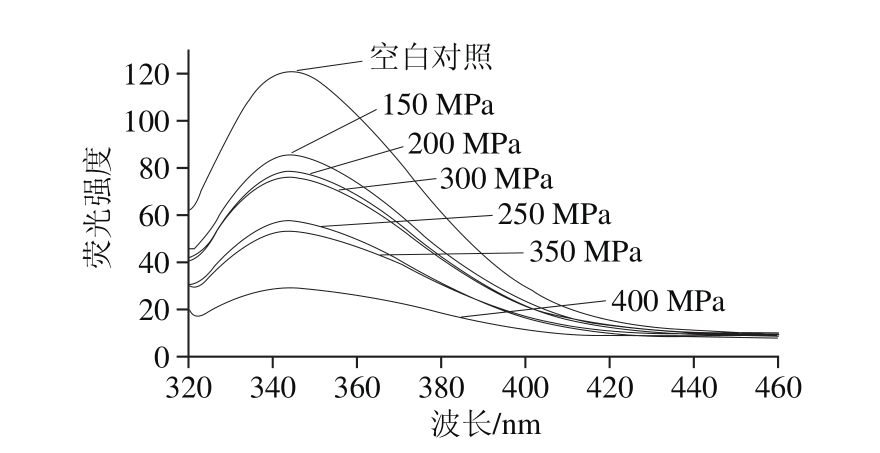
图9 超高压压力对白鲢鱼肌肉LOX三级结构构象的影响
Fig. 9 Effect of UHP pressure on the tertiary conformation of LOX in silver carp muscle
从图9可以看出,随着超高压压力增大,LOX在344 nm波长处荧光强度显著减弱,这与大多数文献中报道的结果并不相同。相关文献报道,当含有芳香族残基的蛋白质三级结构发生改变,一般情况下Trp不断由分子内非极性环境中暴露在外部极性环境中,造成蛋白质在344 nm波长处荧光强度明显增强[24,30]。但是本实验结果出现相反的情况,荧光强度没有出现增强反而显著减弱,经查阅文献并结合超高压作用原理分析,主要原因可能是LOX分子内部的Trp残基在超高压作用下被进一步包埋在蛋白质侧链中,肽链没有展开,荧光基团没有暴露,因此不会产生内源荧光,而且压力越高,包埋作用越明显,造成LOX在344 nm波长处荧光强度显著减弱的现象[31]。这种现象并不是因为LOX三级结构未发生改变,而是由于超高压的压力作用导致Trp残基的包埋所致。氨基酸残基的包埋和暴露均会使带有芳香族残基的微环境发生改变,进而使酶的三级结构也发生改变。因此,随着超高压压力的增加,LOX三级结构也在不断变化,且压力越大,变化越明显。
2.2.2 超高压时间对白鲢鱼肌肉LOX的影响
用300 MPa超高压分别处理白鲢鱼肌肉LOX 5、10、15、20、25、30 min后,LOX活力、CD光谱图、荧光光谱图分别如图10~12所示。
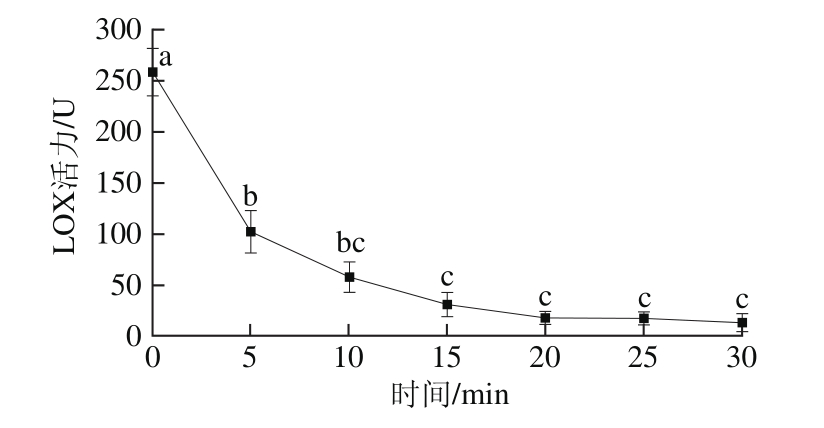
图10 超高压时间对白鲢鱼肌肉LOX活力的影响
Fig. 10 Effect of UHP processing time on LOX activity in silver carp muscle
如图10所示,随着超高压时间延长,LOX活力整体呈下降趋势,在0~20 min之间,酶活力下降显著,压力大于20 min时,酶活力趋于稳定,此时LOX已基本失活;用300 MPa超高压分别处理白鲢鱼肌肉LOX 5、10、15、20、25、30 min后,LOX活力分别下降60.34%、77.59%、87.93%、93.10%、93.10%、94.83%。
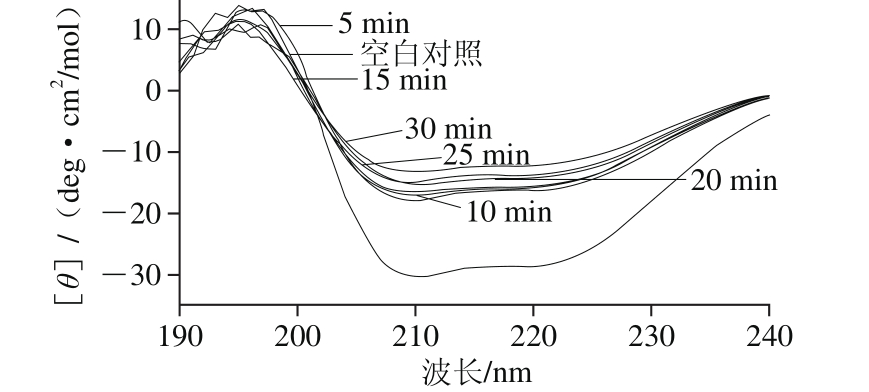
图11 超高压时间对白鲢鱼肌肉LOX二级结构构象的影响
Fig. 11 Effect of UHP processing time on the secondary conformation of LOX in silver carp muscle
图11为白鲢鱼肌肉LOX经300 MPa超高压处理不同时间后CD图。随着超高压时间延长,LOX在208、214 nm和222 nm波长处特征吸收峰强度显著下降,说明LOX内α-螺旋、β-折叠含量明显下降,蛋白质二级结构出现较大变化。而且随着时间的延长,LOX在208、214 nm和222 nm波长处特征吸收峰强度在5 min时极为显著显的变化,5~30 min时,LOX的特征吸收峰强度呈逐渐降低的趋势,结合超高压作用机理,可以得出主要原因是超高压作用使LOX分子构象改变主要发生在超高压加压和泄压过程中,延长超高压时间时,加压和泄压时间不变,只是维持稳压的时间延长,因此变化趋势相较于0~5 min明显降低。
图12为白鲢鱼肌肉LOX经300 MPa超高压处理不同时间后荧光光谱图。随着超高压时间延长,LOX分子内部暴露出来的Trp在超高压作用下又被包埋在蛋白质侧链中,不会产生内源荧光,使LOX在344 nm波长处荧光强度显著减弱,说明LOX三级结构出现明显变化。随着时间延长,包埋作用越明显,LOX三级结构变化越显著。因此,结合白鲢鱼肌肉LOX活力与分子结构的变化趋势可以明显得出,LOX活性与其分子结构有着极为密切的联系,增加超高压压力、延长超声时间能够使白鲢鱼肌肉LOX分子内的二级结构、三级结构发生极为显著的变化,进而使LOX活力大大降低。
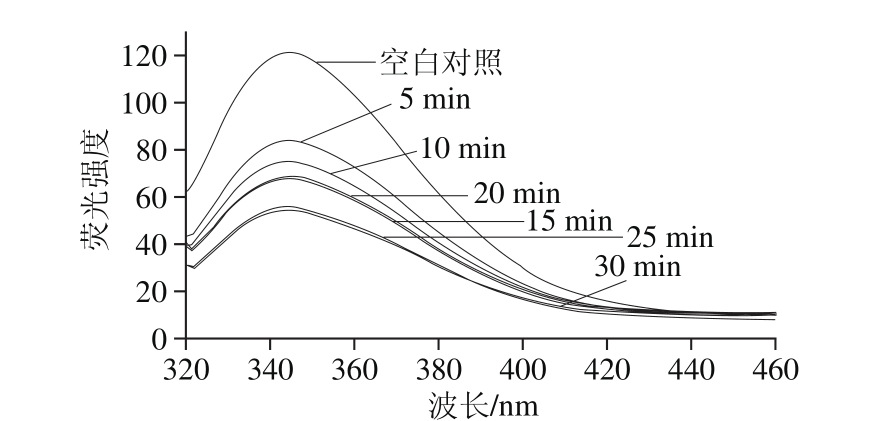
图12 超高压时间对白鲢鱼肌肉LOX三级结构构象的影响
Fig. 12 Effect of UHP processing time on the tertiary conformation of LOX in silver carp muscle
3 结 论
本研究以白鲢鱼肌肉LOX为原料,研究了其在不同超声波和超高压条件下酶活力、二级结构和三级结构变化规律。实验结果显示:随着超声波功率的增加、时间延长,二级结构和三级结构明显发生变化,使LOX活力不断降低,3 h后随着超声时间延长酶活力下降不明显且能耗增加,所以选取最适超声条件为300 W、3 h,但从酶活力变化趋势可知,超声波作用较为缓慢,时间较长,并且引起的热效应明显,因此超声波可作为改变LOX构象,抑制LOX活力,改变白鲢鱼肌肉多不饱和脂肪酸氧化调控的辅助条件;随着超高压压力的增加、时间的延长,二级结构和三级结构发生显著变化,LOX活力迅速降低,综合考虑处理条件对酶活性的影响和能耗,选取最适超高压条件为300 MPa、20 min。超高压作用迅速、时间短,热效应可忽略不计,因此超高压可作为破坏LOX构象、抑制LOX活力、调控白鲢鱼肌肉多不饱和脂肪酸氧化的重要条件;但其对设备要求较高,所以其用于工业化还有一段距离。本实验的研究结果可为白鲢鱼的土腥味控制和精深加工提供参考。
参考文献:
[1] 叶川, 闫虹, 范选娇, 等. 富钙白鲢鱼糜凝胶的制备及其营养分析[J]. 现代食品科技, 2016, 32(2): 227-234. DOI:10.13982/j.mfst.1673-9078.2016.2.034.
[2] URESTI R M, TELLEZ-LUIS S J, RAMIREZ J A, et al. Use of dairy proteinsand microbial transglutaminase to obtain low-salt fish products from filleting waste from silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2004, 86(2): 257-262. DOI:10.1016/j.foodchem.2003.09.033.
[3] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D]. 无锡: 江南大学, 2014: 1-2.
[4] 杨玉平. 鲢鱼体内土腥味物质鉴定及分析方法与脱腥技术研究[D].武汉: 华中农业大学, 2010: 2-3.
[5] FU X J, XU S Y, WANG Z. Kinetics of lipid oxidation and offodor formation in silver carp mince: the effect of lipoxygenase and hemoglobin[J]. Food Research International, 2009, 42(1): 85-90.DOI:10.1016/j.foodres.2008.09.004.
[6] FU X J, LI Q L, XU S Y, et al. Effect of drying methods and antioxidants on the flavor and lipid oxidation of silver carp slices[J]. LWT-Food Science and Technology, 2015, 61(1): 251-257. DOI:10.1016/j.lwt.2014.10.035.
[7] LU W Q, ZHAO X, XU Z Y, et al. Development of a new colorimetric assay for lipoxygenase activity[J]. Analytical Biochemistry, 2013, 441(2):162-168. DOI:10.1016/j.ab.2013.06.007.
[8] 杨文鸽, 薛长湖, 何雄, 等. 南美白对虾血淋巴脂肪氧合酶的分离纯化及其生化特性研究[J]. 中国食品学报, 2006, 6(3): 31-37.DOI:10.3969/j.issn.1009-7848.2006.03.006.
[9] SAE-LEAW T, BENJAKUL S. Fatty acid composition, lipid oxidation,and ベshy odour development in seabass (Lates calcarifer) skin during iced storage[J]. European Journal of Lipid Science and Technology, 2014,116(7): 885-894. DOI:10.1002/ejlt.201300381.
[10] 刘奇. 鲟鱼腥味物质特征及其与脂肪酸氧化的关系研究[D]. 青岛:中国海洋大学, 2013: 8-9.
[11] GAO R C, YUAN L, YU M S, et al. Effects of heat pump drying parameters on the volatile ぼavor compounds in silver carp[J]. Journal of Aquatic Food Product Technology, 2016, 25(5): 735-744. DOI:10.1080/10498850.2014.923082.
[12] 谢秀玲, 李欣, 高金燕, 等. 非热加工对食物过敏原影响的研究进展[J]. 食品科学, 2013, 34(17): 344-349. DOI:10.7506/spkx1002-6630-201317072.
[13] 王薇薇, 孟廷廷, 郭丹钊, 等. 食品加工中超声波生物学效应的研究进展[J]. 食品工业科技, 2015, 36(2): 379-383. DOI:10.13386/j.issn1002-0306.2015.02.074.
[14] 刘平, 胡志和, 吴子健, 等. 超高压对木瓜蛋白酶构象及酶活力的影响[J]. 食品科学, 2015, 36(23): 23-27. DOI:10.7506/spkxl002-6630-201523005.
[15] FENG Liping, CAO Yanping, XU Duoxia, et al. Inぼuence of sodium alginate pretreated by ultrasound on papain properties: activity,structure, conformation and molecular weight and distribution[J].Ultrasonics Sonochemistry, 2016, 32: 224-230. DOI:10.1016/j.ultsonch.2016.03.015.
[16] HUANG Y C, WANG Y R, WU Z M, et al. Combined eあects of highpressure and thermal treatments on lipid oxidation and enzymes in pork[J]. Food Science and Biotechnology, 2016, 25(1): 261-266.DOI:10.1007/s10068-016-0038-2.
[17] YI J Y, JIANG B, ZHANG Z, et al. Effect of ultrahigh hydrostatic pressure on the activity and structure of mushroom (Agaricus bisporus)polyphenoloxidase[J]. Journal of Agricultural and Food Chemistry,2012, 60(2): 593-599. DOI:10.1021/jf203405u.
[18] LU Y J, LIU C C, ZHAO M M, et al. Structure and activity changes of phytohemagglutinin from red kidney bean (Phaseolus vulgaris)affected by ultrahigh-pressure treatments[J]. Journal of Agricultural and Food Chemistry, 2015, 63(43): 9513-9519. DOI:10.1021/acs.jafc.5b03337.
[19] 刘平, 胡志和, 吴子健, 等. 超高压处理菠萝蛋白酶引发构象变化与酶活力的关系[J]. 食品科学, 2014, 35(21): 138-142. DOI:10.7506/spkx1002-6630-201421027.
[20] GATA J L, PINTO M C, MACIAS P. Lipoxygenase activity in pig muscle: purification and partial characterization[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2573-2577.DOI:10.1021/jf960149n.
[21] 付湘晋. 白鲢鱼脱腥及其低盐鱼糜制备的研究[D]. 无锡: 江南大学,2009: 39-40.
[22] KOUASSI G K, ANANTHESWARAN R C, KNABEL S J, et al.Eあect of high-pressure processing on activity and structure of alkaline phosphatase and lactate dehydrogenase in buあer and milk[J]. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9520-9529.DOI:10.1021/jf071518q.
[23] ZHONG K, HU X S, WU J H, et al. Effects of high pulsed electric field on the secondary and tertiary structure of lipoxygenase[J].Spectroscopy and Spectral Analysis, 2009, 29(3): 765-768.DOI:10.3964/j.issn.1000-0593(2009)03-0765-04.
[24] 邱春江. 超高压对鲢鱼中关键酶与结构蛋白质构影响的研究[D]. 无锡: 江南大学, 2014: 49-50.
[25] LI Y X, WANG J P, JIAO, A Q, et al. A study on the potential interaction between cyclodextrin and lipoxygenase[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2013, 76(1): 107-111. DOI:10.1007/s10847-012-0178-9.
[26] BONAVITA A, CARRATORE V, CIARDIELLO M A, et al. Inぼuence of pH on the structure and function of kiwi pectin methylesterase inhibitor[J]. Journal of Agricultural and Food Chemistry, 2016, 64(29):5866-5876. DOI:10.1021/acs.jafc.6b01718.
[27] 王静, 金征宇, 江波, 等. Aspergillus ficuum菊粉酶的荧光光谱研究[J]. 食品科学, 2009, 30(23): 237-241. DOI:10.3321/j.issn:1002-6630.2009.23.053.
[28] PINTO M D, DUQUE A L, MACIAS P. Fluorescence quenching study on the interaction between quercetin and lipoxygenase[J]. Journal of Fluorescence, 2011, 21(3): 1311-1318. DOI:10.1007/s10895-010-0816-9.
[29] PINTO M D, DUQUE A L, MACIAS P. Fluorescence spectroscopic study on the interaction of resveratrol with lipoxygenase[J]. Journal of Molecular Structure, 2010, 980(1/2/3): 143-148. DOI:10.1016/j.molstruc.2010.07.006.
[30] HUANG Y C, GAN Y, LI F. Eあects of high pressure in combination with thermal treatment on lipid hydrolysis and oxidation in pork[J]. LWT-Food Science and Technology, 2015, 63(1): 136-143.DOI:10.1016/j.lwt.2015.03.103.
[31] 黄群, 金永国, 马美湖, 等. 超高压处理对S-卵白蛋白构象与功能特性的影响[J]. 农业机械学报, 2013, 44(3): 161-166. DOI:10.6041/j.issn.1000-1298.2013.03.030.