二十二碳六烯酸(docosahexaenoic acid,DHA)是n-3系多不饱和脂肪酸[1],目前主要的来源是深海鱼油[2]。DHA纯品是一种无色无味的脂溶性液体,低温下具有较高的流动性[3]。研究表明,DHA具有多种生理功能,如预防脑血栓[4]、促进婴幼儿的大脑发育[5-6]、抗炎[7]和抗癌[8]等。自研究证实了DHA的抗癌功能[9-10],对于DHA其他的生物学功能也引起了人们的极大关注。
DHA是一种人体必需的脂肪酸[11],人体无法自身合成,因此,DHA的生理功能成为了当前的研究重点。在《美国高血压》杂志上,澳大利亚西澳大学科学家Moili等[12]指出,DHA能使血液中胆固醇水平和血液黏稠度降低,使人体内脂蛋白和血脂代谢得到调节,达到降血压的目的。Calviello等[13]发现,DHA与5-氟尿嘧啶同时使用,能够抑制结肠癌细胞的生长,诱导癌细胞的凋亡。尤丽菊等[14]在DHA的药理作用中提到,DHA含量增加,花生四烯酸含量降低,丙二醛生成减少,超氧化物歧化酶(superoxide dismutase,SOD)的活性增加。贺敏等[15]证实了高含量二十碳五烯酸(eicosapentaenoic acid,EPA)/DHA甘油三酯型可显著改善免疫低下模型小鼠的免疫调节功能,其免疫调节作用可能与其甘油三酯含量及EPA/DHA含量相关。但目前关于DHA免疫功能方面的研究主要是从动物实验方面,而且仅对其免疫调节活性进行了初步探讨。
以小鼠巨噬细胞RAW264.7细胞为研究对象,采用噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法、细胞染色法、相关酶活力的测定以及关键蛋白酶等方法,研究DHA的免疫调节活性,这将为DHA在食品和保健品中的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
RAW264.7细胞株 中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
DHA标准品 美国Sigma公司;MTT、吖啶橙(acridine orange,AO)染液、高效蛋白裂解液(radio immunoprecipitation assay,RIPA) 北京索莱宝科技有限公司;中性红 天津市天新精细化工开发中心;糖原过碘酸希夫反应(periodic acid Schiff reaction,PAS)染色液 北京雷根生物技术有限公司;酸性磷酸酶(acid phosphatase,ACP)试剂盒、溶菌酶(lysozyme,LSZ)试剂盒、SOD试剂盒 南京建成生物工程研究所;pho-ERK1/2抗体、ERK1/2抗体、pho-JNK/SAPK抗体、JNK/SAPK抗体、pho-p38丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPKs) 抗体、p38 MAPKs抗体、辣根过氧化物标记IgG(H+L)抗体 碧云天生物技术公司。
1.2 仪器与设备
SW-CJ-1F超净工作台 苏州净化设备有限公司;紫外-可见分光光度仪、Multiskan GO酶标仪、3110二氧化碳培养箱 赛默飞世尔科技公司;SU1510扫描电子显微镜 日本日立集团有限公司。
1.3 方法
1.3.1 试剂配制
细胞培养液:RPMI-1640培养液与胎牛血清的比例为9∶1(V/V),必要时可加入0.1%青链霉素混合双抗,4 ℃保存。
细胞冻存液:20%胎牛血清,70% RPMI-1640培养液,10%二甲基亚砜(dimethyl sulfoxide,DMSO),现用现配。
MTT溶液配制:精确称取MTT 50 mg溶于磷酸盐缓冲液(phosphate buffered saline,PBS)缓冲液(pH 7.2),终质量浓度为5 mg/mL,0.22 μm水系滤膜过滤除菌,4 ℃避光保存。
中性红溶液配制:用0.9%的生理盐水使中性红浓度为0.1%,0.22 μm水系滤膜过滤除菌,4 ℃避光保存。
DHA母液配制:将DHA标准品溶于DMSO中,配制成5 mg/mL的DHA溶液,-20 ℃避光保存,现稀释现用。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)缓冲液(10×):Tris 7.5 g、甘氨酸36.0 g、SDS 5.0 g,三蒸水定容至500 mL,4 ℃贮存,用时稀释10 倍。
SDS凝胶上样缓冲液(5×):100 mmol/L Tris-HCl(pH 6.8)1.2 mL、10% SDS 4 mL、0.1%溴酚蓝0.01 mL、20%甘油2 mL、三蒸水2.8 mL。
0.025 mol/L转移电泳缓冲液(5×):Tris 18.925 g、甘氨酸96.5 g,三蒸水定容至1 000 mL,4 ℃贮存备用。
洗涤缓冲液(Tris-buffered saline Tween 20,TBST):Tris 4.84 g、NaCl 58.48 g,加三蒸水至2 000 mL,临用前加入0.5 mL Tween 20,pH 7.5。
1.3.2 DHA增殖和吞噬活性实验
1.3.2.1 DHA对RAW264.7增殖活性的影响
采用MTT法[16]测定DHA对RAW264.7细胞增殖活性的影响,DHA作用RAW264.7细胞一定时间后,使用酶标仪测定各孔570 nm波长处的吸光度。以不加DHA的为空白对照组。采用5 μg/mL的脂多糖(lipopolysaccharide,LPS)处理细胞,作为阳性对照组。细胞增殖率根据下式计算。
1.3.2.2 DHA对RAW264.7吞噬活性的影响
采用中性红实验测定DHA对RAW264.7吞噬活性的影响,巨噬细胞所具有的吞噬活性,能将大分子的中性红内吞入细胞,当用细胞裂解液裂解细胞后,细胞内的中性红溶出,被吞噬的中性红的量与540 nm波长处的吸光度成正比,因此可用此吸光值衡量巨噬细胞的吞噬能力。DHA作用细胞一定时间后,使用酶标仪测定处各孔A540nm。
1.3.3 DHA对RAW264.7细胞形态的影响
1.3.3.1 扫描电子显微镜观察
细胞培养结束后,用PBS洗去残留培养液,以2.5%戊二醛溶液固定细胞2 h,依次以不同体积分数(10%、30%、50%、70%、90%、90%、100%)的乙醇对细胞进行脱水处理。取出盖玻片,剪成适量大小粘于样品台,喷金后进行电子显微镜扫描,观察经DHA作用后RAW264.7细胞的形态变化。
1.3.3.2 AO染色
细胞培养结束后,用PBS洗去残留培养液,细胞固定液(乙醇-冰醋酸-氯仿(6∶1∶3,V/V))固定细胞10 min,加入以1%乙酸溶液酸化后弃去液体,避光条件下加入0.01% AO染液染色20 min,以0.1 mol/L氯化钙溶液分色1 min,PBS洗去残留液。取出盖玻片,置于洁净载玻片上,在荧光显微镜下观察并采集图像。
1.3.3.3 糖原PAS染色
细胞培养结束后,用PBS洗去残留培养液,用10%福尔马林固定细胞30 min,加入过碘酸溶液室温氧化5~8 min,流水冲洗盖玻片后用蒸馏水浸洗,加入Schiff试剂室温避光染色20 min,流水冲洗10 min。取出盖玻片,置于洁净载玻片上,在荧光显微镜下观察并采集图像。
1.3.4 DHA对RAW264.7细胞酶活性的影响
取对数生长期的RAW264.7细胞进行计数,调整细胞悬液密度为1×104个/mL,以4 mL/瓶加入细胞培养瓶中,37 ℃、5% CO2培养过夜,使细胞充分贴壁。弃去培养液,空白对照组只加入培养液,实验组加入分别含有400、600、800、1000 ng/mL DHA的培养液,培养48 h。细胞经胰酶消化、PBS清洗后离心收集,分别测定细胞ACP、LSZ和SOD的活力。
1.3.4.1 ACP活力测定
将细胞重悬于500 μL蒸馏水中,超声破碎1 min,2 500 r/min离心10 min。用BCA蛋白测定试剂盒测定上清液蛋白含量,样品按照ACP测定试剂盒说明书操作,计算细胞中ACP的活力。
1.3.4.2 LSZ活力测定
将细胞重悬于500 μL PBS中,调整细胞悬液密度为1×106mL-1,超声破碎1 min,2 500 r/min离心10 min。样品按照溶菌酶测定试剂盒说明书操作,并计算细胞中LSZ的活力。
1.3.4.3 SOD活力测定
将细胞重悬于500 μL蒸馏水中,超声破碎1 min,2 500 r/min离心10 min。用BCA蛋白测定试剂盒测定上清液蛋白含量,样品按照SOD测定试剂盒说明书进行操作,并计算细胞中SOD的活力。
1.3.5 MAPKs蛋白激酶家族蛋白表达量的测定
采用Western Blot法测定RAW264.7细胞内MAPKs家族蛋白的表达量。
1.3.5.1 蛋白样品的制备
培养RAW264.7至充分贴壁后,吸出培养液,换为含DHA(0、600、800、1 000 ng/mL)的RPMI-1640培养液。
培养结束,收集细胞并重悬于Hanks缓冲液中,1 000 r/min离心5 min,移弃管内液体,重复漂洗2 次。
每管细胞中按照100:1的比例加入RIPA和蛋白酶抑制剂(phenylmethanesulfonyl ぼuoride,PMSF),冰浴中振荡0.5 h。
转移至1.5 mL离心管中,4 ℃、12 000 r/m离心20 min,吸取上清液蛋白提取液。
BCA蛋白法测定蛋白浓度,加入适量上样缓冲液,100 ℃煮沸3~5 min使蛋白变性,10 000 r/min离心5 min后即可上样,上样量为10~40 μL/孔(上样蛋白质量不低于50 μg)。
1.3.5.2 SDS-PAGE
按实验所需检测的蛋白分子质量,配制12%分离胶及5%浓缩胶。电泳时浓缩胶施加80 V电压,待溴酚蓝染料至下层分离胶处,电压调至120 V,直至溴酚蓝染料接近胶体底部,此过程大约需要1.5~2.0 h。
转移电泳:将滤纸和NC膜裁剪成与电泳凝胶相同大小,用预冷并加入甲醇的转移电泳缓冲液平衡约15 min。电转前,利用NC膜、滤纸及分离胶胶制作“三明治”结构:首先,剥弃浓缩胶,将剥离下来的分离胶盖于已平衡的三层滤纸上,安装电泳转移槽,300 mA转移1.5~2.0 h。
杂交:脱脂奶粉溶液封闭膜、T B S T溶液洗膜、一抗4 ℃孵育过夜、TBST溶液洗膜、二抗室温孵育1 h、TBST溶液洗膜、免疫印迹化学发光液(electrochemiluminescence reagent,ECL)显色NC膜、显影液显影、定影液定影,并拍照记录数据。
1.4 数据统计分析
数据统计采用SPSS 18.0软件。实验结果以 表示。组间比较采用t检验。P<0.05为差异有统计学意义。
表示。组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果与分析
2.1 DHA增殖和吞噬活性实验结果
2.1.1 DHA对RAW264.7增殖活性的影响
巨噬细胞是机体重要的免疫细胞,具有多种免疫功能,如吞噬外来的小颗粒物质、呈递抗原、分泌细胞因子等。一般情况下巨噬细胞处于休眠状态,吞噬能力很弱,当受到一些免疫增强剂激活以后,巨噬细胞表现出更强增殖、吞噬及胞饮能力[17]。
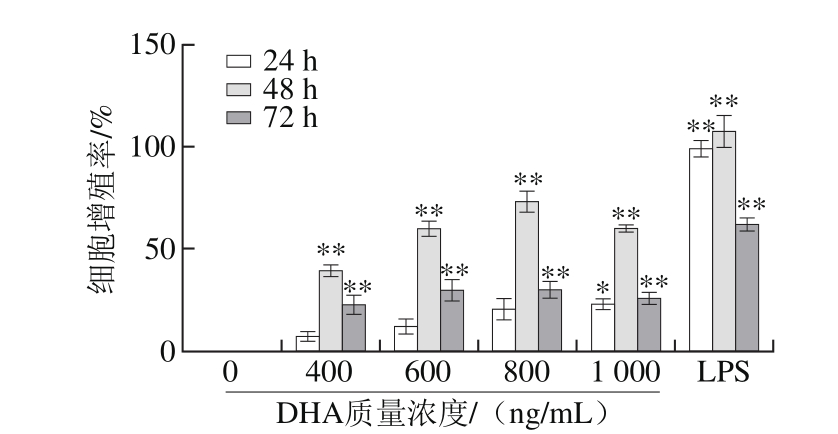
图1 DHA作用质量浓度对RAW264.7细胞增殖率的影响
Fig. 1 Effect of DHA concentration on proliferation index of RAW264.7 cells
与空白对照组相比,*.差异显著(P<0.05),**.差异极显著(P<0.01)。图2、6~8同。
由图1可知,不同质量浓度的DHA与细胞共培养24 h后细胞的增殖能力均有所增加,但其对应质量浓度的增殖能力均小于共培养48 h后的增殖能力。阳性对照组中,经过LPS处理细胞后,细胞增殖能力增加最显著,说明RAW264.7细胞处于正常可被激活的状态。共同培养48 h后的细胞,在给药800 ng/mL时,增殖能力达到顶峰,细胞增殖率为73.03%;在1 000 ng/mL时,细胞增殖能力有所下降,但同空白对照组相比,细胞仍表现为增殖作用。共培养72 h后的细胞,由于细胞营养条件的限制,随着作用剂量的增加,细胞数量增幅较小。
MTT实验结果表明,在实验范围内,DHA与RAW264.7细胞的最佳作用时间为48 h,最佳作用剂量为800 ng/mL,因此后续实验选定DHA的作用时间为48 h。
2.1.2 DHA对RAW264.7吞噬活性的影响
通过对DHA作用后RAW264.7细胞吞噬中性红能力的测定,判断DHA对RAW264.7细胞吞噬活性的影响。
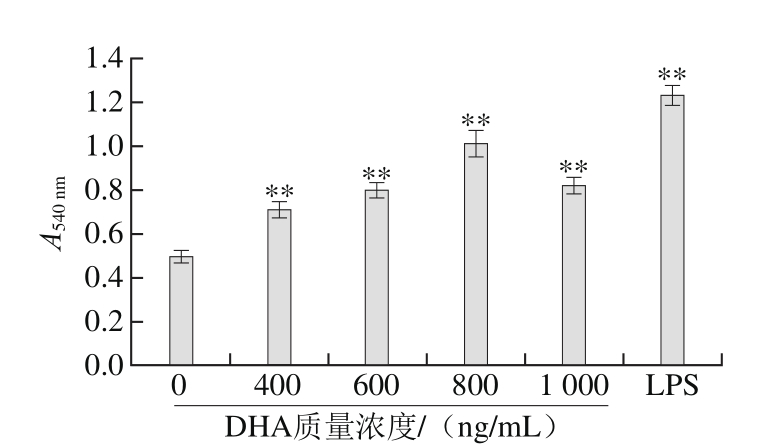
图2 DHA作用质量浓度对RAW264.7细胞吞噬活性的影响
Fig. 2 Effect of DHA concentration on phagocytic activity of RAW264.7 cells
如图2所示,当DHA质量浓度为800 ng/mL时,RAW264.7细胞吞噬活性最高。中性红吞噬实验初步说明DHA能够激活RAW264.7细胞,通过提高巨噬细胞的吞噬能力来发挥DHA的免疫活性,执行各种免疫防御功能,且在一定的质量浓度范围(0~1 000 ng/mL)内,RAW264.7细胞的吞噬活性与DHA具有明显的剂量依赖关系。
2.2 DHA对RAW264.7细胞形态的影响
2.2.1 扫描电子显微镜观察结果
巨噬细胞存在不同的形态和功能等级,在受到外源因素作用的情况下,巨噬细胞从静息状态变成活化状态,细胞形态及功能会发生明显变化。
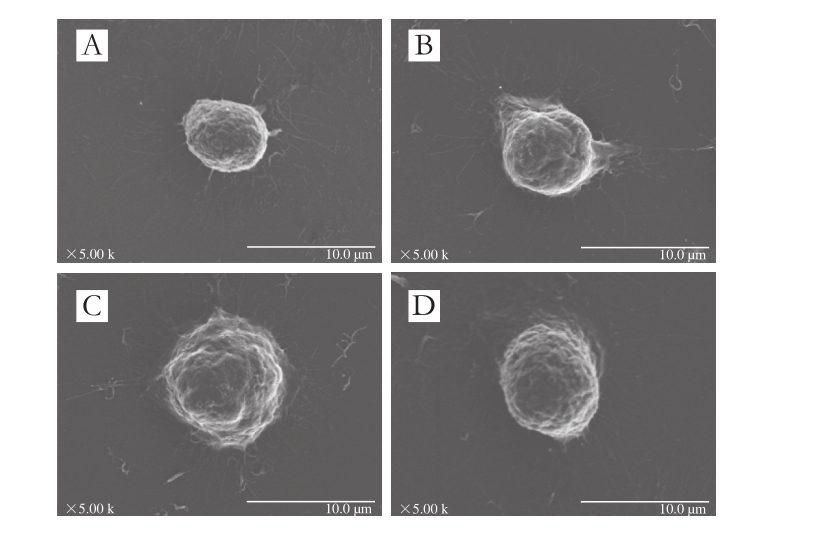
图3 DHA作用RAW264.7细胞的扫描电子显微镜图像
Fig. 3 SEM images showing the microstructure of RAW264.7 treated with DHA
A~D. DHA质量浓度分别为0、600、800、1 000 ng/mL。图4~5同。
由图3可知,以800 ng/mL的DHA作用细胞48 h后,细胞体积增大,表面突起明显,贴壁面积明显增大,褶皱增加,并有部分伪足出现;而空白对照未经激活的细胞体积较小,形状规则,细胞表面突起较小。以上结果表明RAW264.7细胞在800 ng/mL的DHA作用下,外部形态已呈现明显的活化特征。
2.2.2 AO染色结果
采用AO染色观察经DHA作用后,RAW264.7细胞内DNA和RNA代谢情况。AO是一种能和细胞中的核酸相结合并产生特异性荧光的染料[18],能与细胞核内的DNA和RNA结合,呈绿色荧光。

图4 DHA作用RAW264.7细胞的AO染色图(×400)
Fig. 4 AO staining of RAW264.7 treated with DHA (× 400)
图4表明,对照组细胞处于静息状态,细胞呈圆形,形状规则、大小均匀、体积较小,DHA作用组细胞体积变大、数目增多,细胞核区的绿色荧光亮度增强,说明在DHA作用下,RAW264.7细胞被激活,细胞核酸代谢旺盛。
2.2.3 糖原PAS染色结果
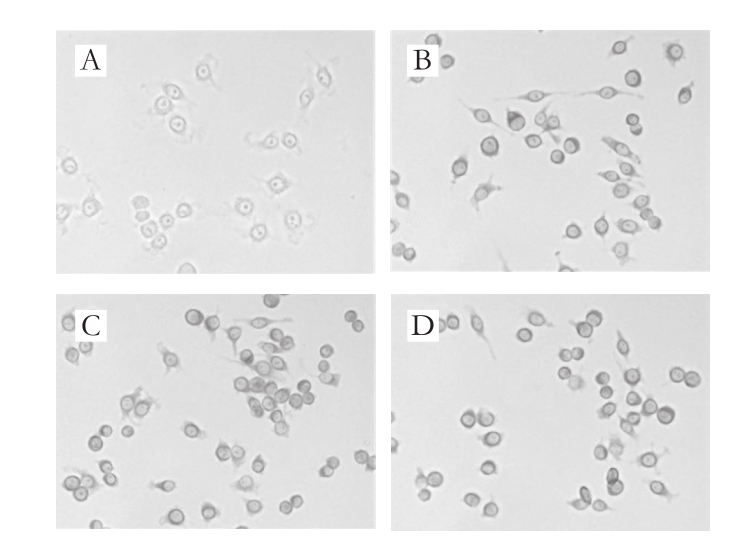
图5 DHA作用RAW264.7细胞的PAS染色图(×400)
Fig. 5 PAS staining of RAW264.7 treated with DHA (× 400)
RAW264.7细胞内的糖原变化情况采用Schiff’s法检测[19]。由图5可知,细胞质中的糖原经DHA作用后被染成紫红色,与对照组细胞相比,DHA作用组细胞的细胞质染色加深,细胞总数明显增多,细胞形态进一步分化,不规则程度加深。当DHA质量浓度为600 ng/mL时,细胞内糖原被紫红色浓染,表明细胞内糖原代谢加快;当DHA质量浓度为800 ng/mL时,视野内梭形细胞聚集,细胞数量进一步增多。以上结果表明,DHA能通过促进RAW264.7细胞内糖原代谢加快细胞的分化。
2.3 DHA对RAW264.7细胞酶活性的影响
2.3.1 DHA对RAW264.7细胞ACP活性的影响
酸性磷酸酶是吞噬细胞杀菌的物质基础,能在第一时间反应巨噬细胞的活化状态。酸性磷酸酶形成的水解酶体系通过参与巨噬细胞的多种溶酶体消化功能,能够破坏和消除侵入机体的异物,达到机体防御的功能[20]。

图6 DHA质量浓度对RAW264.7细胞ACP活性的影响
Fig. 6 Effect of DHA concentration on ACP activity in RAW264.7 cells
由图6可见,与对照组相比,当400 ng/mL DHA作用于RAW264.7细胞48 h后,细胞内ACP活力极显著升高,继续增加DHA的质量浓度,细胞ACP活力也随之增强。当DHA质量浓度为800 ng/mL时,ACP活力达到最大值123 U/g pro,是对照组酶活力的2.20 倍。以上结果表明,DHA能促进RAW264.7细胞分泌ACP,提高细胞的吞噬、杀菌能力。
2.3.2 DHA对RAW264.7细胞LSZ活性的影响
溶菌酶又称胞壁质酶,是一种广泛存在于动植物及微生物中的能水解细菌或真菌的胞壁多糖的碱性蛋白[21]。细菌或真菌的细胞壁经溶菌酶水解后,菌体渗透压失衡发生破裂,溶菌酶起到了破坏和消除入侵机体异物的作用,担负着机体的防御功能,溶菌酶活性的强弱也反映了巨噬细胞的活化能力。
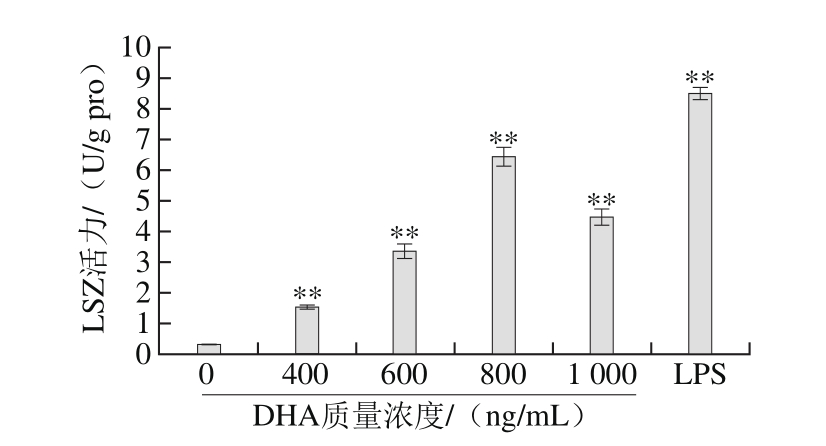
图7 DHA质量浓度对RAW264.7细胞LSZ活力的影响
Fig. 7 Effect of DHA concentration on LSZ activity in RAW264.7 cells
由图7可见,与对照组相比,各剂量组RAW264.7细胞的溶菌酶活力极显著增强,在作用质量浓度为400~800 ng/mL的范围内,细胞中溶菌酶的活力随DHA作用质量浓度的增加而增加,呈现明显的质量浓度依赖性,并在800 ng/mL时活力达到最大值。以上结果表明,DHA能促进RAW264.7细胞产生溶菌酶。
2.3.3 DHA对RAW264.7细胞SOD活性的影响
SOD是细胞内存在的一种抗氧化酶,它能催化超氧阴离子发生反应从而减少其在体内的累积,降低对机体的损伤,是自由基清除体系和机体代谢的关键酶[22]。
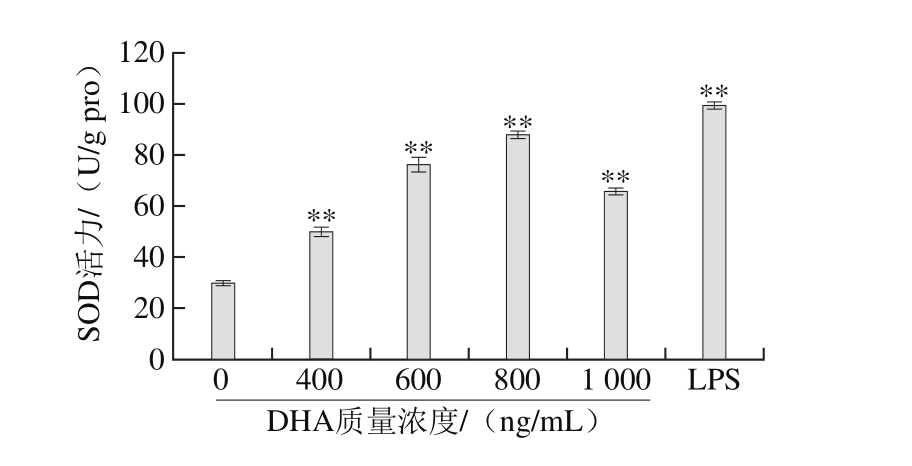
图8 DHA质量浓度对RAW264.7细胞SOD活力的影响
Fig. 8 Effect of DHA concentration on SOD activity in RAW264.7 cells
由图8可见,在实验剂量下,D H A可以刺激RAW264.7细胞,使细胞SOD活力与对照组相比呈极显著增强,当质量浓度在400~800 ng/mL范围内时,作用效果具有剂量依赖,细胞代谢能力随着作用剂量的增加逐步提高,细胞处于活化状态。
测定经不同浓度DHA作用RAW264.7细胞后细胞中酸性磷酸酶、溶菌酶和超氧化物歧化酶的酶活,可知DHA能显著增加RAW264.7细胞相关酶的分泌及活性、提高细胞杀菌、代谢及抗氧化能力,奠定了巨噬细胞活化的基础。
2.4 DHA对RAW264.7细胞MAPKs相关蛋白的影响
MAPKs是细胞内一类丝氨酸/苏氨酸蛋白激酶[23-25]。大量研究证实,MAPKs信号转导通路参与细胞分裂、分化、增殖和凋亡等多种生命体代谢活动。MAPKs信号转导通路中三个经典通路分别是细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、p38 MAPKs和应激活化蛋白激酶(c-Jun N-terminal kinase,JNK)通路[26-27]。磷酸化的ERK由胞质转位到核内,进而介导Elk-1、ATF、NF-κB、Ap-1、c-fos和c-Jun的转录活化,参与细胞增殖与分化、维持形态特征等多种生命体代谢活动[28-29]。此外,p38 MAPKs的激活与控制肿瘤坏死因子(tumor necrosis factor-α,TNF-α)基因表达密切相关[30]。JNK蛋白被环境压力或某些免疫相关细胞因子激活,在免疫系统信号传导中起至关重要的作用[31-32]。当巨噬细胞受到外部刺激处于激活状态时,MAPKs相关蛋白就会出现磷酸化反应,进而调节NO和细胞因子的分泌[33-34]。因此,探究DHA对RAW264.7细胞中MAPKs通路中的蛋白变化情况,对阐述DHA对巨噬细胞的激活作用具有十分重要的意义。
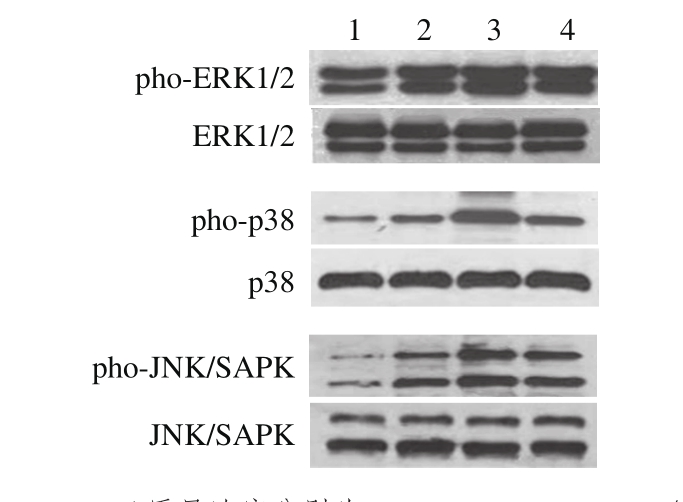
图9 DHA处理后RAW264.7细胞中MAPKs相关蛋白的变化情况
Fig. 9 Effect of DHA on the expression of MAPKs signaling proteins in RAW264.7 cells
泳道1~4. DHA质量浓度分别为0、600、800、1 000 ng/mL。
RAW264.7细胞MAPKs信号转导通路结果如图9所示,正常细胞组中,ERK1/2蛋白磷酸化程度较低,而p38和JNK蛋白磷酸化程度很低。使用600~800 ng/mL的DHA单独诱导巨噬细胞,可以发现,ERK1/2、p38和JNK的磷酸化程度明显升高,并且在800 ng/mL时磷酸化程度最高,到1 000 ng/mL时出现了下降。结果表明:DHA能够引起ERK1/2、p38和JNK出现一定程度的磷酸化,说明DHA诱导巨噬细胞激活部分依赖了MAPKs信号转导通路。
3 讨 论
DHA具有多种生理功能,对人体的健康有着至关重要的作用,已有相关研究表明DHA在增加膜离子渗透率、增加细胞膜流动性、降低膜胆固醇含量、抗炎等多方面均有一定功效[35]。国内外对于DHA的研究主要集中在DHA的抗癌活性上,而有关DHA免疫活性的研究相对较少。本实验以小鼠巨噬细胞RAW264.7为研究对象,研究DHA的体外免疫活性。
巨噬细胞是一种最具有典型性的效应细胞,能够参与机体的非特异性免疫以及特异性免疫。当巨噬细胞遭受到外来的抗原刺激之后,能够发挥其免疫效应,其本身的吞噬能力会自发提高,检测其吞噬能力对了解巨噬细胞的吞噬功能具有重要意义。MAPKs蛋白通路是参与细胞生长、增殖和分化等多种生理活动的重要信号通路。研究证实[36],DHA浓度为20 μmol/L时,能够抑制TNF-α介导的细胞信号调节激酶(ERK)1/2的灭活作用,同时显著降低TNF-α诱导的p38和ERK1/2的mRNA表达。
在本研究中,DHA作为一种人体必需的多不饱和脂肪酸,在较低质量浓度时(0~1 000 ng/mL),能够促进RAW264.7的细胞增殖和吞噬活性,并具有明显的浓度依赖关系。同时,DHA能够增强细胞中相关酶活力,可以一定程度上上调RAW264.7细胞中MAPKs家族中ERK1/2、p38和JNK的蛋白表达情况,使细胞处于激活状态,以上结果说明DHA可以激活RAW264.7细胞,增强机体的免疫防御能力。本研究结果证实了DHA具有一定的体外免疫调节活性。
参考文献:
[1] 曹万新, 孟橘, 田玉霞. DHA的生理功能及应用研究进展[J]. 中国油脂, 2011, 36(3): 1-4.
[2] NORDOY A, MARCHIOLO R, ARNESEN H, et al. n-3 Polyunsaturated fatty acids and cardiovascular diseases: to whom, how much, preparations[J]. Lipids, 2001, 36(Suppl 1): 127-129. DOI:10.1007/s11745-001-0695-7.
[3] 许友卿, 张海柱, 丁兆坤. 二十二碳六烯酸和二十碳五烯酸研究进展[J].生物学通报, 2007, 42(11): 13-15. DOI:10.3969/j.issn.0006-3193.2007.11.007.
[4] UMEMURA K, TOSHIMA Y, ASAI F, et al. Effect of dietary docosahexaenoic acid in the rat middle cerebral artery thrombosis model[J]. Thrombosis Research, 1995, 78(5): 379-387.DOI:10.1016/0049-3848(95)00071-X.
[5] VAN DE LAGEMAAT M, ROTTEVEEL J, MUSKIET F A J, et al.Post Term dietary-induced changes in DHA and AA status relate to gains in weight, length and head circumference in preterm infants[J].Prostaglandins, Leukotrienes & Essential Fatty Acids, 2011, 85(6): 311-316. DOI:10.1016/j.plefa.2011.09.005.
[6] HUFFMAN S L, HARIKA R K, EILANDER A, et al. Essential fats:how do the yaffect growth and development of infants and young children in developing countries? a literature review[J]. Maternal and Child Nutrition, 2011, 7(3): 44-65. DOI:10.1111/j.1740-8709.2011.00356.x.
[7] ENDRES S, GHORBANI R, KELLY V E, et al. The effect of dietary Supplementation with ω-3 polyunsaturated acids on the synthesis of interleukin-1and tumor necrosis factor by mononuclear cells[J]. New England Journal of Medicine, 1989, 320(5): 265-271. DOI:10.1056/NEJM198902023200501.
[8] COLAS S, MAHEO K, DENIS F, et al. Sensitization by dietary docosahexaenoic acid of rat mammary carcinoma to anthracycline: a role for tumor vascularization[J]. Clinical Cancer Research, 2006, 12(19):5879-5886. DOI:10.1158/1078-0432.CCR-06-0386.
[9] TIMMER-BOSSCHA H, HOSPERS G A P, MEIJER C, et al. Inぼuence of docosahexaenoic acid on cisplatin resistance in a human small cell lung carcinoma cell line[J]. Journal of the National Cancer Institute, 1989,81(14): 1069-1075. DOI:10.1093/jnci/81.14.1069.
[10] GLEISSMAN H, YANG R, MARTINOD K, et al. Docosahexaenoic acid metabolome in neural tumors: identification of cytotoxic intermediates[J]. The FASEB Journal, 2010, 24(3): 906-915.DOI:10.1096/fj.09-137919.
[11] 张徐宁, 戴翠萍. 二十二碳六烯酸抗癌作用的研究进展[J]. 亚太传统医药, 2010, 6(6): 165-168.
[12] LLORENTE A M, JENSEN C L, VOIGT R G, et al. Effect of maternal docosahexaenoic acid supplementation on postpartum depression and information processing[J]. American Journal of Obstetrics and Gynecology, 2003, 188(5): 1348-1353. DOI:10.1067/mob.2003.275.
[13] CALVIELLO G, DI NICUOLO F, SERINI S, et al. Docosahexaenoic acid enhances the susceptibility of human colorectal cancer cells to 5-ぼuorouracil[J]. Cancer Chemotherapy and Pharmacology, 2005, 55(1):12-20. DOI:10.1007/s00280-004-0846-6.
[14] 尤丽菊. DHA的药理作用[J]. 河南职工医学院学报, 2008, 20(6): 619-621. DOI:10.3969/j.issn.1008-9276.2008.06.048.
[15] 贺敏, 胡世伟, 吴胜强, 等. 高含量EPA/DHA甘油三酯型鱼油对小鼠的免疫调节作用[J]. 中国海洋药物, 2013, 32(4): 43-48.
[16] 彭颖, 李宗军. 菌物多糖对巨噬细胞和树突状细胞的免疫刺激作用及信号通路[J]. 食品科学, 2012, 33(15): 318-323.
[17] FISHMAN M, GUNTHER G. Induction of tumor cell resistance to macrophagemediated lysis by preexposure to non-activated macrophages[J]. Cellular Immunology,1986, 99(1): 241-256. DOI:10.1016/0008-8749(86)90232-7.
[18] BROWN F M. Urine cytology. It is still the gold standard for screening?[J]. Urologic Clinics of North America, 2000, 27(1): 25-37.DOI:10.1016/S0094-0143(05)70231-7.
[19] 丁彬, 陈姣, 史青, 等. 糖原染色在急性淋巴细胞白血病诊断中的临床意义研究[J]. 华西医学, 2013, 28(6): 902-904. DOI:10.7507/1002-0179.20130281.
[20] BIAN T H, WANG X F, LI X Y. Effects of morphine and naloxone on proliferation of lymphocyte in vitro[J]. Acta Pharmacologica Sinica, 1995, 16(4): 315-318.
[21] HOSTETTER S J. Neutrophil function in small animals[J]. Veterinary Clinics of North America Small Animal Practice, 2012, 42(1): 157-171.DOI:10.1016/j.cvsm.2011.09.010.
[22] 胡平, 吴耿伟, 夏青, 等. SOD模拟及其抗氧化和抗炎症功能的研究进展[J]. 化学进展, 2009, 21(5): 873-879.
[23] KITAMURA K, FUJIYOSHI K, YAMANE J, et al. Human hepatocyte growth factor promotes functional recovery in primates after spinal cord injury[J]. PLoS ONE, 2011, 6(11): e27706. DOI:10.1371/journal.pone.0027706.
[24] KOBAYASHI Y, OKADA Y, ITAKURA G, et al. Pre-evaluated safe human iPSC-derived neural stem cells promote functional recovery after spinal cord injury in common marmoset without tumorigenicity[J]. PLoS ONE, 2012, 7(12): e52787. DOI:10.1371/journal.pone.0052787.
[25] SUGA N, KATSUNO M, KOIKE H, et al. Schwann cell involvement in the peripheral neuropathy of spinocerebellar ataxia type 3[J].Neuropathology and Applied Neurobiology, 2014, 40(5): 628-639.DOI:10.1111/nan.12055.
[26] DAVIS R J. MAPKs: new JNK expands the group[J]. Trends in Biochemical Sciences, 1994, 19(11): 470-473. DOI:10.1016/0968-0004(94)90132-5.
[27] NISHIDA E, GOTOH Y. The MAP kinase cascade is essential for diverse signal transduction pathways[J]. Trends in Biochemical Sciences,1993, 18(4): 128-131. DOI:10.1016/0968-0004(93)90019-J.
[28] GEBOREK P, NILSSON E, BOLZONI F, et al. A survey of spinal collateral actions of feline ventral spinocerebellar tract neurons[J].European Journal of Neuroscience, 2013, 37(3): 380-392. DOI:10.1111/ejn.12060.
[29] WAN S C, FENG Z Z, CHEN Z X, et al. Neuroserpin upregulates in the early period of sustained spinal cord compression[J]. Clinical Laboratory, 2012, 58(9/10): 891-896. DOI:10.7754/Clin.Lab.2011.110527.
[30] BHAT N R, ZHANG P, LEE J C, et al. Extracellular signal-regulated kinase and p38 subgroups of mitogen-activated protein kinases regulate inducible nitric oxide synthase and tumor necrosis factor-alpha gene expression in endotoxin-stimulated primary glial cultures[J]. Journal of Neuroscience, 1998, 18(5): 1633-1641.
[31] DONG C, DAVIS R J, FLAVELL R A. MAP kinases in the immune response[J]. Annual Review of Immunology, 2002, 20(1): 55-72.DOI:10.1146/annurev.immunol.20.091301.131133.
[32] KARIN M, GALLAGHER E. From JNK to pay dirt: jun kinases, their biochemistry, physiology and clinical importance[J]. International Union of Biochemistry and Molecular Biology Life, 2005, 57(4/5): 283-295.DOI:10.1080/15216540500097111.
[33] AJIZIAN S J, ENGLISH B K, MEALS E A. Speciベc inhibitors of p38 and extracellular signal-regulated kinase mitogen-activated protein kinase pathways block inducible nitric oxide synthase and tumor necrosis factor accumulation in murine macrophages stimulated with lipopolysaccharide and interferon-gamma[J]. The Journal of Infectious Diseases, 1999,179(4): 939-944. DOI:10.1086/314659.
[34] CARTER A B, KNUDTSON K L, MONICK M M, et al. The p38 mitogen-activated protein kinase is required for NF-kappaB-dependent gene expression. the role of TATA-binding protein (TBP)[J]. The Journal of Biological Chemistry, 1999, 274(43): 30858-30863. DOI:10.1074/jbc.274.43.30858.
[35] GORIAO R, AZEVEDO-MARTINS A K, RODRIGUES H G,et al. Comparative effects of DHA and EPA on cell function[J].Pharmacology & Therapeutics, 2009, 122: 56-64. DOI:10.1016/j.pharmthera.2009.01.004.
[36] XUE H, WAN M F, SONG D S, et al. Eicosapentaenoic acid and docosahexaenoic acid modulate mitogen-activated protein kinase activity in endothelium[J]. Vascular Pharmacology, 2006, 44(6): 434-439.DOI:10.1016/j.vph.2006.02.005.