白扁豆又名扁豆,系豆科植物扁豆的成熟干燥种子,原产于印度、印度尼西亚等地,在汉、晋时期引入我国[1]。白扁豆营养价值高、味甘性温、生理活性强、作用范围广,其中碳水化合物含量高达57%[2],含有蛋白质、脂肪、微量的钙、磷、铁及多种维生素等重要的生理活性物质,对食欲低下、胸闷胃虚、醉酒呕吐等症状均具有良好的防治效果,在抗菌、抗肿瘤、抗氧化等方面均有重要的生理作用。从张广智等[3]的研究中发现,缺氧/复氧(anoxia/reoxygenation,A/R)除造成脑神经细胞死亡之外,还会造成细胞主动凋亡[4],此过程会受到相应基因的表达与调节[5]。为了研究这种作用,参考神经细胞的体内生存环境,提供适宜的生长条件,实际模拟脑部A/R过程[6],以建立大脑神经细胞A/R应激性损伤模型,根据A/R模型探究白扁豆多糖(dolichos bean seed polysaccharide,DBSP)对神经细胞损伤的保护机制[7]。相关研究证明细胞凋亡过程中相关基因的表达受DBSP提取物的影响,A/R损伤导致神经细胞凋亡受到抑制[8],因此DBSP对神经细胞的A/R应激性损伤具有保护作用。为进一步研究DBSP对神经细胞缺氧性凋亡的保护机制,通过培养原代胎鼠大脑皮层神经细胞[9],建立A/R模型,即先用含糖培养液培养神经细胞,在氮气、氧气以及二氧化碳培养箱中进行缺氧处理,最后灌注复氧[10],加入DBSP处理A/R损伤的胎鼠大脑皮层神经细胞,与正常对照组比较细胞活性以及凋亡水平,同时使用流式细胞仪检测相应乳酸脱氢酶(lactate dehydrogenase,LDH)、活性氧(reactive oxygen species,ROS)、线粒体膜电位及Ca2+相对浓度的变化,来探究DBSP对体外培养的A/R损伤神经细胞的保护机制[11],并根据阻断剂组(LY294002+DBSP+A/R)研究PI3K-Akt信号通路对DBSP的神经保护产生的介导作用。
1 材料与方法
1.1 动物、材料与试剂
清洁级SD大鼠6 只,体质量(200±20)g,购自江西中医药大学动物科技中心,生产许可证号:SCXK(赣)2006-0001,动物合格证号:SCXK(赣)2005-0001,雌雄比例以1∶2合笼,共2 笼,合笼后于每天早晨观察鼠况,若出现阴道栓则表明雌鼠受孕,孕16~18 d的胎鼠用作原代培养神经细胞。
DMEM 美国Thermo Fisher公司;特级马血清北京索莱宝科技有限公司;DBSP 中国科学院成都生物研究所;胎牛血清 杭州四季青生物工程有限公司;胰蛋白酶 美国Amresco公司;Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)试剂盒 美国BD公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 普博欣生物工程有限公司;Fluo-3/AM 美国Biotium公司。
1.2 仪器与设备
3111型二氧化碳培养箱 美国Thermo Fisher公司;090-135.001型倒置显微镜 德国Leica公司;EPICSXL型流式细胞仪、Allegra-64R型离心机 美国Beckman Coulter公司;YQX-2型厌氧培养箱 上海跃进医疗机器厂;DYY-8C型电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 胎鼠大脑皮层神经细胞原代培养
取受孕第16~18天的SD大鼠,用体积分数为10%的水合氯醛1.5 mL注入受孕大鼠的腹腔使其麻醉[12],再用乙醇消毒[13],用高压蒸汽消毒的眼科剪沿两耳连线剪开裂口,后以矢状缝纵向剪口,弯镊分离颅骨,沿颅缝T形剪口使大脑皮层暴露,取全脑置于预冷D-Hank’s液。在放大镜下,用显微剪和弯镊分离全脑中的大脑皮质并剪碎,收集大脑皮层约1 mm3的细小碎块,用质量浓度为1.25 mg/mL胰酶在37 ℃的条件下消化0.5 h左右,DMEM液终止消化,后用移液枪转入离心管,设置1 000 r/min离心5 min,弃上清液,沉淀出来的细胞加以重悬。以2×106cells/孔、2×105cells/孔接种于6 孔或 96 孔培养板中,差速贴壁培养4 h后[14],吸去培养基,加入NB培养液,继续培养,观察细胞生长状态,3 d后半量换液。
1.3.2 实验分组与处理方法
空白对照组:3 d细胞更换培养基后,于培养箱中再孵育2 d,在第5天加入复氧液,放置二氧化碳培养箱(37 ℃,5% CO2、95%空气)3 h,更换复氧液后继续培养2 h。
A/R组:建立A/R损伤模型,细胞更换培养基后,换上模拟缺氧液,缺氧密闭容器置换成以95% N2、5% CO2持续通气的环境(37 ℃),把细胞置于此缺氧密闭容器内3 h,处理结束后取出培养板,换上模拟复氧液,缺氧密闭容器置换成以95% O2、5% CO2持续通气的环境(37 ℃),把细胞置于此缺氧密闭容器内,复氧培养2 h[15]。
DBSP+A/R组:根据前期实验结果[16],本实验选择1.0 mg/mL作为DBSP的作用质量浓度,在缺氧处理前加入1.0 mg/mL DBSP,其他同A/R组且全程给予DBSP。
LY294002+DBSP+A/R组(LY+DBSP+A/R组):即在DBSP+A/R处理组中加入PI3K-Akt信号通路抑制剂LY294002(20 μmol/L)后,培养细胞0.5 h,其他与DBSP+A/R组相同。
1.3.3 检测指标
神经细胞活性检测:于96 孔培养板细胞中每孔加入20 μL 5 g/mL的MTT溶液,在5% CO2、37 ℃的细胞培养箱中孵育4 h后弃每孔的上清液[17],每孔加150 μL裂解液二甲基亚砜溶解,振荡10 min后于酶联免疫检测仪中测定490 nm波长处的各孔光密度值。细胞活性测定工作原理即一定细胞数范围内,MTT结晶的形成量与细胞数成正比,光密度值越大则细胞活性越强。
细胞LDH的测定:实验处理后各组分别取孵育液200 μL,送往南昌大学第一附属医院检验科检测,使用生化自动分析仪测定LDH。
细胞凋亡的测定:弃6 孔培养板培养上清液,用1.25 mg/mL胰酶进行消化[18],然后使用完全培养基终止消化,收集神经细胞于离心管,设置2 000 r/min离心5 min,弃培养液后收集沉淀,用磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤细胞2 次,加结合缓冲液100 μL进行悬浮,加入AnnexinV-FITC 5 μL标记,最后加入碘化丙啶(propidium iodide,PI)5 μL标记染色,混匀,在室温下进行避光反应10 min,再加入结合缓冲液400 μL,立即使用流式细胞仪进行检测。其中,在双变量流式细胞仪的散点图上[19],左上限(FITC-/PI+)对应机械损伤所致死亡的细胞,左下限(FITC-/PI-)对应活细胞,右上限(FITC+/PI+)对应晚期凋亡细胞[20],右下限对应早期凋亡细胞(FITC+/PI-),此实验数据采用右下限的早期凋亡细胞数据。
Ca2+相对浓度的测定:用20 μmol/L Fluo-3/AM分子探针来装载细胞,用标准Tyrode溶液在37 ℃条件下反应50 min,1 000×g离心收集细胞,10 mmol/L 4-羟乙基哌嗪乙磺酸重悬,上样,在流式细胞仪中检测[21],以Fluo-3/AM的荧光强度表示Ca2+相对浓度。
细胞ROS相对含量的测定:收集神经细胞(细胞数约2×106个),3 000 r/min离心10 min,PBS清洗2 次后以0.5 mL DCFH-DA溶液(20 µmol/L)重悬。37 ℃孵育20 min,3 000 r/min离心3 min,弃上清液,PBS洗2 次细胞,在流式细胞仪中检测细胞内2’,7’-二氯荧光素(2’,7’-dichlorofluorescein,DCF)的荧光强度[22],以DCF的荧光强度来表示细胞内ROS的相对含量,荧光强度越强表明ROS相对含量越高。
细胞线粒体膜电位的测定:收集神经细胞,调整细胞浓度为2×105~5×105mL-1,1 000×g离心5 min,100 μL PBS重悬细胞,加入Rho123储存液5 μL[23],37 ℃孵育30 min,1 000×g离心5 min,弃上清液,500 μL PBS洗涤2 次,重悬细胞后用FACScan进行流式细胞仪定量检测[24],设置一个阴性对照组即不加Rho123的细胞。流式细胞仪激发和发射波长分别为488 nm和530 nm,测定Rho123的荧光强度以表示线粒体膜电位。
Western blot法检测蛋白质量浓度:神经细胞弃去上清液,继而用预冷PBS除去残留的培养基;6 孔板以80 μL/孔添加细胞裂解液、60 mm培养皿以300 μL/块添加细胞裂解液(50 mmol/L Tris(pH 8.0)、150 mmol/L NaCl、1%(体积分数,下同)脱氧胆酸钠、0.1%十二烷基硫酸钠、1%乙基苯基聚乙二醇、1 mmol/L苯甲基 磺酰氟、10 μg/mL胰蛋白酶抑制剂、10 μg/mL亮抑酶酞)。4 ℃孵育20 min后,将细胞及其碎片连同裂解液集中一侧,继续4 ℃孵育40 min,4 ℃、12 000×g离心5 min;收集上清液,即为本实验制备的蛋白样本;将上清液一部分用来测蛋白质量浓度外,其余用于后续实验或置于-80 ℃冰箱储备。制备12%分离胶和5%积层胶,取等量蛋白上样,电泳。电泳结束后,电转移,取出聚偏二氟乙烯膜,封闭2 h,结合一抗:磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)(一抗稀释1 000 倍)和总蛋白激酶B(total protein kinase B,T-Akt)(一抗稀释300 倍),4 ℃过夜或室温平摇3 h。TBST缓冲液清洗膜上残余一抗。结合二抗:将二抗稀释2 000 倍后溶于封闭液中,室温平摇2 h后,用TBST缓冲液清洗膜上残余二抗;ECL检测、曝光、显影、定影[25]。
1.4 数据统计分析
本实验各组数据均以 表示,应用SPSS 11.5分析软件进行单因素方差分析,组间比较用LSD法,P<0.05为显著性差异,P<0.01为差异极显著。
表示,应用SPSS 11.5分析软件进行单因素方差分析,组间比较用LSD法,P<0.05为显著性差异,P<0.01为差异极显著。
2 结果与分析
2.1 DBSP对神经细胞活力的影响
表1 DBSP对神经细胞活力的影响
Table 1 Effect of DBSP on the viability of neurons
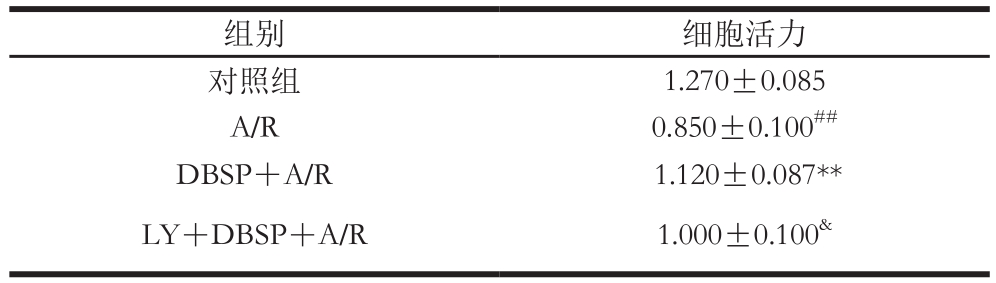
注:##.与对照组相比差异极显著(P<0.01);**.与A/R组相比差异极显著(P<0.01);&.与DBSP+A/R组相比差异显著(P<0.05)。下同。
如表1所示,与对照组相比,A/R组中神经细胞活力由1.270下降到0.850,极显著下降,表明神经细胞A/R损伤明显。与A/R组相比,DBSP+A/R中神经细胞活力由0.850
上升到1.120,极显著增加,表明DBSP对神经细胞A/R损伤具有明显的保护作用。
2.2 DBSP对神经细胞LDH释放的影响
表2 DBSP对神经细胞LDH释放的影响
Table 2 Effect of DBSP on the release of LDH from nerve cells

如表2所示,与对照组相比,A/R组中LDH的释放由17.21 U/L上升到27.52 U/L,极显著增加,表明神经细胞损伤。与A/R组相比,DBSP+A/R组中LDH的释放水平由27.52 U/L下降到17.33 U/L,极显著下降,表明DBSP对受A/R损伤的神经细胞具有保护作用。
2.3 DBSP对神经细胞Ca2+相对浓度的影响
如图1所示,与对照组相比,A/R组中神经细胞Ca2+相对浓度由19.30上升到194.91,极显著增加。而DBSP+A/R组与A/R组相比,细胞中的Ca2+相对浓度由194.91下降至22.37,极显著降低,表明DBSP可抑制A/R介导的Ca2+相对浓度增加。
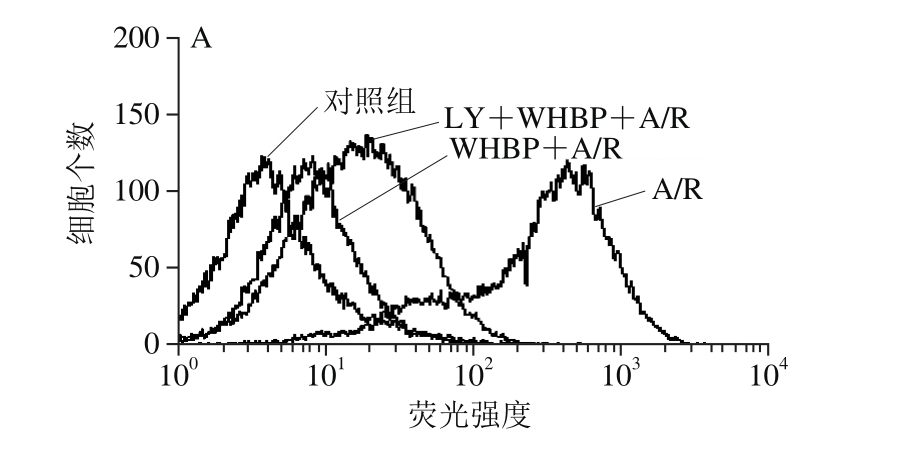
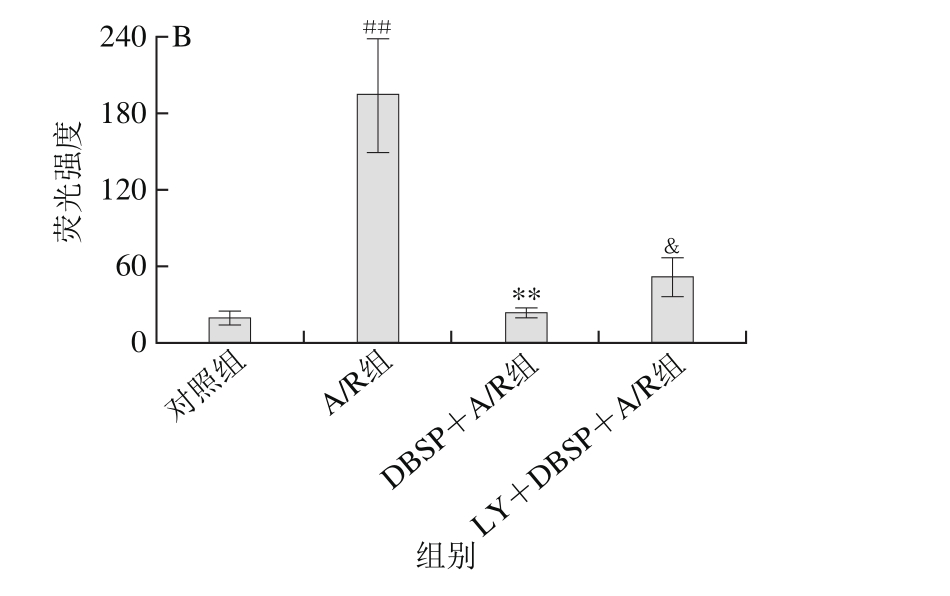
图1 DBSP对神经细胞Ca2+相对浓度的影响
Fig. 1 Effect of DBSP on neuronal Ca2+relative concentration
##.与对照组相比差异极显著(P<0.01);**.与A/R组相比差异极显著(P<0.01);&.与DBSP+A/R组相比差异显著(P<0.05)。下同。
2.4 DBSP对神经细胞凋亡的影响
DBSP对神经细胞凋亡影响如图2所示,与对照组相比,A/R组中细胞凋亡率由5.03%增至46.68%,细胞凋亡率极显著增加,表明A/R可促进神经细胞的凋亡。而与A/R组相比,DBSP+A/R组细胞凋亡率由46.68%下降至18.17%,表明DBSP处理神经细胞后,A/R介导的细胞凋亡显著减少。
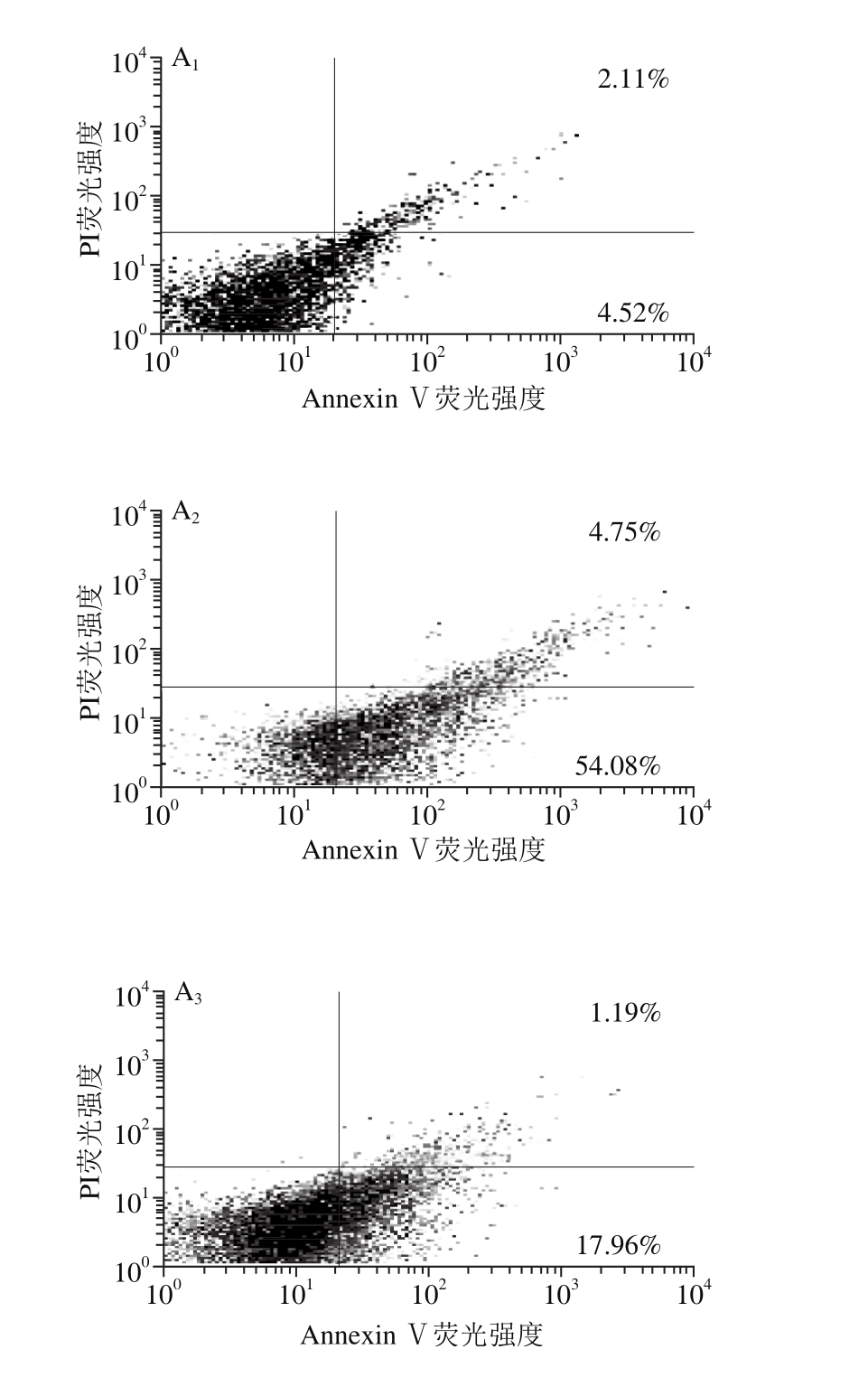
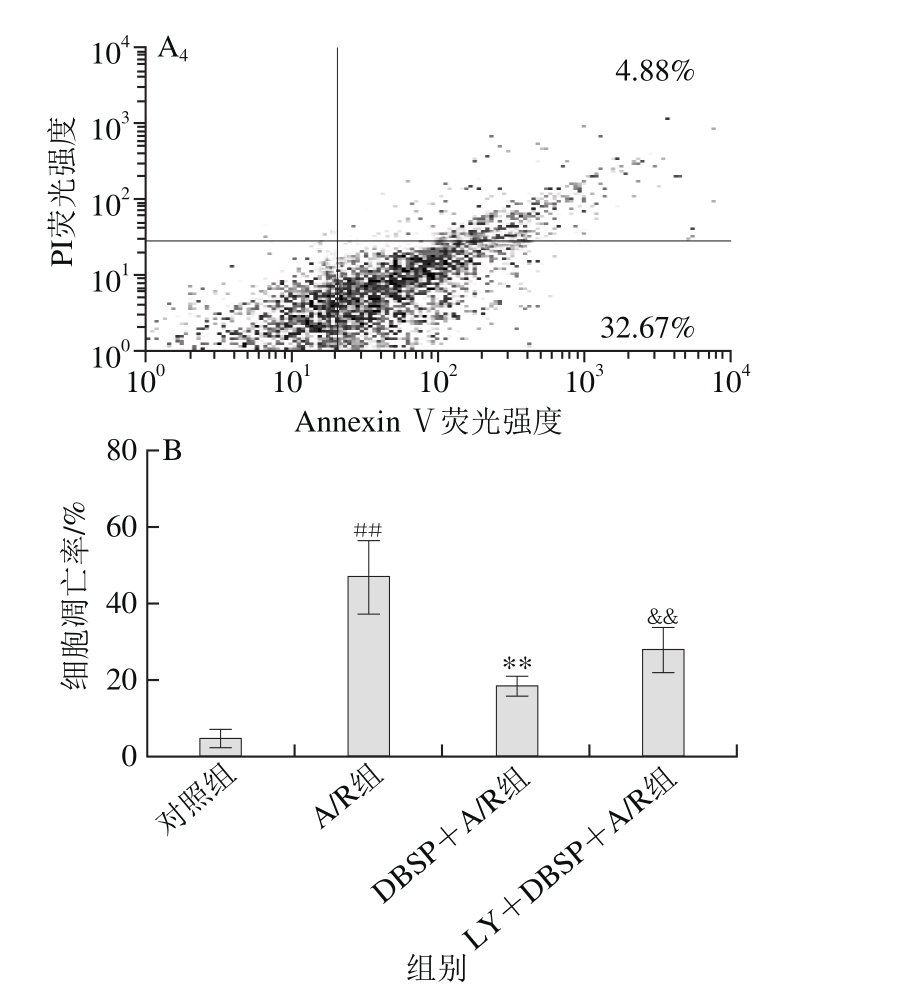
图2 各实验分组对神经细胞凋亡的影响
Fig. 2 Effect of DBSP on neuronal apoptosis
A1~A4.分别为对照组、A/R组、DBSP+A/R组、LY+DBSP+A/P组细胞凋亡流式图;B.细胞凋亡率柱状图。&&.与DBSP+A/R组相比差异极显著(P<0.01)。下同。
2.5 DBSP对神经细胞ROS相对含量的影响

图3 各实验组对胎鼠神经细胞ROS相对含量的影响
Fig. 3 Effect of DBSP on ROS of nerve cells from fetal rats
如图3所示,与对照组相比,A/R组中神经细胞ROS相对含量由94.69上升至154.88,极显著增加,而DBSP+A/R组与A/R组相比,细胞中的ROS相对含量由154.88下降至110.76,极明显减少,表明DBSP可抑制A/R介导的神经细胞ROS相对含量的增加。
2.6 DBSP对神经细胞线粒体膜电位的影响
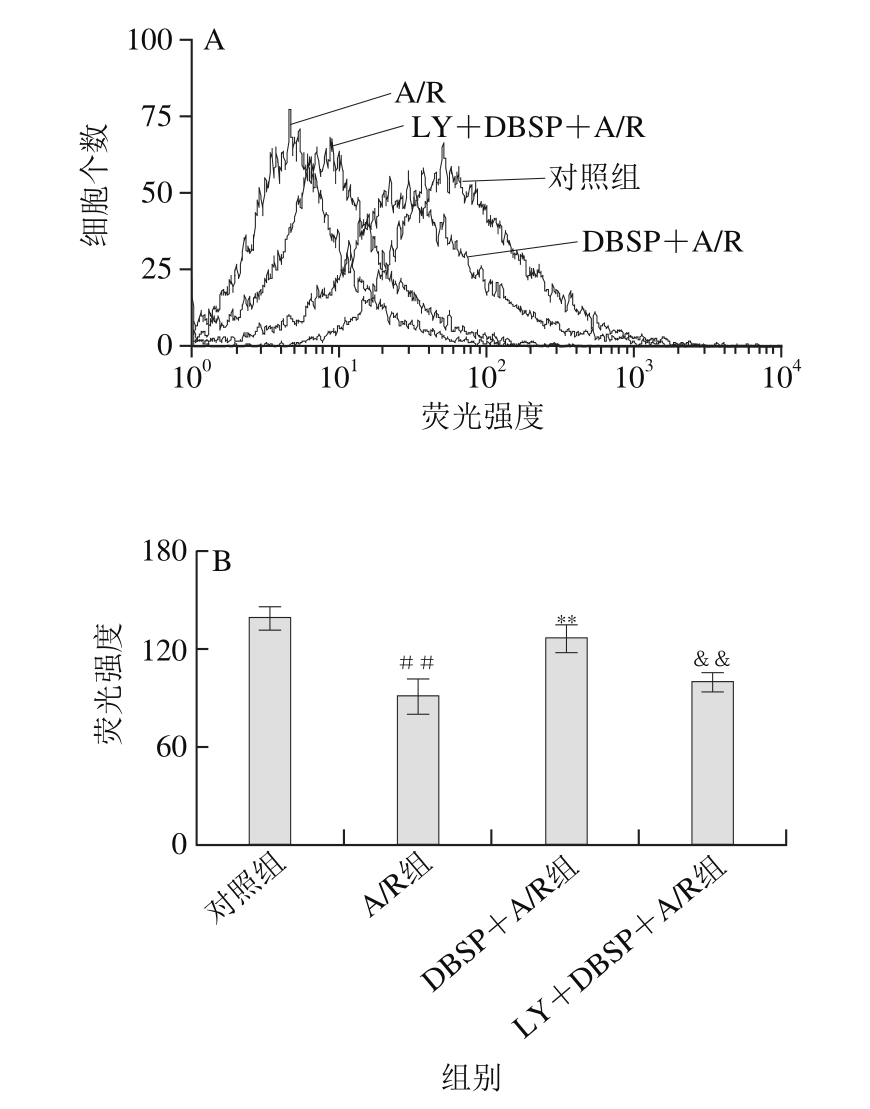
图4 各实验分组对胎鼠神经细胞线粒体膜电位的影响
Fig. 4 Effect of DBSP on mitochondrial membrane potential in nerve cells from fetal rats
A. Rho123荧光强度曲线图;B. Rho123荧光强度柱状图。
如图4所示,与对照组相比,A/R组中神经细胞的线粒体膜电位由138.81下降至91.73,极明显降低,表明神经细胞受A/R损伤,与A/R组相比,DBSP+A/R组中线粒体膜电位由91.73上升至126.84,极显著增加。结果表明DBSP对A/R介导的神经细胞损伤具有保护作用。
2.7 DBSP对神经细胞中T-Akt和p-Akt的蛋白表达影响
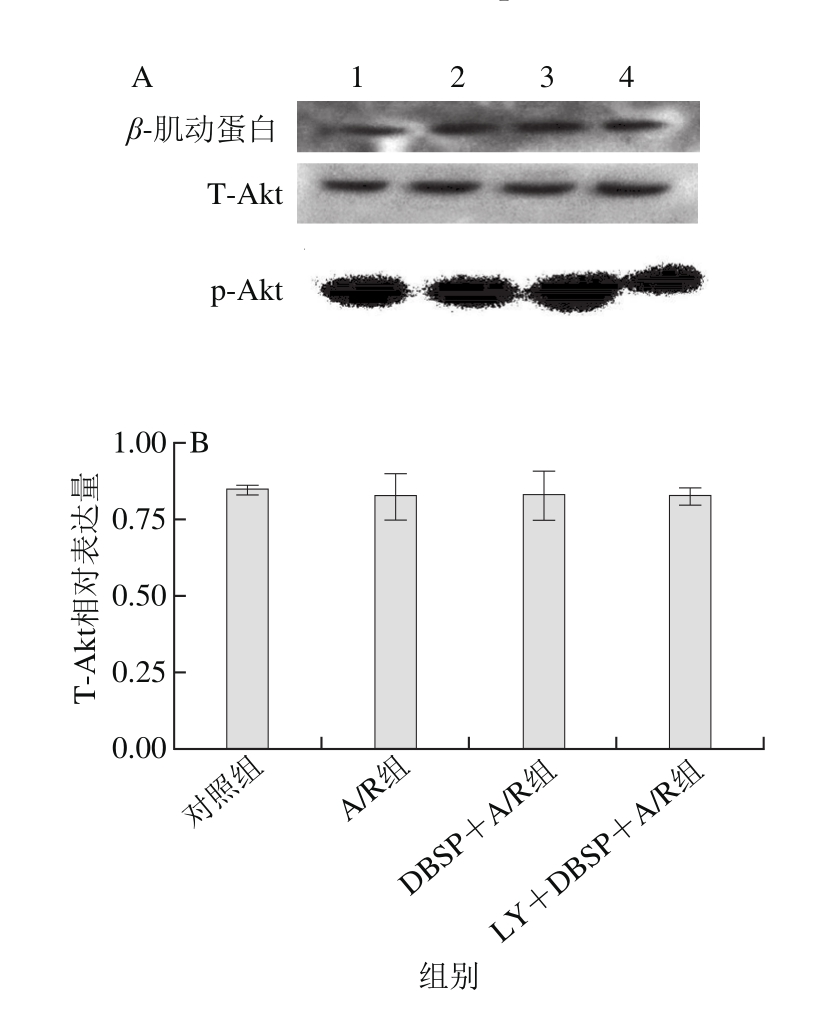

图5 DBSP对神经细胞中T-Akt和p-Akt的蛋白表达影响
Fig. 5 Effect of DBSP on the expression of T-Akt and p-Akt protein in nerve cells
A. p-Akt和T-Akt蛋白印记图;B. T-Akt柱状统计图;C. p-Akt柱状统计图;图A中1~4.分别为对照组、A/R组、DBSP+A/R组、LY+DBSP+A/P组。
应用PI3K-Akt信号通路抑制剂LY294002,研究神经细胞中p-Akt和T-Akt的蛋白表达。结果如图5所示,与对照组相比,各组之间T-Akt的蛋白表达无显著差异(P>0.05)。神经细胞经DBSP处理后,与A/R组相比,p-Akt蛋白表达上调,给予PI3K-Akt信号转导通路阻断剂LY294002后抑制了DBSP介导的p-Akt蛋白表达。
3 讨 论
神经细胞是组成神经系统的基本功能单位,脑部血流正常供应才能保障其正常代谢活动,当脑缺血时,神经细胞将发生坏死和凋亡[26]。由于大脑皮层神经细胞对缺氧复氧环境敏感,本研究通过体外培养胎鼠大脑皮层神经细胞,模拟体内环境,来探究外源物质DBSP对胎鼠神经细胞的保护作用及机制。选取培养时间为16~18 d胎鼠大脑皮层神经细胞作为原代培养的神经细胞建立A/R损伤模型。
实验发现,A/R处理大脑皮层神经细胞后,其细胞活性降低,神经细胞凋亡增加,LDH和ROS释放量增加,表明A/R导致了神经细胞损伤。给予A/R损伤的神经细胞DBSP后,能抑制神经细胞的凋亡和LDH、ROS的释放,提高了神经细胞的存活率,表明DBSP对神经细胞具有保护作用。
研究表明,细胞凋亡过程中,先出现线粒体膜电位的下降,再发生胞膜磷脂酰丝氨酸由内而外的转变,导致某些细胞形态发生改变,半胱氨酸天冬氨酸蛋白酶-3被激活等变化。线粒体膜电位的下降可作为细胞凋亡的早期表现,且当发生膜电位下降时,细胞凋亡不可逆转,因此线粒体膜电位下降也是细胞凋亡的特征表现。当发生A/R诱导时,线粒体通透性发生改变[27],非特异性增加,基质内流入大量具有负电荷的蛋白质,内膜两侧离子梯度发生改变,线粒体膜电位崩溃,引起线粒体内大量的正离子如Ca2+外流等一系列变化,导致细胞凋亡。本实验中利用流式细胞仪来检测Rho123的荧光强度,定量神经细胞线粒体膜电位变化[28]。实验结果显示,A/R组线粒体膜电位极显著降低(P<0.01),促进细胞凋亡,DBSP能抑制A/R介导的线粒体膜电位下降。与对照组相比,A/R组中神经细胞Ca2+相对浓度由19.30上升到194.91,极显著增加(P<0.01),表明A/R介导的神经细胞损伤与Ca2+相对浓度的大量增加有关,而DBSP+A/R组与A/R组相比,细胞中的Ca2+相对浓度由194.91下降至22.37,极显著降低(P<0.01),表明DBSP可显著抑制A/R介导的Ca2+相对浓度增加,促进内环境稳定,对神经细胞产生保护作用。
研究表明,PI3K-Akt信号通路是细胞内重要的信号转导通路[29],该通路的激活在细胞最终存活中起关键性作用。既有抗细胞凋亡作用,又可以促进细胞凋亡,其中以抗细胞凋亡为主[30]。根据LY294002对PI3-Akt信号转导通路的抑制作用,实验中使用LY294002处理神经细胞,与DBSP+A/R组相比,LY+DBSP+A/R组细胞活性以及线粒体膜电位显著降低,细胞凋亡率显著升高,LDH释放水平、ROS相对含量、Ca2+相对浓度均显著升高(P<0.05),表明受到LY294002的阻断作用,DBSP+A/R预处理组对神经细胞产生的保护作用被削弱,实验证明DBSP+A/R预处理组转导PI3K-Akt信号通路对受A/R损伤的神经细胞具有保护作用。
综上讨论可知,DBSP可显著抑制A/R介导的神经细胞损伤,导致LDH的释放水平、ROS相对含量、Ca2+相对浓度和细胞凋亡降低,线粒体膜电位和细胞活性显著增加,即DBSP对A/R损伤的神经细胞具有保护作用。通过PI3K-Akt通路抑制剂LY294002阻断DBSP对神经细胞保护作用得出,PI3K-Akt信号通路介导了DBSP的神经保护作用。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2010: 101.
[2] 郑琳, 赵海泉. 白扁豆淀粉性质的研究[J]. 安徽农业大学学报, 2010,37(2): 214-217. DOI:10.13610/j.cnki.1672-352x.2010.02.007.
[3] 张广智, 胡长敏, 陈颖钰, 等. 细胞凋亡的主要检测方法研究进展[J]. 动物医学进展, 2011, 32(8): 89-92. DOI:10.3969/j.issn.1007-5038.2011.08.020.
[4] EKSHYYAN O, AW T Y.Apoptosis: a key in neurodegenerative disorders[J]. Current Neurovascular Research, 2004, 1(4): 355-371.DOI:10.2174/1567202043362018.
[5] 占今舜, 邢月腾, 张彬. 细胞培养技术的应用研究进展[J]. 饲料博览,2013(1): 8-11. DOI:10.3969/j.issn.1001-0084.2013.01.003.
[6] 杜毓菁, 徐一心, 王紫璇, 等. 细胞缺氧/复氧模型的建立方法与应用[J]. 南昌大学学报(医学版), 2015(2): 88-91. DOI:10.13764/j.cnki.ncdm.2015.02.024.
[7] 杨华, 叶发银, 赵国华. 膳食多酚与肠道微生物相互作用研究进展[J]. 食品科学, 2015, 36(3): 223-227. DOI:10.7506/spkx1002-6630-201503043.
[8] CHEN L J, CHEN M L, DU J, et al. Hyperglycemia attenuates remifentanil postconditioning-induced cardioprotection against hypoxia/reoxygenation injury in H9c2 cardiomyoblasts[J]. Journal of Surgical Research, 2016, 203(2): 483-490. DOI:10.1016/j.jss.2016.03.052.
[9] SUTHERLAND L M, HEMSLEY K M, HOPWOOD J J. Primary culture of neural cells isolated from the cerebellum of newborn and adult mucopolysaccharidosis type ⅢA mice[J]. Cellular and Molecular Neurobiology, 2008, 28(7): 949-959.
[10] CHEN Jiesi, LENG Tiandong, CHEN Wenli, et al. A synthetic steroid 5 α-androst-3β,5,6β-triol blocks hypoxia/reoxygenation-induced neuronal injuries via protection of mitochondrial function[J]. Seteroids, 2013,78(10): 996-1002. DOI:10.1016/j.steroids.2013.06.004.
[11] CHUNG L D, NG Y C. Age-related alterations in expression of apoptosis regulatory proteins and heat shock proteins in rat skeletal muscle[J]. Biochimica et Biophysica Acta, 2006, 1762(1): 103-109.DOI:/10.1016/j.bbadis.2005.08.003.
[12] 姚于飞, 胡国柱, 高幼奇, 等. 白扁豆多糖抗神经细胞缺氧性坏死与凋亡[J]. 中药药理与临床, 2012, 28(3): 58-62. DOI:10.13412/j.cnki.zyyl.2012.03.043.
[13] POTTER S M, DEMARSE T B. A new approach to neural cell culture for long-term studies[J]. Journal of Neuroscience Methods, 2001,110(1/2): 17-24. DOI:10.1016/S0165-0270(01)00412-5.
[14] JACCARD N, GRIFFIN L D, KESER A, et al. Automated method for the rapid and precise estimation of adherent cell culture characteristics from phase contrast microscopy images[J]. Biotechnology and Bioengineering, 2014, 111(3): 504-517. DOI:10.1002/bit.25115.
[15] KOYAMA T, TEMMA K, AKERA T. Reperfusion-induced contracture develops with a decrasing [Ca2+]iin single heart cells[J]. The American Journal of Physiology, 1991, 261: H1115-H1122.
[16] 姚于飞. 白扁豆多糖对体外培养的胎鼠大脑皮层神经细胞缺氧性凋亡的保护性研究[D]. 南昌: 南昌大学, 2011: 14-31.
[17] 熊建文, 肖化, 张镇西. MTT法和CCK-8法检测细胞活性之测试条件比较[J]. 激光生物学报, 2007, 16(5): 559-562. DOI:10.3969/j.issn.1007-7146.2007.05.008.
[18] 孙建平, 谭竹钧, 韩雅莉. 细胞凋亡检测方法的研究进展[J]. 生物技术通报, 2012(1): 54-59. DOI:10.13560/j.cnki.biotech.bull.1985.2012.01.008.
[19] SAEYS Y, VAN GASSEN S, LAMBRECHT B N. Computational flow cytometry: helping to make sense of high-dimensional immunology data[J]. Nature Reviews Immunology, 2016, 16(7): 449-462.
[20] 陈昭华, 卢珍华, 张希春, 等. 食品中丙烯酰胺致小鼠睾丸生殖细胞凋亡的研究[J]. 食品科学, 2006, 27(11): 510-512. DOI:10.3321/j.issn:1002-6630.2006.11.127.
[21] 赵凤命, 张谈顺, 王仲兵, 等. 钙离子与细胞凋亡[J]. 中国动物检疫,2012, 29(2): 67-71. DOI:10.3969/j.issn.1005-944X.2012.02.033.
[22] LIU P, LIN Y L, TANG X Y, et al. Helix B surface peptide protects cardiomyocytes against hypoxia/reoxygenation-induced apoptosis through mitochondrial pathways[J]. Journal of Cardiovascular Pharmacology, 2016,67(5): 418-426. DOI:10.1097/FJC.0000000000000367.
[23] CHEN C M, WU C T, YANG T H, et al. Green tea catechin prevents hypoxia/reperfusion-evoked oxidative stress-regulated autophagyactivated apoptosis and cell death in microglial cells[J]. Journal of Agricultural and Food Chemistry, 2016, 64(20): 4078-4085. DOI:10.1021/acs.jafc.6b01513.
[24] ZHANG W F, XIONG Y W, ZHU T T, et al. MicroRNA let-7g inhibited hypoxia-induced proliferation of PASMCs via G0/G1 cell cycle arrest by targeting c-myc[J]. Life Sciences, 2017, 170: 9-15. DOI:10.1016/j.lfs.2016.11.020.
[25] HAO X P, WILLIS J E, PRETLOW T G, et al. Loss of fragile histidine triad expression in colorectal carcinomas and premaligant lesions[J].Cancer Research, 2000, 60(1): 18-21.
[26] 贺靖澜, 王冉, 申娜, 等. 自噬对氧化应激引起的脊髓神经元细胞损伤的作用及其机制[J]. 中国细胞生物学学报, 2017, 39(4): 440-447.
[27] 马淇, 刘垒, 陈佺. 活性氧、线粒体通透性转换与细胞凋亡[J]. 生物物理学报, 2012, 28(7): 523-536.
[28] RYOU M G, CHOUDHURY G R, LI W, et al. Methylene blueinduced neuronal protective mechanism against hypoxia-reoxygenation stress[J]. Neuroscience, 2015, 301: 193-203. DOI:10.1016/j.neuroscience.2015.05.064.
[29] VARA J Á F, CASADO E, DE CASTRO J, et al. PI3K/Akt signalling pathway and cancer[J]. Cancer Treatment Reviews, 2004, 30(2): 193-204.DOI:10.1016/j.ctrv.2003.07.007.
[30] COIMBRA-COSTA D, ALVA N, DURAN M, et al. Oxidative stress and apoptosis after acute respiratory hypoxia and reoxygenation in rat brain[J]. Redox Biology, 2017, 12: 216-225. DOI:10.1016/j.redox.2017.02.014.