甘蓝是十字花科芸薹属植物[1],富含VC、VK和多酚化合物等大量的营养成分及对健康有益的次生代谢产物[2],与胡萝卜、花椰菜并称为“防癌三剑客”[3-4]。紫甘蓝是甘蓝种中的一个变种,由于富含花青素而呈紫色。近年来,鲜切蔬菜被人们称为新世纪革命的新生食品,国外一般称作最少加工蔬菜,又称为半加工蔬菜、调理蔬菜、轻度加工蔬菜或切分蔬菜[5]。对于鲜切紫甘蓝,国内外的食用方法主要是将其制成方便、安全的沙拉[6],并由于其独特的紫色,可用于什锦沙拉中增加感官品质。但鲜切产品在具有方便性和可食性的同时却破坏了组织的完整性,扰乱了正常的生理代谢过程[7],例如,鲜切处理会产生大量活性氧分子,对植物造成氧化伤害和代谢紊乱,加速植物的衰老进程等。
异硫氰酸烯丙酯(allyl isothiocyanate,AITC)天然存在于十字花科植物中[8-9],其提取物是一种无色至淡黄色油状液体,高浓度下具有强烈的挥发性,有刺激性芥子气味,常用于制备食品添加剂、医药、杀虫剂、杀菌剂等[8,10],GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[11]将AITC列为香料范畴。作为一种广受关注的食品防腐剂,美国食品药品监督管理局将AITC的安全性等级列为一般公认安全级[10],其对食品中常见腐败菌、致病菌都具有很强的杀灭作用[10],可以抵抗大肠杆菌(Escherichia coli)、鼠伤寒沙门氏菌(Salmonella typhimurium)、绿脓假单胞菌(Pseudomonas aeruginosa)以及其他病原菌[12-14]。根据流行病学资料显示,十字花科蔬菜中的AITC及异硫氰酸盐对啮齿类动物肝癌、乳腺癌、肺癌、食道癌以及前胃癌有明显的阻断作用[15-16],不但可以激活许多抗氧化酶或者非酶蛋白,防止发生氧化性紧张性刺激[17],还会直接烷基化或清除掉硫醇,起到提高抗氧化能力等作用[18]。近年来关于AITC用于果蔬保鲜中的研究报道较多[19-21],但AITC处理用于鲜切果蔬中的报道甚少。本实验系统研究了AITC熏蒸处理对鲜切紫甘蓝的呼吸代谢、生理品质及自身防御系统相关指标的影响,旨在探索最适的AITC处理方法及内在机理,为鲜切果蔬品质的提升提供理论参考。
1 材料与方法
1.1 材料与试剂
聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、邻苯二酚、浓盐酸、磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·2H2O)、愈创木酚、体积分数30%H2O2、硼砂(Na2B4O7·10H2O)、硼酸(H2BO3)、L-苯丙氨酸、甲醇 天津科密欧化学试剂有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、还原型谷胱甘肽(glutathione,GSH)试剂盒、总抗氧化能力试剂盒、羟自由基清除能力试剂盒 苏州科铭生物技术有限公司。
1.2 仪器与设备
CR400/CR410型色差计 日本Konica Minolta公司;UV-9200紫外-可见分光光度计 北京瑞利分析仪器有限公司;AL240电子精密天平 瑞士Mettler-Toledo公司;DK-S26恒温水浴锅、DHG-9053A电热恒温鼓风干燥箱上海精宏实验设备有限公司;TGL-20M高速台式冷冻离心机 湖南湘仪离心机仪器有限公司;T-25匀浆机德国IKA公司;LC-20AB型高效液相色谱仪 日本岛津公司;酶标仪 美国Thermo Scientiベc公司。
1.3 方法
1.3.1 样品处理
紫甘蓝购买于大连开发区乐购超市,挑选大小合适、颜色正常、新鲜度高的紫甘蓝,取其外层第3~7片叶片为实验材料,将实验材料与切割用的菜刀菜板均放在体积分数2%的次氯酸钠溶液中浸泡10 min,取出后双蒸水冲洗2~3 次并沥干,然后用已消毒的菜刀菜板去除紫甘蓝主脉和叶片基部1/4部分后,将叶片从中间切开,再切成0.5 cm×5 cm细丝。每处理组随机取1 kg鲜切紫甘蓝置于体积为6 L的玻璃干燥器中,用微量取样器将挥发性化合物AITC注射在一张滤纸上,并将滤纸贴附在玻璃干燥器的内部。在20 ℃下,分别用添加量为0、5、10 µL/L的AITC密闭熏蒸16 h,每组处理重复3 次。熏蒸完毕,打开玻璃干燥器盖子通风1 h。将鲜切紫甘蓝用托盘保鲜盒进行分装,并用线型低密度聚乙烯保鲜膜包装(200 g/盒),后于4 ℃贮藏,分别于第0、2、4、6、8天时测定相关指标。8 d后,对照组和10 µL/L AITC处理组的鲜切紫甘蓝感官上褐变和失水较严重(切口部位尤为严重),10 µL/L AITC处理组的鲜切紫甘蓝局部还出现了软化腐烂现象,因此不适宜做商品,结束实验。
1.3.2 色泽及生理代谢指标的测定
色泽的测定采用色差计测定样品表面的L值和a值,每处理组重复10 次。选取紫甘蓝叶片主脉右侧中部组织专用于色泽的测定,测定色泽时将相邻的细丝拼接在一起进行测定,将用于色泽测定的样品及部位做好标记,贮藏过程中始终作为色泽测定的对象。
质量损失率采用公式(1)进行计算。
式中:m0表示样品初始质量/g;mn表示第n天的质量/g。
呼吸强度的测定参照姜爱丽等[22]的方法。
1.3.3 相关酶活力的测定
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力和苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)活力的测定参照姜爱丽等[22]的方法。过氧化物酶(peroxidase,POD)活力和过氧化氢酶(catalase,CAT)活力的测定分别参照Wang Yousheng[23]和Pasquariello[24]等的方法。酶活力单位均以每克鲜质量每分钟内吸光度变化量来表示,计作U,其中APX和PAL的测定波长为290 nm,POD活力的测定波长为460 nm,CAT活力的测定波长为240 nm。重复测定3 次。
1.3.4 抗氧化物质含量的测定
总酚含量的测定参照曹建康等[25]的方法并加以修改。取样品1.0 g,加入少许体积分数为1%的盐酸-甲醇溶液,冰浴匀浆后,再用上述盐酸-甲醇溶液定容到20 mL,混匀后置于4 ℃条件下避光提取20 min,期间摇动数次后过滤,收集滤液待用。以上述盐酸-甲醇溶液作参比,280 nm波长处测定滤液的吸光度,重复3 次。样品定量采用外标法,以没食子酸(gallic acid,GA)为标准品,准确称取0.017 2 g的GA,用上述盐酸-甲醇溶液溶解配制成1 mmol/L的母液,再依次稀释为0.2、0.4、0.6、0.8、1.0 mmol/L,并绘制标准曲线,回归方程为y=0.865x+0.020 5(R2=0.995 5)。样品的总酚含量用每克果蔬组织相当于GA的物质的量表示,单位为mmol GA/g。
由于鲜切紫甘蓝提取液呈红色,VC含量测定若采用常规的2,6-二氯酚靛酚滴定法无法判断滴定终点,因此参照张宪政[26]的钼酸铵显色法进行VC含量的测定,单位为mg/100 g。
总花色苷的提取采用Lohachoompol等[27]的方法。将样品在5 ℃条件下用匀浆机混匀,精确称取20 g匀浆液,用75 mL甲醇-水-醋酸溶液(25∶24∶1,V/V)提取,15 ℃、15 000×g离心15 min,收集上清液,重复提取2 次。合并2 次提取的上清液在35 ℃条件下真空蒸发,得到的残渣用5 mL、体积分数3%甲酸的水溶液溶解,再用C18Sep-Pak cartridge柱纯化。得到的花色苷在35 ℃下真空蒸干,残渣再用1.0 mL甲醇-3%甲酸溶液(3∶17,V/V)溶解。取10 μL样品注入带有二极管阵列检测器的LC-20AB型高效液相色谱仪中进行分析。色谱条件参见姜爱丽等[28]的方法。标准样品为矢车菊-3-O-葡萄糖苷(cyanidin-3-O-glucoside chloride,CGC),单位为mg CGC/g。
GSH含量参照GSH试剂盒说明书测定。
1.3.5 抗氧化能力的测定
羟自由基清除率和总抗氧化能力的测定分别参照羟自由基清除能力测试盒和总抗氧化能力测试盒说明书的方法。
1.4 数据统计分析
数据处理采用Excel 2013软件,所有的数据用 表示,利用SPSS 20.0软件对数据进行最小差异显著性(LSD)分析,并使用皮尔森积差相关法分析参数间的相关性,主成分分析(principal component analysis,PCA)参照武松等[29]的方法,PCA中的综合得分参照邵明灿等[30]的方法。
表示,利用SPSS 20.0软件对数据进行最小差异显著性(LSD)分析,并使用皮尔森积差相关法分析参数间的相关性,主成分分析(principal component analysis,PCA)参照武松等[29]的方法,PCA中的综合得分参照邵明灿等[30]的方法。
2 结果与分析
2.1 AITC处理对鲜切紫甘蓝生理品质的影响
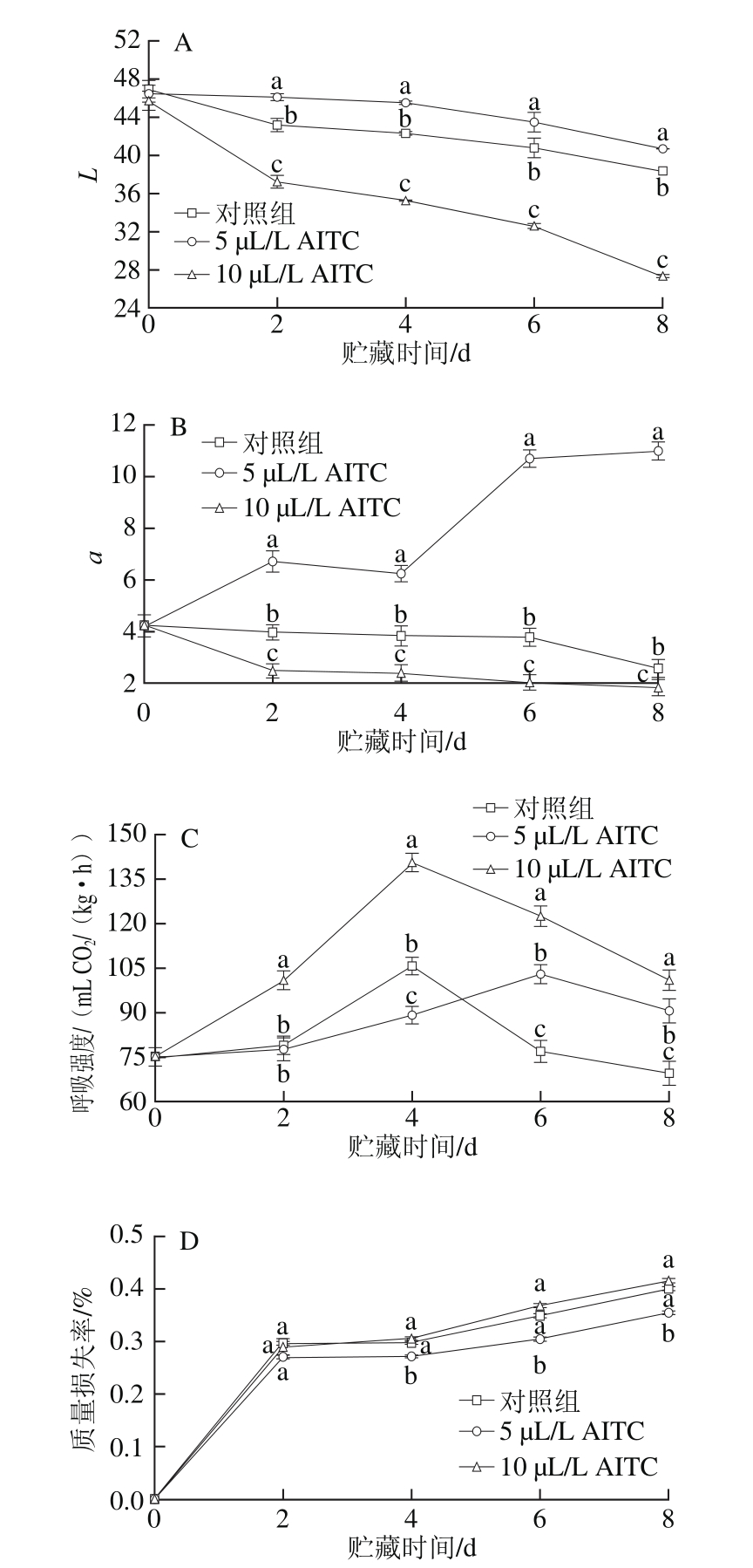
图1 AITC处理对鲜切紫甘蓝L值(A)、a值(B)、呼吸强度(C)和质量损失率(D)的影响
Fig. 1 Effect of AITC treatment at different concentrations on L value (A),a value (B), respiration intensity (C) and weight loss percentage (D) of fresh-cut purple cabbage
L值表示样品的明暗程度,L值越大说明色泽越鲜亮。如图1A所示,贮藏期间所有样品的L值均逐渐降低,相同贮藏时间,5 µL/L AITC处理组的L值始终高于对照组和10 µL/L AITC处理组,且与10 µL/L AITC处理组间差异达显著性水平(P<0.05),说明5 µL/L AITC处理更有利于保持鲜切紫甘蓝的原有色泽和亮度,而10 µL/L AITC处理则加快了鲜切紫甘蓝亮度的下降。
a值代表红色(正值)和绿色(负值),5 µL/L AITC处理使鲜切紫甘蓝的红色增加,表现为a值呈先缓慢上升后迅速上升趋势(图1B),而对照组和10 µL/L AITC处理组的a值则呈逐渐下降趋势,且以10 µL/L AITC处理组的a值下降速率最快。相同贮藏时间3 种处理组的a值间均差异显著(P<0.05)。
呼吸强度是反映果蔬采后生理代谢速率最重要的指标,由图1C可知,鲜切紫甘蓝的呼吸强度随贮藏时间呈先上升后下降趋势,对照组和10 µL/L AITC处理组均在第4天即达到呼吸高峰,而5 µL/L AITC处理有效地延缓了呼吸高峰的到来,在第6天时出现呼吸高峰。10 µL/L AITC处理则加快了呼吸速率,从而加速了鲜切紫甘蓝的衰老进程,表现为在整个贮藏过程中呼吸强度始终显著高于对照组和5 µL/L AITC处理组(P<0.05)。可见,5 µL/L AITC处理更有利于抑制呼吸速率。
紫甘蓝经过鲜切加工后,会增加失水面积,导致蒸腾失水加重,所有样品在贮藏期间的质量损失率均呈先迅速上升后缓慢上升趋势(图1D),相比之下5 µL/L AITC处理组的质量损失率上升较缓慢,并在第4、6、8天时与其他两组相比差异达显著性水平(P<0.05)。10 µL/L AITC处理组的质量损失率高于5 µL/L AITC处理组,但与对照组差异不显著(P>0.05)。实验结束时(第8天),对照组和10 µL/L AITC处理组的鲜切紫甘蓝切口部位褐变程度较重,尤其是10 µL/L AITC处理组,局部还出现了软化现象,而5 µL/L AITC处理的鲜切紫甘蓝外观品质与0 d时相比基本无变化。
2.2 AITC处理对鲜切紫甘蓝相关酶活力的影响
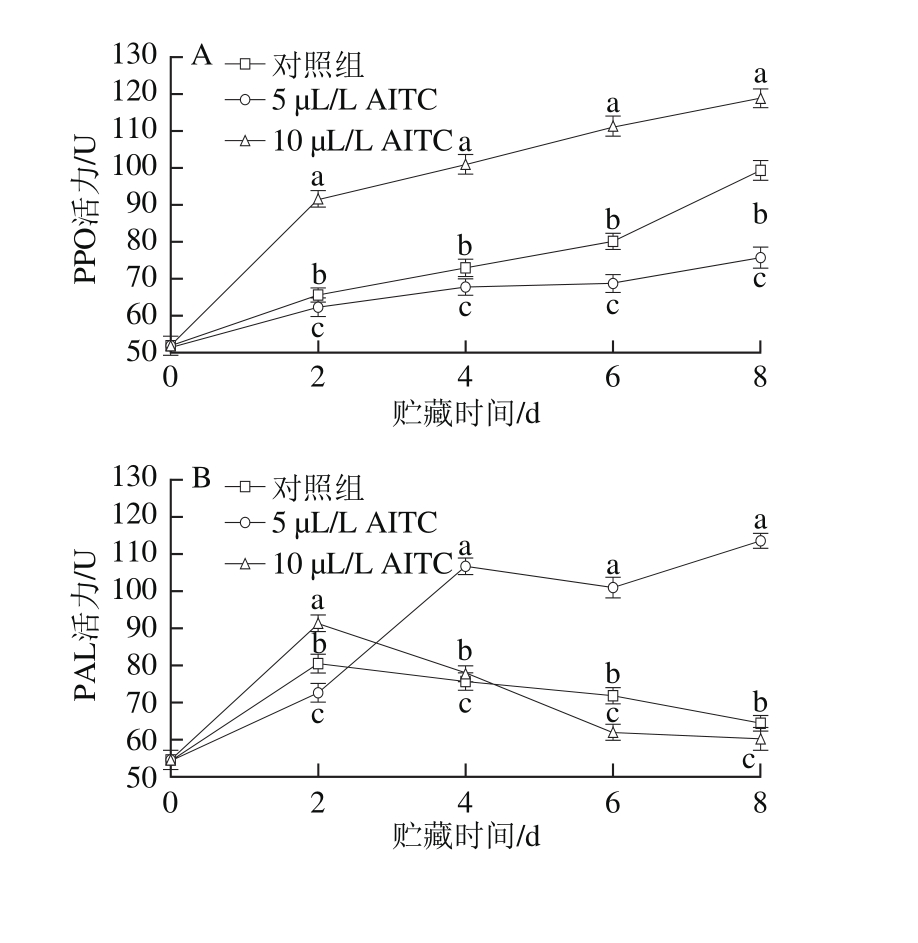

图2 AITC处理对鲜切紫甘蓝PPO(A)、PAL(B)、POD(C)和APX(D)活力的影响
Fig. 2 Effect of AITC treatment at different concentrations on PPO (A),PAL (B), POD (C) and APX (D) activity of fresh-cut purple cabbage
PPO不仅催化果蔬产生褐变反应,还与植物抗性密切相关[28]。如图2A所示,贮藏期间,所有样品的PPO活力均呈逐渐上升趋势,其中5 µL/L AITC处理组的PPO活力低于对照组和10 µL/L AITC处理组,且上升趋势最小,10 µL/LAITC处理组的PPO活力显著高于同一贮藏期其他处理组(P<0.05)。
PAL是许多植物次生物质生物合成途径——苯丙烷代谢的关键酶,与植物的抗逆境胁迫和抗病性相关,在植物的正常生长发育和抵御病原菌侵害过程中起着重要的作用[28]。由图2B可见,贮藏期间PAL活力均呈先上升后下降趋势,其中对照组和10 µL/L AITC处理组在第2天时即达到活力高峰,后逐渐下降,而5 µL/L AITC处理组的PAL活力在第4天时达到高峰,在第4、6天和8天时,5 µL/L AITC处理组的PAL活力显著高于其他组(P<0.05)。可见,5 µL/L AITC处理组可维持较高的PAL活力,有利于紫甘蓝抵抗伤害胁迫。
POD和APX活力均呈先上升后下降趋势(图2C、D),各处理组的POD活力在第6天时出现高峰,而APX活力在第2天时最高。5 µL/L AITC处理组的POD和APX活力在贮藏过程中始终显著高于对照组和10 µL/L AITC处理组(P<0.05)。POD和APX对植物体的保护作用均是通过分解H2O2来抵抗氧化胁迫,其中APX是通过专一性地催化VC与H2O2反应形成单脱氢H2O2,从而降低H2O2对植物体的危害。APX是抗坏血酸-谷胱甘肽循环系统重要的工具酶,APX活力的上升可能是导致VC降解的原因之一。
2.3 AITC处理对鲜切紫甘蓝抗氧化物质含量的影响
紫甘蓝中富含多酚、花色苷、VC等抗氧化物质,因此具有较强的抗氧化能力[1]。实验结果表明:鲜切紫甘蓝的总酚和总花色苷含量变化趋势相似,二者均呈先上升后下降趋势(图3A、B),其中对照组和10 µL/L AITC处理组的总酚和总花色苷含量均在第2天时达到峰值,而5 µL/L AITC处理组则在第4天时最高,且2 d后,5 µL/L AITC处理组的总酚和总花色苷含量均显著高于对照组和10 µL/L AITC处理组(P<0.05),说明适宜添加量的AITC处理有利于鲜切紫甘蓝中酚类物质的保持。对照组和两种AITC处理组的鲜切紫甘蓝中总酚含量及总花色苷含量在前2 d内均有所增加,这种现象在蓝莓的贮藏过程中也出现过[14],Wang等[14]的研究结果表明,蓝莓果实的花色苷和酚类物质在采后贮藏过程中依然会继续合成。

图3 不同添加量AITC处理对鲜切紫甘蓝总酚(A)、总花色苷(B)、VC(C)和GSH(D)含量的影响
Fig. 3 Effect of AITC treatment at different concentrations on phenol (A), total anthocyanin (B), VC (C) and GSH (D) of fresh-cut purple cabbage
作为重要的营养物质和抗氧化物质,VC在贮藏过程中呈下降趋势(图3C),但5 µL/L AITC处理能降低VC含量下降的速率,表现为第2天和第6天时VC含量显著高于同期的对照组和10 µL/L AITC处理组(P<0.05)。GSH作为一种重要的非酶抗氧化物质,在紫甘蓝中含量很高,GSH在抗氧化、蛋白质巯基保护和氨基酸跨膜运输等方面具有重要作用[31]。如图3D所示,贮藏期间,GSH含量整体呈先上升后下降趋势,10 µL/L AITC处理组在第2天时达到峰值后急速下降,其他2 组的GSH含量在第6天时达到峰值,4 d后,5 µL/L AITC处理组的GSH 含量显著高于其他2 组(P<0.05)。综上,5 µL/L AITC处理更有利于保持GSH不被破坏,而10 µL/L AITC处理效果相反。
2.4 不同添加量AITC处理组对鲜切紫甘蓝抗氧化能力的影响

图4 不同添加量AITC处理对鲜切紫甘蓝羟自由基清除率(A)和总抗氧化能力(B)的影响
Fig. 4 Effect of AITC treatment at different concentrations on hydroxyl radical-scavenging capacity (A) and total antioxidant capacity (B) of fresh-cut purple cabbage
如图4A所示,对照组和10 µL/L AITC处理组的羟自由基清除率整体呈缓慢下降趋势,而5 µL/L AITC处理组则呈先上升后下降趋势,在第2天时达到峰值,并且在整个贮藏期间羟自由基清除率始终显著高于其他两组(P<0.05)。由图4B可见,鲜切紫甘蓝的总抗氧化能力呈先上升后下降趋势,10 µL/L AITC处理组在第2天时达到峰值,而对照组和5 µL/L AITC 处理组均在第4天时达到峰值,2 d后,5 µL/L AITC 处理组的总抗氧化能力显著高于其他处理组(P<0.05),而10 µL/L AITC处理组的总抗氧化能力降低最快。综上,5 µL/L AITC处理能有效地保持鲜切紫甘蓝的羟自由基清除能力和总抗氧化能力。
2.5 不同添加量AITC处理组鲜切紫甘蓝生理代谢影响的PCA和Pearson相关性分析结果
PCA是一种针对于多变量的统计分析方法,可以从多元事物中解析出主要影响因素,揭示事物的本质,使复杂问题简单化[29-30]。如图5A所示,将12 个原始指标综合为两个主成分PC1和PC2,这两个主成分分别占数据集总方差的46.857%和25.267%(所有数据均进行标准化)[30],PC1与总酚、总花色苷、VC含量呈高度相关,PC2与POD、PPO、APX活力及GSH含量呈高度正相关。由图5B可知,与对照组相比,5 µL/L AITC处理组的鲜切紫甘蓝的综合评分均处于较高水平,其中5 µL/L AITC处理组在第6天处于最高水平,10 µL/L AITC处理组在第2天时处于最高水平,但随着贮藏时间的延长,综合评分呈下降趋势,且在第4天时显著低于对照组(P<0.05),说明10 µL/L AITC处理加速了鲜切紫甘蓝的生理代谢,促进了鲜切紫甘蓝的衰老,而5 µL/L AITC处理最有利于保持鲜切紫甘蓝的品质和营养价值。

图5 不同添加量AITC处理对鲜切紫甘蓝各生理指标的主成分载荷(A)和综合得分(B)的影响
Fig. 5 Effect of AITC treatment at different concentrations on principal component loading (A) and comprehensive scores (B) for physiological indexes of fresh-cut purple cabbage
表1 各生理指标的相关性
Table 1 Correlations of physiological indexes
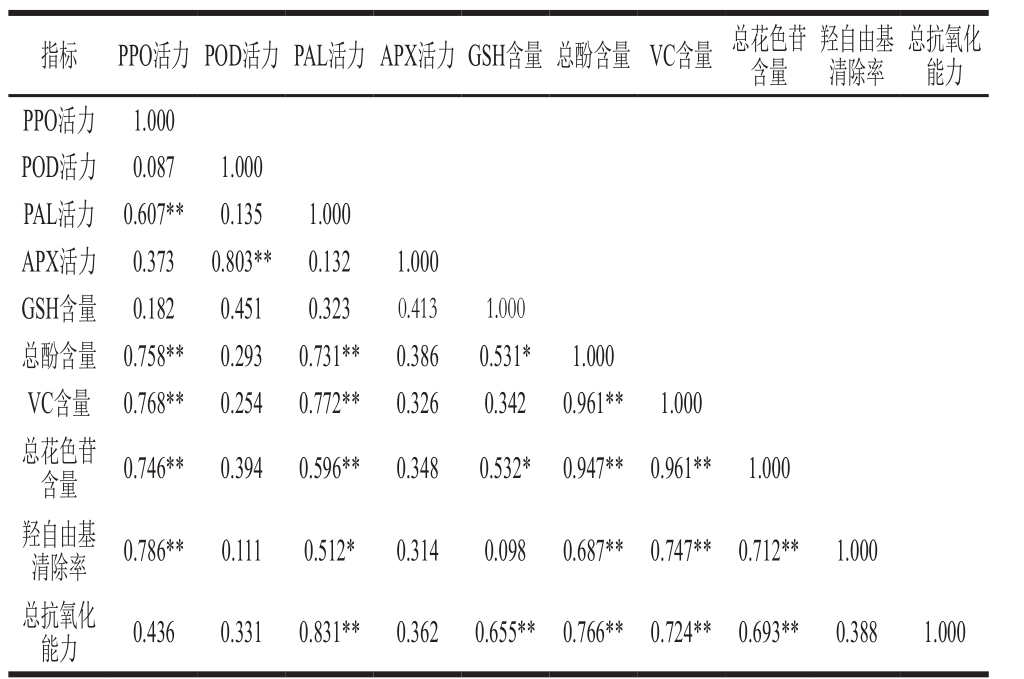
注:*.显著相关(0.468<R<0.590,P<0.05);**.极显著相关(R>0.590,P<0.01)。
由表1相关性分析结果可知,PPO活力与L值间存在着极显著负相关关系(P<0.01),R2=0.92,而PPO活力与代表红色程度的a值间却不存在相关性关系(R2=0.31),说明鲜切紫甘蓝由PPO催化的褐变反应主要是引起亮度的下降。
3 结 论
5 µL/L AITC处理有利于保持紫甘蓝原有的亮度,降低了褐变程度;5 µL/L AITC处理降低了质量损失率,并抑制了呼吸代谢速率,而10 µL/L AITC处理则提高了贮藏前期鲜切紫甘蓝的PPO活力、GSH含量和总抗氧化能力,并提高了呼吸强度上升的速率,导致样品色泽逐渐暗淡且在第6天时开始有明显腐烂现象的发生,质量损失率也显著高于对照组,尽管2 d时10 µL/L AITC处理组的综合得分最高,但接下来急剧下降,可见AITC添加量过高会加快呼吸代谢速率,加速衰老进程。
5 µL/L AITC处理可能是通过启动鲜切紫甘蓝的自身防御系统来起到保鲜的作用。5 µL/L AITC处理均不同程度地提高了鲜切紫甘蓝抗性相关酶(POD、PAL、APX)活力,表现为抗氧化物质含量的增加和抗氧化能力的提高。当然,要进一步验证这一结论,还需对自由基变化情况等一系列活性氧代谢指标做进一步研究。
以上结论表明:5 µL/L AITC处理能够对鲜切紫甘蓝起到保鲜作用,较好地保持其营养成分和抗氧化能力,并可更有效地降低呼吸强度。虽然AITC是公认的抗菌剂,但因其高波动性和强烈的气味,其在食品中的应用也是有限度的[18],AITC添加量过高反而会破坏鲜切紫甘蓝正常的生理代谢过程,使得代谢紊乱,加速衰老进程[32]。本研究所选择的AITC处理添加量和处理时间是经过大量预实验选定的结果,尽管10 µL/L AITC处理加速了鲜切紫甘蓝贮藏后期的衰老进程,但该添加量处理后的产品无论是鲜食还是烹饪均没有风味上的劣变。
参考文献:
[1] LI Z, WANG L, WANG D, et al. Research on respiration characteristics of fresh cut purple cabbage[C]// International Forum on Energy, Environment and Sustainable Development. Paris: Atlantis Press, 2016: 466-469. DOI:10.2991/ifeesd-16. 2016.83.
[2] 宋亚, 李凯利, 方佳宁, 等. 鲜切紫甘蓝中花青苷和硫代葡萄糖苷在贮藏过程中的变化[J]. 食品科学, 2016, 37(18): 96-101.DOI:10.7506/spkx1002-6630-201618016.
[3] KOIDE S, TAKEDA J I, SHI J, et al. Disinfection eきcacy of slightly acidic electrolyzed water on fresh cut cabbage[J]. Food Control, 2009,20(3): 294-297.
[4] 吴建生, 姚勇芳, 陈祖佑, 等. 鲜切甘蓝O3处理与保鲜效果研究[J].食品科学, 2008, 29(7): 452-456.
[5] CHRDON J, SWART A, EVERS E, et al. Public health relevance of cross-contamination in the fresh-cut vegetable industry[J]. Journal of Food Protection, 2016, 79(1): 30-36. DOI:10.4316/0362-028x.JFP-15-272.
[6] KIM H J, KOO M, HWANG D, et al. Contamination patterns and molecular typing of Bacillus cereus, in fresh-cut vegetable salad processing[J]. Applied Biological Chemistry, 2016, 59(4): 573-577.DOI:10.1007/s13765-016-0198-z.
[7] ZHANG H, LIU Y F, YANG X U. Study on mechanism and inhibitory methods of fresh-cut cabbage browning[J]. Science & Technology of Food Industry, 2009, 30(9): 366-369.
[8] 梁浩, 李瑞敏, 袁其朋. 天然活性异硫氰酸酯类化合物的研究进展[J].北京化工大学学报(自然科学版), 2015, 42(2): 1-12.
[9] JAILWAL A K, ABU-GHANNAM N. Fermentation-assisted extraction of isothiocyanates from brassica vegetable using box-behnken experimental design[J]. Foods, 2016, 5(4): 1-10. DOI:10.3390/foods5040075.
[10] IRBAHIM R, OSMAN A, SAARI N, et al. Eあects of anti-browning treatments on the storage quality of minimally processed shredded cabbage[J]. Journal of Food Agriculture & Environment, 2004, 2(2):54-58.
[11] 国家卫生与计划生育委员会. 食品安全国家标准 食品添加剂使用标准: GB 2760—2014[S]. 北京: 中国标准出版社, 2014: 159.
[12] WU H, ZHANG X, ZHANG G A, et al. Antifungal vapourphase activity of a combination of allyl isothiocyanate and ethyl isothiocyanate against Botrytis cinerea, and Penicillium expansum,infection on apples[J]. Journal of Phytopathology, 2011, 159(6): 450-455. DOI:10.1111/j.1439-0434.2011.01792.x.
[13] RADEKUKIC K, SCHMITT C, RAWEL H M. Formation of conjugates between β-lactoglobulin and allyl isothiocyanate: effect on protein heat aggregation, foaming and emulsifying properties[J].Food Hydrocolloids, 2011, 25(4): 694-706. DOI:10.1016/j.foodhyd.2010.08.018.
[14] WANG S Y, CHEN C T, YIN J J. Effect of allyl isothiocyanate on antioxidants and fruit decay of blueberries[J]. Food Chemistry, 2010,120(1): 199-204. DOI:10.1016/j.foodchem.2009.10.007.
[15] WU H, LIU X R, YU D D, et al. Effect of allyl isothiocyanate on ultra-structure and the activities of four enzymes in adult Sitophilus zeamais[J]. Pesticide Biochemistry & Physiology, 2014, 109(1): 12-17. DOI:10.1016/j.pestbp.2014.01.001.
[16] MANOLOPOULOU E, VARZAKAS T. Eあect of storage conditions on the sensory quality, colour and cexture of fresh-cut minimally processed cabbage with the addition of ascorbic acid, citric acid and calcium chloride[J]. Food and Nutrition Sciences, 2011, 2(9): 956-963.DOI:10.4236/fns.2011.29130.
[17] BANERJEE A, PENNA S, VARIYAR P S. Allyl isothiocyanate enhances shelf life of minimally processed shredded cabbage[J]. Food Chemistry, 2015, 183: 265-272. DOI:10.1016/j.foodchem.2015.03.063.
[18] KO J A, KIM W Y, PARK H J. Effects of microencapsulated allyl isothiocyanate (AITC) on the extension of the shelf-life of kimchi[J].International Journal of Food Microbiology, 2011, 153(1/2): 92-98.DOI:10.1016/j.ijfoodmicro.2011.10.021.
[19] PIERCEY M J, MAZZANTI G, BUDGE S M, et al. Antimicrobial activity of cyclodextrin entrapped allyl isothiocyanate in a model system and packaged fresh-cut onions[J]. Food Microbiology, 2012,30(1): 213-218. DOI:10.1016/j.fm.2011.10.015.
[20] PANG Y H, SHEEN S, ZHOU S, et al. Antimicrobial eあects of allyl isothiocyanate and modiベed atmosphere on Pseduomonas aeruginosa in fresh catfish fillet under abuse temperatures[J]. Journal of Food Science, 2013, 78(4): 555-559. DOI:10.1111/1750-3841. 12065.
[21] UGOLINI L, MARTINI C, LAZZERI L, et al. Control of postharvest grey mould (Botrytis cinerea, Per.: Fr.) on strawberries by glucosinolate-derived allyl-isothiocyanate treatments[J].Postharvest Biology & Technology, 2014, 90: 34-39. DOI:10.1016/j.posharvbio.2013.12.002.
[22] 姜爱丽, 胡文忠, 田密霞, 等. 水杨酸处理对采后番茄果实后熟衰老的影响[J]. 食品与发酵工业, 2009, 35(5): 205-209.
[23] WANG Yousheng, TIAN Shiping, XU Yong, et al. Changes in the activities of pro-and anti-oxidant enzymes in peach fruit inoculated with Cryptococcus laurentii or Penicillium expansum at 0 or 20 °C[J].Postharvest Biology and Technology, 2004, 34(1): 21-28.
[24] PASQUARIELLO M S, DI PATRE D, MASTROBUONI F, et al.Influence of postharvest chitosan treatment on enzymatic browning and antioxidant enzyme activity in sweet cherry fruit[J]. Postharvest Biology & Technology, 2015, 109: 45-56.
[25] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 44-45.
[26] 张宪政. 植物生理学实验技术[M]. 沈阳: 辽宁科学技术出版社,1994: 161-163.
[27] LOHACHOOMPOL V, MULHOLLAND M, SRZEDNICKI G, et al.Determination of anthocyanins in various cultivars of highbush and rabbiteye blueberries[J]. Food Chemistry, 2008, 111(1): 249-254.
[28] 姜爱丽, 孟宪军, 胡文忠, 等. 不同北高丛蓝莓品种的抗氧化成分及其抗氧化活性[J]. 食品与发酵工业, 2011, 37(9): 161-165.
[29] 武松, 潘发明. SPSS统计分析大全[M]. 北京: 清华大学出版社,2014: 334-344.
[30] 邵明灿, 胡花丽, 王毓宁, 等. 基于主成分分析法分析一氧化氮对绿芦笋贮藏品质的影响[J]. 食品科学, 2012, 33(20): 318-322.
[31] 卓肇文. 还原型谷胱甘肽(GSH)的功能与应用[J]. 氨基酸杂志,1989(1): 41-42.
[32] UGOLINI L, RIGHETTI L, CARBONE K, et al. Postharvest application of brassica meal-derived allyl-isothiocyanate to kiwifruit:effect on fruit quality, nutraceutical parameters and physiological response[J]. Journal of Food Science & Technology, 2017, 54(3): 751-760.