鲜切苹果是指新鲜苹果经分级、清洗、整修、去皮、切分、保鲜、包装等处理,供消费者直接食用或餐饮业使用的一种新式苹果加工产品,其清脆多汁,且富含抗氧化成分等多种营养物质,是餐饮业及零售业最受消费者喜爱的零食餐点之一,目前在欧洲、美国、日本等发达国家和地区已经实现系统化、规范化生产,在鲜切市场中占有重要地位[1]。然而新鲜果蔬在去皮、切分等加工过程中,细胞组织结构会受到伤害,使细胞组织与空气直接接触,呼吸速率升高,蒸腾作用加快,加速了产品的衰老进程,造成营养物质流失,尤其是切割操作伤害引起酶促褐变反应的迅速发生,造成品质下降,货架期缩短,这是包括鲜切苹果在内的许多鲜切果蔬产品加工与贮藏保鲜过程中面临的主要问题之一,已成为鲜切果蔬研究的热点问题[2]。
鲜切果蔬酶促褐变是一个复杂的过程,一般认为其产生机理是鲜切操作导致果蔬组织结构和细胞空间区域化丧失,使原来多酚氧化酶(polyphenol oxidase,PPO)与底物多酚的分区定位遭到破坏,导致酶与底物接触,诱发了酶促褐变反应,即PPO在有氧的条件下催化酚类物质形成邻苯醌,后者通过复杂的醌聚合反应形成褐色物质是酶促褐变发生的直接原因[3]。当前采用物理、化学等方法降低PPO活力、酚类物质含量和氧浓度是控制鲜切果蔬酶促褐变的主要途径[4-6]。半胱氨酸是一种天然的具有生理功能的氨基酸,作为食品添加剂应用于食品加工中,同时在医药领域也有广泛应用[7]。许多学者将半胱氨酸作为抗褐变剂单独或与其他保鲜剂联合应用于鲜切苹果的贮藏保鲜[8,9-11]。Ali等[12]研究认为半胱氨酸是一种高效的PPO抑制剂,但其作用机理较为复杂。PPO在鲜切苹果组织中主要以膜PPO和游离PPO两种形式存在,膜PPO活力比游离PPO活力高,半胱氨酸对膜PPO活力具有很强的抑制作用[13]。但高愿军等[14]研究认为半胱氨酸不直接作用于PPO,它对褐变反应的抑制在于其能与醌类物质反应生成稳定的无色化合物防止醌氧化成有色物质。近年来,越来越多研究表明,酶促褐变不仅与酚类物质含量以及PPO的活力有关,还受细胞膜透性以及膜脂过氧化等多因素影响[15],而半胱氨酸控制鲜切苹果褐变的生理机制仍缺乏系统研究。
本研究以鲜切苹果为研究对象,采用0.5 g/L的半胱氨酸溶液浸泡处理1 min,分析在4 ℃贮藏过程中,鲜切苹果PPO活力、抗氧化相关酶活力、抗氧化物质含量以及抗氧化活力的变化,系统研究半胱氨酸对鲜切苹果褐变控制的生理机制,为鲜切苹果的贮藏保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
富士苹果购于大连经济技术开发区乐购超市。
过氧化氢、福林-酚试剂、苯丙氨酸、抗坏血酸、硝普钠、聚乙烯吡咯烷酮、亚油酸钠、三聚乙酸、硫代巴比妥酸、无水乙醇、丙酮、愈创木酚、邻苯二酚等(均为分析纯) 天津市科密欧化学试剂有限公司;L-半胱氨酸(食品级) 上海富源生物科技有限公司。
1.2 仪器与设备
CR400/CR410型色差计 日本Konica Minolta公司;DK-S26电热恒温水浴锅、DHG-9053A电热恒温鼓风干燥箱上海精宏实验设备有限公司;AL240电子分析天平瑞士Mettler Toledo公司;UV-9200紫外-可见分光光度计北京瑞利分析仪器有限公司;T-25匀浆机 德国IKA公司;BR4i台式高速冷冻离心机 法国Jouan公司;BCD-257DVC冰箱 青岛海尔股份有限公司;SiM-F140制冰机 日本三洋公司。
1.3 方法
1.3.1 样品的预处理
苹果经自来水清洗后,在灭菌砧板上用灭菌的削皮刀削皮去除果核,切割成约1 cm×1 cm×1 cm的小块,将鲜切苹果采用0.5 g/L的半胱氨酸溶液浸泡处理1 min,取蒸馏水浸泡1 min作为对照。将处理后的样品沥干后均匀放入一次性托盘中并用聚乙烯保鲜膜包好,置于4 ℃冷库中贮藏。定期取样用于分析生理生化变化。
1.3.2 褐变指数的测定
采用色差计测定L*、a*、b*值,L*值表示明亮度,a*值表示红/绿,b*值表示黄/蓝。褐变指数(browning index,BI)根据公式(1)、(2)进行计算[16]。
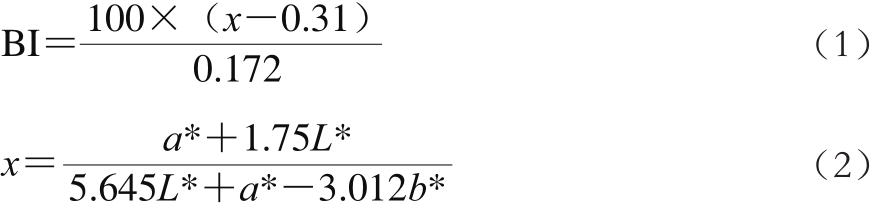
1.3.3 抗坏血酸和总酚含量的测定
抗坏血酸含量的测定采用2,6-二氯酚靛酚滴定法[17]。总酚含量的测定采用福林-酚法[18]。
1.3.4 相关酶活力的测定
过氧化氢酶(catalase,CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力的测定参考闫媛媛等[19]的方法,PPO和过氧化物酶(peroxidase,POD)活力测定参考Chen Chen等[20]的方法,谷胱甘肽还原酶(glutathione reductase,GR)活力测定参考Zhang Jie等[21]的方法。
1.3.5 抗氧化活性的测定
抗氧化活性评价采用测定1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) ammonium salt,ABTS)自由基(ABTS+·)清除能力两种方法[22],测定结果以每克鲜切苹果相当于标准抗氧化物质水溶性VE(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)的物质的量表示。
1.3.6 丙二醛质量摩尔浓度测定
丙二醛(malondialdehyde,MDA)质量摩尔浓度的测定参考Ren Yalin等[23]的方法。
1.4 数据处理与分析
采用SPSS 17.0软件进行统计分析,结果用 表示,其中生理指标显著性分析采用邓肯氏多重比较法,相关性采用Pearson相关分析。
表示,其中生理指标显著性分析采用邓肯氏多重比较法,相关性采用Pearson相关分析。
2 结果与分析
2.1 半胱氨酸对鲜切苹果褐变的控制效果
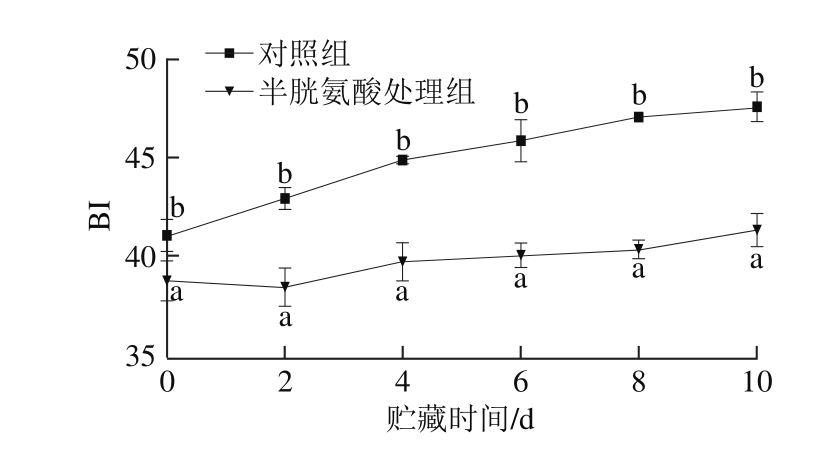
图1 半胱氨酸处理后鲜切苹果的BI
Fig. 1 Effect of cysteine on browning index of fresh-cut apples during storage
小写字母不同表示对照组与半胱氨酸处理组样品差异显著(P<0.05)。下同。
BI值越大,表示褐变程度越严重。如图1所示,随着贮藏时间的延长,对照组和半胱氨酸处理组的鲜切苹果褐变程度均逐渐上升,半胱氨酸处理组样品BI值在贮藏过程中均显著低于对照组(P<0.05),说明半胱氨酸处理能够有效抑制鲜切苹果的褐变。
2.2 半胱氨酸对鲜切苹果抗坏血酸含量的影响
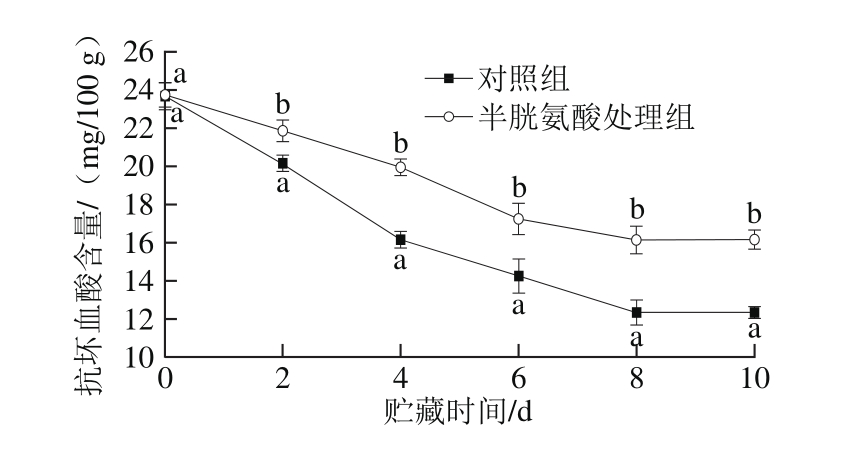
图2 半胱氨酸处理对鲜切苹果抗坏血酸含量的影响
Fig. 2 Effect of cysteine on ascorbic acid content of fresh-cut apples during storage
抗坏血酸是鲜切水果中重要的抗氧化物质,由图2可知,对照组和半胱氨酸处理组鲜切苹果贮藏过程中抗坏血酸含量均呈下降的趋势。但是半胱氨酸处理组的抗坏血酸含量整体高于对照组(P<0.05),且下降速率较慢,在贮藏第10天时,与第0天相比其含量下降了32%,而对照组下降了48%。说明半胱氨酸处理能够有效抑制抗坏血酸在鲜切苹果贮藏过程中的氧化损失,更好地保持了其抗氧化能力,可保护细胞组织免受氧化损害而延缓果实衰老。
2.3 半胱氨酸对鲜切苹果总酚含量的影响
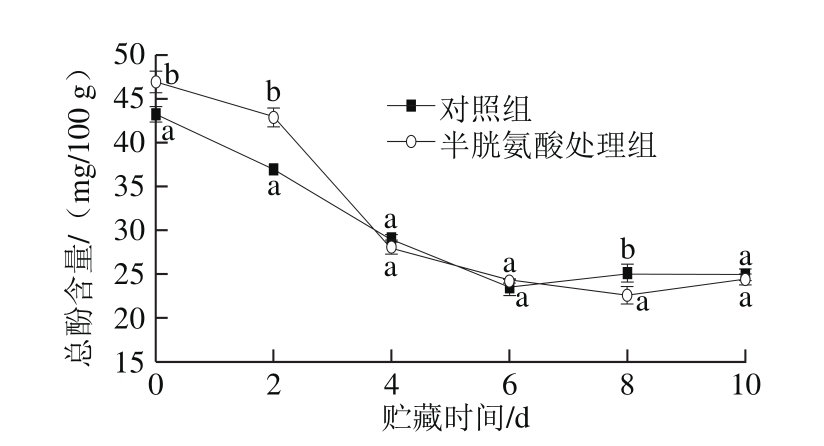
图3 半胱氨酸处理对鲜切苹果总酚含量的影响
Fig. 3 Effect of cysteine on total polyphenol content of fresh-cut apples during storage
苹果富含的多酚类物质是苹果中重要的抗氧化成分;同时,多酚也作为多酚氧化酶的底物,参与苹果的褐变反应[20]。如图3所示,对照组和半胱氨酸处理组鲜切苹果的总酚含量在贮藏的最初6 d内快速下降,第8天以后无显著变化。半胱氨酸处理组总酚含量在贮藏最初2 d显著高于对照组,在随后的贮藏过程中,除第8天外,两组无显著差异(P>0.05)。在贮藏过程中,鲜切苹果中多酚类物质不断被PPO催化消耗,其含量逐渐降低,但半胱氨酸处理诱导鲜切苹果多酚类物质的合成,使总酚含量增加,但随着贮藏时间的延长,多酚合成能力逐渐减弱;因此,半胱氨酸处理组鲜切苹果的总酚含量仅在贮藏初期高于对照组。
2.4 半胱氨酸对鲜切苹果PPO活力的影响

图4 半胱氨酸处理对鲜切苹果PPO活力的影响
Fig. 4 Effect of cysteine on PPO activity of fresh-cut apples during storage
PPO是引起鲜切苹果组织褐变的关键酶,半胱氨酸对鲜切苹果PPO活力的影响如图4所示。对照组鲜切苹果的PPO活力随贮藏时间延长,呈先上升后下降的趋势,在贮藏第6天时达到最大值,这与胡文忠等[24]的研究结果一致,半胱氨酸处理能够延迟鲜切苹果PPO活力的上升,其PPO活力在贮藏初期受到抑制,逐渐降低,在第4天时达到最低,随后逐渐升高。鲜切苹果贮藏期间PPO活力的增加可能由多种因素造成,如可能是结合态酶的释放所致,也可能是由酶前体的转化而来,或是由于机械伤害促使合成了新的PPO,也有可能是这些因素相互影响的作用结果。在贮藏的0~6 d,半胱氨酸处理组样品PPO活力显著低于对照组(P<0.05),而从第8天开始显著高于对照组(P<0.05),说明半胱氨酸处理能够在贮藏初期抑制鲜切苹果的PPO活力,对延缓其褐变起到很大作用。
2.5 半胱氨酸对鲜切苹果POD活力的影响
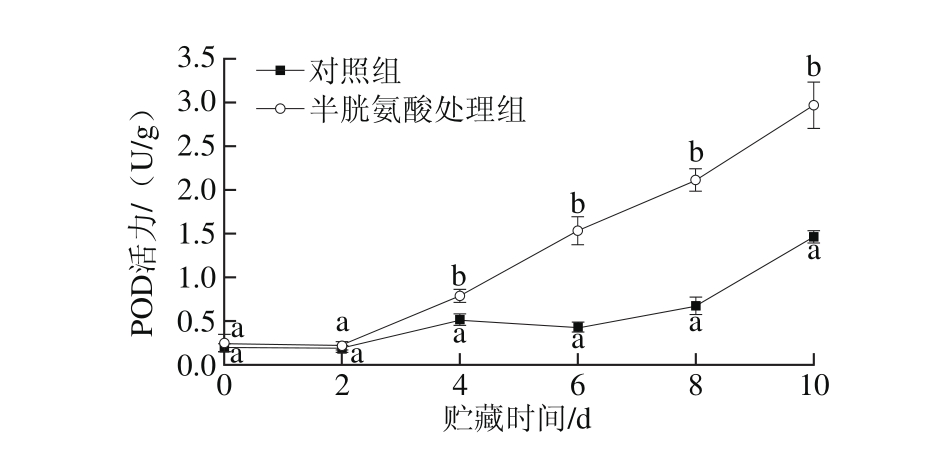
图5 半胱氨酸处理对鲜切苹果POD活力的影响
Fig. 5 Effect of cysteine on POD activity of fresh-cut apples during storage
POD是植物体内普遍存在的一种抗氧化酶,可以清除植物体内过量的自由基,保持膜系统的完整性,维持正常代谢;但另一方面POD可以利用H2O2释放出的O2氧化酚类物质,引发褐变反应[25]。如图5所示,对照组鲜切苹果的POD活力在贮藏最初6 d无明显变化,从第8天开始逐渐升高,而半胱氨酸处理组样品在贮藏过程中POD活力呈上升趋势,且显著高于对照组(P<0.05)。机械伤害诱导半胱氨酸处理组鲜切苹果POD活力提高,有助于及时清除因氧化和机械损伤而产生的过量H2O2,对延缓鲜切苹果衰老具有积极的作用[26]。
2.6 半胱氨酸对鲜切苹果CAT活力的影响

图6 半胱氨酸处理对鲜切苹果CAT活力的影响
Fig. 6 Effect of cysteine on CAT activity of fresh-cut apples during storage
CAT能催化植物体内积累的H2O2分解为H2O和O2,从而减轻H2O2对组织产生的氧化损伤[27]。图6表示鲜切苹果在贮藏期间的CAT活力变化情况,对照组样品在贮藏过程中CAT活力逐渐下降,这可能是因为随着贮藏时间的延长,苹果组织衰老进程加剧,组织中了产生大量活性氧,从而抑制了CAT的活性。半胱氨酸处理样品的CAT活力在贮藏第2天时有所提高,随后也逐渐下降,在贮藏过程其活力显著高于对照组(P<0.05)。半胱氨酸处理使鲜切苹果CAT活力得到增强,有利于组织中H2O2的清除,减轻了自由基引起的氧化损伤,进而抑制鲜切苹果的褐变程度。
2.7 半胱氨酸对鲜切苹果APX活力的影响
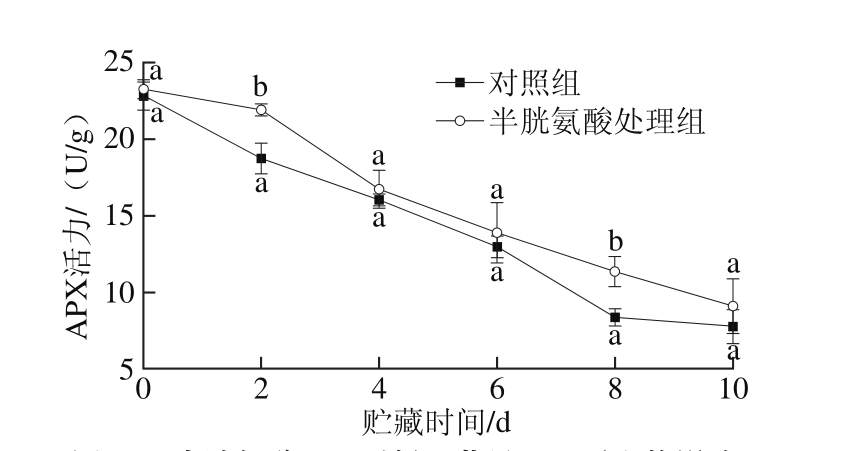
图7 半胱氨酸处理对鲜切苹果APX活力的影响
Fig. 7 Effect of cysteine on APX activity of fresh-cut apples during storage
APX通过催化抗坏血酸与H2O2发生氧化还原反应,清除果蔬体内的H2O2,从而降低其对细胞产生损伤[19]。对照组和半胱氨酸处理组鲜切苹果的APX活力在贮藏过程中均呈下降趋势(图7),在贮藏的第2天和第8天,半胱氨酸处理组样品APX活力显著高于对照组(P<0.05),除此之外,二者无显著差异(P>0.05)。鲜切苹果贮藏过程中的APX活力快速下降,导致其对H2O2清除能力大幅降低,使鲜切苹果内部的活性氧大量积聚,从而引发细胞膜脂过氧化反应,最终加剧褐变反应。
2.8 半胱氨酸对鲜切苹果GR活力的影响
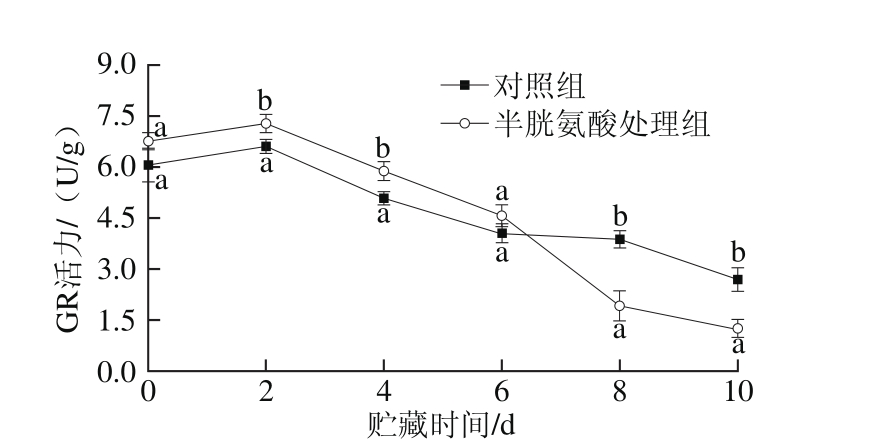
图8 半胱氨酸处理对鲜切苹果GR活力的影响
Fig. 8 Effect of cysteine on GR activity of fresh-cut apples during storage
GR能够将氧化型谷胱甘肽(oxidized glutathione,GSSG)还原成还原型谷胱甘肽(reduced glutathione,GSH),维持细胞内充足的GSH水平,是果蔬组织中重要的抗氧化酶之一[21]。如图8所示,两组鲜切苹果的GR活力变化趋势大体一致,均呈先上升后下降的趋势,在第2天时二者GR活力达到最大值,其中半胱氨酸处理组样品GR活力下降速率较快,其活力仅在第2天和第4天时显著高于对照组(P<0.05),贮藏至8 d以后,半胱氨酸处
理组样品的GR活力显著低于对照组(P<0.05);因此,半胱氨酸处理仅能够在贮藏初期提高鲜切苹果的GR活力,增强其抗氧化能力。在植物体内GR活力受到还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)与GSSG的双重调控,同时也受细胞内氧化还原状态的调节[28]。半胱氨酸处理组鲜切苹果在贮藏后期可能积累了大量活性氧,改变了苹果组织内的氧化还原电位,或者是半胱氨酸处理对鲜切苹果的NADPH和GSSG产生了不利影响,从而引起GR活力的迅速降低,后续还应进一步深入研究揭示半胱氨酸处理对鲜切苹果GR活力的影响机理。
2.9 半胱氨酸对鲜切苹果抗氧化活性的影响

图9 半胱氨酸处理对鲜切苹果DPPH自由基(A)和ABTS+·(B)清除能力的影响
Fig. 9 Effect of cysteine on DPPH (A) and ABTS+· (B) radical scavenging activity of fresh-cut apples during storage
分别采用DPPH自由基清除能力和ABTS+·清除能力两种方法评价鲜切苹果的抗氧化活性。如图9所示,鲜切苹果具有较高的抗氧化活性,其对ABTS+·清除能力大于对DPPH自由基清除能力。对照组鲜切苹果对DPPH自由基的清除能力在贮藏最初4 d下降速率较快,随后趋于平缓,半胱氨酸处理组样品从第2天开始缓慢下降,在贮藏的2~8 d内,其DPPH自由基清除能力均显著高于对照组(P<0.05),而贮藏至第10天时,与对照组无显著差异(P>0.05)。对照组鲜切苹果对ABTS+·清除能力在贮藏过程呈下降趋势,而半胱氨酸处理组呈先上升后下降的趋势,且在贮藏4 d后无显著变化,在贮藏10 d内半胱氨酸处理组鲜切苹果对ABTS+·清除能力显著高于对照组(P<0.05)。半胱氨酸处理激发了鲜切苹果中抗氧化物质的合成和积累,抑制了鲜切苹果ABTS+·和DPPH自由基清除能力的下降,很大程度上提升了鲜切苹果的活性氧代谢能力,减轻活性氧对组织产生的氧化损伤。
2.10 半胱氨酸对鲜切苹果MDA质量摩尔浓度的影响

图10 半胱氨酸处理对鲜切苹果MDA质量摩尔浓度的影响
Fig. 10 Effect of cysteine on MDA content of fresh-cut apples during storage
MDA是膜脂过氧化产物,其含量的高低可表示细胞膜脂质过氧化程度[24]。由图10可见,随着贮藏时间的延长,对照组与半胱氨酸处理组鲜切苹果的MDA质量摩尔浓度均呈上升趋势,说明在贮藏过程中鲜切苹果的膜脂过氧化程度逐渐增加。在贮藏初期(0~4 d),对照组与半胱氨酸处理组样品的MDA质量摩尔浓度无显著差异(P>0.05),贮藏至第6天以后,半胱氨酸处理可以显著抑制鲜切苹果MDA的积累,说明半胱氨酸可以在贮藏后期降低鲜切苹果的膜脂过氧化程度,减轻细胞膜的氧化损伤,保持膜的完整性。
2.11 相关性分析
表1 鲜切苹果褐变指标的相关性分析
Table 1 Pearson correlation coefベcients of BI, PPO activity, MDA content and antioxidant capacity

注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
如表1所示,鲜切苹果对D P P H自由基和ABTS+·清除能力与其总酚和抗坏血酸含量呈极显著或显著正相关,这许多研究结果一致,鲜切水果的非酶抗氧化能力与总酚和抗坏血酸含量相关[6,18]。鲜切苹果贮藏期间褐变程度(BI值)与抗坏血酸含量、CAT和APX活力以及DPPH自由基、ABTS+·清除能力呈极显著(P<0.01)或显著负相关(P<0.05),与MDA质量摩尔浓度呈极显著正相关(P<0.01),而与PPO活力相关性较弱(R=0.269)。
3 讨 论
酶促褐变是影响鲜切果蔬贮藏品质的重要因素之一,在完整的果实中,PPO主要存在于细胞质、细胞膜和细胞壁上,而酚类物质通常贮存和积累在液泡中,鲜切机械操作破坏了PPO和酚类物质区域化分布,同时切割伤害诱导PPO活力逐渐上升,在贮藏过程中PPO不断催化多酚类物质氧化成醌类,使多酚类物质含量逐渐降低,加剧鲜切果蔬组织褐变[29]。本研究中,对照组鲜切苹果的总酚含量在贮藏前6 d下降速率较快,这可能与PPO活力的升高有关;而半胱氨酸处理后鲜切苹果的PPO活力呈先下降后上升的趋势。因此贮藏初期其总酚消耗较慢,且总酚含量显著高于对照组,说明半胱氨酸对鲜切苹果PPO活力的抑制具有时效性。相关性分析显示鲜切苹果的BI值与PPO活力和总酚含量相关性较小,半胱氨酸处理仅能在贮藏初期抑制鲜切苹果的PPO活力,并且抑制总酚含量降低,由此可见半胱氨酸可能还通过其他途径抑制鲜切苹果的褐变。Cantos等[30]研究表明鲜切马铃薯褐变速率与PPO、酚类物质浓度无关,细胞膜的完整性才是控制褐变速率的关键因素。保持膜的完整性是控制鲜切梨褐变的主要因素[31]。细胞膜的破坏除了是由于鲜切操作带来的直接机械损伤外,更主要的是由于机械损伤引发大量活性氧的产生,直接或间接启动膜脂的过氧化作用,引起细胞膜的氧化损伤,最终导致细胞膜的区室化功能丧失,从而加快酶促反应的发生[15,32-33]。这与本研究鲜切苹果褐变程度(BI值)与膜脂过氧化程度(MDA质量摩尔浓度)呈极显著正相关(P<0.01)的结果一致。
活性氧积累引起的膜脂过氧化能够加剧酶促褐变,但果蔬体内具备一套精确和完整的抗氧化防卫系统:酶促活性氧自由基清除系统(包括SOD、CAT、APX、GR、POD等)和非酶促活性氧自由基清除系统(抗坏血酸、多酚、谷胱甘肽等),当植物遭受机械伤害胁迫后,其体内便产生一系列的伤信号分子(茉莉酸、乙烯、水杨酸、脱落酸等),激活局部损伤部位和未损伤部位或远离伤害部位内的抗氧化防御基因的转录与表达,从而提高鲜切果蔬的抗氧化能力,清除自由基,减轻氧化损伤[34-35]。而半胱氨酸处理后鲜切苹果的CAT和GR活力在贮藏最初2 d升高,随后逐渐下降,说明半胱氨酸诱导提高其抗氧化酶活力,从而抵御逆境胁迫伤害,随着贮藏时间延长,鲜切苹果抗氧化酶活力逐渐降低,因而氧化损伤逐渐加剧,细胞膜结构被破坏,进而加速酶促褐变反应。相关性分析也表明鲜切苹果的膜脂过氧化程度(MDA质量摩尔浓度)与抗氧化酶(CAT、APX、GR)活力、抗氧化物质(总酚)含量以及抗氧化活力(DPPH自由基和ABTS+·清除能力)呈极显著(P<0.01)或显著负相关(P<0.05),褐变程度(BI值)与抗氧化酶活力、抗坏血酸含量和抗氧化能力呈极显著负相关(P<0.01)。半胱氨酸处理后鲜切苹果抗氧化酶活力和抗氧化物质含量得到显著提高,抗氧化能力得到增强,并且在贮藏后期MDA的积累得到抑制。因此,推断半胱氨酸可能通过提高鲜切苹果的抗氧化能力,减缓自由基引起的氧化损伤,降低鲜切苹果的膜脂过氧化程度,进而减缓鲜切苹果的褐变反应。
4 结 论
本研究结果表明,半胱氨酸可能是通过提高鲜切苹果内部抗氧化酶活力和抗氧化物质的含量,增强其抗氧化能力,降低膜脂过氧化程度,减少MDA对细胞膜的损伤,同时抑制PPO活力,延缓鲜切苹果贮藏期间的组织褐变,提高其贮藏品质。因此,半胱氨酸可以作为一种安全的食品添加剂用于鲜切苹果的贮藏保鲜。
参考文献:
[1] CORTELLINO G, GOBBI S, BIANCHI G, et al. Modiベed atmosphere packaging for shelf life extension of fresh-cut apples[J]. Trends in Food Science & Technology, 2015, 46(2): 320-330. DOI:10.1016/j.tifs.2015.06.002.
[2] HASAN S M K, MANZOCCO L, MOROZOVA K, et al.Effects of ascorbic acid and light on reactions in fresh-cut apples by microcalorimetry[J]. Thermochimica Acta, 2017, 649: 63-68.DOI:10.1016/j.tca.2017.01.008.
[3] HUQUE R, WILLS R B H, PRISTIJONO P, et al. Effect of nitric oxide (NO) and associated control treatments on the metabolism of fresh-cut apple slices in relation to development of surface browning[J].Postharvest Biology & Technology, 2013, 78(2): 16-23. DOI:10.1016/j.postharvbio.2012.12.006.
[4] SOLIVA-FORTUNY R C, MARTI N-BELLOSO O. New advances in extending the shelf-life of fresh-cut fruits: a review[J]. Trends in Food Science and Technology, 2003, 14(9): 341-353. DOI:10.1016/S0924-2244(03)00054-2.
[5] RICO D, MARTÍN-DIANA A B, BARAT J M, et al. Extending and measuring the quality of fresh-cut fruit and vegetables: a review[J]. Trends in Food Science and Technology, 2007, 18(7): 373-386. DOI:10.1016/j.tifs.2007.03.011.
[6] OMS-OLIU G, ROJAS-GRAÜ M A, GONZÁLEZ L A, et al. Recent approaches using chemical treatments to preserve quality of fresh-cut fruit: a review[J]. Postharvest Biology and Technology, 2010, 57(3): 139-148. DOI:10.1016/j.postharvbio.2010.04.001.
[7] CABEZAS-SERRANO A B, AMODIO M L, COLELLI G. Effect of solution pH of cysteine-based pre-treatments to prevent browning of fresh-cut artichokes[J]. Postharvest Biology and Technology, 2013, 75(2):17-23. DOI:10.1016/j.postharvbio.2012.07.006.
[8] PEREZ-GAGO M B, SERRA M, RÍO M A D. Color change of freshcut apples coated with whey protein concentrate-based edible coatings[J].Postharvest Biology and Technology, 2006, 39(1): 84-92. DOI:10.1016/j.postharvbio.2005.08.002.
[9] 卢影, 郑建仙. 复合护色液对鲜切苹果的防褐变研究[J].现代食品科技, 2009, 25(9): 1024-1028. DOI:10.13982/j.mfst.1673-9078.2009.09.017.
[10] TORTOE C, ORCHARD J, BEEZER A. Prevention of enzymatic browning of apple cylinders using different solutions[J]. International Journal of Food Science & Technology, 2007, 42(12): 1475-1481.DOI:10.1111/j.1365-2621.2006.01367.x.
[11] HEMACHANDRAN H, ANANTHARAMAN A, MOHAN S, et al. Unraveling the inhibition mechanism of cyanidin-3-sophoroside on polyphenol oxidase and its effect on enzymatic browning of apples[J]. Food Chemistry, 2017, 227: 102-110. DOI:10.1016/j.foodchem.2017.01.041.
[12] ALI S, KHAN A S, MALIK A U. Postharvest L-cysteine application delayed pericarp browning, suppressed lipid peroxidation and maintained antioxidative activities of litchi fruit[J]. Postharvest Biology and Technology, 2016, 121: 135-142. DOI:10.1016/j.postharvbio.2016.07.015.
[13] LIU F, ZHAO J H, GAN Z L, et al. Comparison of membrane-bound and soluble polyphenol oxidase in Fuji apple (Malus domestica Borkh.cv. Red Fuji)[J]. Food Chemistry, 2015, 173: 86-91. DOI:10.1016/j.foodchem.2014.09.169 .
[14] 高愿军, 南海娟, 郝亚勤. 鲜切苹果品质保持研究[J]. 食品科学, 2006,27(8): 254-258.
[15] TOIVONEN P M A, BRUMMELL D A. Biochemical bases of appearance and texture changes in fresh-cut fruit and vegetables[J].Postharvest Biology and Technology, 2008, 48(1): 1-14. DOI:10.1016/j.postharvbio.2007.09.004.
[16] PALOU E, LÓPEZ-MALO A, BARBOSA-CÁNOVAS G V, et al.Polyphenoloxidase activity and color of blanched and high hydrostatic pressure treated banana puree[J]. Journal of Food Science, 1999. 64(1):42-45. DOI:10.1111/j.1365-2621.1999.tb09857.x.
[17] CHOMKITICHAI W, FAIYUE B, RACHTANAPUN P, et al.Enhancement of the antioxidant defense system of post-harvested ‘daw’longan fruit by chlorine dioxide fumigation[J]. Scientia Horticulturae,2014, 178: 138-144. DOI:10.1016/j.scienta.2014.08.016.
[18] 陈晨, 胡文忠, 田沛源, 等. 超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J]. 食品科学, 2014, 35(2): 12-17. DOI:10.7506/spkx1002-6630-201402003.
[19] 闫媛媛, 胡文忠, 姜爱丽, 等. 茉莉酸甲酯和乙烯利处理对鲜切苹果膜质过氧化反应的影响[J]. 食品工业科技, 2015, 36(14): 345-349.
[20] CHEN Chen, HU Wenzhong, HE Yubo, et al. Effect of citric acid combined with UV-C on the quality of fresh-cut apples[J]. Postharvest Biology and Technology, 2016, 111: 126-131. DOI:10.1016/j.postharvbio.2015.08.005.
[21] ZHANG Jie, YUAN Li, LIU Wei, et al. Effects of UV-C on antioxidant capacity, antioxidant enzyme activity and colour of fresh-cut red cabbage during storage[J]. International Journal of Food Science & Technology,2017, 52(3): 626-634. DOI:10.1111/ijfs.13315.
[22] CHEN C, HU W Z, ZHANG R D, et al. Levels of phenolic compounds,antioxidant capacity, and microbial counts of fresh-cut onions after treatment with a combination of nisin and citric acid[J]. Horticulture,Environment, and Biotechnology, 2016, 57(3): 266-273. DOI:10.1007/s13580-016-0032-x.
[23] REN Yalin, WANG Yunfei, BI Yang, et al. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon (Cucumis melo L.) fruit[J]. European Food Research and Technology, 2012, 234(6): 963-971. DOI:10.1007/s00217-012-1715-x.
[24] 胡文忠, 姜爱丽, 杨宏, 等. 茉莉酸甲酯对鲜切苹果生理生化变化的影响[J]. 食品工业科技, 2012, 33(16): 338-341; 346.
[25] 谭谊谈, 曾凯芳. 抗坏血酸、半胱氨酸与氯化钙复合处理对鲜切芋艿褐变的影响[J]. 食品科学, 2014, 35(4): 231-235. DOI:10.7506/spkx1002-6630-201404047.
[26] 范林林, 李萌萌, 冯叙桥, 等. 壳聚糖涂膜对鲜切苹果贮藏品质的影响[J]. 食品科学, 2014, 35(22): 350-355. DOI:10.7506/spkx1002-6630-201422068.
[27] ZHANG T, CHE F B, ZHANG H, et al. Effect of nitric oxide treatment on chilling injury, antioxidant enzymes and expression of the CmCBF1 and CmCBF3 genes in cold-stored Hami melon (Cucumis melo L.) fruit[J]. Postharvest Biology and Technology, 2017, 127: 88-98.DOI:10.1016/j.postharvbio.2017.01.005.
[28] 林源秀, 顾欣昕, 汤浩茹. 植物谷胱甘肽还原酶的生物学特性及功能[J]. 中国生物化学与分子生物学报, 2013, 29(6): 534-542.
[29] LUNADEI L, GALLEGUILLOS P, IGLESIAS B D, et al. A multispectral vision system to evaluate enzymatic browning in fresh-cut apple slices[J]. Postharvest Biology and Technology, 2011, 60(3): 225-234. DOI:10.1016/j.postharvbio.2011.02.001.
[30] CANTOS E, TUDELA J A, GIL M I, et al. Phenolic compounds and related enzymes are not rate-limiting in browning development of freshcut potatoes[J]. Journal of Agricultural and Food Chemistry, 2002, 50(10):3015-3023. DOI:10.1021/jf0116350.
[31] LI Z G, ZHANG Y X, GE H B. The membrane may be an important factor in browning of fresh-cut pear[J]. Food Chemistry, 2017, 230: 265-270. DOI:10.1016/j.foodchem.2017.03.044.
[32] HU K D, WANG Q, HU L Y, et al. Hydrogen sulfide prolongs postharvest storage of fresh-cut pears (Pyrus pyrifolia) by alleviation of oxidative damage and inhibition of fungal growth[J]. PLoS ONE, 2014,9(1): e85524. DOI:10.1371/journal.pone.0085524.
[33] SUN Y, ZHANG W, ZENG T, et al. Hydrogen sulfide inhibits enzymatic browning of fresh-cut lotus root slices by regulating phenolic metabolism[J]. Food Chemistry, 2015, 177: 376-381. DOI:10.1016/j.foodchem.2015.01.065.
[34] LEÓN J, ROJO E, SÁNCHEZ-SERRANO J J. Wound signalling in plants[J]. Journal of Experimental Botany, 2001, 52: 1-9. DOI:10.1093/jexbot/52.354.1.
[35] SHARMA P, JHA A B, DUBEY R S, et al. Reactive oxygen species,oxidative damage, and antioxidative defense mechanism in plants under stressful conditions[J]. Journal of Botany, 2012, 2012: 1-26.DOI:10.1155/2012/217037.