近年来有研究指出,过多的摄入动物性蛋白(尤其是红肉)与较高的死亡率相关,然而多摄入植物性蛋白则与死亡风险的降低相关[1]。王金芯[2]和杜春红[3]报道称蛋白质代谢可引起血压波动,应限制动物蛋白。因此,人们应选优质蛋白,其中植物蛋白质可占50%,动物蛋白选用鱼肉、鸡肉等白肉蛋白。前期研究表明,食物中的蛋白经降解成为小分子多肽,且可以直接被人体消化吸收[4],这些小分子多肽具有降血脂、增强免疫力、改善心血管功能和预防心血管疾病等功效。高血压是一种常见的心血管疾病,它不仅患病率高,而且常引起严重的心、脑、肾等其他疾病[5]。因此,研究生产高效安全的降血压肽已经成为国内外科学家积极探索的一项重要课题。血管紧张素转化酶(angiotensin conversion enzyme,ACE)在激肽释放酶-激肽系统中能使舒缓激肽失活,使激肽释放酶-激肽系统处于抑制状态,从而导致血管收缩,血压升高,因此抑制ACE的活性是改善高血压,从而抑制动脉粥样硬化等心血管疾病的重要途径之一。
自从Ferreira等[6]首次从南美洲蛇毒中发现天然ACE抑制肽以来,研究学者们又开始从更多的蛋白源中获取ACE抑制肽,包括植物蛋白来源,如谷类蛋白:大米蛋白[7]、燕麦蛋白[8]、小麦蛋白[9]和玉米蛋白[10];豆类蛋白:大豆蛋白[11]、豌豆蛋白[12]、绿豆蛋白[13],肉类蛋白来源,如鸡肉蛋白[14-15]、猪肉蛋白[16-17]、牛肉蛋白、鱼肉蛋白[18]、蚕蛹蛋白[19],乳制品蛋白来源[20],如牛奶中的酪蛋白[21]以及其他蛋白来源。这些蛋白的ACE抑制肽功能活性虽然已有众多报道,但是关于动植物源蛋白肽的横向比较研究以及借此探究不同蛋白来源的ACE抑制肽对于血压影响的差异尚需明确。
尽管ACE抑制肽的体外活性研究较多,但是功能肽在进入人体后经胃肠道消化酶消化,使得肽的空间结构、氨基酸序列、分子质量等发生改变。因此,ACE抑制肽经过胃肠道消化酶的作用后其降血压活性发生怎样的变化亦受到研究者关注。并且,多肽能否穿过小肠壁,能否最后到达靶器官等都影响着其活性的发挥。因此,应用模拟体外消化模型来评价多肽的ACE抑制活性对于功能肽的开发更具有现实意义。Wendy等[22]发现大豆分离蛋白经模拟消化后能直接产生ACE抑制肽。因此,应用模拟体外消化模型来评价多肽的ACE抑制活性有着重要的意义。
本研究采用植物蛋白(大米蛋白、燕麦蛋白、大豆蛋白、豌豆蛋白)、红肉蛋白(猪肉蛋白、牛肉蛋白)、白肉蛋白(鸡肉蛋白),3 类不同来源的蛋白作为原料。在模拟胃肠道消化环境的基础上,研究3 类蛋白在消化过程中ACE抑制肽活性变化以及与水解度、分子质量分布和氨基酸组成的相互关系,以探讨植物蛋白、红肉蛋白和白肉蛋白在血压调节功能上的差异以及形成的原因,为蛋白资源的深度开发、保健食品、降压药品的开发和人们在日常膳食中对蛋白来源的选择提供科学的理论依据。
1 材料与方法
1.1 材料与试剂
大米蛋白 安徽陆荣生物技术有限公司;燕麦粉河北石家庄凌峰农副产品开发公司;大豆蛋白、豌豆蛋白 烟台东方蛋白科技有限公司;鸡肉蛋白、猪肉蛋白、牛肉蛋白 山东青岛德润隆食品有限公司;胃蛋白酶、胰蛋白酶 北京索莱宝科技有限公司;ACE、马尿酰组氨酰亮氨酸(Hip-His-Leu,HHL) 美国Sigma公司;高分子质量蛋白质标准品(10~200 kDa)英国GE Healthcare公司;其他试剂均为国产分析纯。燕麦蛋白采用碱溶酸沉自制。
1.2 仪器与设备
DGG-9203A电热恒温鼓风干燥箱 上海森新实验仪器有限公司;Kieltec Analysister全自动凯氏定氮仪 瑞典FOSS仪器有限公司;U-3010紫外-可见分光光度计日本日立公司;UB-7 pH计 美国丹佛仪器公司;TGL-16台式高速冷冻离心机 湖南湘一实验室仪器开发有限公司;WE-2恒温水浴振荡器 天津市欧诺仪器仪表有限公司;DF-101S集热式恒温加热磁力搅拌器巩义市予华仪器有限责任公司;LGJ-25C型冷冻干燥机北京四环科学仪器厂有限公司;Mini-Protean电泳仪美国Bio-Rad公司;FluorChem FC2凝胶成像系统 美国Alpha公司;1200高效液相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 原料蛋白基本成分的测定
采用GB 5009.3—2010《食品中水分的测定》,105 ℃常压干燥法测定水分含量;采用GB/T 5512—2008《粮油检验 粮食中粗脂肪含量测定》,索氏抽提法测定脂肪含量;采用GB 5009.4—2010《食品中灰分的测定》,550 ℃灼烧法测定灰分含量;采用GB 5009.5—2010《食品中蛋白质的测定》,凯氏定氮法测定蛋白质含量。氮转换系数:大米蛋白为5.95;燕麦蛋白为5.83;大豆及豌豆蛋白为6.25;猪肉、牛肉、鸡肉蛋白为6.25。其中,蛋白质、脂肪、灰分均以干质量计。
1.3.2 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfonate polyacrylamide gel electrophoresis,SDSPAGE)
采用12%的分离胶和5%的浓缩胶对大米蛋白、燕麦蛋白、大豆蛋白、豌豆蛋白、猪肉蛋白、牛肉蛋白、鸡肉蛋白进行SDS-PAGE分析,样品在浓缩胶时电压70 V,样品到分离胶之后,电压升高到120 V,电泳过程保持电流稳定。R-250考马斯亮蓝染色3 h,用脱色液脱色。FluorChemFC2凝胶成像系统拍照。
1.3.3 蛋白体外模拟胃肠道消化
体外消化过程参照Wendy等[22]的方法,并略作修改。将1 g原料蛋白中加入20 mL的蒸馏水配制成质量分数为5%的溶液,煮沸2 min,冷却后,用1 mol/L的盐酸溶液调pH值至2.0,加入0.04 g胃蛋白酶(占底物质量的4%),37 ℃恒温反应1 h;用0.9 mol/L的NaHCO3溶液将pH值调至5.3,再用1 mol/L的NaOH溶液调pH值至7.0,加入0.04 g胰蛋白酶(占底物质量的4%),37 ℃恒温反应2 h,沸水浴10 min终止反应,分别在消化过程中(0、30、60、90、120、180 min)取样。冷却后离心(14 000 r/min,10 min)收集上清液,随后冷冻干燥于4 ℃冰箱保存备用。
1.3.4 水解度的测定
采用邻苯二甲醛法[23],将5 mL试管中加入3.00 mL邻苯二甲醛溶液,再加入400 μL稀释至一定倍数的水解上清液,室温条件下反应2 min后在波长340 nm处测定光密度。同时用丝氨酸标准溶液(0.951 6 mmol/L)做参考,用水做空白实验。按公式(1)计算每克蛋白质中丝氨酸氨基含氨基的量:
式中:Serine NH2为每克蛋白质中含丝氨酸氨基的量/(mmol/g);X为样品质量/g;P为样品中的蛋白质量分数/%;N为稀释倍数;V为上清液体积/L。
按公式(2)计算水解度:
式中:htot、β、α均为常数;htot为每克原料蛋白的肽键毫摩尔数/(mmol/g);大米蛋白、燕麦蛋白β、α分别为0.4和1,htot=7.72;大豆蛋白,豌豆蛋白β、α分别为0.342和0.970,htot=7.8;猪肉蛋白、牛肉蛋白、鸡肉蛋白β、α分别为0.40和1.00,htot=7.6。
1.3.5 ACE抑制活性的测定
用含有0.3 mol/L NaCl的0.1 mol/L硼酸盐缓冲液(pH 8.3)将HHL配成5 mmol/L溶液。将80 μL的5.0 mmol/L HHL溶液和20 μL的样品加入到1.5 mL EP管中,在37 ℃反应5 min后,再加入20 μL活力为0.1 U/mL ACE溶液,旋涡混匀后在37 ℃反应30 min,用200 μL的1.0 mol/L盐酸溶液终止反应。同时用等量硼酸盐缓冲液代替样品做空白实验。
采用高效液相色谱法测定马尿酸的含量[24]。色谱条件:ZORBAX Eclipse Plus-C18色谱柱(150 mm×4.6 mm);流动相为乙腈-水-三氟乙酸溶液(50∶50∶0.05,V/V);检测波长228 nm;流速0.4 mL/min;柱温30 ℃;进样量10 μL。按公式(3)计算ACE抑制率:
式中:A为含有样品和ACE反应液的峰面积;B为不含样品,含有ACE反应液的峰面积。
1.3.6 胃蛋白酶、胰蛋白酶消化产物的分子质量分布
采用高效液相色谱法测定[25]。将胃蛋白酶和胰蛋白酶消化以后的上清液稀释一定倍数后,用0.45 μm微孔过滤膜过滤后上色谱柱。色谱条件:TSK gel 2000SWXL色谱柱(300 mm×7.8 mm),流动相为乙腈-水-三氟乙酸溶液(45∶55∶0.1,V/V);检测波长220 nm;流速0.5 mL/min;柱温30 ℃;进样量10 μL。分子质量校正标准品:乙氨酰氨-乙氨酰氨-乙氨酰氨(mw=189 Da)、乙氨酰氨-乙氨酰氨-精氨酸(mw=451 Da)、杆菌肽(mw=1450 Da)、抑肽酶(mw=6 500 Da)和细胞色素C(mw=12 500 Da)。
1.3.7 蛋白消化产物的氨基酸组成分析
采用酸水解法,参照GB/T 5009.124—2003《食品中氨基酸的测定》。称取40~60 mg酶解后冷冻干燥的样品,将10 mL 6 mol/L盐酸溶液加入到水解管中,用氮气吹干后盖好盖子,放入到110 ℃恒温干燥箱内,水解24 h以后,取出冷却。打开水解管,将水解液过滤后,用纯净水将水解管冲洗3 次,液体全部转移到50 mL容量瓶,定容后取1 mL滤液,氮气吹干,加5 mL 0.02 mol/L盐酸复溶。使用氨基酸自动分析仪测定氨基酸组成。
其中,色氨酸采用高效液相色谱法测定[26]。取70~80 mg冷冻干燥的样品,将1.5 mL 4 mol/L氢氧化钠溶液加入到离心管中,用镊子将离心管放入到水解管中,用氮气吹干后盖好盖子,放入到110 ℃恒温干燥箱内,水解24 h以后,取出冷却。打开水解管,将1.14 mL 6 mol/L盐酸溶液加入到离心管中,用纯净水将离心管和水解管冲洗3 次,调pH 4~5,液体全部转移到50 mL容量瓶,定容后取1 mL滤液,用0.45 μm微孔过滤膜过滤后上色谱柱。色谱条件:Agela Technologies Innoval-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-乙酸钠溶液(5∶95,V/V);检测波长280 nm,流速1 mL/min;柱温25 ℃;进样量20 μL。
1.4 数据处理
每组实验重复3 次,采用Excel软件计算,结果以 表示,所有图中误差值采用标准差值,采用Origin 9.0统计软件对数据进行分析,组间比较采用T检验。
表示,所有图中误差值采用标准差值,采用Origin 9.0统计软件对数据进行分析,组间比较采用T检验。
2 结果与分析
2.1 蛋白的基本成分分析
对植物蛋白(大米、燕麦、大豆、豌豆)、红肉蛋白(猪肉、牛肉)和白肉蛋白(鸡肉)3 类蛋白样品的基本成分进行了分析,如表1所示。3 类蛋白样品的蛋白质质量分数均达到85%以上,高于谢柳倩等[27]研究ACE抑制活性中所用蜈蚣蛋白的含量,且对ACE抑制活性影响较大的脂肪和灰分质量分数相对较低,较高的纯度可保证不同蛋白的ACE抑制活性比较研究中实验结果的准确性。
表1 植物、红肉和白肉3 类原料蛋白的基本组成(n=3)
Table1 Proximate composition of plant, red meat and white meat proteins (n= 3)
2.2 蛋白的SDS-PAGE分析

图1 植物、红肉和白肉3 类蛋白的SDS-PAGE图谱
Fig. 1 SDS-PAGE patterns of plant, red meat and white meat proteins
通过对3 类蛋白进行了SDS-PAGE分析,如图1所示。植物蛋白分子质量分布范围在10~100 kDa之间,红肉和白肉蛋白分子质量分布范围在30~200 kDa之间。其中,大米蛋白最大分子质量为97 kDa,3 条带在60~80 kDa之间,较宽且颜色较深,说明在这3 个条带分子质量大小的蛋白含量较大,分子质量最小的在10~15 kDa之间,该结果与相关报道一致[28];燕麦蛋白分子质量主要5 个条带分布,分别是13~18、31~37、50~60 kDa以及60~66 kDa左右,其中最大分子质量大概在70~72 kDa之间,与王霞霞等[29]报道的一致;大豆和豌豆蛋白分子量质分布范围较广,最大分子质量为85 kDa和83 kDa,最小分子质量为10 kDa左右,在65~80、50、25~40 kDa之间也有条带分布,与陈振家等[30]报道的一致;猪肉、牛肉和鸡肉蛋白,出现电泳条带的位置相似,第1个条带在30 kDa左右,第2个条带在70~80 kDa之间,而且大于200 kDa的蛋白含量较多,与方绍庆等[31]报道一致。由3 类蛋白的电泳条带分析可知,在体外消化前,红肉和白肉蛋白分子质量显著高于植物蛋白。
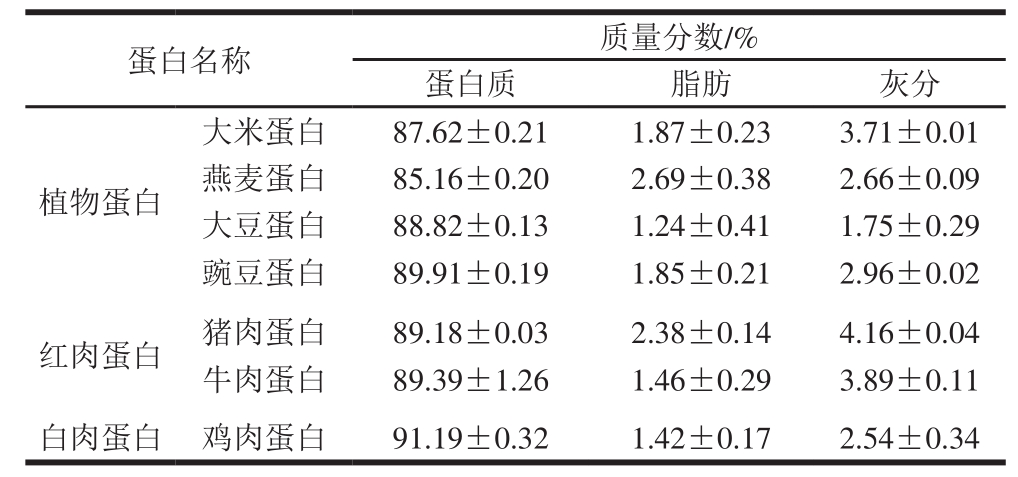
2.3 蛋白体外模拟胃肠消化产物的水解度变化
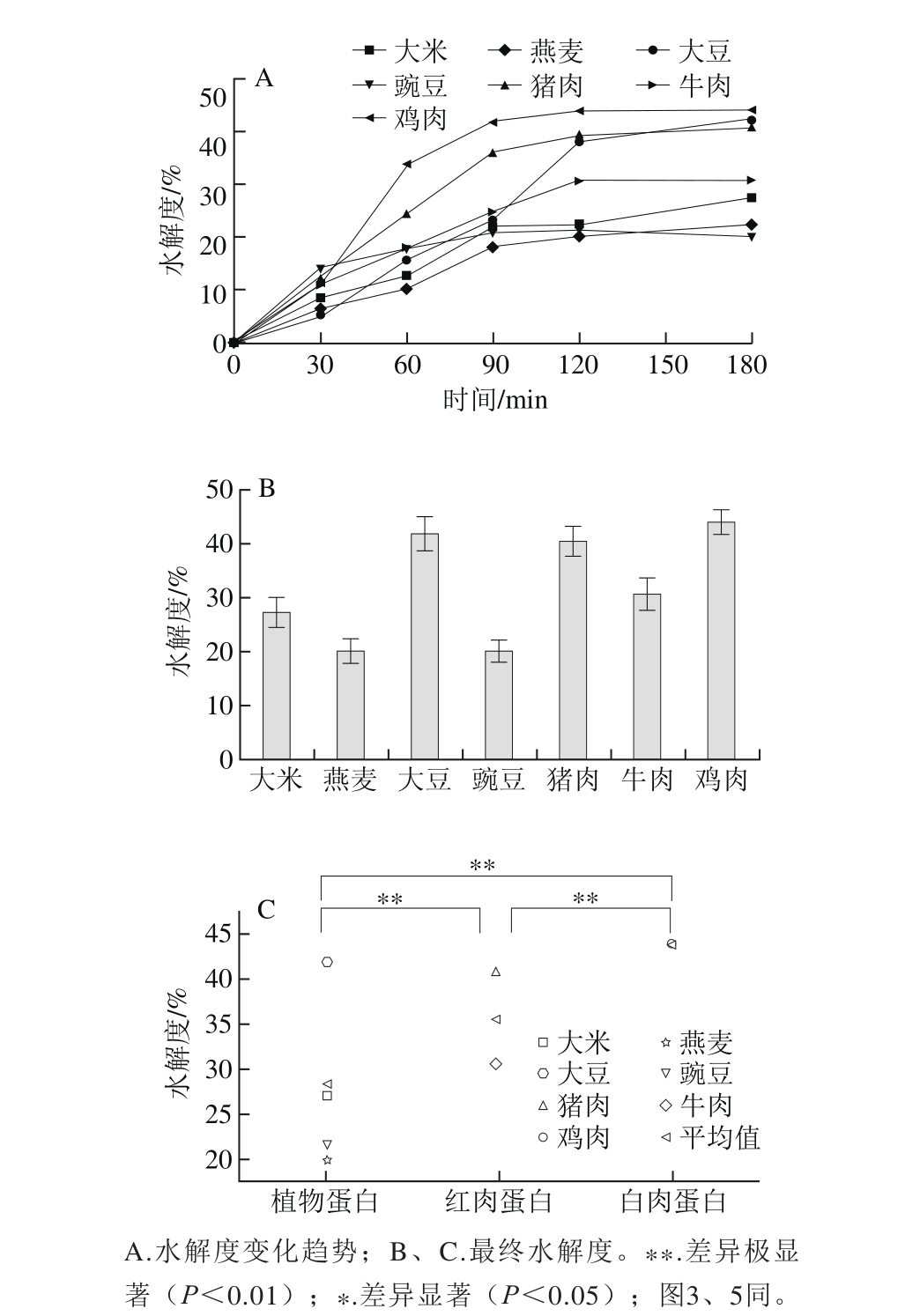
图2 体外模拟胃肠消化酶解3 类蛋白的水解度变化
Fig. 2 Changes in degree of hydrolysis of plant, red meat and white meat proteins during stimulated in vitro gastrointestinal digestion
蛋白质的水解度,即测定生成的有效蛋白肽。图2A为植物蛋白、红肉蛋白和白肉蛋白被胃蛋白酶、胰蛋白酶消化水解的进程曲线。前60 min为胃蛋白酶水解阶段,60~180 min为胰蛋白酶水解阶段,蛋白消化液的水解度随消化时间的延长而增加,到120 min左右,各蛋白消化产物基本达到最高水解度,之后变化较缓慢。这是因为随着消化反应的进行,消化产物浓度增大,底物浓度减小,蛋白酶的活性受到抑制等综合因素所致[32]。由图2B、C显示可知,3 类不同来源蛋白经过体外消化最终水解度有一定的差别,白肉蛋白水解度极显著高于红肉蛋白和植物蛋白(P<0.01),在3 h内其最大水解度可达44.04%,红肉蛋白次之,植物蛋白的水解度较低,最低仅为20.15%,这与报道中的一致,即仅从消化性方面看,红肉和白肉蛋白比植物蛋白更易消化[33],这是因为植物蛋白外周有纤维薄膜的包裹而难以消化,故红肉和白肉蛋白比植物蛋白更易消化和吸收。
2.4 蛋白体外模拟胃肠道消化产物的ACE抑制活性变化
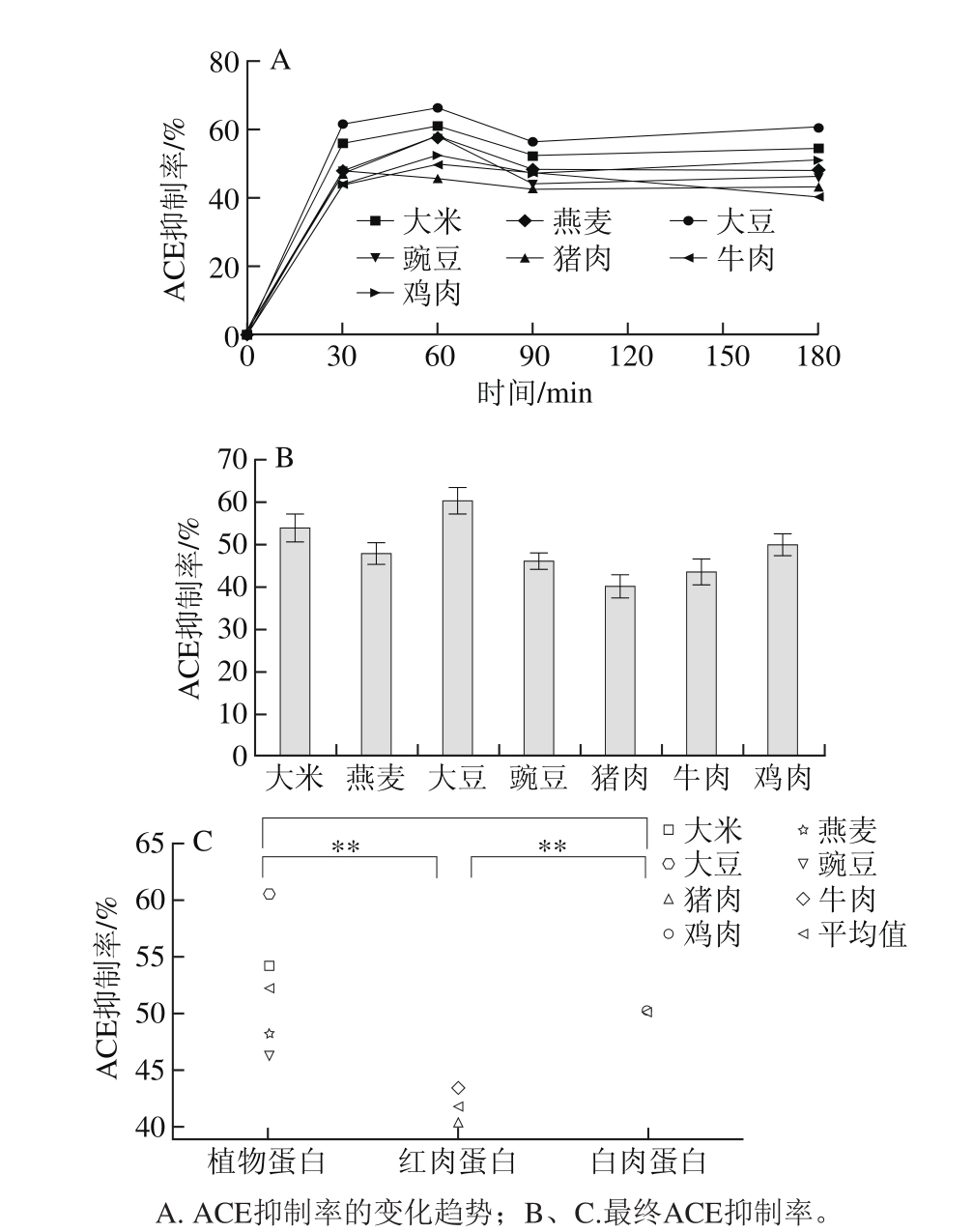
图3 体外模拟胃肠消化酶解3 类蛋白的ACE抑制活性变化
Fig. 3 Changes in ACE inhibitory activity of plant, red meat and white meat proteins during in vitro gastrointestinal digestion
由图3A、B可知,3 类不同来源蛋白在不同消化时间段的变化趋势是一致的,且其ACE抑制活性的产生主要集中在胃蛋白酶阶段,即在60 min内的消化产物快速产生ACE抑制活性。加入胰蛋白酶后,3 类蛋白的ACE抑制活性都显著降低,90 min以后ACE抑制活性变化较平缓,与刘志伟等[34]对大豆蛋白体外消化酶解产物ACE抑制活性研究相一致。由图3C可知,植物蛋白消化产物抑制ACE的活性极显著高于红肉蛋白(P<0.01),白肉蛋白消化产物抑制ACE的活性极显著高于红肉蛋白(P<0.01),植物蛋白与白肉蛋白无显著性差异(P>0.05)。以上结果表明,动植物蛋白在血压调节功能上的差异可能与其ACE抑制活性的差异相关。
2.5 胃蛋白酶和胰蛋白酶消化产物的分子质量分布
图4 体外模拟胃肠消化1 h和3 h酶解产物的分子质量分布
Fig. 4 Molecular weight distribution profiles of peptides after in vitro gastrointestinal digestion for 1 h and 3 h
如图4所示,3 类蛋白经胃蛋白酶和胰蛋白酶消化以后,消化液中的组分其分子质量分布广泛。胃蛋白酶消化产物分子质量集中在3 000 Da以下,经胰蛋白酶消化以后,3 类蛋白消化产物的分子质量分布是相似的,分子质量范围在1 000 Da以下的多肽混合物的含量最高。其中,植物蛋白消化产物大于5 000 Da的多肽占5%左右,红肉和白肉蛋白消化产物大于5 000 Da的多肽占比不到1%,该结果与模拟体外消化的水解度变化结果一致,即水解度越大,它们的分子质量越小。随着水解度的增大,分子质量的减小,3 类蛋白消化产物的ACE活性抑制率均相应增大,与Hyun[35]和Oshima[36]等报道的一致,即具有ACE抑制活性的肽分子质量大小集中在1 500 Da左右。尽管肉类蛋白的分子质量小、水解度高,但是同等浓度条件下的ACE抑制活性却弱于植物蛋白,表明ACE活性差异可能受分子质量以外的其他因素影响。
2.6 蛋白消化产物氨基酸组成的变化
近年来,国内外研究者从很多不同膳食蛋白中酶解得到具有ACE抑制活性的多肽,相关研究得出,若序列上存在芳香性和疏水性氨基酸残基的多肽,其具有较高ACE抑制活性[19]。因此,本研究除上述的分子质量外,还关注了消化产物中相关氨基酸的含量。

图5 体外模拟胃肠消化酶解3 类蛋白的芳香性氨基酸和疏水性氨基酸含量
Fig. 5 Contents of aromatic and hydrophobic amino acids of plant, red meat and white meat proteins after in vitro gastrointestinal digestion
蛋白经过胃蛋白酶和胰蛋白酶消化后产物的芳香性氨基酸组成如图5A、B所示,植物蛋白肽中的芳香性氨基酸(Tyr、Phe和Trp)含量极显著高于红肉和白肉蛋白肽(P<0.01),白肉蛋白肽的芳香性氨基酸含量显著高于红肉蛋白肽(P<0.05)。此外,由图5C、D可知,植物蛋白肽中的疏水性氨基酸含量极显著高于红肉蛋白肽(P<0.01),白肉蛋白肽的疏水性氨基酸含量显著高于红肉蛋白肽(P<0.05),但植物蛋白肽与白肉蛋白肽无显著性差异(P>0.05)。由这一结果可以看出,3 类蛋白中消化产物的疏水性氨基酸含量越高,则ACE抑制活性越高,表明高疏水性氨基酸含量可能是植物蛋白肽具有高的ACE抑制活性的主要原因之一。
但是,燕麦蛋白与豌豆蛋白的芳香性和疏水性氨基酸含量低于红肉蛋白,ACE抑制活性反而高于红肉蛋白,因此,芳香族和疏水性氨基酸含量还不能完全解释植物蛋白的ACE抑制活性高于红肉的原因,这可能是由于不同蛋白来源的功能活性肽通过其他的作用方式发挥ACE抑制活性以及血压调节功能的作用,例如植物蛋白中存在更多的特定的、亦或活性更高的ACE抑制功能肽段等,但具体原因仍有待于深入研究。
3 结 论
植物蛋白与白肉蛋白消化产物的ACE抑制活性极显著高于红肉蛋白(P<0.01),这一结果与植物蛋白源的血压调节功能高于红肉的前人研究结果相一致,表明动植物蛋白在血压调节功能上的差异可能与其ACE抑制活性的大小直接相关。总体上看,植物蛋白消化产物的疏水性氨基酸含量极显著高于红肉蛋白肽(P<0.01),这一结果表明高疏水性氨基酸含量是植物蛋白肽具有比较高的ACE抑制活性的主要原因之一。另一方面,燕麦蛋白与豌豆蛋白的芳香族和疏水性含量低于红肉蛋白肽,而ACE抑制活性高于红肉蛋白肽,因此单纯从芳香族和疏水性氨基酸含量解释不同蛋白源蛋白肽的ACE抑制活性乃至血压调节功能的差异仍不尽然,具体的作用机制仍有待明确。
参考文献:
[1] SONG M, FUNG T T, HU F B, et al. Association of animal and plant protein intake with all-cause and cause-specific mortality[J].JAMA Internal Medicine, 2016, 176(10): 1453-1463. DOI:10.1001/jamainternmed.2016.4182.
[2] 王金芯. 浅谈高血压患者的健康教育与饮食护理[J]. 中国中医药科技, 2014(2): 334-335.
[3] 杜春红. 中老年高血压病人的饮食护理[J]. 世界最新医学信息文摘(连续型电子期刊), 2015, 15(47): 225. DOI:10.3969/j.issn.1671-3141.2015.47.182.
[4] GILBERT E R, WONG E A, WEBB K E. Board-invited review:peptide absorption and utilization: implications for animal nutrition and health[J]. Journal of Animal Science, 2008, 86(9): 2135-2155.DOI:10.2527/jas.2007-0826.
[5] 徐伟仙, 佘飞, 李昭屏, 等. 高血压合并肾功能不全患者的降压治疗[J]. 中华高血压杂志, 2014(7): 618-619. DOI:10.16439/j.cnki.1673-7245.2014.07.006.
[6] FERREIRA S H, ROCHA E S M. Potentiation of bradykinin and eledoisin by BPF (bradykinin potentiating factor) from Bothrops jararaca venom[J]. Cellular and Molecular Life Sciences, 1965, 21(6):347-349. DOI:10.1007/BF02144709.
[7] 陈倩倩, 佟立涛, 钟葵, 等. 大米蛋白酶解物的ACE抑制活性研究[J]. 现代食品科技, 2015, 31(3): 91-96. DOI:10.13982/j.mfst.1673-9078.2015.3.016.
[8] 张晓平, 赵世锋, 蒋琼, 等. 酶解燕麦蛋白制备ACE抑制肽的研究[J]. 食品科学, 2009, 30(11): 189-193. DOI:10.3321/j.issn:1002-6630.2009.11.042.
[9] 辛志宏, 马海乐, 吴守一, 等. 从小麦胚芽蛋白中分离和鉴定血管紧张素转化酶抑制肽的研究[J]. 食品科学, 2003, 24(7): 130-133.DOI:10.3321/j.issn:1002-6630.2003.07.032.
[10] 陈贵堂, 赵霖. 食物源生物活性肽及其营养生理价值[J]. 中国临床营养杂志, 2005, 13(5): 312-315. DOI:10.3760/cma.j.issn.1674-635X.2005.05.015.
[11] 张国胜, 孔繁东, 祖国仁, 等. 大豆蛋白抗高血压活性肽的研究[J]. 中国乳品工业, 2004, 32(8): 12-14. DOI:10.3969/j.issn.1001-2230.2004.08.004.
[12] 唐力. 豌豆蛋白有助于改善血压及肾病[J]. 心血管病防治知识,2009(5): 30-30.
[13] LI G H, LE G W, LIU H, et al. Mung-bean protein hydrolysates obtained with alcalase exhibit angiotensin Ⅰ-converting enzyme inhibitory activity[J]. Food Science & Technology International, 2005,11(4): 281-287. DOI:10.1177/1082013205056781.
[14] DZIUBA J, MINKIEWICZ P, PLITNIK K. Chicken meat proteins as potential precursors of bioactive peptides[J]. Polish Journal of Food and Nutrition Sciences, 1996, 5(4): 85-96.
[15] SAIGA A, OKUMURA T, MAKIHARA T, et al. AngiotensinⅠ-converting enzyme inhibitory peptides in a hydrolyzed chicken breast muscle extract[J]. Journal of Agricultural and Food Chemistry,2003, 51(6): 1741-1745. DOI:10.1021/jf020604h.
[16] 吴琼英, 马海乐, 崔恒林, 等. 猪肺血管紧张素转化酶的提取纯化及其性质研究[J]. 食品科学, 2004, 25(9): 71-74. DOI:10.3321/j.issn:1002-6630.2004.09.012.
[17] ESCUDERO E, TOLDRA F, SENTANDREU M A, et al.Antihypertensive activity of peptides identified in the in vitro gastrointestinal digest of pork meat[J]. Meat Science, 2012, 91(3):382-384. DOI:10.1016/j.meatsci.2012.02.007.
[18] FUJITA H, YOSHIKAWA M. LKPNM: a prodrug-type ACE-inhibitory peptide derived from fish protein[J]. Immunopharmacology,1999, 44(1): 123-127. DOI:10.1016/S0162-3109(99)00118-6.
[19] CHEN J, WANG Y, ZHONG Q, et al. Purification and characterization of a novel angiotensin-Ⅰ converting enzyme (ACE) inhibitory peptide derived from enzymatic hydrolysate of grass carp protein[J]. Peptides,2012, 33(1): 52-58. DOI:10.1016/j.peptides.2011.11.006.
[20] MEISEL H. Biochemical properties of regulatory peptides derived from milk proteins[J]. Peptide Science, 1997, 43(2): 119-128.
[21] MARUYAMA S, SUZUKI H. A peptide inhibitor of angiotensin Ⅰconverting enzyme in the tryptic hydrolysate of casein[J]. Agricultural and Biological Chemistry, 1982, 46(5): 1393-1394. DOI:10.1080/0002 1369.1982.10865255.
[22] WENDY M Y L O, EUNICE C Y L C. Angiotensin Ⅰ converting enzyme Inhibitory peptides from in vitro pepsin-pancreatin digestion of soy protein[J]. Journal of Agriculture and Food Chemistry, 2005,53: 3369-3376. DOI:10.1021/jf048174d.
[23] NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science, 2001, 66(5): 642-646. DOI:10.1111/j.1365-2621.2001.tb04614.x.
[24] WANG C, TIAN J, WANG Q. ACE inhibitory and antihypertensive properties of apricot almond meal hydrolysate[J]. European Food Research and Technology, 2011, 232(3): 549-556. DOI:10.1007/s00217-010-1411-7.
[25] SU G, REN J, ZHAO M, et al. Comparison of Superdex Peptide HR 10/30 column and TSK Gel G2000 SWXL column for molecular weight distribution analysis of protein hydrolysates[J]. Food and Bioprocess Technology, 2013, 6(12): 3620-3626. DOI:10.1007/s11947-012-0965-8.
[26] 李家胜, 陈忠明. 高效液相色谱法测定饲料中色氨酸含量[J]. 科技通报, 1999, 15(3): 219-222. DOI:10.3969/j.issn.1001-7119.1999.03.014.
[27] 谢柳倩, 赵灵灵, 袁建娜, 等. 蜈蚣蛋白水解产物ACE抑制活性的初步研究[J]. 世界科学技术-中医药现代化, 2014, 1(10): 2214-2218.DOI:10.11842/wst.2014.10.027.
[28] 王章存, 姚惠源. 大米蛋白质的酶法水解及其性质研究[J]. 中国粮油学报, 2003, 18(5): 5-7. DOI:10.3321/j.issn:1003-0174.2003.05.002.
[29] 王霞霞, 柴守玺, 常磊, 等. 燕麦种子蛋白质组的GeLC-MS/MS分析[J]. 草地学报, 2012, 20(1): 108-115. DOI:10.11733/j.issn.1007-0435.2012.01.018.
[30] 陈振家, 施小迪, 杜昱蒙, 等. 不同热处理大豆分离蛋白凝胶冻藏特性[J]. 农业工程学报, 2016, 32(11): 283-289. DOI:10.11975/j.issn.1002-6819.2016.11.040.
[31] 方绍庆, 鲁闽, 许红岩, 等. SDS-聚丙烯酰胺凝胶电泳法鉴定动物肌肉蛋白热变性的研究[J]. 肉类研究, 2006, 20(5): 41-44.DOI:10.3969/j.issn.1001-8123.2006.05.015.
[32] SABIHA-HANIM S, NOOR M A M, ROSMA A. Effect of autohydrolysis and enzymatic treatment on oil palm (Elaeis guineensis Jacq.) frond fibres for xylose and xylooligosaccharides production[J].Bioresource Technology, 2011, 102(2): 1234-1239. DOI:10.1016/j.biortech.2010.08.017.
[33] 刘源, 安星兰, 王志红, 等. 不同蛋白质来源配合饲料对犬饲喂效果及养分消化率研究[J]. 实验动物科学与管理, 2004, 21(4): 22-24.DOI:10.3969/j.issn.1006-6179.2004.04.007.
[34] 刘志伟, 刘秀梅, 郑梦云. 大豆蛋白体外酶解物中血管紧张素转化酶抑制剂活性肽研究[J]. 营养学报, 2007, 29(1): 69-73.DOI:10.3321/j.issn:0512-7955.2007.01.019.
[35] HYUN C K, SHIN H K. Utilization of bovine blood plasma proteins for the production of angiotensin Ⅰ converting enzyme inhibitory peptides[J]. Process Biochemistry, 2000, 36(1): 65-71. DOI:10.1016/S0032-9592(00)00176-X.
[36] OSHIMA G, SHIMABUKURO H, NAGASAWA K. Peptide inhibitors of angiotensin Ⅰ-converting enzyme in digests of gelatin by bacterial collagenase[J]. Biochimica et Biophysica Acta, 1979, 566:128-137. DOI:10.1016/0005-2744(79)90255-9.