荞麦为蓼科荞麦属(Fagopyrum Mill.)一年生双子叶植物,主要包括普通荞麦(Fagopyrum esculentum Moench)和鞑靼荞麦(F. tartaricum Gaertn)两种,在我国分别又称甜荞和苦荞。荞麦不仅有含量很高的蛋白质、脂肪、维生素和微量元素等基本营养元素,还含大量的多酚类物质。多酚类化合物是苦荞籽粒中最重要的功能因子之一,在植物体内起到抗氧化损伤的作用。苦荞黄酮是一类多酚类化合物,主要包括芦丁、槲皮素、山柰酚等天然化合物。其中,芦丁占苦荞总黄酮含量的70%~90%,其具有抗感染、抗突变、抗肿瘤、平滑松弛肌肉、维持血管张力等的作用,是荞麦发挥抗氧化作用的主要功能成分之一,具有很高的药用价值[1]。
微酸性电解水(slightly acidic electrolyzed water,SAEW)在指无隔膜的电解装置中电解稀盐酸溶液,获得的pH值(5.0~6.5)、氧化还原电位(oxidationreduction potential,ORP)在800 mV左右,有效氯质量浓度(available chlorine concentration,ACC)为10~30 mg/L 的功能水[2]。SAEW具有成本低廉、pH值适中、对人体无危害,对物体几乎没有腐蚀性等优点。相比较强酸性电解水具有更稳定的物理化学性质,遮光密闭环境下放置40 d,ACC仍为初始值的78%[3]。
大量研究表明,萌发可以改善谷物、豆类的食用品质,提高其营养价值[4-7]。萌发的荞麦具有更高质量的蛋白质及更加合理的氨基酸组成,同时其体内的酚、酮等活性物质含量也有所增加[8]。有研究表明,SAEW对于许多种类芽苗菜活性物质含量都表现出了促进及提升作用[9-11],但其对于苦荞萌发的影响却缺少系统的研究。苦荞适于在pH 5.0~6.0的微酸性环境下生长[12],SAEW的pH值范围恰好适宜苦荞的生长。本研究以苦荞种子为原料,采用不同ACC的SAEW进行培育,生产苦荞芽,旨在找出可提高苦荞活性物质含量,增强其抗氧化能力的适宜条件和SAEW指标范围,为扩大苦荞及其相关产品应用提供新的途径。
1 材料与方法
1.1 材料与试剂
苦荞种子购自太谷县晋农瓜菜种子服务部; HCl(食品级) 北京化学试剂公司;甲醇(色谱纯)美国Fisher Scientific公司;芦丁、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、水溶性VE(Trolox)(均为分析纯) 美国Sigma公司;2,4,6-三吡啶基三嗪(2,4,6-triphenyl-2H-tetrazolium, chloride,TPTZ,分析纯) 南京都莱生物技术有限公司;2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS,分析纯) 东京化成工业株式会社。
1.2 仪器与设备
SAEW发生装置,由本实验室自行研制;RC-3F高浓度有效氯测定仪 日本KRK笠原理化公司;WS 150 III恒温恒湿培养箱 上海树立仪器仪表有限公司;LGJ-18真空冷冻干燥机 北京四环科学仪器厂;UV-1600紫外-可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 SAEW的制备
为研究不同ACC的SAEW对苦荞芽活性成分含量的影响,分别制备了pH 5.5,ACC为10、20、30、40、50、60 mg/L的SAEW,并以自来水处理组作为对照。不同ACC的SAEW通过在无隔膜的电解槽中电解HCl溶液并调整电解液浓度及电解时间制得。
1.3.2 苦荞芽生产方法
首先将苦荞籽粒用12 目筛网筛理,去除杂物及土块,选取无虫蛀饱满籽粒;洗去种子表面的尘土;加以超过种子体积3 倍的处理用水,于25 ℃浸泡24 h;将浸泡后的荞麦籽粒均匀地摊于发芽盒中,加入适量的处理用水,温度25 ℃,相对湿度80%的恒温恒湿培养箱中黑暗培养;发芽7 d采收,冻干磨粉,过40 目筛备用。
1.3.3 苦荞芽总酚[13]、总黄酮[14]的测定
样品的提取:称取(0.200 0±0.000 5)g 样品冻干粉,加入5 mL 70%甲醇溶液,60 ℃超声30 min,提取2 次,8 000 r/min离心10 min,过滤备用。
总酚测定:根据福林-酚比色法,取100 µL样品,加入Foline-Phenol试剂1.0 mL,7.5% Na2CO3溶液 1.0 mL,用蒸馏水定容至10 mL,室温条件下静置 30 min,765 nm波长处测定吸光度,同时做空白。以没食子酸标准品绘制标准曲线,结果以每毫升溶液中没食子酸当量(gallic acid equivalents,GAE)表示测定样品(干物质,下同)中总酚含量。
总黄酮测定:取200 µL样品,加入0.1 mol/L的AlCl3溶液2.0 mL,1 mol/L CH3COOK溶液3.0 mL,用70%的甲醇溶液定容至10 mL,室温条件下静置 30 min,4 000 r/min离心10 min,420 nm波长处测定吸光度,同时做空白。以芦丁标准品绘制标准曲线,总黄酮含量以芦丁质量计。
1.3.4 苦荞芽芦丁含量的测定[15]
样品的提取:称取(0.500 0±0.000 5)g样品冻干粉,加入10 mL 70%的乙醇溶液,超声提取45 min,3 000 r/min离心5 min,取上清液10 000 r/min离心15 min。
液相色谱条件:反相 C-18 分离柱(Inertsil ODS-3(250 mm×4.6 mm,5 µm));流动相A:乙腈-甲醇-水-四氢呋喃(19∶5∶76∶1,V/V),pH 3.0;流动相 B:乙腈-甲醇-水(55∶15∶30,V/V),pH 3.0;波长:360 nm;柱温:20 ℃;流速:1.0 mL/min;进样量:10 µL。
1.3.5 苦荞芽苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)比活力的测定
1.3.5.1 总可溶性蛋白质含量测定
采用二喹啉甲酸法测定总可溶性蛋白。取0.1 mL粗酶液,加入的二喹啉甲酸-Cu试剂(50∶1),37 ℃反应30 min后,以空白管为对照,测定562 nm波长处的吸光度。结果以牛血清蛋白作为标准物质,计算苦荞芽中所含可溶性蛋白质的含量。在测得苦荞芽可溶性蛋白含量的基础上,PAL比活力的表达均基于蛋白质含量,即每毫克蛋白质所具有的酶活力单位数。
1.3.5.2 PAL比活力测定
按组织-提取液1∶9(g/mL)加提取液冰浴匀浆,10 000 r/min离心10 min。取上清液待测。取80 L粗酶液,加入1 480 L缓冲液和400 L底物液,用旋涡混匀器充分混匀,置于30 ℃恒温水浴30 min后加入80 L终止液,混匀,室温放置10 min,双蒸水调零,以空白管为对照,于波长290 nm处比色。以每毫克组织蛋白在每毫升反应体系中每分钟使290 nm波长处吸光度变化0.1为1 个酶活力单位。
1.3.6 苦荞芽抗氧化性的测定[16]
1.3.6.1 总还原力的测定
采用FRAP法。具体方法:取0.1 mL苦荞芽提取稀释液加0.3 mL蒸馏水,加入3 mL预热至37 ℃的FRAP工作液(需现用现配),摇匀后避光反应30 min,于593 nm波长处测其吸光度,以蒸馏水代替样品加入FRAP工作液作为空白。以Trolox作标准曲线,结果以每克苦荞芽中所含Trolox当量表示(µmol TE/g)。
1.3.6.2 对DPPH自由基清除能力的测定[17]
在试管中依次加入 0.2 mL苦荞芽提取稀释液和4.8 mL 1.0×10-4mol/L DPPH甲醇溶液,总体积为5.0 mL,混匀后避光反应30 min,于517 nm波长处测定吸光度,记为Ai;加入0.2 mL苦荞芽提取稀释液和4.8 mL 甲醇,测定吸光度记为Aj;加入0.2 mL甲醇和4.8 mL 1.0×10-4mol/L DPPH乙醇溶液,测定吸光度记为A0。按下列公式计算提取液对DPPH自由基的清除率。以Trolox作标准曲线,结果以每克苦荞芽中所含Trolox当量表示(µmol TE/g)。
1.3.6.3 对ABTS+·清除能力测定[18]
加0.2 mL苦荞芽提取稀释液于9.8 mL ABTS混合液(需现用现配)中,室温条件下避光30 min后在734 nm波长处测定吸光度,以甲醇做空白。用Trolox作标准品,结果以每克苦荞芽中所含Trolox当量表示(µmol TE/g)。
1.4 统计分析
每个实验独立重复3 次,结果以平行测定所得的±s表示。用SPSS软件进行数据处理,显著性水平为P<0.05。
2 结果与分析
2.1 SAEW处理对苦荞芽总酚、总黄酮和芦丁含量的影响

图1 SAEW对苦荞芽总酚含量的影响
Fig. 1 Effect of SAEW on total phenol content in tartary buckwheat sprouts
如图1所示,苦荞经过发芽,其总酚含量显著增加。与自来水对照组相比,SAEW普遍促进苦荞芽总酚的积累。ACC在10、20、30 mg/L的SAEW处理组总酚含量分别为(2 390.41±17.70)、(2 647.57±15.11)、(2 526.04±26.58) mg GAE/100 g,较自来水对照组分别提升了16.19%、28.69%和22.78%。可见此ACC范围的SAEW较适宜苦荞芽总酚含量的积累。
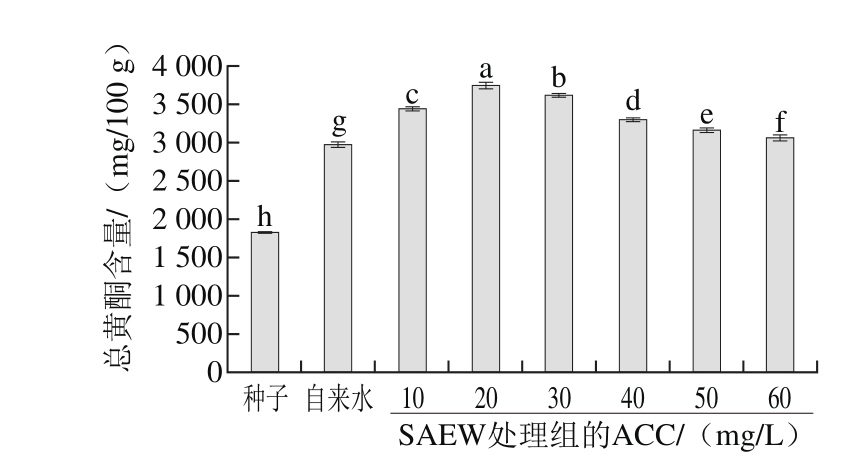
图2 SAEW对苦荞芽总黄酮含量的影响
Fig. 2 Effect of SAEW on total flavonoid content in tartary buckwheat sprouts
如图2所示,ACC在20 mg/L的SAEW处理组总黄酮含量较自来水对照组提升了26.19%,为(3 741.13±45.42) mg/100 g,为各处理组中较适宜苦荞芽总黄酮积累的处理用水。
如图3所示,芦丁标准品在高效液相色谱测定中的保留时间为10.406 min(图3a)。苦荞样品中芦丁保留时间为(10.280±0.140) min(图3b~d),重复性良好。样品芦丁物质峰形对称尖锐,无拖尾重叠,洗脱效果良好。
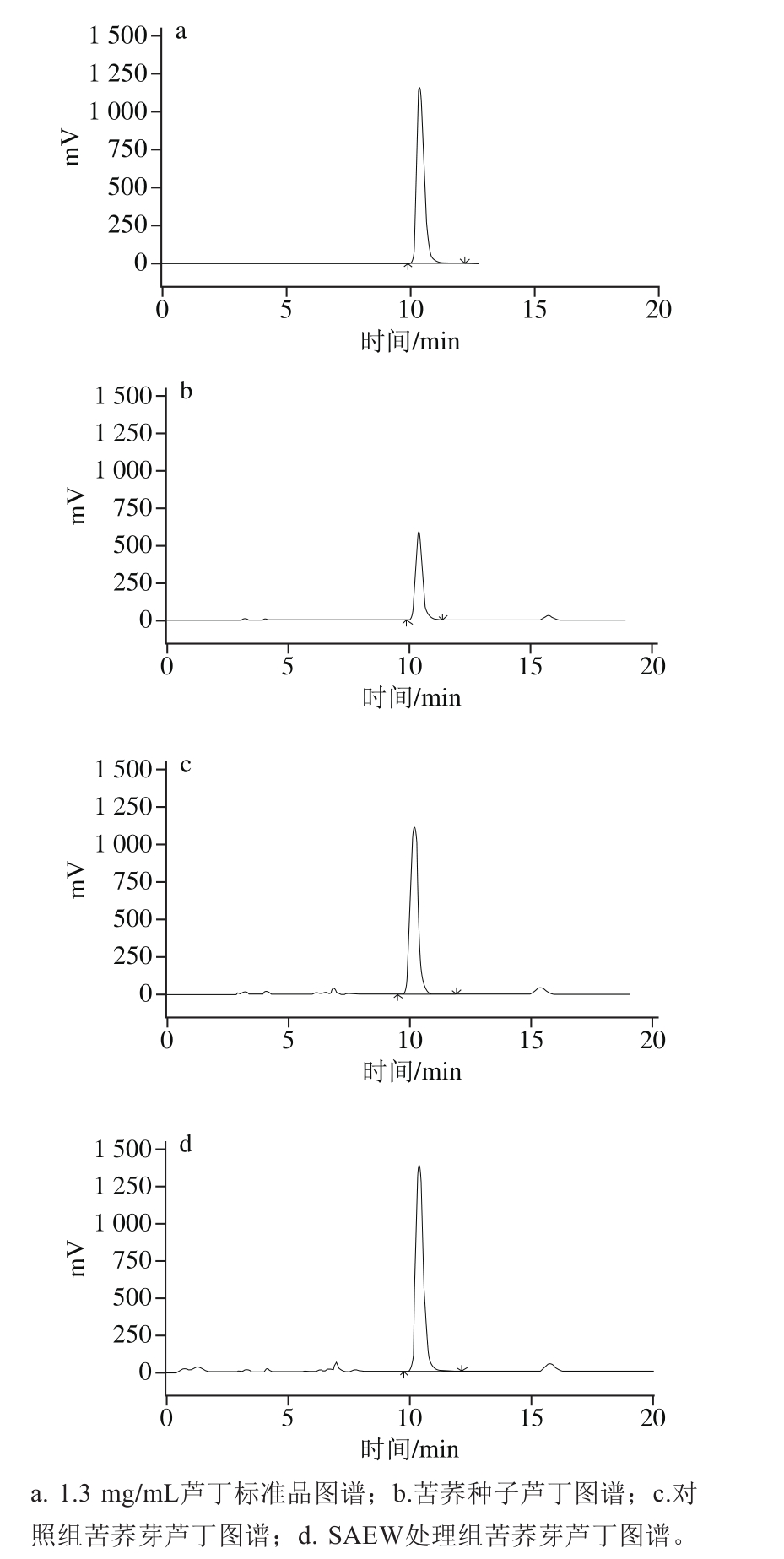
图3 芦丁高效液相色谱图谱
Fig. 3 HPLC chromatograms of rutin standard, and rutin in tatary buckwheat seeds, control sprouts and SAEW-treated spouts

图4 不同处理液对苦荞芽芦丁含量的影响
Fig. 4 Effect of SAEW on rutin content in tartary buckwheat sprouts
如图4所示,苦荞经过发芽,其芦丁含量显著提升。与自来水对照组相比,SAEW普遍促进苦荞芽芦丁含量的提升。ACC为10、20、30 mg/L的SAEW处理组芦丁含量较自来水对照组分别提升了19.75%、29.08%和24.27%,ACC为20 mg/L的SAEW处理苦荞萌发,对其体内芦丁含量的积累效果最佳。
电解水中有效氯的存在形式随pH值的变化而不同,pH值小于3时,有效氯主要以Cl2的形式存在,当pH值介于4~6之间,有效氯主要以HOCl分子的形式存在,当pH值大于7时,有效氯主要以OCl-形式存在,SAEW所处的pH值范围恰为有效氯以HOCl分子为主的范围[19]。HOCl是一种小分子,可以自由通过细胞膜[20],基础水平的HOCl在机体防御系统中起重要作用,然而高浓度的HOCl会引起机体组织细胞的氧化伤害,植物体通过机体氧化应激产生更多的酚类物质以抵御环境中活性氧对机体的损伤,因而适宜质量浓度的有效氯可以促进植物体酚类物质的积累[21]。
SAEW不仅含有有效氯成分,还含有·OH等活性氧成分。电子自旋仪测试结果显示,SAEW比强酸性电解水含有更多的·OH[22]。植物体在外界环境刺激下产生更多的酚、酮等抗氧化剂,以清除由于应激反应而产生的过多的活性氧,这些产生的抗氧化剂既可以直接还原活性氧,又可以作为酶的底物在活性氧清除中发挥作用[9]。
张春玲[23]用SAEW对荞麦进行发芽处理,发现荞麦芽芦丁含量显著高于自来水浸种喷淋的对照组。Hao Jianxiong等[2]研究了SAEW处理对荞麦发芽过程中芦丁含量的影响,发现SAEW可以显著提升萌发荞麦的芦丁含量,发芽第8天SAEW处理组荞麦芽芦丁含量为(739.9±24.7) mg/100 g,相较对照组提升了28.97%。
2.2 SAEW处理对苦荞芽PAL比活力的影响
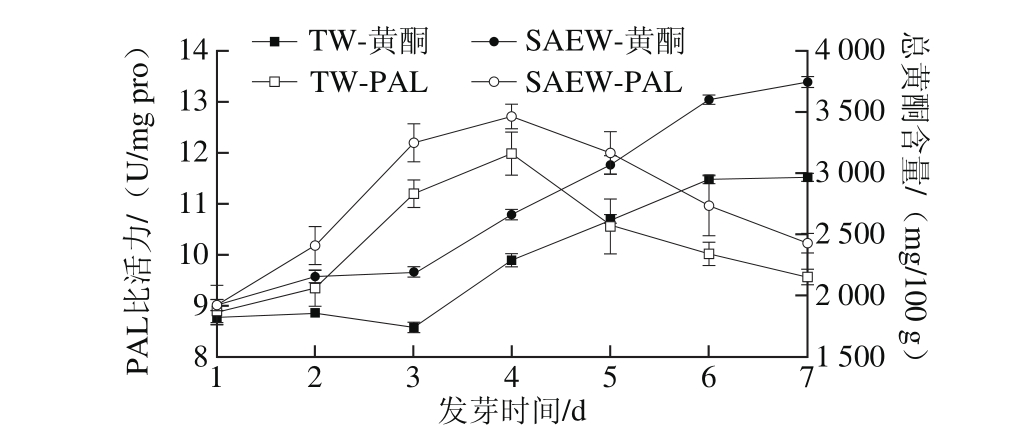
图5 萌发苦荞PAL比活力与总黄酮含量的关系
Fig. 5 Relationship between PAL activity and total flavonoid content during tartary buckwheat germination
为探讨PAL比活力与总黄酮形成的关系,对荞麦萌发过程中PAL比活力变化与总黄酮含量变化进行了分析。从图5可以看出,苦荞萌发后其PAL比活力随萌发时间的延长而增大,在第4天时达到最大值,为(13.11±0.24) U/mg pro,第5天比活力开始降低。SAEW处理荞麦萌发的PAL比活力在各时期均高于对照组。SAEW可能由于其具有一定的氧化性,使苦荞芽生长过程中产生氧化应激,从而影响了荞麦籽粒萌发过程中代谢途径[2]。在萌发初期,PAL比活力略有提升,总黄酮含量变化不大。萌发第3天苦荞的PAL比活力达到较高水平,在第4天时达到最大,此时苦荞总黄酮含量迅速积累;发芽第5 天后,PAL比活力逐渐下降,总黄酮含量趋于稳定,在第7天达最大值。
PAL是黄酮和酚类物质合成途径的关键酶,它可以催化L-苯丙氨酸脱氨产生反式肉桂酸。反式肉桂酸通过进一步的苯丙烷类代谢途径产生香豆酸、阿魏酸、芥子酸等,再进一步转化为香豆素、绿原酸、辅酶A酯等,最终被转化为黄酮、木质素等其他次生代谢产物[24]。PAL是催化苯丙烷类代谢途径第一步反应的酶,也是这个途径的关键酶和限速酶,对植物有非常重要的生理意义[25]。
张美莉[26]测定了荞麦萌发84 h内PAL比活力变化规律,结果表明,苦荞萌发初期PAL比活力变化不大,总黄酮含量先较稳定然后略有下降;随后PAL比活力迅速上升,而苦荞总黄酮含量在萌发36 h后迅速上升;在实验的萌发时间范围内,总黄酮含量尚未达到最大值,苦荞芽生长过程中总黄酮含量变化速度与PAL比活力变化呈正相关。唐宇等[27]的研究显示,荞麦在萌发早期,PAL比活力较低,随着芽菜生长,酶比活力不断增高,达到高峰后又逐渐下降。萌发初期荞麦中总黄酮含量随着PAL比活力的增强逐步增加;在酶比活力达到最大值时总黄酮含量以较快速度持续增加;6 d以后PAL比活力降至较低时总黄酮含量的增加趋于平缓;在8 d以后总黄酮的含量开始下降,此时酶比活力降至极低值。表明荞麦中总黄酮含量与PAL比活力的变化呈现一定的规律性。
2.3 SAEW处理对苦荞芽抗氧化能力的影响
2.3.1 SAEW处理对苦荞芽总还原力的影响

图6 SAEW处理对苦荞芽总还原力的影响
Fig. 6 Effect of SAEW on reducing power of tartary buckwheat sprouts
如图6所示,苦荞发芽后总还原力显著提升,生长第7天的苦荞芽,总还原力相较未发芽的苦荞籽粒提升了427.88%,可见苦荞萌发可显著增强苦荞抗氧化能力。SAEW处理发芽的苦荞芽总还原力较对照组均有着大幅度提升,pH 5.5 ACC为20 mg/L SAEW处理组相比对照组总还原力提升了51.55%,为(416.00±6.53) µmol TE/L。
2.3.2 SAEW处理对苦荞芽DPPH自由基清除能力的影响

图7 SAEW处理对苦荞芽DPPH自由基清除能力的影响
Fig. 7 Effect of SAEW on DPPH radical scavenging activity of tartary buckwheat sprouts
如图7所示,苦荞发芽后DPPH自由基清除能力相比苦荞籽粒提升了131.51%。各个处理组与对照组相比,DPPH自由基清除能力都显著升高,其中pH 5.5 ACC为20 mg/L的SAEW处理组清除能力最高,为(448.31±11.57) µmol TE/L,相比对照组DPPH自由基清除能力提升了28.40%。
2.3.3 SAEW处理对苦荞芽ABTS+·清除能力的影响
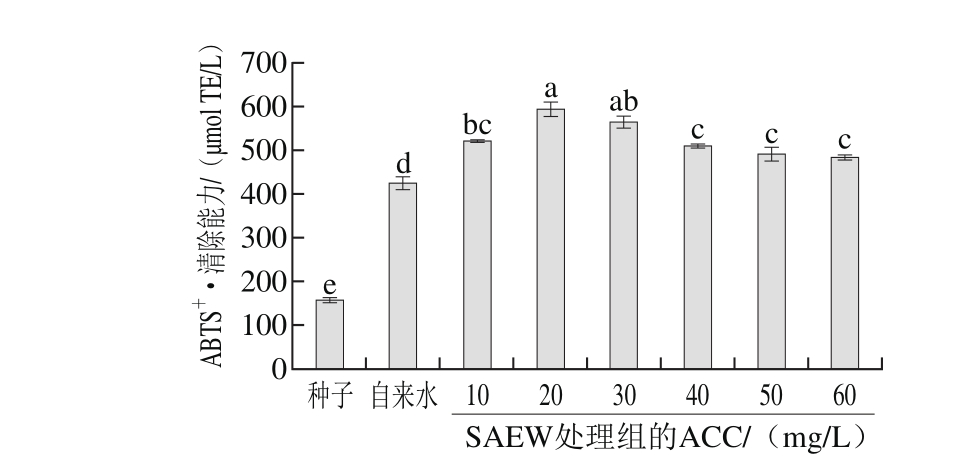
图8 SAEW处理对苦荞芽ABTS+·清除能力的影响
Fig. 8 Effect of SAEW on ABTS+· scavenging activity of tartary buckwheat sprouts
如图8所示,苦荞发芽后ABTS+·清除能力与未发芽苦荞籽粒相比提升了168.24%。各处理组与对照组相比ABTS+·清除能力都显著升高(P<0.05),pH 5.5 ACC为20 mg/L的SAEW处理组ABTS+·清除能力最高,为(593.31±17.42)µmol TE/L,相比对照组提升了39.77%。
2.3.4 苦荞芽抗氧化能力与抗氧化物质含量的相关性
以苦荞芽总酚、总黄酮和芦丁的含量测定结果及不同方法测得的抗氧化能力结果作了相关性分析,结果如表1所示。由此可知,苦荞芽中的总酚、总黄酮及芦丁含量与不同方法测得的抗氧化能力均呈显著相关(P<0.01)。
抗氧化活性是酚类化合物的最重要的生物活性,酚类物质的抗氧化活性及自由基清除能力是由其分子结构,特别是环结构上羟基化的位置和程度决定的,酚羟基与氧自由基反应,形成共振稳定的半醌式自由基而中断链式反应[28]。
表1 苦荞芽抗氧化能力与抗氧化物质含量的相关性
Table1 Correlation coefficients between antioxidant capacity and bioactive components of tartary buckwheat sprouts
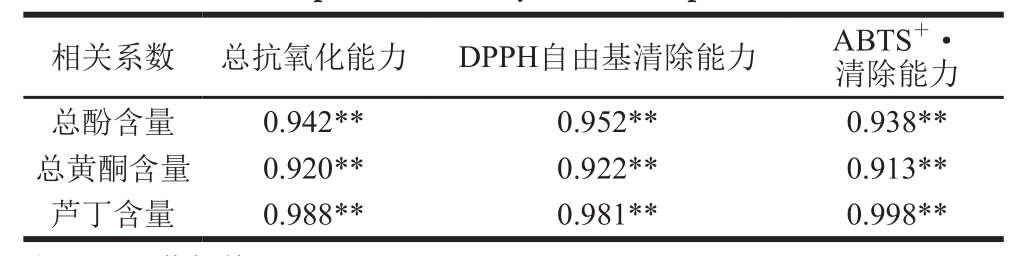
注:**.显著相关,P<0.01。
张冬晨[11]用电生功能水处理甜荞萌发7 d,发现处理组的总还原力和DPPH自由基清除能力均高于自来水对照组,总酚含量和抗氧化性之间呈正相关。Liu Haiying等[29]研究了68 种植物提取物,其总酚含量与抗氧化活力之间的关系呈显著正相关(R2=0.946 7)。Pyo等[30]研究表明多种蔬菜和水果中总酚含量与其清除DPPH自由基之间呈显著相关。本实验研究结果也表明苦荞芽提取物抗氧化活力与其体内的酚类物质含量呈显著正相关。
3 结 论
苦荞萌发后,体内活性成分含量有所提升。SAEW处理组苦荞芽总酚、总黄酮及芦丁含量相比对照组均显著增加,以pH 5.5 ACC为20 mg/L的SAEW对苦荞芽体内抗氧化活性成分的提升最显著,总酚、总黄酮和芦丁含量相较对照组分别提升了28.69%、26.19%和29.08%。苦荞芽提取液的抗氧化能力与其体内的总酚、总黄酮及芦丁含量均呈显著正相关,经SAEW处理发芽的苦荞芽,总还原力及对DPPH自由基、ABTS+·的清除能力均有不同程度的提升,pH 5.5 ACC为20 mg/L的SAEW处理组苦荞芽提取物的抗氧化能力最强。
参考文献:
[1] 姚亚平, 曹炜, 陈卫军, 等. 不同品种荞麦提取物抗氧化作用的研究[J]. 食品科学, 2006, 27(11): 49-52. DOI:10.3321/j.issn:1002-6630.2006.11.005.
[2] HAO J X, WU T J, LI H Y, et al. Dual effects of slightly acidic electrolyzed water (SAEW) treatment on the accumulation of γ-aminobutyric acid (GABA) and rutin in germinated buckwheat[J]. Food Chemistry, 2016, 201: 87-93. DOI:10.1016/j.foodchem.2016.01.037.
[3] SUZUKI K, NAKAMURA T, KOKUBO S, et al. The physical properties of slightly acidic electrolyzed water prepared with hydrochloric acid as a raw material[J]. Journal of Antibacterial &Antifungal Agents Japan, 2005, 33(2): 55-62.
[4] BAU H M, VILLAUME C, NICOLAS J P, et al. Effect of germination on chemical composition, biochemical constituents and antinutritional factors of soyabean (Glycine max) seeds[J]. Journal of the Science of Food & Agriculture, 2015, 73(1): 1-9. DOI:10.1002/(sici)1097-0010(199701)73:1<1::aid-jsfa694>3.3.co;2-2.
[5] CHEN L M, WELLS C E, FORDHAM J R. Germinated seeds for human consumption[J]. Food Science, 1999, 40: 1290-1294.DOI:10.1111/j.1365-2621.1975.tb01075.x.
[6] 徐茂军, 杜修桥, 包开洪. 发芽处理对大豆中铁化学状态的影响[J]. 中国粮油学报, 2002, 17(5): 48-50. DOI:10.3321/j.issn:1003-0174.2002.05.013.
[7] 熊善柏, 杨尔宁, 王益, 等. 稻谷发芽中的营养变化及儿童膨化米粉的研制[J]. 食品科学, 1993, 14(8): 51-54.
[8] 徐坤. 苦荞麦芽的开发价值及生产方法[J]. 农业科技通讯, 2001(7):34-35. DOI:10.3969/j.issn.1000-6400.2001.07.033.
[9] LIU R, ZHANG D, HE X, et al. The relationship between antioxidant enzymes activity and mungbean sprouts growth during the germination of mungbean seeds treated by electrolyzed water[J]. Plant Growth Regulation, 2014, 2: 1-9. DOI:10.1007/s10725-014-9899-7.
[10] LIU R, HAO J X, LIU H J, et al. Application of electrolyzed functional water on producing mung bean sprouts[J]. Food Control, 2011, 22:1311-1315. DOI:10.1016/j.foodcont.2011.02.005.
[11] 张冬晨. 三种处理技术对荞麦种子发芽及其抗氧化性的影响[D]. 北京: 中国农业大学, 2015: 28-29. DOI:10.13386/j.issn1002-0306.2015.07.005.
[12] 劳家怪. 土壤农业化学分析手册[M]. 北京: 农业出版社, 1988: 5-10.
[13] KIM S L, KIM S K, PARK C H. Introduction and nutritional evaluation of buckwheat sprouts as anew vegetable[J]. Food Research International, 2004, 37: 319-327. DOI:10.1016/j.foodres.2003.12.008.
[14] 农业部. 荞麦及其制品中总黄酮含量的测定: NY/T 1295—2007[S].北京: 中国标准出版社, 2007.
[15] FANG F, LI J M, PAN Q H, et al. Determination of red wine flavonoids by HPLC and effect of aging[J]. Food Chemistry, 2007, 101(1): 428-433. DOI:10.1016/j.foodchem.2005.12.036.
[16] 高蓓. 广陈皮黄酮类化合物和挥发油成分及其活性研究[D]. 武汉:华中农业大学, 2011: 52-53. DOI:10.7666/d.Y2004715.
[17] 杨继涛, 李明军, 杜国荣, 等. 不同基因型柿果实抗氧化物成分分析[J]. 西北农业学报, 2010, 19(7): 138-141. DOI:10.3969/j.issn.1004-1389.2010.07.030.
[18] SIDDHURAJU P, BECKER K. The antioxidant and free radical scavenging activities of processed cowpea (Vigna unguiculata(L.) Walp.) seed extracts[J]. Food Chemistry, 2007, 101(1): 10-19.DOI:10.1016/j.foodchem.2006.01.004.
[19] 韩志涛, 杨少龙, 郑德康, 等. 紫外辐照强化NaClO溶液湿法脱硝的实验研究[J]. 科学技术与工程, 2016, 16(28): 134-138; 170.DOI:10.3969/j.issn.1671-1815.2016.28.023.
[20] 李婷婷, 彭军. 次氯酸介导的氧化应激及其病理生理学意义[J].中国药理学与毒理学杂志, 2010(4): 307-310. DOI:10.3867/j.issn.1000-3002.2010.04.012.
[21] CHANDRASEKARA A, SHAHIDI F. Inhibitory activities of soluble and bound millet seed phenolics on free radicals and reactive oxygen species[J]. Journal of Agricultural & Food Chemistry, 2014, 59(1):428-436. DOI:10.1021/jf103896z.
[22] XIONG K, LIU H J, LI L T, et al. Differences in fungicidal eきciency against Aspergillus flavus forneutralized and acidic electrolyzed oxidizing waters[J]. International Journal of Food Microbiology, 2010,137: 67-75. DOI:10.1016/j.ijfoodmicro.2009.10.032.
[23] 张春玲. 微酸性电解水在芽苗菜生产中的应用研究[D]. 北京: 中国农业大学, 2011: 45-46. DOI:10.13684/j.cnki.spkj.2014.06.021.
[24] 周小理, 成少宁, 周一鸣, 等. 苦荞芽中黄酮类化合物的抑菌作用研究[J]. 食品工业, 2010(2): 12-14.
[25] RICEEVANS C A, MILLER N J, BOLWELL P G, et al. The relative antioxidant activities of plant-derived polyphenolic flavonoids[J]. Free Radical Research, 1995, 22(4): 256-259.DOI:10.3109/10715769509145649 .
[26] 张美莉. 萌发荞麦种子内黄酮与蛋白质的动态变化及抗氧化性研究[D]. 北京: 中国农业大学, 2004: 36. DOI:10.7666/d.y658768.
[27] 唐宇, 赵钢. 荞麦中苯丙氨酸解氨酶活力与黄酮含量的关系[J].植物生理学通讯, 1992, 28(6): 419-420.
[28] 张红雨. 黄酮类抗氧化剂结构活性关系的理论解释[J]. 中国科学: B辑, 1999(1): 91-96. DOI:10.3321/j.issn:1006-9240.1999.01.013.
[29] LIU H Y, QIU N X, DING H H, et al. Polyphenols contents and antioxidant capacity of 68 Chinese herbals suitable for medical or food uses[J]. Food Research International, 2008, 41(4): 363-370.DOI:10.1016/j.foodres.2007.12.012.
[30] PYO Y H, LEE T C, LOGENDRA L, et al. Antioxidant activity and phenolic compounds of Swiss chard (Beta vulgaris subspecies cycla)extracts[J]. Food Chemistry, 2004, 85(1): 19-26. DOI:10.1016/S0308-8146(03)00294-2.