玫瑰茄(Hibiscus sabdariffa Linn.),又名山琉、洛神花、芙蓉煎,是锦奏科木槿属一年生药食两用的草本植物,2004年被卫生部和卫计委列入新食品原料名单[1],其原产地在非洲,中国引种成功后,目前在中国台湾、广西、广东、福建均有分布,在云南南部具有相当的种植规模[2]。玫瑰茄花萼颜色鲜亮,富含花青素、多酚、黄酮等生物活性成分,具有抗癌、降血压、降血脂和降血糖等保健功能[3-5]。相关研究表明,玫瑰茄花萼中有机酸含量较高,口感较酸,而其含有的有机酸种类和含量与其诸多的保健功能有着密切关系[6];其含有的羟基柠檬酸(hydroxycitric acid,HCA)在抑制脂肪酸和脂肪合成、抑制食欲和降低体重方面具有良好功效,是天然减肥食品中的一种功能成分,而木槿酸是HCA的另一种存在形式,被认为对治疗高血压、动脉粥样硬化、心脏病等疾病有一定的疗效,是玫瑰茄中所特有的一种有机酸[7-9];酚酸也是玫瑰茄的主要功能成分之一,具有抗氧化、抗癌、抗炎症等作用。玫瑰茄花萼中还含有丰富的蛋白质、维生素、碳水化合物等营养成分[10]。
基于其营养丰富、功能特异的特点,玫瑰茄花萼在食品领域有着较好的开发应用前景。但是由于玫瑰茄口感较为尖酸,直接食用口感让人难以接受,而目前以玫瑰茄花萼为原料的产品还较少,大部分为粗加工产品且还在试制中,玫瑰茄资源并未得到充分利用[11-12]。酒是人类生活中的主要饮料之一,随着人们生活水平的提高及国家政策的调整,对低乙醇体积分数、高营养且具有保健功能的发酵酒的需求会越来越大。现有的研究表明,若外加营养物质将其进行发酵,玫瑰茄将是酿酒的良好原料,且发酵过程会对其活性成分造成较大影响[13-14]。然而目前对玫瑰茄酒工艺及其活性成分的研究较少。本研究以我国云南产地的玫瑰茄干花萼为原料,采用单因素和响应面优化探索了玫瑰茄浸提工艺及其酒发酵工艺的最佳条件,并测定了玫瑰茄酒中活性成分花青素和多酚含量,用高效液相色谱(high performance liquid chromatography,HPLC)法比较了发酵前后其主要有机酸和酚酸含量的变化。本研究满足了人们对天然健康食品的追求,有利于促进玫瑰茄资源的开发和利用,并为玫瑰茄酒的相关研究提供了理论支持。
1 材料与方法
1.1 材料与试剂
S1、S2、S3、S4、S5和S6为果酒酿造酵母,购自安琪、拉曼德和Lalvin酵母公司;玫瑰茄干花萼购自云南省昆明市中药材市场。
福林-酚试剂 坛墨质检科技有限公司;缓冲液(B1、B2、B3和B4)、再生液(RG)、显色液(R1和R2)、茚三酮缓冲液 日本和光公司;有机酸及酚酸标准品(纯度95%以上) 索莱宝生物科技有限公司;木槿酸和HCA标准品(纯度95%以上) 美国Sigma公司;KCl、HCl、CH3CO2Na·3H2O、HAc和Na2CO3等试剂(分析纯) 广州化学试剂厂。
1.2 仪器与设备
LC-20A型高HPLC仪、UV-2450S(E)型紫外分光光度计 日本岛津公司;L-8800型氨基酸自动分析仪日本日立公司;HH-6型数显恒温水浴锅 金坛市富华仪器有限公司。
1.3 方法
1.3.1 玫瑰茄酿制工艺

1.3.2 玫瑰茄花萼浸提条件优化[15]
1.3.2.1 浸提条件的单因素优化试验
考虑到实际生产和应用,将玫瑰茄进行全花萼浸提。选择料液比、浸提温度和浸提时间作为影响因素,进行单因素试验。考察料液比对浸提效果的影响:选择料液比(玫瑰茄-水)1∶20、1∶25、1∶30、1∶35(g/mL),浸提温度75 ℃,浸提时间50 min;考察浸提温度对浸提效果的影响:选择最佳料液比1∶30,浸提温度分别为45、65、75、85、95 ℃,浸提时间50 min;考察浸提时间对浸提效果的影响:在上述最佳单因素试验基础上,选择浸提时间分别为30、50、70、90 min。以浸提液花青素提取率和多酚提取率为评价指标确定各单因素最佳提取条件,计算如式(1)、(2)所示:
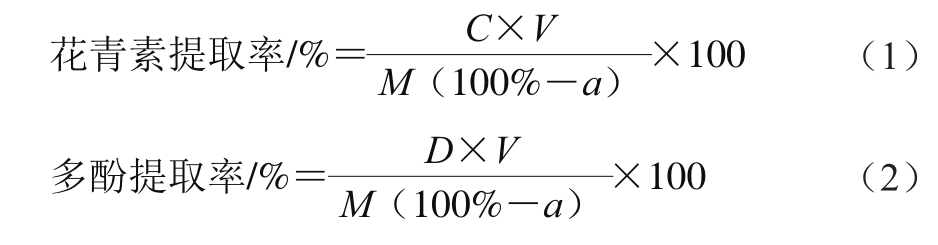
式中:C为花青素质量浓度/(g/L);D为多酚质量浓度/(g/L);V为玫瑰茄浸提液体积/L;M为玫瑰茄干花萼质量/g;a为玫瑰茄干花萼水分质量分数,9.72%。
1.3.2.2 浸提条件的响应面优化试验
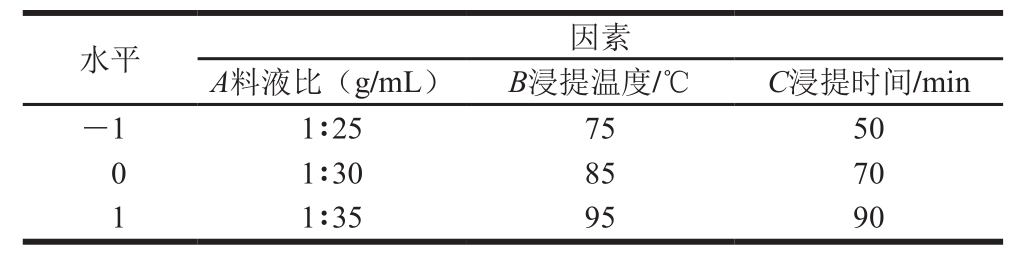
在1.3.2.1节基础上考虑各个因素的交互影响,以料液比(A)、浸提温度(B)、浸提时间(C)3 个因素为响应变量,以花青素提取率和多酚提取率为响应值设计Box-Behnken响应面三因素三水平试验方案,各因素及水平见表1。
表1 浸提条件响应面试验因素及水平
Table1 Level and code of independent variables used in Box-Behnken design for extraction optimization
1.3.3 玫瑰茄酒发酵条件的优化
1.3.3.1 玫瑰茄酒发酵条件的单因素优化试验
在1.3.2节基础上,将最优浸提条件下得到的玫瑰茄浸提液作为发酵液,选择酵母种类、酵母接种量、加糖量、发酵时间为影响因素,测定乙醇体积分数、还原糖、花青素和多酚含量并结合感官评定,进行单因素试验。各单因素试验设计如下:1)取200 mL玫瑰茄浸提液于锥形瓶中,调整其含糖量为25%,各浸提液中分别接种1.5 g/L活化好的S1、S2、S3、S4、S5和S6酵母,并在23 ℃发酵10 d后测定乙醇体积分数、还原糖、花青素和多酚含量,并做感官评定(以下各单因素测定指标同上);2)选择最优酵母种类,含糖量为25%,酵母接种量分别为0.5、1.0、1.5、2.0、2.5 g/L,发酵温度23 ℃,发酵时间10 d;3)选择最优酵母种类及其接种量,调整浸提液含糖量分别为21%、23%、25%、27%、29%,发酵温度23 ℃,发酵时间10 d;4)在前面最优酵母及其接种量和最优含糖量基础上,选择发酵温度23 ℃,在发酵期间每天监测玫瑰茄酒的发酵情况;5)在前面最优条件的基础上,选择发酵温度分别为20、24、28、32 ℃。
1.3.3.2 玫瑰茄酒发酵条件的响应面优化试验
表2 发酵条件响应面试验因素及水平
Table2 Level and code of independent variables used in Box-Behnken design for fermentation optimization
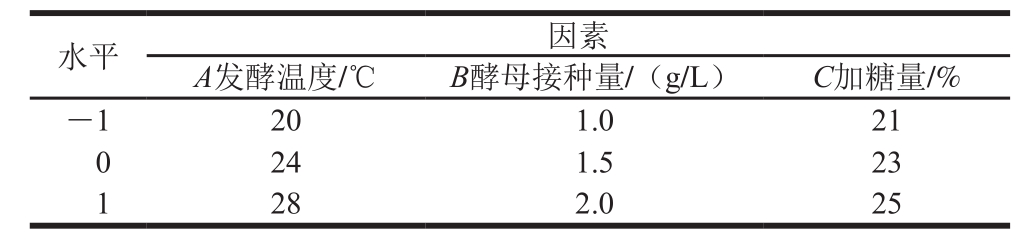
在固定酵母种类和发酵时间基础上选择发酵温度(A)、酵母接种量(B)、加糖量(C)3 个因素为响应变量,以乙醇体积分数、花青素含量及多酚含量为响应值设计Box-Behnken响应面试验方案,各因素及水平设计见表2。
1.3.4 指标测定
1.3.4.1 多酚和花青素总量的测定
多酚总量采用Folin-Ciocalteu法测定,参照李升峰等[16]方法,略作修改。以没食子酸质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到线性回归方程y=0.011 33x+0.079 52,R2=0.999 7。花青素总量采用pH值示差法测定,参照桑戈等[17]方法,略作修改。
1.3.4.2 有机酸含量的测定[18-20]
色谱条件:色谱柱Eclipse AAAC18(4.6 mm×150 mm,5 μm);柱温28 ℃,流速0.6 mL/min,进样量15 μL,检测波长210 nm,流动相0.06 mol/L的KH2PO4溶液(用磷酸调pH 2.5)-甲醇体积比99∶1。将质量浓度范围为0.02~4.08 g/L的有机酸混合标准液、玫瑰茄浸提液(稀释3 倍)及玫瑰茄酒经0.45 μm水相微孔膜过滤后按照上述色谱条件进样。
1.3.4.3 酚酸含量的测定[19-20]
色谱条件为:色谱柱Eclipse AAAC18(4.6 mm×150 mm,5 μm),柱温30 ℃,流速0.7 mL/min,进样量10 μL,检测波长280 nm,流动相A为2%冰乙酸水溶液,B为乙腈,洗脱程序如下:0~5 min,10% B;0~8 min,15% B;8~12 min,20% B;12~20 min,60% B;20~22 min,10% B。将质量浓度范围为2.0~160 mg/L的酚酸混合标准液、玫瑰茄浸提液及玫瑰茄酒经0.45 μm有机微孔膜过滤后按照上述色谱条件进样。
1.3.4.4 木槿酸和HCA的测定[20-22]
色谱条件:色谱柱Eclipse AAAC18(4.6 mm×150 mm,5 μm);柱温28 ℃,流速0.5 mL/min,进样量15 μL,检测波长210 nm,流动相0.1%磷酸水溶液-甲醇体积比90∶10。将质量浓度范围为0.05~3.0 g/L的木槿酸和HCA混合标准液、玫瑰茄浸提液及玫瑰茄酒经0.45 μm水相微孔膜过滤后按照上述色谱条件进样。
1.3.4.5 其他指标的测定
乙醇体积分数、可滴定酸、残糖、挥发酸等指标的测定均参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》;氨基酸含量的测定参照吕乐福等[23]方法;总酯测定参照史静霞等[24]方法。
1.3.4.6 玫瑰茄酒的感官评定
挑选15 名经过感官评定培训的同学作为感官评定小组成员,参照GB/T 15038—2006中感官评定方法,从外观、香气、口感及风格4 个方面对玫瑰茄酒进行感官评定,结果取平均值,具体评分标准如表3所示。
表3 玫瑰茄酒评分标准
Table3 Criteria for sensory evaluation of roselle wine

1.4 数据分析
每个样品做3 次重复试验,结果用 s表示,用Origin 8.6作图,用SPSS 19.0进行单因素方差分析及数据间的显著性差异分析,用Design-Expert 8.0软件对响应面数据进行分析。
s表示,用Origin 8.6作图,用SPSS 19.0进行单因素方差分析及数据间的显著性差异分析,用Design-Expert 8.0软件对响应面数据进行分析。
2 结果与分析
2.1 玫瑰茄浸提条件的优化
2.1.1 玫瑰茄酒浸提条件单因素试验结果
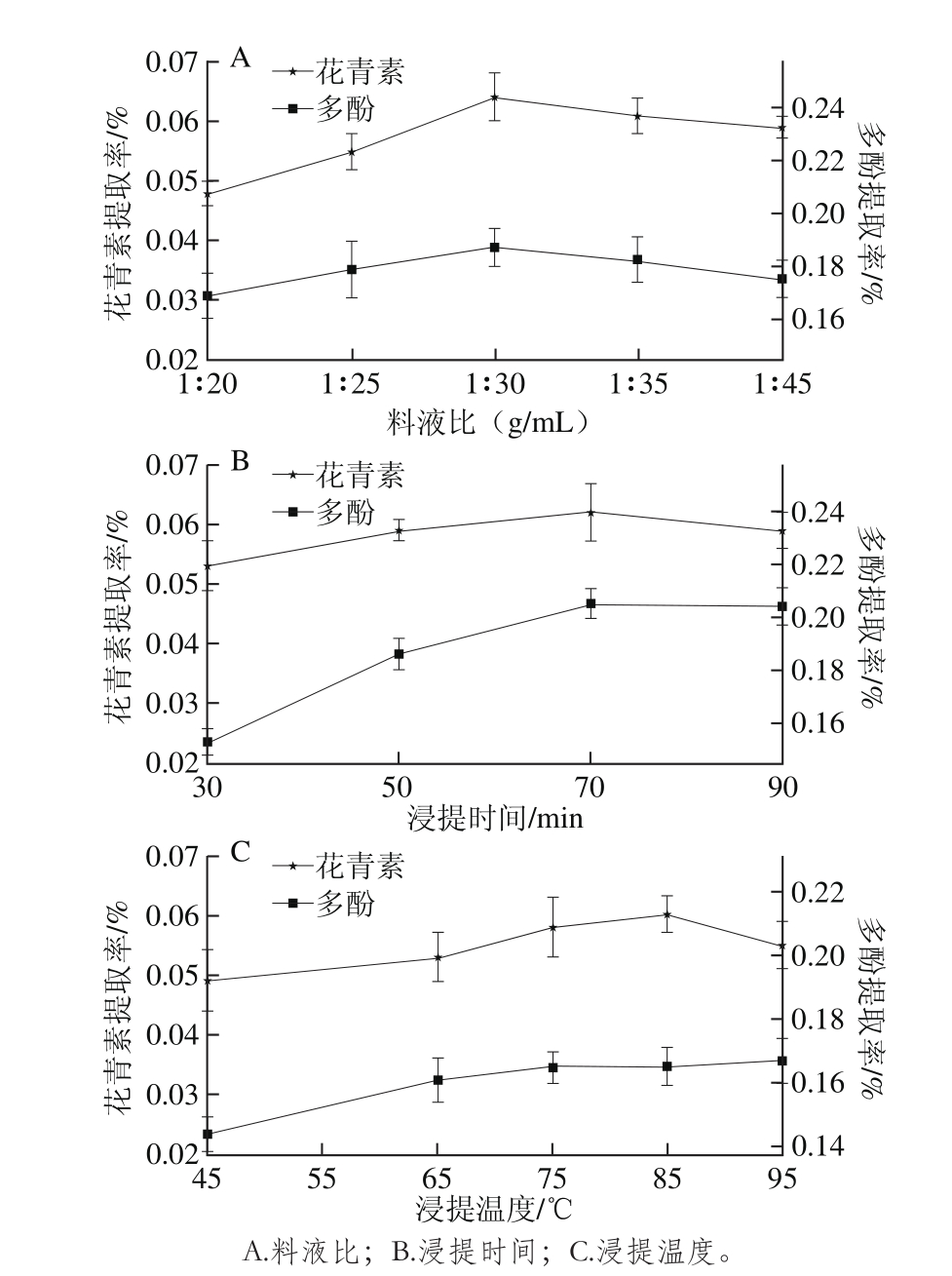
图1 各因素对花青素及多酚提取率的影响
Fig. 1 Effects of variables on the yield of anthocyanins and polyphenols
如图1A所示,不同料液比对提取效果的影响效果存在显著差异性(P<0.05),花青素和多酚提取率随溶剂用量的增大呈先上升后下降的趋势,原因可能是当溶剂用量较小时,溶液中花青素和多酚质量浓度较高,不利于玫瑰茄中有效成分的溶出,而溶剂用量较小时,玫瑰茄内部向表面传递的阻力占主导作用,从而降低了其溶出率[25]。当料液比为1∶30时,花青素和多酚提取率达到最大值。如图1B所示,延长浸提时间可提高玫瑰茄中花青素和多酚的提取率,但当浸提时间达到70 min时,渗透达到平衡,时间对浸提效果的影响不大,并且长时间的水热焖蒸状态反而会使原料中的成分发生氧化[26],从而使其提取率降低。因此,玫瑰茄浸提时间应选择70 min左右为宜。如图1C所示,随着温度的升高,花青素和多酚的提取率不断增加,在浸提温度为85 ℃时花青素提取率达到最大值,多酚的提取率也较高,但当温度超过85 ℃时,花青素提取率出现了降低,这是因为一方面高温可以提高玫瑰茄中成分的溶出速度,另一方面温度过高会导致花青素的氧化降解[15]。
2.1.2 玫瑰茄浸提条件响应面试验结果
表4 Box-Behnken试验方案及结果
Table4 Box-Behnken design with experimental yield of anthocyanins and polyphenols
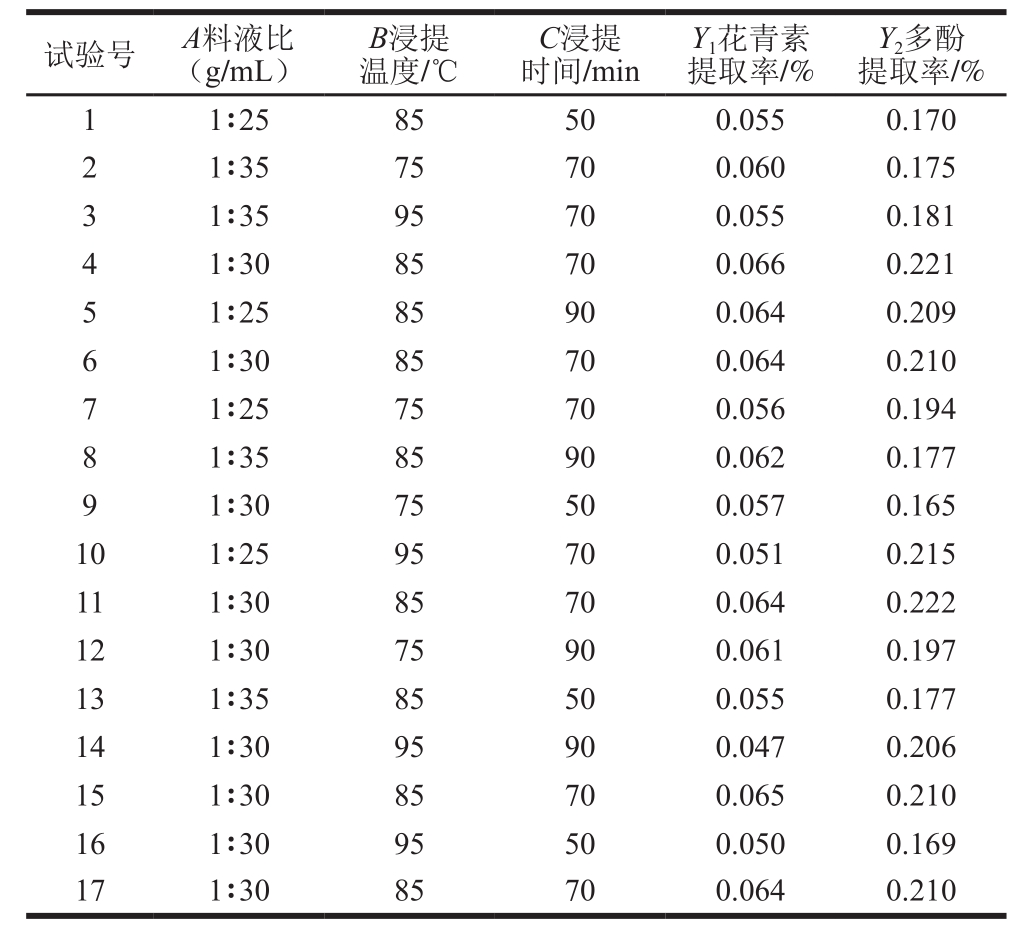
表5 浸提条件回归模型拟合结果
Table5 Regression models predicting the extraction yield of anthocyanins and polyphenols

表4为玫瑰茄浸提条件响应面试验的结果,表5为以花青素和多酚提取率为目标函数的二次多项式回归方程,可知拟合模型效果显著(P<0.05)。为了验证方程的有效性,对该模型进行回归分析,结果如表6所示,可以看出,各影响浸提效果的因素间存在不同的交互作用。结合F值的大小,可知所选因素对花青素提取率的影响强弱顺序为:料液比<浸提时间<浸提温度;对多酚提取率的影响强弱顺序为:浸提温度<料液比<浸提时间。
表6 回归统计分析
Table6 Analysis of variance of response surface regression models predicting the extraction yield of anthocyanins and polyphenols
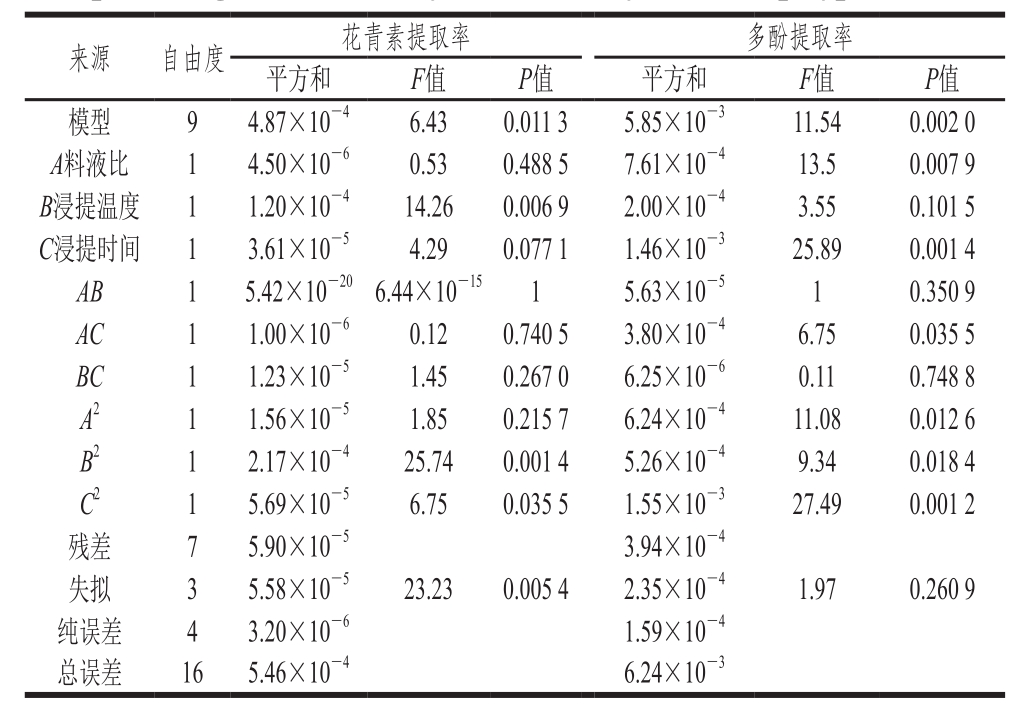
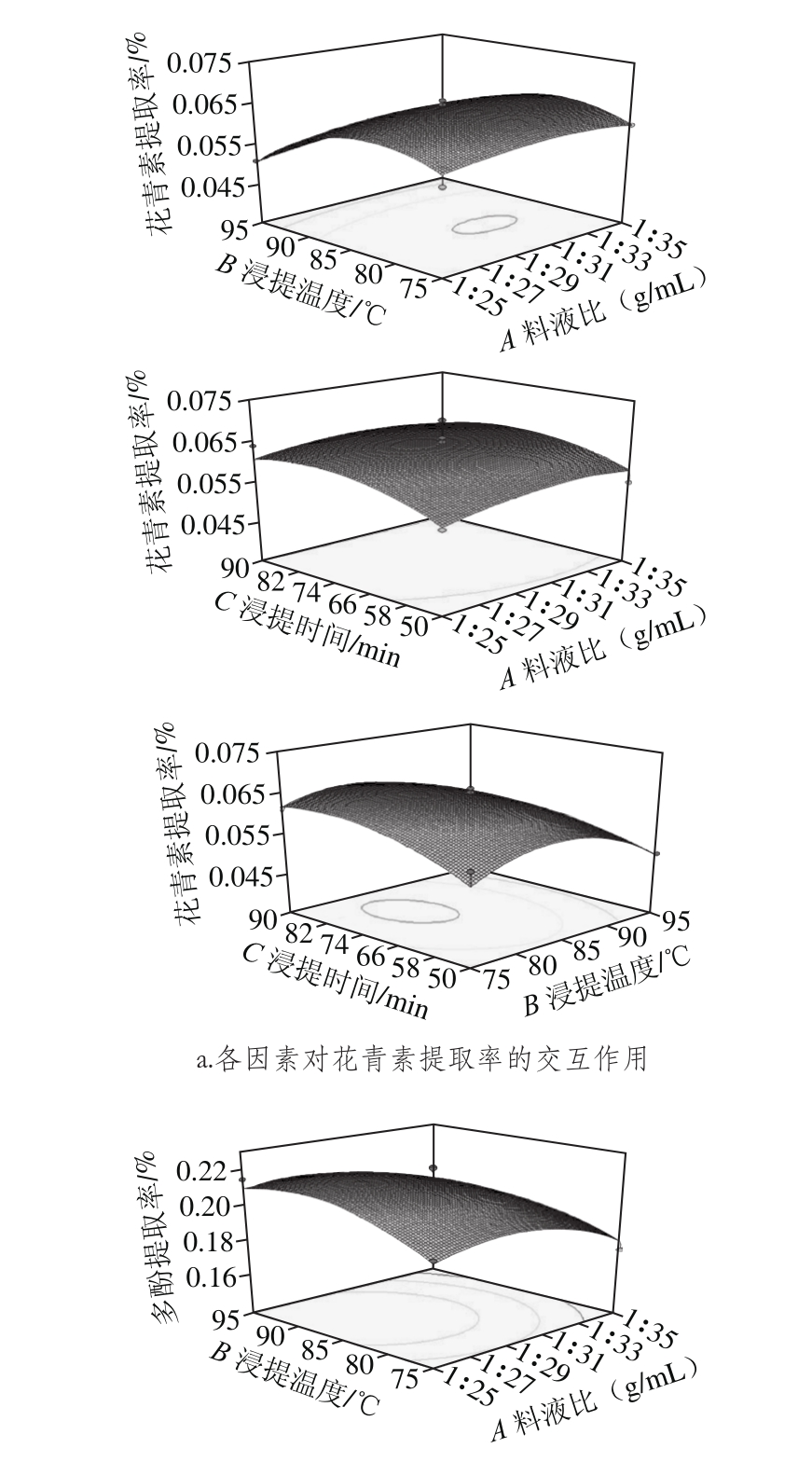
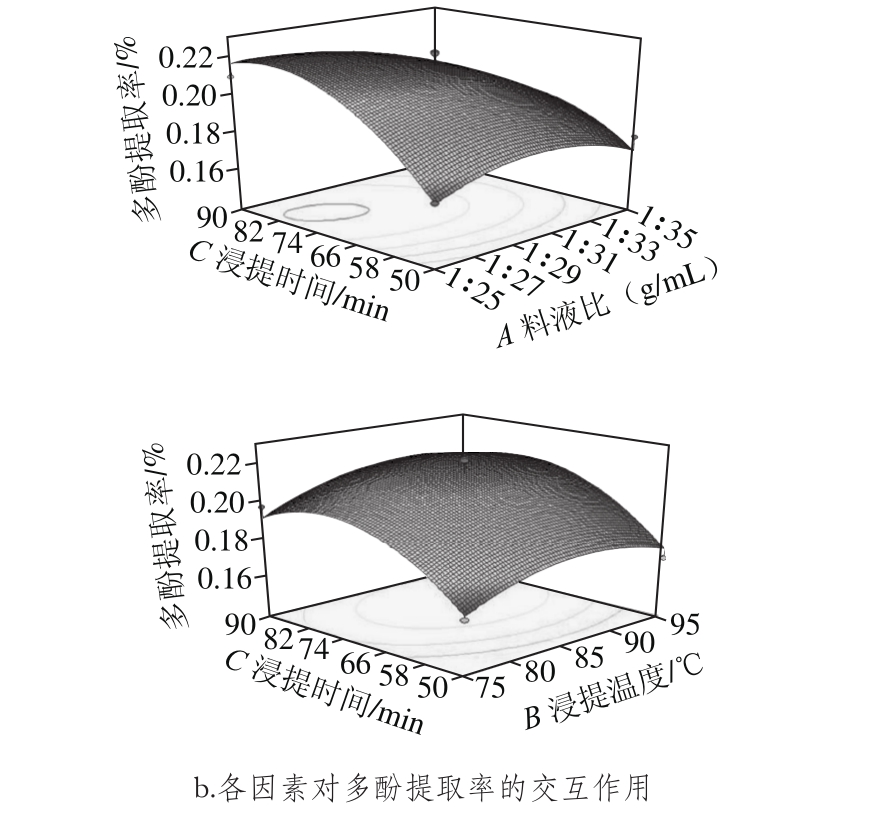
图2 各因素对花青素及多酚提取率影响的响应面图
Fig. 2 Response surface plots showing the interactive effects of variables on the extraction yield of anthocyanins and polyphenols
从图2可知,各响应曲面的坡度较陡,说明所选因素对响应值的影响较大,且各因素间有较强的交互影响。通过以上模型预测得到的玫瑰茄最佳浸提工艺条件为:料液比1∶28.39、浸提温度83.92 ℃、浸提时间78 min。在此浸提条件下预测得到的花青素提取率为0.0651%,多酚提取率为0.223%。
为验证模型预测的准确性,考虑实际条件情况,将玫瑰茄浸提工艺条件定为料液比1∶28、浸提温度84.0 ℃、浸提时间78 min。在该条件下进行3 次平行实验,取平均值,花青素提取率为(0.060±0.009)%,多酚提取率为(0.201±0.05)%。实际值与预测的理论值相差不大,因此响应面法对玫瑰茄浸提条件的优化是可行的。该试验所得最优浸提条件与前人文献中报道的有所不同[15],这可能与所选评价指标的不同有关。
2.2 玫瑰茄酒发酵条件的优化
2.2.1 玫瑰茄酒发酵条件单因素试验结果
2.2.1.1 不同酵母菌种对发酵效果的影响
表7 不同菌种对发酵酒品质的影响
Table7 Influence of starter cultures on the quality of roselle wine

注:同列不同字母表示有显著性差异(P<0.05)。
如表7所示,各发酵液的乙醇体积分数、花青素、多酚及还原糖含量存在显著性差异(P<0.05)。其中S1酵母发酵的乙醇体积分数显著高于其他发酵菌种,但花青素和多酚含量较低,且在口感上较为苦涩;S5酵母发酵的乙醇体积分数较高,但花青素含量显著低于其他发酵菌种;S2、S6酵母发酵的乙醇体积分数较低,感官得分也较低;而S4酵母发酵的酒中花青素和多酚含量均较高,感官得分最高,且乙醇体积分数能达到10%以上,有利于发酵酒的保藏且口感较好,综合考虑,选择S4作为玫瑰茄发酵酒的发酵菌种。
2.2.1.2 酵母接种量对发酵效果的影响

图3 酵母接种量对乙醇体积分数、还原糖、花青素及多酚含量的影响
Fig. 3 Effects of yeast inoculum size on the concentrations of alcohol,reducing sugar, anthocyanins and polyphenols in roselle wine
由图3可知,随着酵母接种量的增加,发酵液乙醇体积分数呈上升趋势,还原糖含量不断减少,而花青素和多酚含量呈降低趋势。当酵母接种量达到1.5 g/L时,玫瑰茄酒的口感最佳,随着酵母接种量的增多还原糖含量不断降低,但乙醇体积分数不再升高,说明此时还原糖的消耗不再用于乙醇的产生而是用于酵母自身的生长,当酵母接种量超过1.5 g/L后,花青素含量显著降低(P<0.05),原因可能是酵母的增多使得花青素被大量消耗。综上考虑,选择酵母接种量1.5 g/L为中心点,在1.0~2.0 g/L之间进行优化。
2.2.1.3 加糖量对发酵效果的影响
由图4可知,随加糖量的增多还原糖含量不断升高,乙醇体积分数呈先上升后下降的趋势,多酚含量呈上升趋势,花青素含量略微升高。当加糖量为23%时发酵液乙醇体积分数显著高于其他发酵液(P<0.05),所得玫瑰茄酒感官得分最高,当加糖量超过23%时,高渗透压可能抑制了酵母的活性[27],乙醇体积分数降低,因而选择加糖量23%为优化的中心点。

图4 加糖量对乙醇体积分数、还原糖、花青素及多酚含量的影响
Fig. 4 Effect of sucrose addition on the concentrations of alcohol,reducing sugar, anthocyanins and polyphenols in roselle wine
2.2.1.4 发酵时间对发酵效果的影响
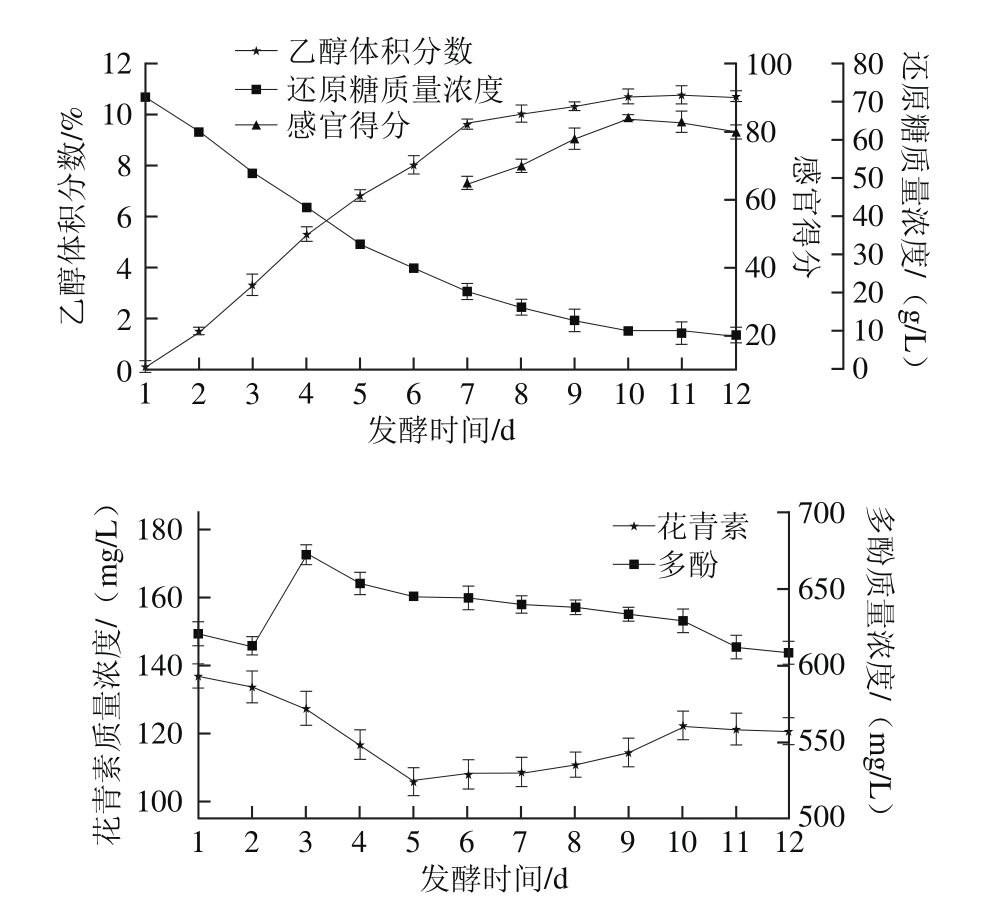
图5 发酵时间对乙醇体积分数、还原糖、花青素及多酚含量的影响
Fig. 5 Effect of fermentation time on the concentrations of alcohol,reducing sugar, anthocyanins and polyphenols in roselle wine
由图5可知,随着发酵时间的延长,乙醇体积分数不断升高,还原糖、花青素和多酚含量不断降低。在发酵前7 d乙醇体积分数上升较快,之后上升比较缓慢,当发酵时间为10 d时,发酵液乙醇体积分数达10.7%左右,之后乙醇体积分数不再增加且略有降低的趋势,乙醇发酵趋于终点。花青素在前5 d降低速度较快,之后含量有回升的趋势,在发酵第10天时花青素含量达122.4 mg/L左右,之后含量略有降低。而多酚含量在第3天出现了升高,之后含量随发酵时间的延长缓慢降低。发酵液中花青素及多酚含量的降低可能与酵母的消耗和利用有关,这与Ifie等[14]的报道一致。通常果酒的发酵时间在7 d以上,在发酵前期发酵不完全,发酵液中乙醇含量较低,从第7天起对玫瑰茄酒做感官评价,玫瑰茄酒在发酵10 d后口感达到了最佳,综上考虑,玫瑰茄酒的发酵时间选择10 d为宜。
2.2.1.5 发酵温度对发酵效果的影响
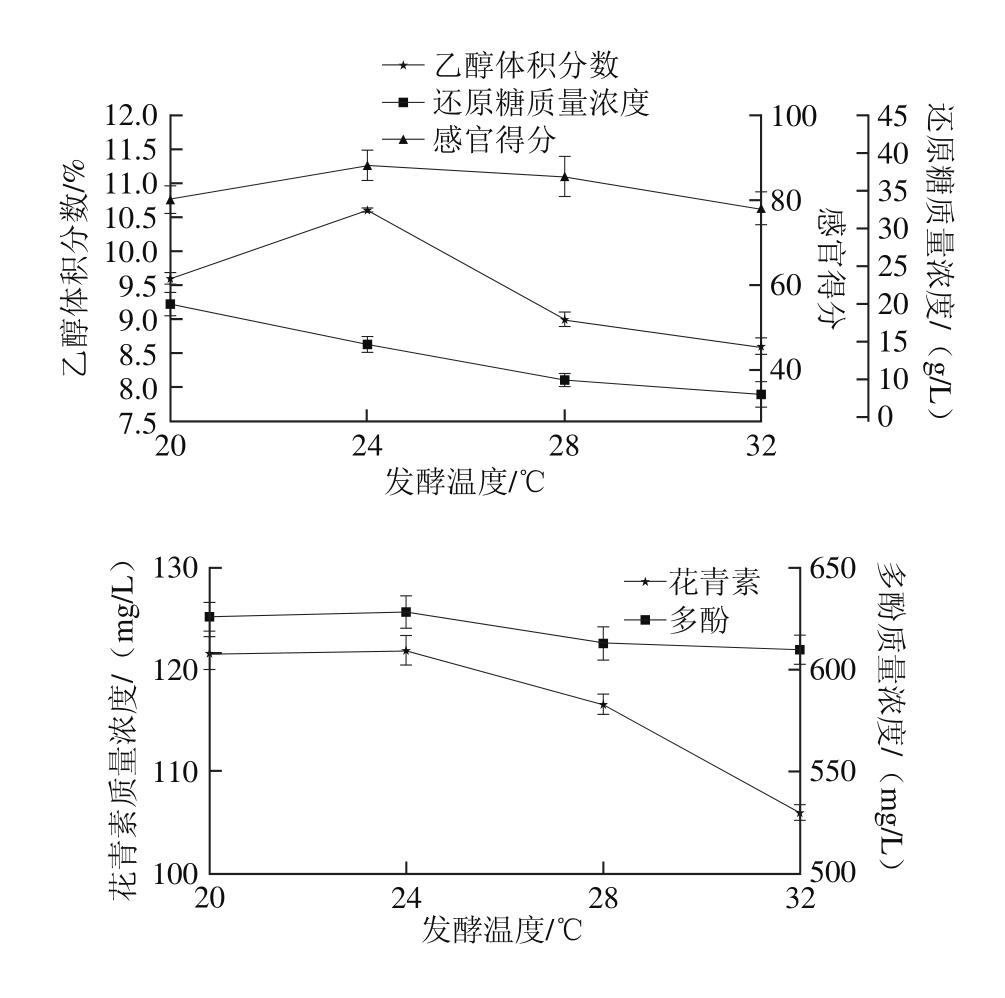
图6 发酵温度对乙醇体积分数、还原糖、花青素及多酚含量的影响
Fig. 6 Effect of fermentation temperature on the concentrations of alcohol, reducing sugar, anthocyanins and polyphenols in roselle wine
如图6所示,在24 ℃发酵时乙醇体积分数达到最大值为(10.5±0.21)%,花青素和多酚也显著高于其他温度的含量(P<0.05),所得玫瑰茄酒口感最好,故选择发酵温度24 ℃为中心点进行优化。通常22~25℃是果酒酵母最适宜的生长范围,温度越高,起酵快,发酵时间短,但酵母衰老快,反而导致乙醇体积分数较低,并且高温条件下挥发性成分损失较多,腐败微生物易繁殖生长,使得发酵酒的品质降低[28]。
2.2.2 玫瑰茄发酵酒工艺参数的响应面优化
2.2.2.1 Box-Behnken试验设计方案及结果
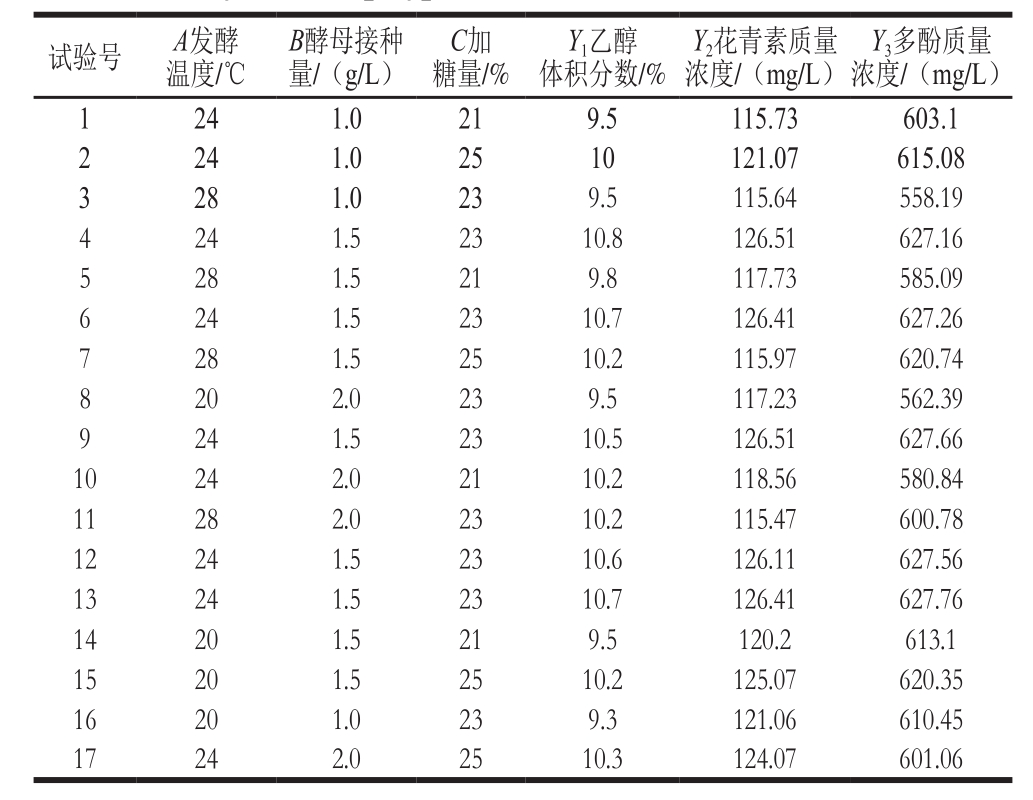
在单因素试验基础上,用Design-Expert 8.0.6软件,根据Box-Behnken设计原理,以发酵温度、酵母接种量、加糖量3 个影响玫瑰茄酒发酵的主要因素为响应变量(以A、B和C来表示),以乙醇体积分数、花青素质量浓度及多酚质量浓度为响应值进行响应面优化,试验方案及结果见表8。
表8 Box-Behnken试验方案及结果
Table8 Box-Behnken design with experimental values of alcohol,anthocyanin and polyphenol concentrations in roselle wine
2.2.2.2 工艺模型的建立及显著性检验
表9 玫瑰茄酒回归模型拟合结果
Table9 Regression models predicting alcohol, anthocyanin and polyphenol concentrations in roselle wine

由表9可知,以乙醇体积分数、花青素及多酚质量浓度为响应值的数学拟合模型效果极显著,R2分别为0.966 6、0.929 8及0.980 9,说明该模型拟合度较好,该试验方法可靠,可用于预测和分析玫瑰茄发酵酒的乙醇体积分数、花青素及多酚含量。
表10 回归统计分析
Table10 Analysis of variance of response surface regression models predicting alcohol, anthocyanin and polyphenol concentrations in roselle wine
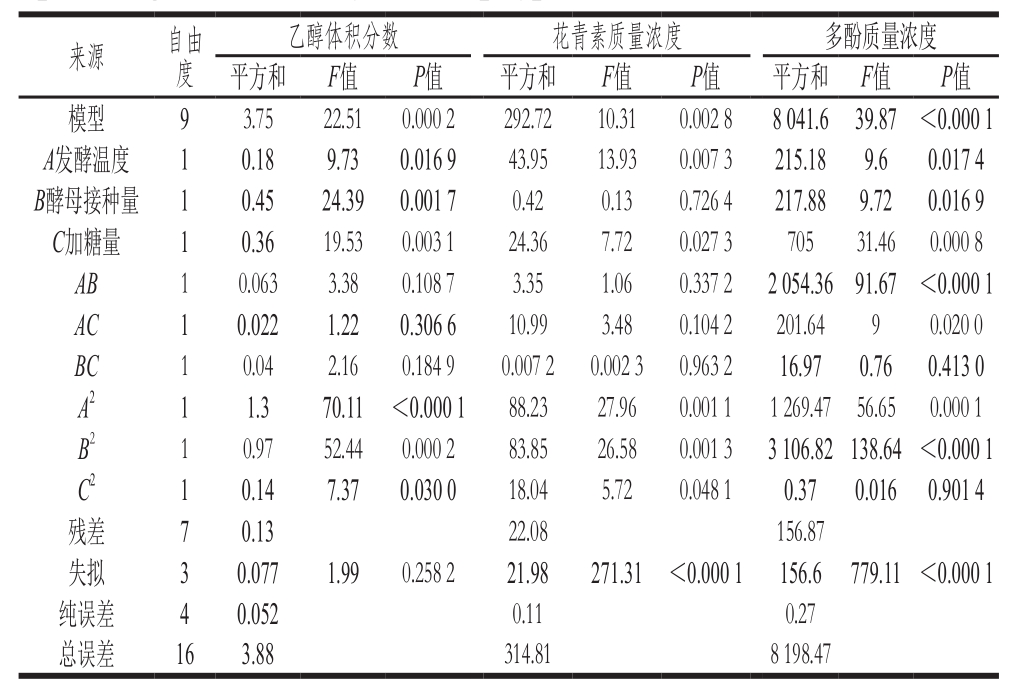
为了验证方程的有效性,对该模型进行回归分析,结果如表10所示,各发酵因素对3 个响应值存在不同的交互作用的影响。结合F值的大小,可知所选因素对玫瑰茄酒乙醇体积分数的影响强弱顺序为:发酵温度<加糖量<酵母接种量;对玫瑰茄酒花青素含量的影响强弱顺序为:酵母接种量<加糖量<发酵温度;对玫瑰茄酒多酚含量的影响强弱顺序为:发酵温度<酵母接种量<加糖量。
2.2.2.3 响应面分析及优化
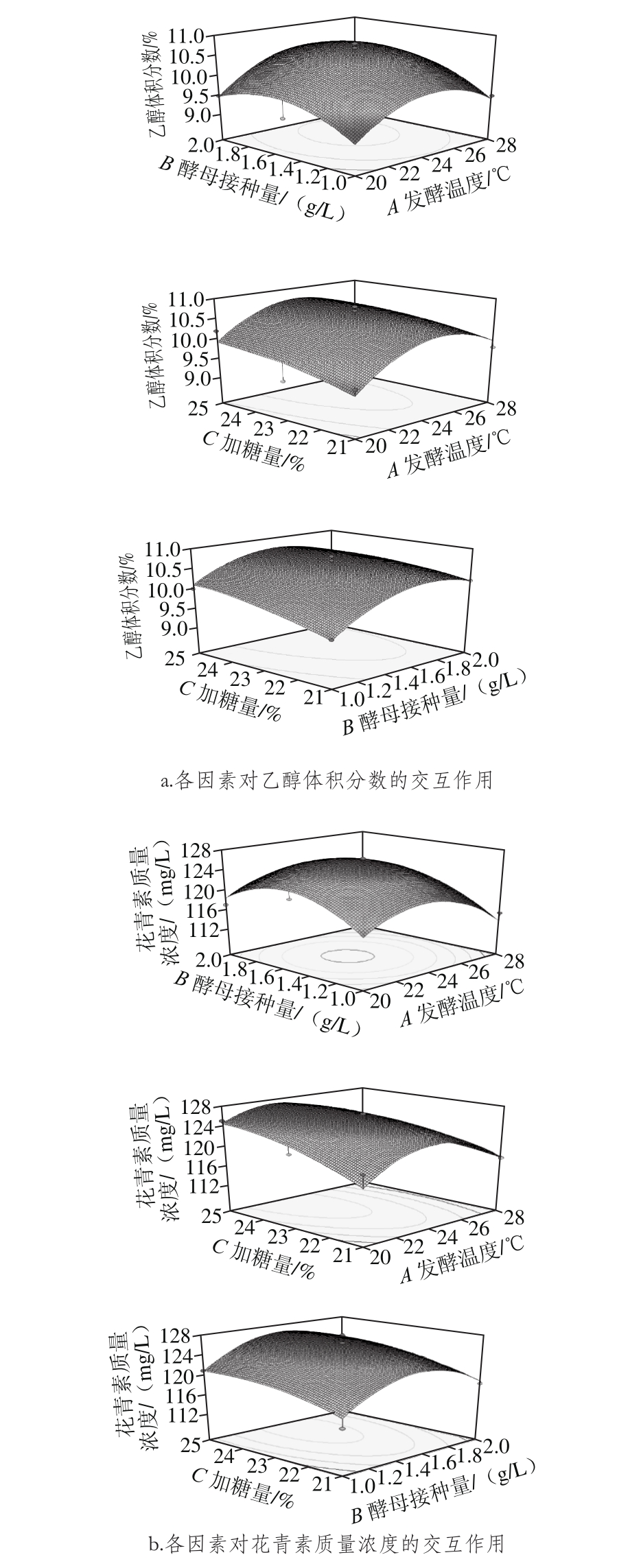
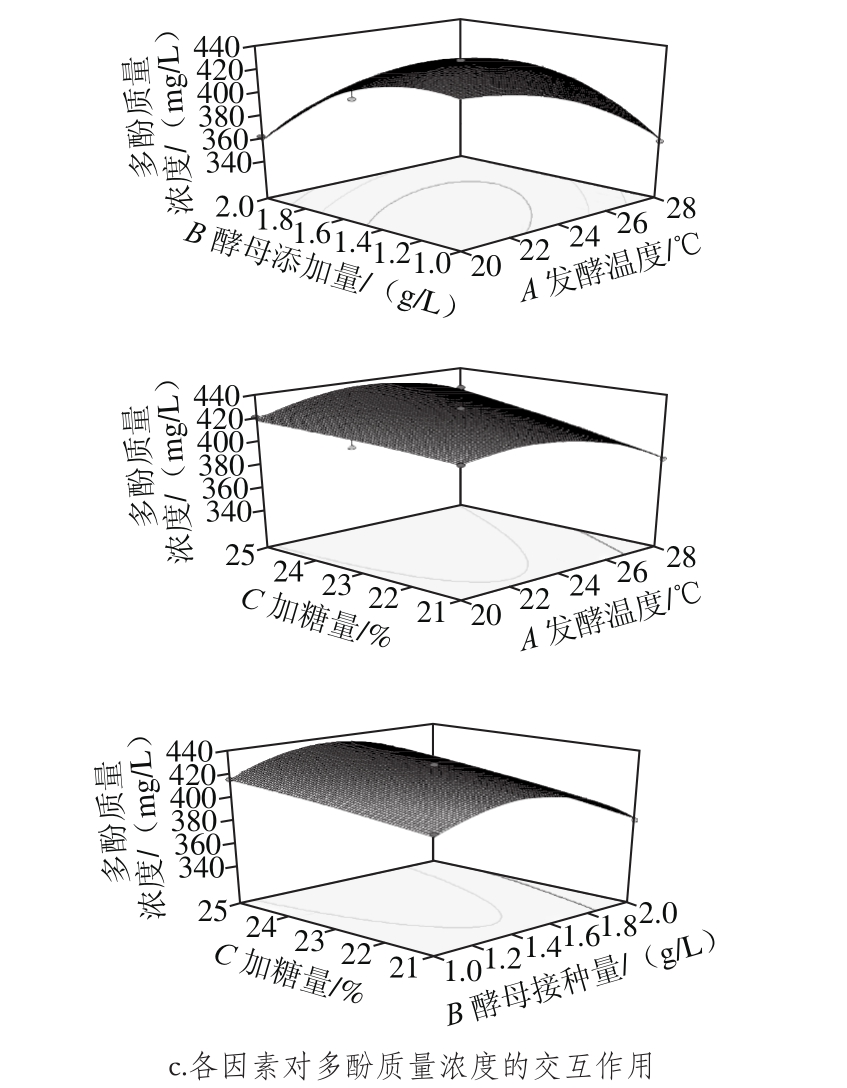
图7 各因素对乙醇体积分数、花青素及多酚含量影响的响应面图
Fig. 7 Response surface plots showing the interactive effects of variables on alcohol, anthocyanin and polyphenol concentrations
从图7可直观看出,发酵温度、酵母接种量及加糖量对玫瑰茄酒乙醇体积分数和花青素质量浓度有较大影响,并且各因素之间有较显著的交互作用,表现为响应面的坡度较陡。而响应值为多酚质量浓度的曲面坡度较为平缓,说明各因素对多酚含量的影响稍弱。
由于本试验主要关注玫瑰茄中的主要功能成分花青素和多酚含量在发酵过程中能够得到最大程度的保留,并且最终乙醇体积分数能达到10%以上,因而选择乙醇体积分数的重要性为3,花青素及多酚质量浓度的重要性分别为5,乙醇体积分数目标值为10.0%~12.0%的最大响应值,花青素目标质量浓度为115.47~200 mg/L的最大响应值,多酚目标质量浓度为358.19~600mg/L的最大响应值,在此条件下该模型预测得到的玫瑰茄酒最佳发酵工艺条件为:发酵温度24.81 ℃、酵母接种量1.6 g/L、加糖量22.64%。在此发酵条件下预测得到的玫瑰茄酒乙醇体积分数为10.63%,花青素质量浓度为125.17 mg/L,多酚质量浓度为621.33 mg/L。
2.3 验证实验
根据模型预测,考虑实际条件情况,将玫瑰茄酒发酵的最佳工艺条件定为:发酵温度24.5 ℃、酵母接种量1.6 g/L、加糖量22.5%。为验证模型预测的准确性,在该条件下进行3次平行实验,取平均值,得到的实际值与预测的理论值相差不大,因此响应面法对玫瑰茄花酒发酵条件的优化是可行的。
2.4 玫瑰茄酒主要品质指标及其有机酸类成分测定结果
2.4.1 玫瑰茄酒主要指标检测结果
表11 玫瑰茄酒中的氨基酸种类及相对及酚酸含量
Table11 Amino acid composition of roselle wine
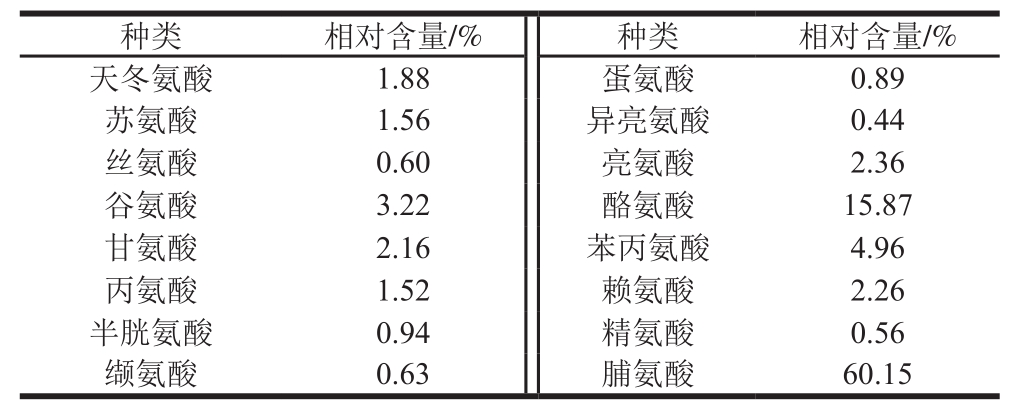
经检测,在最佳工艺条件下发酵得到的玫瑰茄酒的乙醇体积分数为(10.6±0.12)%,花青素质量浓度为(121.25±0.35)mg/L,多酚质量浓度为(629.58±0.22)mg/L,可滴定酸质量浓度为8.06 g/L(以酒石酸计),还原糖质量浓度为(14.47±0.19)g/L,总酯质量浓度为(1.97±0.20)g/L,挥发酸质量浓度为(0.84±0.12)g/L,感官得分为89.57±2.25。玫瑰茄酒中氨基酸种类齐全,各氨基酸种类及相对含量如表11所示,玫瑰茄酒中共检出16 种氨基酸(组氨酸未检出),总质量浓度为(67.32±0.32)mg/L,脯氨酸是玫瑰茄酒中的主要氨基酸,其含量占氨基酸总量的60.15%,而具有刺激系统、缓解慢性疲劳的酪氨酸占氨基酸总量的15.87%,此外,除色氨酸以外的7 种必需氨基酸占氨基酸总量的10.85%。
2.4.2 有机酸及酚酸测定结果
表12 玫瑰茄浸提液及其发酵酒中各有机酸含量
Table12 Organic acid composition of water extract from roselle and wine

注:同行不同字母表示有显著性差异(P<0.05)。—.未检出。
如表12所示,玫瑰茄浸提液中共检测出7种有机酸,主要的有机酸为柠檬酸和木槿酸,这与张赛男等[2]的报道一致,其含量占有机酸总量的59.05%,而木槿酸和HCA占有机酸总量的30.00%。玫瑰茄酒中的主要有机酸为乳酸和木槿酸,占总有机酸含量的55.26%,而柠檬酸在发酵过程中大幅度降低,因而玫瑰茄的尖酸感得到了较大的缓和,与其浸提液相比玫瑰茄酒酸度较柔和,玫瑰茄酒中槿酸和HCA含量与浸提液相比有所降低,占有机酸总量的24.58%,而乳酸、琥珀酸及丙酮酸的含量升高可能是因为酵母菌的发酵作用造成的[29]。此外在玫瑰茄浸提液及其发酵酒中均未检出乙酸。
玫瑰茄浸提液中含有除肉桂酸以外的8 种酚酸,原儿茶酸含量最高,占酚酸总量的39.15%,这与Borrás-Linares等[30]报道的玫瑰茄中主要含有羟基苯甲酸类、羟基肉桂酸类等酚酸相符。在发酵过程中原儿茶酸、绿原酸、龙胆酸、咖啡酸及阿魏酸含量有一定程度的降低,而没食子酸、丁香酸和香豆酸的含量升高,这与IFIE等[14]报道的玫瑰茄酒发酵过程中咖啡酸含量有所升高不同,可能与玫瑰茄种类及玫瑰茄酒发酵条件的不同有关。
3 结 论
玫瑰茄最优浸提工艺为料液比1∶28、浸提温度84.0 ℃、浸提时间78 min,优化后的浸提工艺可使玫瑰茄花青素提取率为(0.060±0.009)%,多酚提取率为(0.201±0.05)%。玫瑰茄酒的最优发酵条件为发酵温度24.5 ℃、S4酵母接种量1.6 g/L、加糖量22.5%,在最优发酵条件下所得玫瑰茄酒的乙醇体积分数为(10.6±0.12)%,花青素质量浓度为(121.25±0.35)mg/L,多酚质量浓度为(629.58±0.22)mg/L。木槿酸、柠檬酸和原儿茶酸是玫瑰茄浸提液中的主要有机酸和酚酸,在发酵过程中,各有机酸和酚酸含量发生了不同程度的升高和降低,其中柠檬酸含量显著降低,而没食子酸、丁香酸和香豆酸等酚酸的含量得到了提高。玫瑰茄酒中的主要的有机酸为乳酸和木槿酸,原儿茶酸仍为其主要的酚酸。所得玫瑰茄酒保留了其特有的木槿酸、HCA、酚酸、花青素等功能成分,氨基酸种类齐全,具有一定的保健功效,各主要指标均符合果酒标准,其颜色鲜亮透明,酸甜适宜,满足人们对天然、健康食品的追求,具有良好的开发价值和市场潜能。
参考文献:
[1] 佚名. 卫计委: 有关新食品原料、普通食品名单汇总[J]. 饮料工业,2014, 17(8): 58-62.
[2] 张赛男. 玫瑰茄的药用价值与利用现状[J]. 现代化农业, 2014(12):23-25. DOI:10.3969/j.issn.1001-0254.2014.12.012.
[3] HANSAWASDII C, KASAI T K J. Alpha-amylase inhibitors from roselle (Hibiscus sabdariffa Linn.) tea[J]. Bioscience Biotechnology &Biochemistry, 2000, 64(5): 1041-1043. DOI:10.1271/bbb.64.1041.
[4] LIU L C, WANG C J, LEE C C, et al. Aqueous extract of Hibiscus sabdariffa L. decelerates acetaminophen-induced acute liver damage by reducing cell death and oxidative stress in mouse experimental models[J]. Journal of the Science of Food & Agriculture, 2010, 90(2):329-337. DOI:10.1002/jsfa.382110.1002/jsfa.3821.
[5] FAROMBI E O, IGE O O. Hypolipidemic and antioxidant effects of ethanolic extract from dried calyx of Hibiscus sabdariffa in alloxaninduced diabetic rats[J]. Fundamental & Clinical Pharmacology, 2007,21(6): 601-609. DOI:10.1111/j.1472-8206.2007.00525.x.
[6] RODRÍGUEZMEDINA I C, BELTRÁNDEBÓN R, MOLINA V M,et al. Direct characterization of aqueous extract of Hibiscus sabdariffa using HPLC with diode array detection coupled to ESI and ion trap MS[J]. Journal of Separation Science, 2009, 32(20): 3441-3448.DOI:10.1002/jssc.200900298.
[7] 李升锋, 刘学铭, 朱志伟, 等. 玫瑰茄资源的开发利用[J]. 食品科技,2003, 36(6): 86-88. DOI:10.3969/j.issn.1005-9989.2003.06.031.
[8] 陈政. 玫瑰茄的开发和利用[J]. 饮料工业, 2007, 10(3): 13-16.DOI:10.3969/j.issn.1007-7871.2007.03.004.
[9] 惠战锋, 肖红, 惠玉虎, 等. RP-HPLC法测定藤黄果原料中羟基柠檬酸的含量[J]. 西北药学杂志, 2015, 30(4): 371-372. DOI:10.3969/j.issn.1004-2407.2015.04.014.
[10] 鞠玉栋, 吴维坚. 玫瑰茄化学成分及其综合利用[J]. 中国园艺文摘,2009, 25(12): 171-172. DOI:10.3969/j.issn.1672-0873.2009.12.084.
[11] ALI B H, AL W N, BLUNDEN G. Phytochemical, pharmacological and toxicological aspects of Hibiscus sabdariffa L.: a review[J]. Phytotherapy Research Ptr, 2005, 19(5): 369-375. DOI:10.1002/ptr.1628.
[12] CID-ORTEGA S, GUERRERO-BELTRÁN J A. Roselle calyces(Hibiscus sabdariffa), an alternative to the food and beverages industries: a review[J]. Journal of Food Science and Technology, 2015,52(11): 6859-6869. DOI:10.1007/s13197-015-1800-9.
[13] ARUBIP A, OFFONRY S U. Characteristics of coloured wine produced from roselle (Hibiscus sabdariffa) calyx extract[J]. Journal of the Institute of Brewing, 2009, 115(2): 91-94.
[14] IFIE I, MARSHALL L J, HO P, et al. Hibiscus sabdariffa (Roselle)extracts and wine: phytochemical profile, physicochemical properties, and carbohydrase inhibition[J]. Journal of Agricultural & Food Chemistry,2016, 64(24): 4921-4931. DOI:10.1021/acs.jafc.6b01246.
[15] 李升锋, 徐玉娟, 刘学铭, 等. 玫瑰茄浸提工艺条件的研究[J].农产品加工: 学刊, 2006(7): 11-13. DOI:10.3969/j.issn.1671-9646-B.2006.07.003.
[16] 李升锋, 徐玉娟, 张友胜, 等. 玫瑰茄多酚提取条件的优化研究[J]. 安徽农业科学, 2007, 35(13): 3769-3770. DOI:10.3969/j.issn.0517-6611.2007.13.001.
[17] 桑戈, 赵力, 谭婷婷, 等. pH示差法测定紫薯酒中花青素的含量[J].酿酒科技, 2015(6): 88-91. DOI:10.13746/j.njkj.2014449.
[18] 马倩倩, 吴翠云, 蒲小秋, 等. 高效液相色谱法同时测定枣果实中的有机酸和VC含量[J]. 食品科学, 2016, 37(14): 149-153. DOI:10.7506/spkx1002-6630-201614026.
[19] 向进乐, 罗磊, 马丽苹, 等. 木瓜酒和木瓜醋发酵工艺及其有机酸组成分析[J]. 食品科学, 2016, 37(23): 191-195. DOI:10.7506/spkx1002-6630-201623032.
[20] 余永建, 邓晓阳, 陆震鸣, 等. 高效液相色谱法定量分析固态发酵食醋中有机酸的方法优化[J]. 食品科学, 2014, 35(4): 55-59.DOI:10.7506/spkx1002-6630-201404012.
[21] 卢可可, 谭玉荣, 吴素蕊, 等. 不同产地尖顶羊肚菌多酚组成及抗氧化活性研究[J]. 食品科学, 2015, 36(7): 6-12. DOI:10.7506/spkx1002-6630-201507002.
[22] 吕国涛, 牛宇, 单璐, 等. 高效液相色谱法测定樱桃汁及不同酿酒酵母所酿樱桃酒的活性成分[J]. 食品与发酵工业, 2016, 42(8): 171-177. DOI:10.13995/j.cnki.11-1802/ts.201608030.
[23] 吕乐福, 赵旭东, 张红卫, 等. 氨基酸原料中游离氨基酸测定及风险评估[J]. 山东农业科学, 2016, 48(4): 129-133. DOI:10.14083/j.issn.1001-4942.2016.04.032.
[24] 史静霞. 配制酒总酯的测定[J]. 酿酒, 2001, 28(4): 95-96.DOI:10.3969/j.issn.1002-8110.2001.04.041.
[25] 宋洪波. 绿茶浸提工艺的研究[J]. 中国食品学报, 2001, 1(1): 19-23.DOI:10.3969/j.issn.1009-7848.2001.01.004.
[26] 葛尧, 陈文伟, 贾振宝, 等. 中心组合设计法优化速溶茶粉提取工艺的研究[J]. 中国食品添加剂, 2008(2): 102-105. DOI:10.3969/j.issn.1006-2513.2008.02.024.
[27] 赵欠, 王巧碧, 袁敏, 等. 白肉枇杷白兰地原酒发酵条件优化[J]. 食品与发酵工业, 2017, 43(1): 104-109. DOI:10.13995/j.cnki.11-1802/ts.201701018.
[28] 涂行浩, 张弘, 郑华, 等. 玛咖发酵酒工艺优化[J]. 食品与发酵工业,2015, 41(1): 156-161. DOI:10.13995/j.cnki.11-1802/ts.201501030.
[29] 韩晓鹏, 牟德华, 赵英莲, 等. HPLC法检测树莓果汁和果酒中的有机酸[J]. 酿酒科技, 2015(5): 107-110. DOI:10.13746/j.njkj.2014426.
[30] BORRÁS-LINARES I, FEMÁNDEZ-ARROYO S, ARRÁEZ-ROMAN D, et al. Characterization of phenolic compounds, anthocyanidin,antioxidant and antimicrobial activity of 25 varieties of Mexican Roselle(Hibiscus sabdariffa )[J]. Industrial Crops & Products, 2015, 69: 385-394. DOI:10.1016/j.indcrop.2015.02.053.