自然界中半纤维素是最丰富的多聚物,植物的茎干、种子、果壳等部分含有大量的半纤维素,如在针叶树中其含量占细胞壁干质量的10%~15%,阔叶树中为18%~23%,禾草类中为20%~25%[1]。木聚糖是植物半纤维素的主要成分[2-3],是自然界中除纤维素之外含量最丰富的多糖[4]。木聚糖是一种多聚五碳糖,大多以β-1,4糖苷键[5]连接形成主链,主链上连有4-O-甲基葡萄糖醛酸或L-阿拉伯呋喃糖侧枝结构[6-7]。自然界中大多数木聚糖均未被利用,造成很大的资源浪费。如果合理开发利用,不仅可以减少污染,而且能够变废为宝,实现资源的可持续循环利用[8]。
低聚木糖主要包括木二糖、木三糖和木四糖[9],作为一种新兴的保健产品,具有用量低、难消化、稳定性高和对双歧杆菌的高选择性增殖效果等优点,近年来在食品、药品等行业被广泛应用[10-11]。由于传统化学法存在着能耗高、产率低和污染严重等问题,使得具有反应条件温和、效率高、特异性强等优点的酶法水解木聚糖制备低聚木糖具有重要的工业应用意义[12-13]。木聚糖结构复杂,完全降解木聚糖需要多种木聚糖降解酶的协同作用,包括β-1,4内切木聚糖酶、β-木糖苷酶和侧枝酶α-L-阿拉伯呋喃糖苷酶、α-葡萄糖醛酸酶等[14-16]。其中,β-1,4内切木聚糖酶和β-木糖苷酶(统称为木聚糖酶)作为降解木聚糖主要的酶系已被广泛研究,但是当利用单一木聚糖酶水解这类木聚糖制备低聚木糖时,α-葡萄糖醛酸侧枝则对木聚糖酶的作用产生空间屏障,使得木聚糖酶不能结合和分解邻近这些侧枝的木聚糖,不仅影响酶法水解的效率,而且影响低聚木糖的质量。国内外对木聚糖酶水解木聚糖产生低聚木糖的研究较多,赵力超等[17]研究发现重组多功能木聚糖酶加酶量900 U/mL、底物质量浓度110 mg/mL、反应时间80 min的条件下,酶解木聚糖质量分数为54.7%的蔗渣半纤维素,得到的还原糖质量浓度为4.23 mg/mL。黄家骥等[18]研究发现在pH 7.6、反应温度40 ℃、加酶量800 U/g、水解时间12 h的条件下,以木聚糖酶水解自制玉米芯木聚糖产生的还原糖质量浓度为8.58 mg/mL。Boonchuay等[19]研究发现先用KOH预处理玉米芯,然后在酶含量129.43 U/g、53.80 ℃和pH 6.17的条件下进行酶解反应,还原糖产量为162.97 mg/g。但是木聚糖酶和葡萄糖醛酸酶联合作用于木聚糖生产低聚木糖的研究相对较少。为了提高低聚木糖的产量,本课题组前期构建了共生产木聚糖酶和葡萄糖醛酸酶工程菌[20],并对重组菌产酶水平进行了优化,使其产酶水平达到最高,并发现在低聚木糖的制备中,双酶在相同的条件下相比单酶能够彻底快速地水解桦木木聚糖产生木寡糖,酶解产物中木二糖含量及纯度更高。低聚木糖,尤其是木二糖,具有显著的双歧杆菌增殖能力、不被消化性、无龋齿性以及促进人体对钙吸收等特性。
近年来,响应面法[21]已成为建立数学模型的一种有效工具,可以用来优化多因素试验并评估几种因素之间的影响。通过响应面法不仅可以从少量的实验中获得大量的信息,而且可以观察到单个因素之间的相互影响。响应面法已被广泛应用于优化各种因素的试验中,如优化草鱼内脏蛋白质的水解条件[22]等。因此,本研究利用重组木聚糖酶和葡萄糖醛酸酶共同水解桦木木聚糖制备低聚木糖,应用响应面法优化木聚糖的水解条件,以期提高低聚木糖的产量。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒
含有海栖热袍菌(Thermotoga maritima MSB8)木聚糖酶B(xylanase,XynB)和葡萄糖醛酸酶(glucuronidase,AguA)基因的共表达质粒pET-28a-T7-xynB-Hsh-aguA(以下简称为pET-28a-XPA)由本实验构建保存。大肠杆菌Escherichia coli JM109(DE3)(Promega)作为目的基因的表达宿主。
1.1.2 培养基
TB培养基(1 L):900 mL去离子水中加入胰蛋白胨12 g、酵母提取物24 g、甘油4 mL,摇匀,高温灭菌20 min,冷却至60 ℃以下,加入100 mL无菌0.17 mol/L KH2PO4、0.72 mol/L K2HPO4溶液。
1.1.3 试剂
桦木木聚糖、咪唑 美国Sigma公司;正丁醇、冰乙酸、乙醇(均为分析纯) 南京宁氏试剂公司;邻苯二甲酸氢钾 成都市科龙化工试剂厂;浓硫酸 南京化学试剂一厂;GF-254硅胶板 山东江友硅胶开发有限公司。
1.2 仪器与设备
分光光度计 日本Unico公司;HH-S2数显恒温水浴锅 金坛市医疗仪器厂;台式离心机 上海安亭科学仪器厂;层析缸 南京丁贝生物科技有限公司。
1.3 方法
1.3.1 重组菌E. coli JM109(DE3)/pET-28a-XPA产酶
将重组质粒pET-28a-XPA转入E. coli JM109(DE3)中,挑取单菌落接入含有Kan抗性的TB培养液中,37 ℃、220 r/min培养过夜,以1.5%种子液接入含相同抗生素的新鲜TB培养液中,30 ℃振荡培养至OD600nm约为2.0时,加入异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG)至终浓度为0.8 mmol/L,并升温至42 ℃继续诱导培养。加入诱导剂后,每隔一定时间取出一支菌液在600 nm波长处测定OD值判定菌体的生长速率,并取菌液1 mL离心收集的菌体,用400 μL 50 mmol/L邻苯咪唑缓冲液(pH 6.2)重悬,超声波破碎,离心取上清液检测胞内XynB和AguA表达量。
1.3.2 酶活性测定
XynB和AguA酶活性检测方法分别参考文献[23]和[24]。
1.3.3 单因素试验
以桦木木聚糖为底物恒温水浴振荡进行酶解反应,以还原糖释放量为指标,采用单因素试验,探讨混合酶添加量、酶解时间、pH值、酶解温度和底物质量浓度对桦木木聚糖酶解的影响。其中混合酶XynB/AguA添加量分别为20/3、40/6、60/9、80/12、100/15、150/22.5、200/30 U/g(双酶液添加量记为XynB/AguA);酶解反应时间为0.5、1、2、4、6、8、10 h;pH值为5.8、6.2、6.6、7.0、7.4、7.8、8.2;酶解温度为60、70、80、90、95 ℃;底物质量浓度为1、2、4、6、8 g/100 mL。酶解结束后将酶解液在100 ℃水浴中灭酶10 min,酶解液经5 000×g离心10 min得上清液,用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定还原糖含量,实验重复3 次。同时取4 μL上清液用于薄层色谱(thin layer chromatography,TLC)分析。
1.3.4 DNS法检测还原糖
1.3.4.1 DNS试剂的配制
称取(10±0.1)g DNS溶于600 mL水中,逐渐加入10 g NaOH,50 ℃水浴磁力搅拌溶解,然后依次加入200 g酒石酸钾钠,2 g重蒸苯酚和0.5 g无水亚硫酸钠,待全部溶解并澄清后,冷却至室温,用水定容至1 000 mL,过滤,贮存于棕色试剂瓶中,暗处放置7 d后使用。
1.3.4.2 DNS比色法测定
取80 μL酶解液加入DNS试剂60 μL,煮沸5 min,冰水冷却,加860 μL水,混匀,在520 nm波长处测定吸光度。用10 mg/mL的木糖溶液作标准曲线,计算出酶解后还原糖的含量。
1.3.5 TLC检测法
展层剂为正丁醇-乙酸-水体积比2∶1∶1,显色剂为浓硫酸-甲醇体积比1∶4。采用硅胶板,点样量4 μL,105 ℃加热5 min显色。
1.3.6 高效液相色谱法检测酶解产物
采用YWG-NH2氨基合固定相不锈钢色谱柱(4.6 mm×250 mm,10 μm);检测器为515示差折光检测器;流动相为乙腈-水体积比70∶30;流速2 mL/min;柱温为室温;酶解产物在进样之前经0.45 μm微孔滤膜过滤。
1.3.7 桦木木聚糖酶解的响应面试验
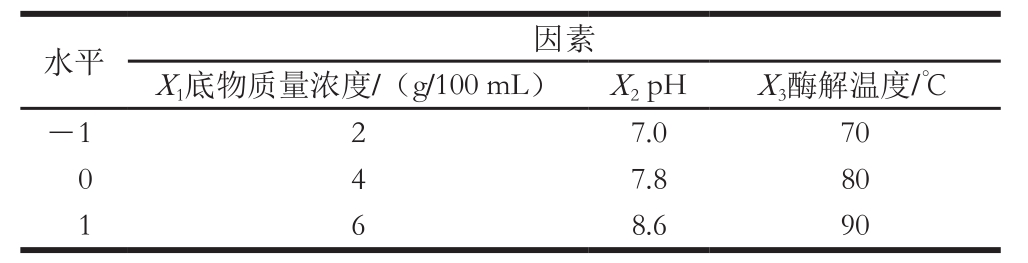
在酶解单因素试验的基础上,选取底物质量浓度(X1)、pH值(X2)、酶解温度(X3)为影响因素,以还原糖释放量作为评价指标,采用三因素三水平Box-Behnken模型进行响应面优化,试验设计因素与水平如表1所示。采用Design-Expert 7.0软件,对响应面试验设计及数据进行分析。
表1 Box-Behnken试验设计因素与水平
Table1 Level and code of independent variables used for Box-Behnken design
2 结果与分析
2.1 不同诱导时间下XynB和AguA的产量
由图1可知,随着诱导时间的不断延长XynB的酶活力变化不大,在诱导8 h时活性达到最大10.4 U/mL,比活力达到6.639 U/mg;随着诱导时间的延长,AguA的酶活力不断上升,当诱导8 h时酶活力达到最高1.6 U/mL,比活力为1.093 U/mg,8 h后AguA的酶活力有所下降;加入诱导剂IPTG后菌体的生长速率明显减慢,这是因为IPTG有一定的毒性,抑制了菌体的快速生长[14]。因此选择8 h为诱导时间,制备XynB和AguA的双酶液用于桦木木聚糖的水解实验。

图1 不同诱导时间下混合酶的活力和比活力
Fig. 1 Effect of induction time on XynB/AguA and activities and specific activities produced by the engineered strain
2.2 XynB和AguA对桦木木聚糖水解作用的影响
2.2.1 加酶量对桦木木聚糖水解作用的影响
在底物质量浓度1 g/100 mL、pH 6.6、酶解温度80 ℃、酶解时间8 h条件下,XynB/AguA加酶量分别为20/3、40/6、60/9、80/12、100/15、150/22.5、200/30 U/g,研究加酶量对桦木木聚糖水解的影响。
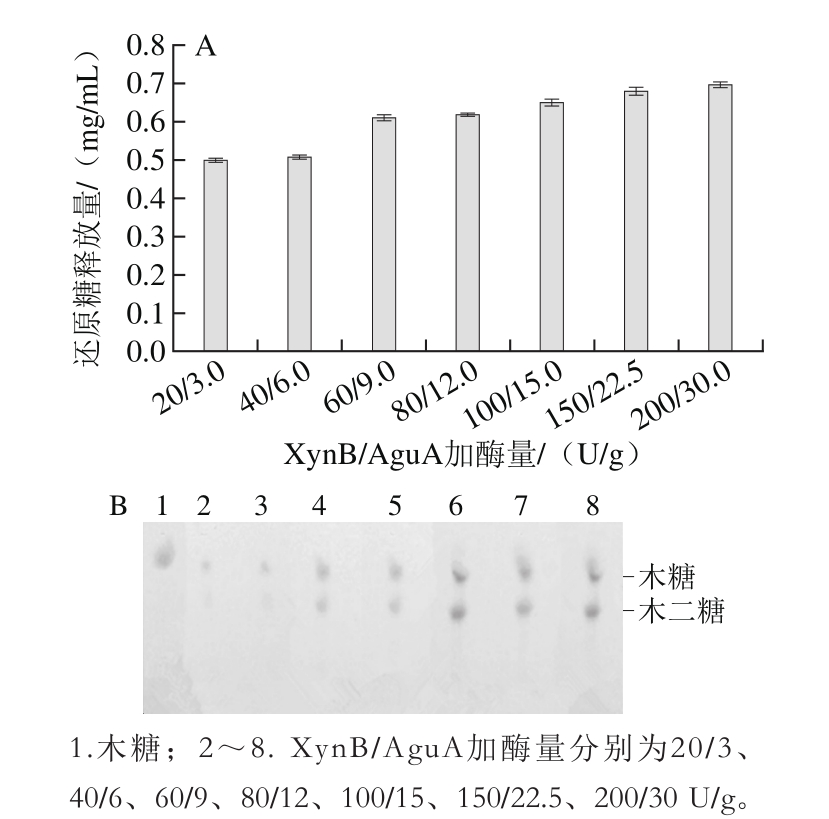
图2 加酶量对水解桦木木聚糖的还原糖释放量的影响(A)和TLC图(B)
Fig. 2 Effect of enzyme dosage on reducing sugar concentration in xylan hydrolysates (A) and TLC profiles of hydrolysates (B)
由图2A可知,酶解所释放的还原糖量随着酶量增加而增多,XynB加酶量超过60 U/g时,还原糖释放量趋于平缓;由图2B可知,随着酶量的增加木糖及木二糖含量逐渐增加,XynB/AguA加酶量为60/9 U/g时,还原糖释放量可达到0.61 mg/mL,加酶量超过60/9 U/g时,木寡糖含量基本无变化。这种现象与张根生等[25]在响应面法优化双酶酶解酪蛋白工艺的结果一致。考虑到低聚木糖产量及生产成本,选择复合酶加酶量为XynB 60U/g、AguA 9 U/g。
2.2.2 酶解时间对桦木木聚糖水解作用的影响

图3 酶解时间对水解桦木木聚糖的还原糖释放量的影响(A)和TLC图(B)
Fig. 3 Effect of hydrolysis time on reducing sugar concentration in xylan hydrolysates (A) and TLC profiles of hydrolysates (B)
由图3A可知,不同酶解时间下还原糖释放量差距并不明显,说明初始酶解效率较高,能够高效地将木聚糖充分酶解为木糖和木二糖,酶解4 h时,还原糖释放量达到0.622 mg/mL;由图3B可知,酶解4 h后,低聚木糖总量不再增加,木糖及木二糖产量变化趋缓。Boonchuay等[19]研究发现来源于嗜热菌Streptomyces thermovulgaris TISTR1948的木聚糖酶,在使用KOH预处理,53.80 ℃和pH 6.17的条件下,水解玉米芯的最佳时间为12 h,而本实验所需的酶解时间为4 h。这可能是由于木聚糖酶来源不同,酶解底物不同,也可能因为本实验采用的是XynB和AguA的双酶液进行酶解使酶解时间缩短为4 h。
2.2.3 pH值对桦木木聚糖水解作用的影响
由图4A可知,pH值对酶解效率有着极显著的影响。在pH 7.8时还原糖释放量达到最高1.44 mg/mL,图4B也显示木二糖含量最高,在pH值大于7条件下酶解液中几乎只有木糖和木二糖的存在,pH值达到8.2时,木寡糖种类几乎无变化,但是还原糖释放量和木二糖的含量略有减少。反应体系的pH值是影响木聚糖酶和葡萄糖醛酸酶活力的关键因素,当反应体系的pH值大于8.2或小于7.4时,酶解产物的平均聚合度较大,低聚木糖得率和纯度降低。这可能是由于酶的空间构象受pH值的影响,从而使酶的活性受到影响[25]。
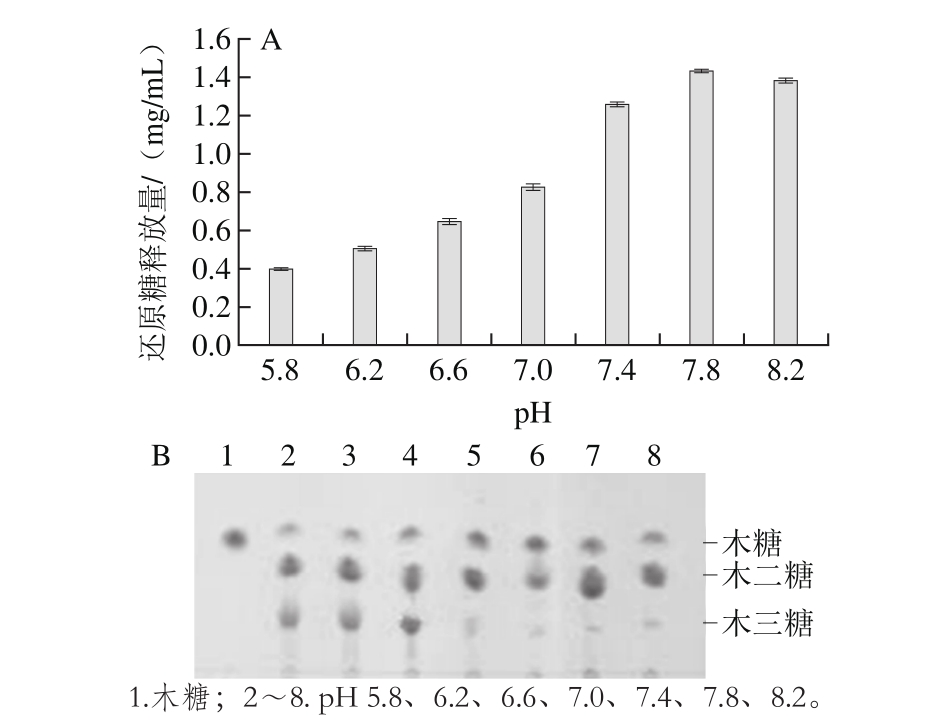
图4 pH值对水解桦木木聚糖的还原糖释放量的影响(A)和TLC图(B)
Fig. 4 Effect of pH on reducing sugar concentration in xylan hydrolysates (A) and TLC profiles of hydrolysates (B)
2.2.4 酶解温度对桦木木聚糖水解作用的影响

图5 酶解温度对水解桦木木聚糖的还原糖释放量的影响(A)和TLC图(B)
Fig. 5 Effect of hydrolysis temperature on reducing sugar concentration in xylan hydrolysates (A) and TLC profiles of hydrolysates (B)
由图5A可知,酶解温度对酶解效率有着较显著的影响。在80 ℃时还原糖释放量达到最高为1.57 mg/mL,超过80 ℃时,还原糖释放量趋于平缓;由图5B可知,随着温度的升高,低聚木糖含量也显著增高,到80 ℃时,木聚糖几乎全被降解为木糖和木二糖。高温下有利于木聚糖的彻底水解,当温度低于最适反应温度时,木聚糖酶和葡萄糖醛酸酶活力受到一定抑制,酶解速率较低,低聚木糖得率也较低,温度过高不利于酶活力稳定性的保持。一般来说,反应温度对酶解效果的影响是多方面的,在一定范围内,升高温度可以加快酶-底物中间体分解转化为产物的速度,然而温度过高会降低酶的稳定性,使其失去活性,最终影响酶的酶解效果[26-27]。
2.2.5 底物质量浓度对桦木木聚糖水解作用的影响
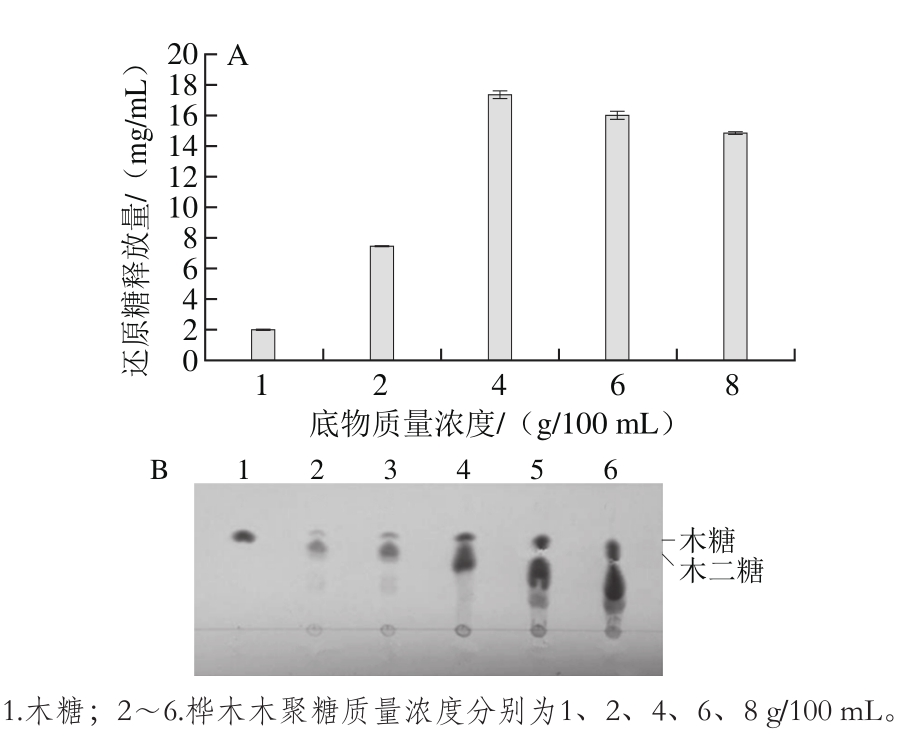
图6 底物质量浓度对水解桦木木聚糖的还原糖释放量的影响(A)和TLC图(B)
Fig. 6 Effect of substrate concentration on reducing sugar concentration in xylan hydrolysates (A) and TLC profiles of hydrolysates (B)
由图6A可知,随着底物质量浓度的增加,还原糖释放量几乎随底物质量浓度呈直线上升。还原糖释放量在底物质量浓度4 g/100 mL时达到最大,为17.45 mg/mL,图6B也可清晰地显示,在底物质量浓度为4 g/100 mL时,木二糖的含量最高。在低底物质量浓度范围内,低聚木糖组分主要为木二糖和少量木糖,当底物质量浓度上升至6 g/100 mL时,还原糖释放量有所下降,低聚木糖的比例减少。这可能是因为随着底物质量浓度的增加,低聚合度木寡糖发生转糖苷反应生成了高聚合度木寡糖。
2.3 响应面优化试验结果与分析
表2 响应面试验设计与结果
Table2 Box-Behnken design with experimental values of reducing sugar concentration
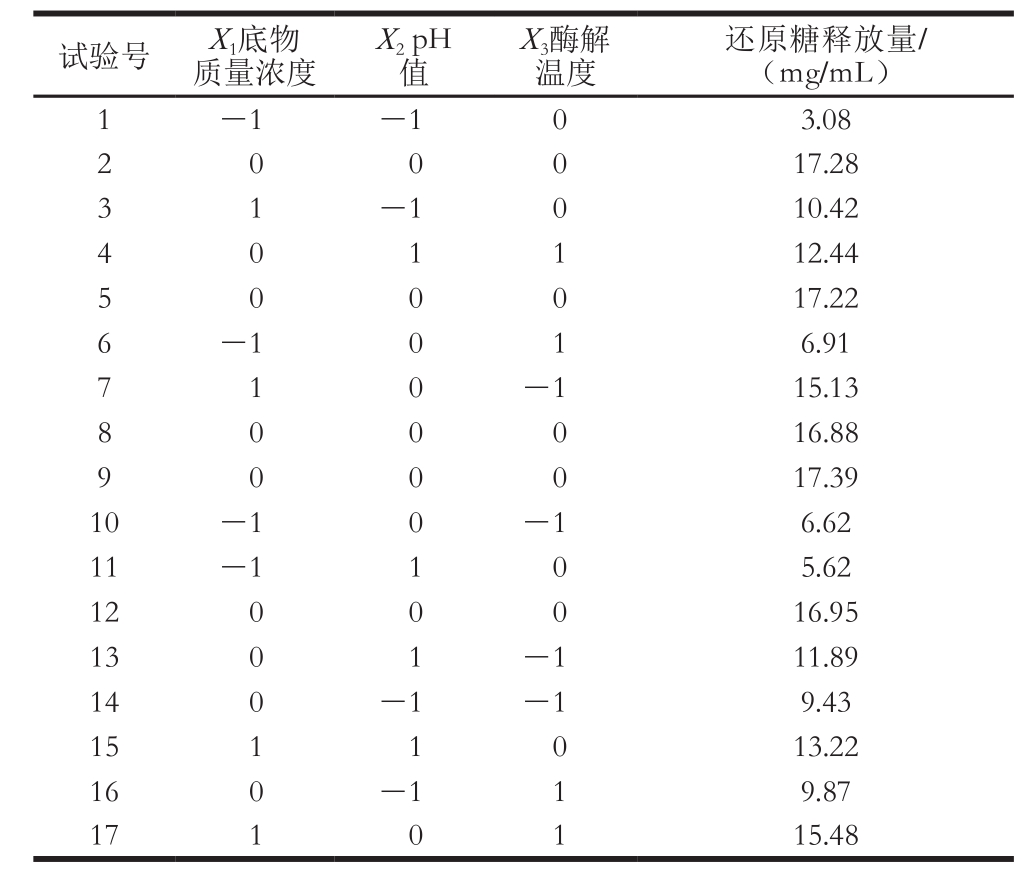
根据单因素试验结果,选取底物质量浓度、pH值、酶解温度3 个因素,设计三因素三水平试验。以底物质量浓度(X1)、pH值(X2)、酶解温度(X3)为自变量,以还原糖释放量为响应值,试验设计与结果见表2。
利用Design-Expert 7.0软件对表2数据进行多元回归拟合,其中第2、5、8、9、12组试验为5次重复的中心点,用于估算试验误差,其他为析因试验。得到底物质量浓度(X1)、pH值(X2)、酶解温度(X3)的二次多项回归模型:
Y=-561.1+113.14X1+10.56X2+2.6X3+0.04X1X2+7.5×10-4X1X3+3.4×10-3X2X3-1.1 -7.17
-7.17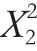 -0.016
-0.016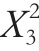
表3 回归模型显著性检验结果
Table3 Analyses of variance (ANOVA) of regression model and significance test

注:*.差异显著,P<0.05;**.差异极显著,P<0.01。
从表3可知,酶解条件对还原糖释放量的影响所建立的回归模型差异极显著(P=0.000 1),说明该回归方程因变量与全体自变量的相关关系是显著的,即这种试验方法是可靠的。失拟项P值大于0.05,差异不显著,可以用该回归方程对不同酶解条件下的还原糖释放量进行检测。底物质量浓度、pH值、酶解温度二次方差异均极显著(P<0.000 1);底物质量浓度和pH值影响差异极显著。由3 个因素的F值以及多项式系数绝对值大小可知,对还原糖释放量影响显著性顺序依次为底物质量浓度>pH值>酶解温度。
根据回归模型作出两因素交互作用的响应面,如图7所示。
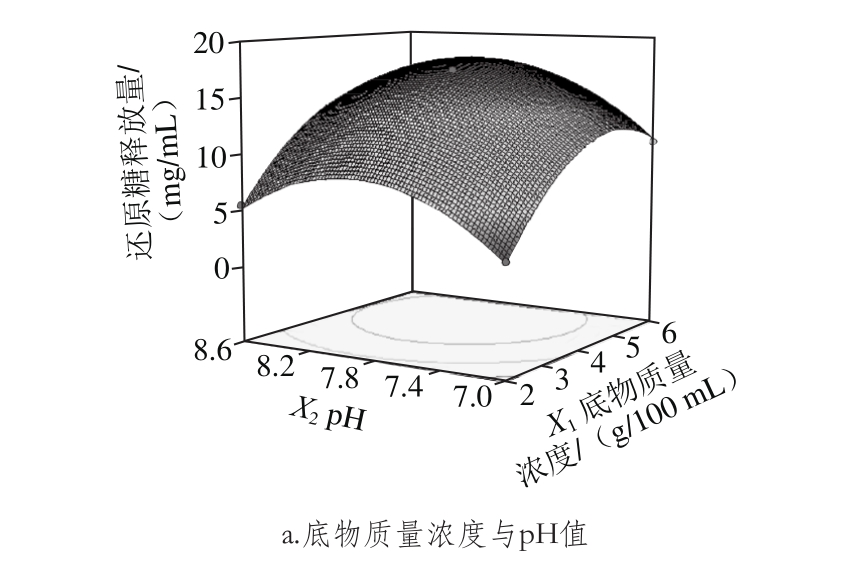
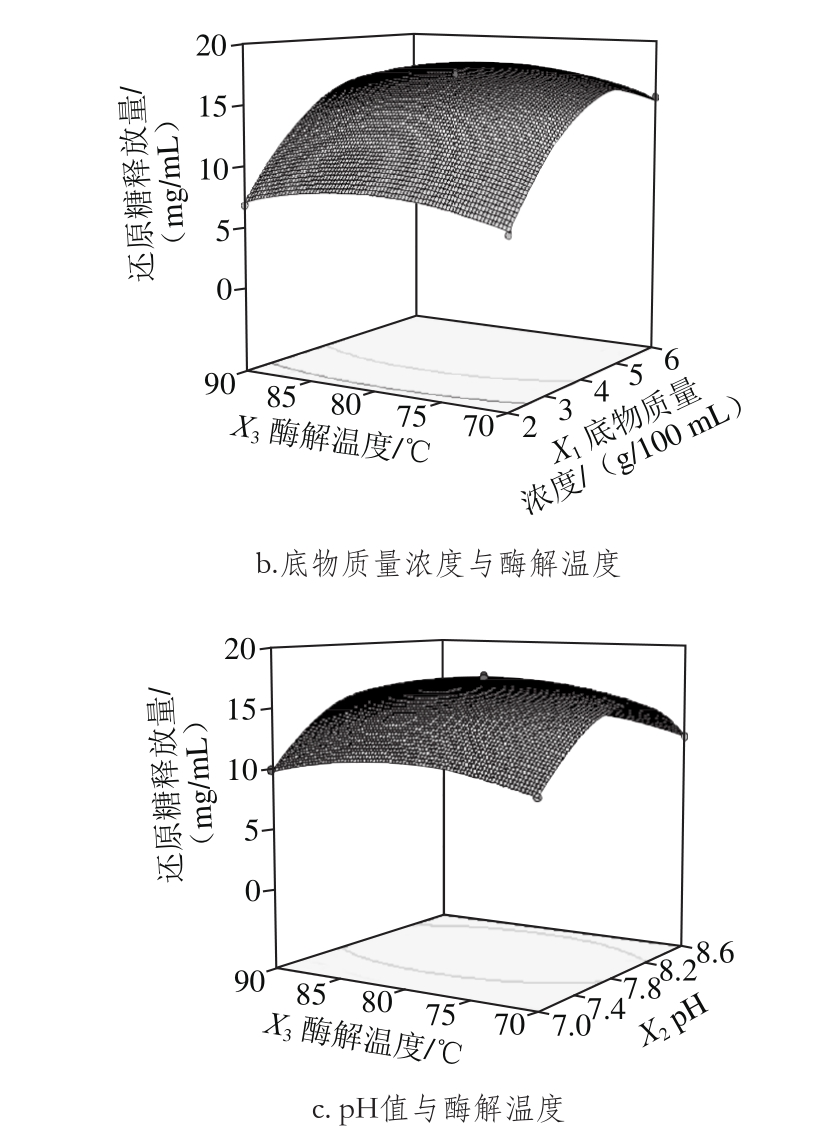
图7 混合酶液水解桦木木聚糖响应面图
Fig. 7 Response surface plots showing the interactive effects of variables on reducing sugar concentration of hydrolysates
由图7a可知,沿底物质量浓度轴向等高线更为密集,说明还原糖释放量对底物质量浓度的变化比对pH值的变化更为敏感,两因素的交互作用不显著。
由图7b可知,底物质量浓度影响比酶解温度显著,曲面相对陡峭。沿底物质量浓度轴向等高线更为密集,说明底物质量浓度对还原糖释放量的影响变化敏感。
由图7c可知,pH值影响极显著,曲面较陡,酶解温度对还原糖释放量的影响不太显著,曲面相对缓和。沿pH值轴向等高线密集,而温度轴向等高线相对稀疏,说明还原糖释放量对pH值的变化比对酶解温度的变化更为敏感,两因素的交互作用不显著。
对回归方程取一阶偏导数等于零,联立解方程组,换算成试验条件,得到最优条件为底物质量浓度4.2 g/100 mL、pH 7.65、酶解温度80.66 ℃,预计最大还原糖释放量为18.04 mg/mL。为检测模型预测的准确性,在优化条件下进行验证实验,实际释放量17.82 mg/mL非常接近预测值,在允许的误差范围之内。
2.4 XynB和AguA水解木聚糖的反应历程
在底物质量浓度4.2 g/100 mL、pH 7.65、酶解温度80.66 ℃、XynB/AguA加酶量60/9 U/g的条件下,选取10 min~12 h的酶解时间,观察酶解过程中木寡糖产生速率的变化。
由图8可知,酶解时间在10 min~4 h范围内,随着酶解时间的延长,还原糖释放量也随之增加,在4~12 h范围内,随着酶解时间的延长,酶解得率几乎不变。这一结果表明,在较短的时间内,延长反应时间有助于提高酶解率,但进一步增加酶解时间,酶解速度逐渐放缓,说明反应在后期存在产物抑制等不利因素的影响。木糖浓度越高,越不利于低聚木糖的积累,当酶解4 h时,还原糖释放量达到17.91mg/mL,木二糖质量浓度为13.66 mg/mL。较刘明启等[28]研究的黑曲霉木聚糖酶酶解桦木木聚糖所得低聚木糖产物木糖至木六糖成分更高,还原糖释放量在酶解4 h时即可达到1.6 mg/mL左右,相比其酶解24 h后木二糖质量浓度的1.599 mg/mL效率也更高。优化前酶解8 h还原糖释放量仅为0.61 mg/mL,优化后酶解4 h还原糖释放量高达17.91 mg/mL,还原糖释放量比优化前提高了近30 倍。这说明底物质量浓度、pH值、酶解温度等条件对酶解反应影响较大,通过优化反应条件不仅可以缩短反应历程而且还可以大大提高还原糖释放量,这对于工业生产有极大的意义,为进一步研究工业化酶反应提供参考。

图8 XynB和AguA水解历程的还原糖释放量(A)和TLC图谱(B)
Fig. 8 Time course of reducing sugar release (A) during hydrolysis of xylan with XynB and AguA and TLC profiles of hydrolysates (B)
3 结 论
海栖热袍菌所产XynB和AguA的热稳定性好,在生物处理过程中具有减少污染、加快反应速率、提高酶作用底物溶解度和较高的抗化学变性等优点[17]。利用耐热性XynB和AguA酶解农业废弃物中的木聚糖类半纤维素生产高附加值的低聚木糖,不仅变废为宝,而且可保护环境,经济、社会效益显著。利用蛋白质工程构建共生产木聚糖酶和葡萄糖醛酸酶工程菌,不仅能减少反应和操作步骤,而且降低酶催化剂生产成本,成为当今生物技术和生物资源利用领域的研究热点。为了研究共生产木聚糖酶和葡萄糖醛酸酶工程菌在制备低聚木糖中的应用效果,本研究采用前期构建的重组菌JM109(DE3)/pET-28a-XPA制备耐热性XynB和AguA用于桦木木聚糖的水解,经过单因素和响应面分析法对酶解条件进行优化,结果表明,各因素对还原糖释放量影响显著性顺序依次为底物质量浓度>pH值>酶解温度,当桦木木聚糖底物质量浓度4.2 g/100 mL、酶解温度80.66 ℃、pH 7.65、XynB/AguA加酶量60/9 U/g,还原糖释放量为17.82 mg/mL,进一步经酶解反应历程显示酶解4 h所得低聚木糖中还原糖质量浓度为17.91 mg/mL,木二糖质量浓度为13.66 mg/mL。而木二糖是促进人体内双歧杆菌生长和稳定肠道菌群的主要益生因子,能广泛应用食品药品工业和饲料生产等领域。低聚木糖不仅具有增加体内不饱和脂肪的含量,提高钙元素的吸收利用[29-31],降低胃溃疡发病率,而且有助于降低结肠癌,降血脂和血压[32-34],使得低聚木糖成为功能性寡糖中的佼佼者。
参考文献:
[1] 张宏书. 半纤维素及其结构研究[J]. 广州化学, 1990(1): 57-66.
[2] ZHU Y, LI X, SUN B, et al. Properties of an alkaline-tolerant,thermostable xylanase from Streptomyces chartreusis L1105, suitable for xylooligosaccharide production[J]. Journal of Food Science, 2012, 77(5):506-511. DOI:10.1111/j.1750-3841.2012.02671.x.
[3] ZHANG H, SANG Q. Production and extraction optimization of xylanase and β-mannanase by Penicillium chrysogenum QML-2 and primary application in saccharification of corn cob[J]. Biochemical Engineering Journal, 2015, 97: 101-110. DOI:10.1016/j.bej.2015.02.014.
[4] CHRISTAKOPOULOS P, KATAPODIS P, KALOGERIS E, et al. Antimicrobial activity of acidic xylo-oligosaccharides produced by family 10 and 11 endoxylanases[J]. International Journal of Biological Macromolecules, 2003, 31(4): 171-175. DOI:10.1016/S0141-8130(02)00079-X.
[5] TUNCER M, BALL A S. Co-operative actions and degradation analysis of purified xylan-degrading enzymes from Thermomonospora fusca BD25 on oat-spelt xylan[J]. Journal of Applied Microbiology, 2003, 94(6):1030-1035. DOI:10.1046/j.1365-2672.2003.01943.x.
[6] 薛业敏, 毛忠贵. α-葡萄糖醛酸酶的研究进展[J]. 林产化学与工业,2002, 22(4): 75-79. DOI:10.3321/j.issn:0253-2417.2002.04.019.
[7] 薛业敏, 毛忠贵, 邵蔚蓝. 极端嗜热菌海栖热袍菌α-葡萄糖醛酸酶的高效表达和重组酶的纯化[J]. 生物工程学报, 2004, 20(4): 555-560.DOI:10.3321/j.issn:1000-3061.2004.04.016.
[8] 周良. 对国内秸秆利用现状的思考[J]. 安徽农业科学, 2012, 40(32):15853-15855. DOI:10.3969/j.issn.0517-6611.2012.32.105.
[9] WANG T H, LU S. Production of xylooligosaccharide from wheat bran by microwave assisted enzymatic hydrolysis[J]. Food Chemistry, 2012,138(2): 1531-1535. DOI:10.1016/j.foodchem.2012.09.124.
[10] 聂卉, 李晓静, 李坚斌. 低聚木糖的生物活性、制备及应用研究进展[J]. 食品研究与开发, 2016, 37(14): 210-213. DOI:10.3969/j.issn.1005-6521.2016.14.051.
[11] 张玲, 长河, 阮文彬. 低聚木糖的应用研究和产品开发进展[J]. 粮食与油脂, 2015, 28(2): 9-11. DOI:10.3969/j.issn.1008-9578.2015.02.003.
[12] 宋贤良, 朱江. 纤维素酶法水解的研究进展[J]. 郑州工程学院学报,2001, 22(4): 67-71. DOI:10.3969/j.issn.1673-2383.2001.04.015.
[13] 周建, 罗学刚, 苏林. 纤维素酶法水解的研究现状及展望[J]. 化工科技, 2006, 14(2): 51-56. DOI:10.3969/j.issn.1008-0511.2006.02.014.
[14] LI X, LI E, ZHU Y, et al. A typical endo-xylanase from Streptomyces rameus L2001 and its unique characteristics in xylooligosaccharide production[J].Carbohydrate Research, 2012, 359: 30-36. DOI:10.1016/j.carres.2012.05.005.
[15] SILVA M R, SEVERO M G, DELABONA P S, et al. High cell density co-culture for production of recombinant hydrolases[J]. Biochemical Engineering Journal, 2012, 71: 38-46. DOI:10.1016/j.bej.2012.11.008.
[16] XUE Y, YU J, SONG X, et al. Over-expression of xylanolytic α-glucuronidase from Thermotoga maritima in the pHsh system of Escherichia coli for the production of xylobiose from xylan[J]. African Journal of Biotechnology, 2008, 7(14): 2454-2461.
[17] 赵力超, 王燕, 刘晓娟, 等. 重组多功能木聚糖酶酶解条件的优化[J]. 农业工程学报, 2014, 30(1): 270-277. DOI:10.3969/j.issn.1002-6819.2014.01.034.
[18] 黄家骥, 许正宏, 陶文沂. 以Bacilluc pumlic.木聚糖酶水解玉米芯制备木寡糖[J]. 食品与发酵工业, 2004, 30(5): 5-9.
[19] BOONCHUAY P, TECHAPUN C, SEESURIYACHAN P, et al.Production of xylooligosaccharides from corncob using a crude thermostable endo-xylanase from Streptomyces thermovulgaris TISTR1948 and prebiotic properties[J]. Food Science and Biotechnology, 2014, 23 (5): 1515-1523.DOI:10.1007/s10068-014-0207-0.
[20] 沈艺红, 薛业敏, 侯静静, 等. 耐热木聚糖酶和葡萄糖醛酸酶的共表达及应用[J]. 食品科学, 2015, 36(1): 146-152.DOI:10.7506/spkx1002-6630-201501028.
[21] MA L, HAN Y, SUN K, et al. Optimization of acidified oil esterification catalyzed by sulfonated cation exchange resin using response surface methodology[J]. Energy Conversion and Management, 2015, 98: 46-53.DOI:10.1016/j.enconman.2015.03.092.
[22] 丛艳君, 于晓凤, 陈澍, 等. 响应面法优化草鱼内脏蛋白质的水解条件[J]. 食品科学, 2015, 36(10): 43-48.DOI:10.7506/spkx1002-6630-201510009.
[23] LEVER M. A new reaction for colorimetric determination of carbohydrates[J]. Analytical Biochemistry, 1972, 47(1): 273-279.DOI:10.1016/j.enconman.2015.03.092.
[24] SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular cloning:a laboratory manual[M]. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 345-347.
[25] 张根生, 丁琬莹, 王月, 等. 响应面法优化双酶酶解酪蛋白工艺[J]. 食品科学, 2013, 34(21): 237-241. DOI:10.7506/spkx1002-6630-201321048.
[26] 张帆, 李敏康, 宋宏新. 两种酶法制备麦麸低聚木糖的比较[J]. 陕西科技大学学报, 2013, 31(4): 105-109. DOI:10.3969/j.issn.1000-5811.2013.04.024.
[27] 杨然, 朱培华, 姚君, 等. 重组木聚糖酶酶解玉米芯制备低聚木糖[J].食品与发酵工业, 2015, 41(4): 115-120.
[28] 刘明启, 关荣发, 陈文伟. 黑曲霉固体发酵产木聚糖酶的响应面优化设计及其酶学性质的研究[J]. 农业生物技术学报, 2010, 18(1): 52-60.DOI:10.3969/j.issn.1674-7968.2010.01.009.
[29] AKPINAR O, ERDOGAN K, BAKIR U, et al. Comparison of acid and enzymatic hydrolysis of tobacco stalk xylan for preparation of xylooligosaccharides[J]. LWT-Food Science and Technology, 2010, 43(1):119-125. DOI:10.1016/j.lwt.2009.06.025.
[30] BIAN J, PENG F, PENG X, et al. Structural features and antioxidant activity of xylooligosaccharides enzymatically produced from sugarcane bagasse[J]. Bioresource Technology, 2013, 127(1): 236-241. DOI:10.1016/j.biortech.2012.09.112.
[31] YANG H, WANG K, SONG X, et al. Production of xylooligosaccharides by xylanase from Pichia stipites based on xylan preparation from triploid Populas tomentosa[J]. Bioresource Technology, 2011, 102(14): 7171-7176.
[32] CHAPLA D, PANDIT P, SHAH A. Production of xylooligosaccharides from corncob xylan by fungal xylanase and their utilization by probiotics[J]. Bioresource Technology, 2012, 115(5): 215-221.DOI:10.1016/j.biortech.2011.10.083.
[33] AKPINAR O, ERDOGAN K, BOSTANCI S. Enzymatic production of xylooligosaccharide from selected agricultural wastes[J]. Food and Bioproducts Processing, 2009, 87(2): 145-151. DOI:10.1016/j.fbp.2008.09.002.
[34] SAMANTA A K, SENANI S, KOLTE A P, et al. Production and in vitro evaluation of xylooligosaccharides generated from corn cobs[J].Food and Bioproducts Processing, 2012, 90(3): 466-474. DOI:10.1016/j.fbp.2011.11.001.