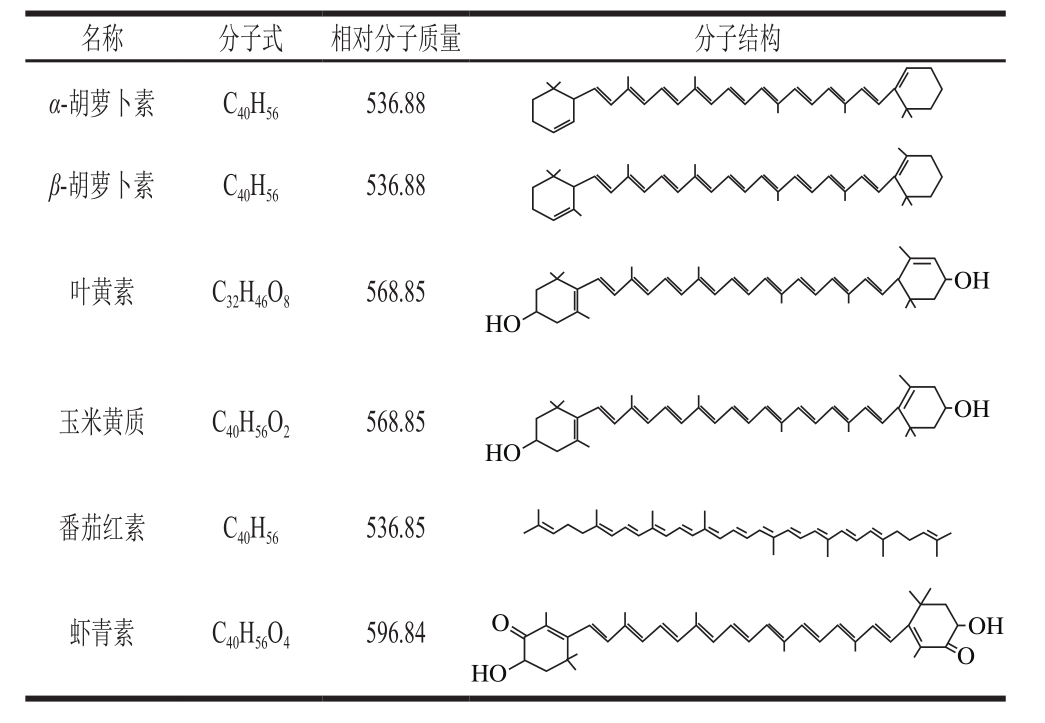
类胡萝卜素是一类重要的天然色素的总称,普遍存在于动物、高等植物、真菌、藻类中的黄色、橙红色或红色的色素之中,性质极其不稳定,受热、遇氧、见光容易受到破坏。迄今,被发现的天然类胡萝卜素已达600多种[1-2],其中几种常见的类胡萝卜素有α-胡萝卜素、β-胡萝卜素、叶黄素、玉米黄质、番茄红素及虾青素等。常见类胡萝卜素如表1所示。研究表明,类胡萝卜素物质主要存在于天然果蔬中[3-4],具有较强抗氧化性[5]、可以预防和治疗糖尿病[6]、减少心血管疾病发病率[7]、保护视力和抗癌[8]等多种生理功能。在自然条件下类胡萝卜素是动物体内VA的主要来源,约有10%的类胡萝卜素(主要为α-胡萝卜素、β-胡萝卜素)是VA的前体,其中β-胡萝卜素的VA原活性最高[9-10],这主要是因为β-胡萝卜素具有的对称结构,1 分子β-胡萝卜素可以产生2 分子的VA[9]。随着人们健康意识的增强,对天然类胡萝素的需求大大增加,开发利用类胡萝卜素已经成为一个引人注目的发展趋势[11-12]。
表1 常见几种类胡萝卜素的分子式和结构式
Table1 Molecular formulas and structures of several carotenes
植物源食品中类胡萝卜素的测定方法以及背景资料是开展类胡萝卜素营养研究工作的重要基础[13]。目前,食物中类胡萝卜素的测定方法有分光光度法[14]、柱层析法[5,15]、薄层色谱法[16]、高效液相色谱法[17-18]、质谱[19]、电化学检测器[20]、核磁共振[21]。分光光度法适用于测定单一类胡萝卜素的量,不能对多种类胡萝卜素分别定量;薄层色谱法和柱层析法成本低廉,能对多种胡萝卜素进行分离,但分析时间长、重复性差且不能精确定量;质谱、核磁共振和电化学检测器等串联仪器设备昂贵,测定成本高。高效液相色谱法具有分离效能高、分析速度快等优点,目前基本采用反相高效液相色谱法,并配合紫外-可见光检测器或二极管阵列检测器,对样品中的类胡萝卜素进行定性定量分析。研究人员用液相色谱法测定油料作物种子[22]、小麦类[23]、番茄和胡萝卜[24]、白菜[25]、茶[26]、水果[27]等多种植物源食品中类胡萝卜素的含量,但不同植物源食品中类胡萝卜素含量及其活性比较研究较少,目前我国尚缺少植物源食品中各种类胡萝卜素组分含量方面的背景资料和相关数据[28],因此,建立、完善测定植物源食品中各种类胡萝卜素组分的方法亟待解决,建立一个同时测定胡萝卜素的定量方法,对于正确评价各种水果蔬菜及植物源食品的营养价值,开展营养学的研究至关重要。本实验在借鉴前人研究的基础上,利用高效液相色谱法建立植物源食品中α-胡萝卜素及β-胡萝卜素的同时在线分析检测,以胡萝卜冻干粉为样品进行方法学验证,并用该方法测定多种植物源食品中胡萝卜素的含量并进行比较分析,旨在为科研和实际应用提供理论依据和数据支持。
1 材料与方法
1.1 材料与试剂
胡萝卜冻干粉 实验室自制;果蔬、谷物、植物油、茶等样品各6 种 市购;β-胡萝卜素标准品(纯度>95.0%)、α-胡萝卜素标准品(纯度>95.0%) 美国Sigma公司;甲醇、乙腈、三乙胺、甲基叔丁基醚、二氯甲烷、正己烷(均为色谱纯) 美国Fisher公司;无水硫酸钠、乙醇、氢氧化钾、丙酮、三氯甲烷、石油醚、抗坏血酸(均为分析纯) 北京化工厂。
1.2 仪器与设备
BS224S分析天平 德国赛多利斯公司;EYELA N-1100旋转蒸发仪 东京理化株式会社;98-Ⅱ-B磁力搅拌电热套 天津市泰斯特仪器有限公司;L-2000高效液相色谱仪 日本日立科技有限公司。
1.3 方法
1.3.1 样品制备
称取胡萝卜冻干粉约0.03 g和果蔬、谷物、植物油、茶等样品2~5 g(精确至0.000 1 g),置于250 mL平底烧瓶中,加入10 mL抗坏血酸水溶液(10%),再加入30 mL乙醇溶解,摇匀,加入质量分数50%氢氧化钾溶液10 mL,混匀,于磁力搅拌电热套上皂化回流30 min,取出立即放入冷水中冷却。
将皂化后的液体转移至500 mL分液漏斗中,用约50 mL水分2 次洗皂化瓶,洗液并入分液漏斗中。用50 mL石油醚分2 次洗皂化瓶,石油醚液同样转移至分液漏斗,将分液漏斗置于振荡器上振摇,280 r/min振摇2 次,每次振摇3 min,其间放气;振摇后取下分液漏斗,静置分层,将下层溶液转移至另一分液漏斗中,重复上述步骤2 次;弃去下层液体,合并2 次提取液后用水洗至中性;将液体经过约5 g无水硫酸钠后滤入150 mL蒸发瓶中,用约10 mL石油醚冲洗分液漏斗及无水硫酸钠3 次,并入蒸发瓶中。将蒸发瓶接至旋转蒸发仪上蒸发,蒸至近干后用氮气吹干蒸发瓶,取下蒸发瓶,剩余物用甲醇-乙腈-二氯甲烷-正己烷(3∶4∶4∶4,V/V)溶液定容至5 mL,样品过0.45 μm滤膜,备用。
1.3.2 色谱条件
色谱柱:YMC C30(4.6 mm×250 mm,5 µm);流动相A为乙腈-甲醇-三乙胺溶液(70∶30∶0.05,V/V),流动相B为甲基叔丁基醚-三乙胺溶液(100∶0.05,V/V);检测波长450 nm;柱温30 ℃;进样体积20 µL;洗脱程序:0~27 min,100%~45% A,0%~55% B;27.0~27.1 min,45%~100% A,55%~0% B,保留8 min。
1.3.3 胡萝卜素含量的测定
胡萝卜素含量按下式计算:
式中:X为样品中胡萝卜素含量/(µg/100 g);c为由标准曲线而得的试样溶液中胡萝卜素质量浓度/(µg/mL);V为试样溶液最终定容体积/mL;m为试样质量/g。
2 结果与分析
2.1 标准曲线的绘制
2.1.1 α-胡萝卜素标准曲线的绘制
α-胡萝卜素标准储备液:称取α-胡萝卜素标准品1 mg(精确到0.1 mg),用丙酮定容至10 mL棕色容量瓶中,临用前在波长450 nm处用丙酮作空白于分光光度计上标定溶液浓度。
α-胡萝卜素标准工作液:从α-胡萝卜素标准储备液中分别准确移取1、1、1、2、1 mL溶液转移至100、50、25、25、5 mL棕色容量瓶中,用丙酮定容至刻度,得到质量浓度为0.8~20 μg/mL的标准系列工作液,分别进样20 µL。按1.3.2节色谱条件测定,记录所得峰面积,以峰面积为横坐标,以标准溶液质量浓度为纵坐标绘制标准曲线,得到回归方程为y=1.886 3×10-6x,R2=0.999 7。
2.1.2 β-胡萝卜素标准曲线的绘制
β-胡萝卜素标准储备液:准确称取β-胡萝卜素标准品10 mg(精确到0.1 mg),用三氯甲烷定容至10 mL棕色容量瓶中,临用前在波长450 nm处用正己烷作空白于分光光度计上标定溶液浓度。
β-胡萝卜素标准中间液(20 µg/mL):从β-胡萝卜素标准母液中准确移取1.0 mL溶液转入50 mL棕色容量瓶中,用甲醇-乙腈-二氯甲烷-正己烷(3∶4∶4∶4,V/V)溶液定容至刻度,得到质量浓度为20 μg/mL的标准中间液。
β-胡萝卜素标准工作液:从β-胡萝卜素标准中间液中分别准确移取1.0、2.0、2.0、1.0、2.0 mL溶液转入50、50、25、5、5 mL棕色容量瓶中,用甲醇-乙腈-二氯甲烷-正己烷(3∶4∶4∶4,V/V)溶液定容至刻度,得到质量浓度为0.4~8.2 μg/mL的系列标准工作液,分别进样20 µL。按1.3.2节色谱条件测定,记录所得峰面积,以峰面积为横坐标,以标准溶液质量浓度为纵坐标绘制标准曲线,得到回归方程为y=9.183 7×10-7x,R2=0.999 2。
2.2 方法精密度的测定结果
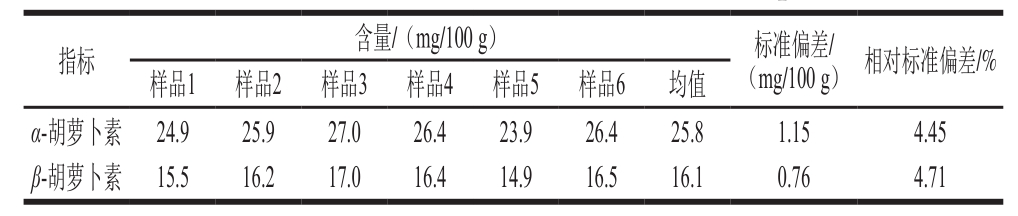
准确称取0.03 g(精确至0.000 1 g)胡萝卜冻干粉样品,做6 个平行,进行α-胡萝卜素和β-胡萝卜素含量测定。如表2所示,胡萝卜冻干粉中α-胡萝卜素和β-胡萝卜素的平均值分别为25.8 mg/100 g和16.1 mg/100 g,标准偏差分别为1.15 mg/100 g和0.76 mg/100 g,相对标准偏差分别为4.45%和4.71%。实验具有较好重复性,能够满足对样品测定平行的要求。
表2 胡萝卜冻干粉中胡萝卜素的含量
Table2 Carotene content of freeze-dried carrot powder
2.3 加标回收率的测定结果
表3 胡萝卜素加标回收实验结果
Table3 Recoveries from spiked samples
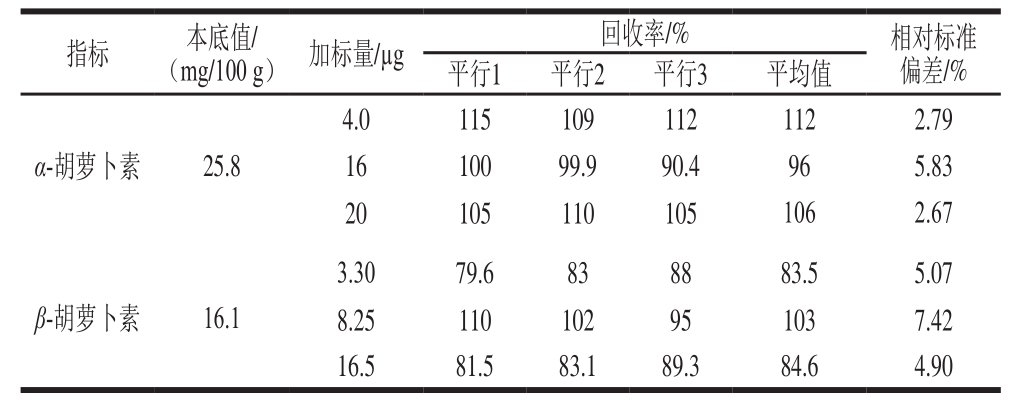
取胡萝卜冻干粉为样品基质,分别以样品本底的0.5、1、2 倍添加低、中、高3 个添加量的标准溶液,每个质量浓度水平重复3 次测定,分别计算加标回收率和相对标准偏差。如表3所示,α-胡萝卜素及β-胡萝卜素加标回收率分别为96%~112%、83.5%~103%,加标回收率的相对标准偏差分别为2.67%~5.83%、4.90%~7.42%,能够满足检测实际样品需要。胡萝卜冻干粉中α-胡萝卜素及β-胡萝卜素的谱图如图1所示。
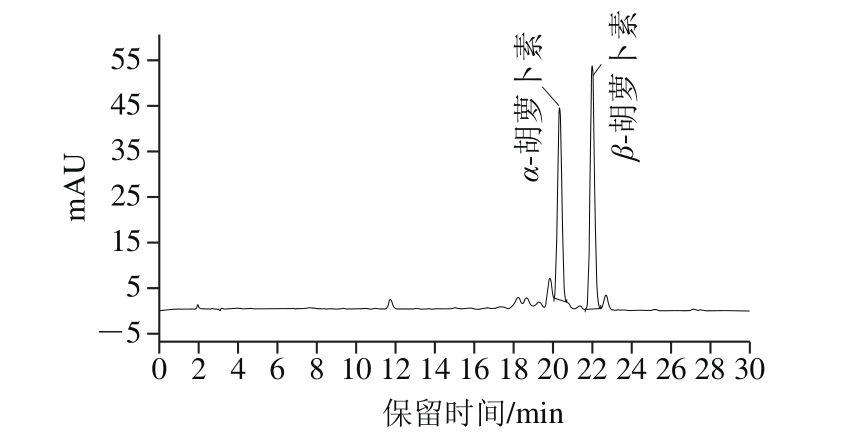
图1 胡萝卜冻干粉中α-胡萝卜素及β-胡萝卜素谱图
Fig. 1 HPLC-UV chromatograms of α-carotene and β-carotene in freezedried carrot powder
2.4 植物源食品中胡萝卜素含量的测定结果
2.4.1 水果中胡萝卜素含量的测定结果
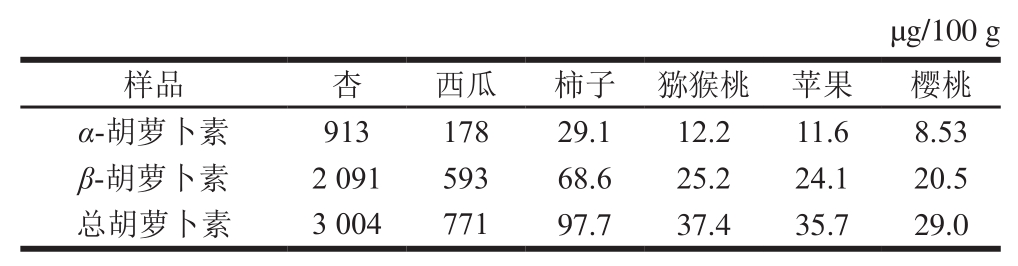
选取杏、西瓜、柿子、猕猴桃、苹果和樱桃6 种常见水果,用优化方法同时测定α-胡萝卜素及β-胡萝卜素的含量,如表4所示,杏中的胡萝卜素含量最高,总量达到3 000 µg/100 g以上,西瓜次之,樱桃中的胡萝卜素含量最低,低于30 µg/100 g。
表4 6 种水果中胡萝卜素的含量
Table4 Carotene contents of six fruits
2.4.2 蔬菜中胡萝卜素含量的测定结果
表5 6 种蔬菜中胡萝卜素的含量
Table5 Carotene contents of six vegetables
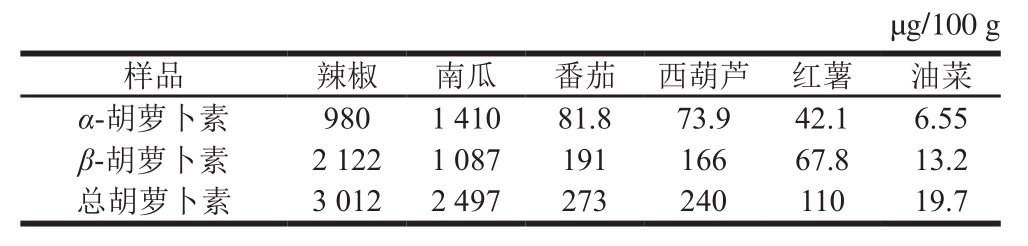
选取辣椒、南瓜、番茄、西葫芦、红薯和油菜6 种常见蔬菜,用优化方法同时测定α-胡萝卜素及β-胡萝卜素的含量,如表5所示,辣椒中胡萝卜素含量最高,总量达到3 000 µg/100 g以上,南瓜次之,油菜中的胡萝卜素含量最低,低于20 µg/100 g。
2.4.3 谷物中胡萝卜素含量的测定结果
表6 6 种谷物中胡萝卜素的含量
Table6 Carotene contents of six cereals

选取大米、小米、藜麦、玉米面、黄豆和黑豆6 种常见谷物,用优化方法同时测定α-胡萝卜素及β-胡萝卜素的含量,如表6所示,谷物中胡萝卜素含量整体较低,总量均低于60 µg/100 g,可见,果蔬是胡萝卜素的主要食物来源,谷物可以辅助提供胡萝卜素的供给[29-30]。
2.4.4 植物油中胡萝卜素含量的测定结果
表7 6 种植物油中胡萝卜素的含量
Table7 Carotene contents of six vegetable oils
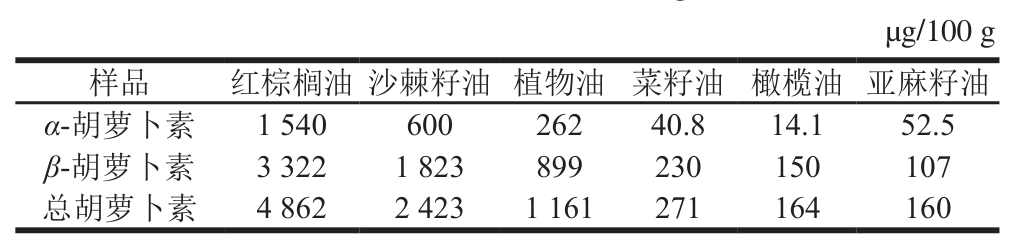
选取红棕榈油、沙棘籽油、植物油、菜籽油、橄榄油和亚麻籽油6 种植物油,用优化方法同时测定α-胡萝卜素及β-胡萝卜素的含量,如表7所示,红棕榈油中胡萝卜素含量最高,总量近5 000 µg/100 g,亚麻籽油中胡萝卜素含量最低,含量为160 µg/100 g,可见植物油中胡萝卜素含量比较高。
2.4.5 茶中胡萝卜素含量的测定结果
表8 6 种茶中胡萝卜素的含量
Table8 Carotene contents of six types of tea
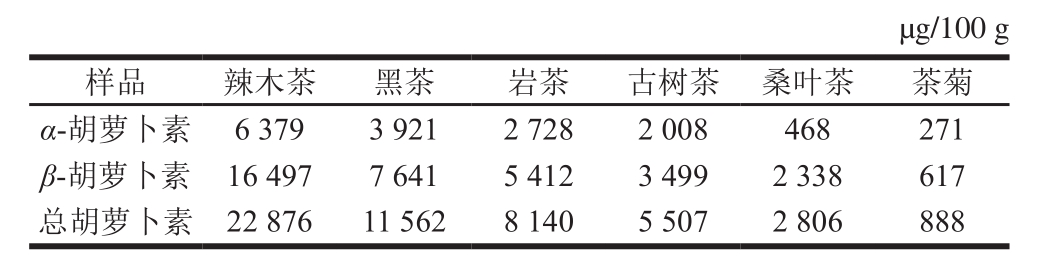
选取辣木茶、黑茶、岩茶、古树茶、桑叶茶和茶菊6 种茶类,用上述方法同时测定α-胡萝卜素及β-胡萝卜素的含量,如表8所示,茶中胡萝卜素含量非常高,辣木茶和黑茶胡萝卜素总量均在10 000 µg/100 g以上,其他茶中胡萝卜素含量也在2 800 µg/100 g以上,只有茶菊中胡萝卜素含量较低,为888 µg/100 g。
3 结论与讨论
本实验利用高效液相色谱法建立了植物源食品中α-胡萝卜素及β-胡萝卜素的同时在线分析检测,并以胡萝卜冻干粉为样品进行了方法学验证,该方法线性良好,稳定性好,回收率满足分析要求。与目前常用方法相比,优化了样品前处理过程,缩短了分析时间。
姚建花等[31]报道,选用胡萝卜、玉米、蜜橘、菠菜制备混样,用直接溶剂提取法和皂化提取法进行比较,结果显示,α-胡萝卜素和β-胡萝卜素均为皂化提取效果更好,样品经皂化后,叶绿素已破坏,皂化可排除叶绿素干扰,皂化提取法适用于所有果蔬类样品。张彩凌等[32]同时采用直接提取法和皂化提取法对β-胡萝卜素进行测定,并对2 种方法的结果进行了比较,结果表明皂化不会影响β-胡萝卜素含量测定,因此,本研究选用皂化提取法。
本实验用该方法测定了不同的水果、蔬菜、谷物、植物油、茶叶等植物源食品中α-胡萝卜素及β-胡萝卜素的含量,不同的植物源食品中二者含量差异较大,茶叶和植物油中胡萝卜素含量普遍较高、果蔬中胡萝卜素含量次之、谷物中胡萝卜素含量较低,尽管谷物不是胡萝卜素的主要提供者,但即使是低含量的谷物食物用该实验所建的方法也能检测到,可见该方法灵敏度高,能够为企业研发、质量控制和相关科学研究提供较为合适的方法保障,同时会给相关机构和部门提供准确的检测方法和完备的技术支持。
本实验筛选了30 种常见植物源食品进行研究,为后期营养膳食数据库的建立提供数据基础。绝大多数植物源食物中α-胡萝卜素的含量小于β-胡萝卜素,与文献报道一致,只有南瓜中α-胡萝卜素的含量高于β-胡萝卜素。
本实验数据可以为科研和实际应用提供一定的理论数据和技术支持,但还不能完全反映出我国大量植物源食品中胡萝卜素的含量及差异,日后还会继续增大样品量的研究,同时该数据可以为食物成分数据库的完善提供数据支持。
参考文献:
[1] STAHL W, SIES H. Bioactivity and protective effects of natural carotenoids[J]. Biochemical Biophysic Acta, 2005, 1740(2): 101-107.DOI:10.1016/j.bbadis.2004.12.006.
[2] GU Z X, CHEN D M, HAN Y B, et al. Optimization of carotenoids extraction from Rhodobacter sphaeroides[J]. Swiss Society of Food Science and Technology, 2008, 41: 1082-1088. DOI:10.1016/j.lwt.2007.07.005.
[3] DELGADO-PELAYO R, HORNERO-MÉNDEZ D. Identification and quantitative analysis of carotenoids and their esters from Sarsaparilla(Smilax aspera L.) berries[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 8225-8232. DOI:10.1021/jf302719g.
[4] ELISEU R, LILIAN R B M, ADRIANA Z. Mercadante carotenoids and phenolic compounds from Solanum sessiliflorum, an unexploited Amazonian fruit, and their scavenging capaci-tiesagainst reactive oxygen and nitrogen species[J]. Journal of Agricultural and Food Chemistry, 2013, 61: 3022-3029. DOI:10.1021/jf3054214.
[5] WANG C C, CHANG S C, STEPHEN I B, et al. Isolation of carotenoids, flavonoids and polysaccharides from Lycium barbarum L.and evaluation of antioxidant activity[J]. Food Chemistry, 2010, 120:184-192. DOI:10.1016/j.foodchem.2009.10.005.
[6] HOFE C R, FENG L, ZEPHYR D. Fruit and vegetable intake, as reflected by serum carotenoid concentrations, predicts reduced probability of polychlorinated biphenyl-associated risk for type 2 diabetes: National Health and Nutrition Examination Survey 2003-2004[J]. Nutrition Research, 2014, 34: 285-293. DOI:10.1016/j.nutres.2014.02.001.
[7] TANG L, ZHANG Y, JIANG Y, et al. Dietary wolfberry ameliorates retinal structure abnormalities in db/db mice at the early stage of diabetes[J]. Experimental Biology and Medicine, 2011, 236(9): 1051-1063.
[8] SE K, LEE H, MIN J, et al. Proposed cytotoxic mechanisms of the saffron carotenoids crocin and crocetin on cancer cell lines[J].Biochemistry and Cell Biology-Biochimie et Biologie Cellulaire,2014, 92: 105-111.
[9] WEBER D, GRUNE T. The contribution of β-carotene to vitamin A supply of humans[J]. Molecular Nutrition & Food Research, 2012,56(2): 251-258. DOI:10.1002/mnfr.201100230.
[10] DONHOWE E G, KONG F. Beta-carotene: digestion,microencapsulation, and in vitro bioavailability[J]. Food and Bioprocess Technology, 2014, 7(2): 338-354. DOI:10.1007/s11947-013-1244-z.
[11] 范立梅. 类胡萝卜素的生物学功能[J]. 生物学通报, 2001, 36(4): 10.DOI:10.3969/j.issn.0006-3193.2001.04.004.
[12] 林海峰. 健康一生[M]. 北京: 中国物资出版社, 2005.
[13] 赵显峰, 潘丽莉, 孟晶, 等. 高效液相色谱法测定蔬菜中类胡萝卜素组分[J]. 卫生研究, 2008, 37(2): 228-230. DOI:10.3969/j.issn.1000-8020.2008.02.029.
[14] 李玉环, 王锋, 刘群山. 皂化法提取番茄红素的研究[J]. 食品科学,2002, 23(8): 146-150. DOI:10.3321/j.issn:1002-6630.2002.08.040.
[15] 娄天军, 赵功玲, 张炎, 等. 柱层析法纯化番茄红素的研究[J]. 食品研究与开发, 2005, 26(4): 28-29. DOI:10.3969/j.issn.1005-6521.2005.04.010.
[16] 刘敬业, 丘玲, 王亮. 薄层色谱分离测定烤烟中的β-胡萝卜素[J]. 昆明师范专科学校(自然科学版), 1998(13): 1-3. DOI:10.1007/s00256-009-0793-8.
[17] 曹梦锦, 张雪松, 王晓婧, 等. 蔬菜中胡萝卜素测定方法的改良[J].卫生研究, 2016, 45(3): 477-482.
[18] INBARAJ B S, LU H, HUNG C F, et al. Determination of carotenoids and their esters in fruits of Lycium barbarum Linnaeus by HPLCDAD-APCI-MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(4/5): 812-818. DOI:10.1016/j.jpba.2008.04.001.
[19] MERCADANTE A Z, RODRIGUEZ-AMAYA D B, BRITTON G.HPLC and mass spectrometric analysis of carotenoids from mango[J].Journal of Agricultural and Food Chemistry, 1997, 45(1): 120-123.DOI:10.1021/jf960276j.
[20] FERRUZZI M G, SANDERL C, ROCK C L. Carotenoid determination in biological microsamples using liquid chromatography with a coulometric electrochemical arraydetector[J]. Analytical Biochemistry,l998, 256: 74-81. DOI:10.1006/abio.1997.2484.
[21] STROHSCHEIN S, PURSCH M, ALBERT K. Hyphenation of high performance liquid chromatography with nuclear magnetic resonance spectroscopy for the characterization of β-carotene isomers employing a C30stationary phase[J]. Journal of Pharmaceutical & Biomedical Analysis,1999, 21(3): 669-677. DOI:10.1016/S0731-7085(99)00164-8.
[22] 高桂珍, 伍晓明, 陆光远, 等. 几种油料作物种子中类胡萝卜素含量的分析[J]. 中国油料作物学报, 2008, 30(3): 312-315. DOI:10.3321/j.issn:1007-9084.2008.03.009.
[23] 孙延芳, 王成社, 杨进荣, 等. 硬粒小麦类胡萝卜素含量的定量分析[J]. 西北农林科技大学学报(自然科学版), 2007, 35(5): 102-106.DOI:10.3321/j.issn:1671-9387.2007.05.022.
[24] 惠伯棣, 李京, 孙拿拿, 等. 番茄和胡萝卜中类胡萝卜素的C30与C18HPLC分离[J]. 中国食品卫生杂志, 2006, 18(4): 289-292.
[25] 陈鹏飞, 刘栓桃, 张志刚, 等. 大白菜的类胡萝卜素种类鉴定[J]. 中国农学通报, 2011, 27(19): 137-143.
[26] 徐仲溪, 王坤波, 简伯华. 沱茶中叶绿素和类胡萝卜素组分的高效薄层色谱分析[J]. 云南农业大学学报, 2005, 20(3): 384-387.DOI:10.3969/j.issn.1004-390X.2005.03.017.
[27] 蔡智鸣, 王振, 王枫华, 等. 深色果蔬食品中番茄红素与β-胡萝卜素的HPLC测定[J]. 同济大学学报(医学版), 2006, 27(1): 17-20.DOI:10.3969/j.issn.1008-0392.2006.01.005.
[28] 杨月欣, 王光亚, 潘兴昌. 中国食物成份表2002[M]. 北京: 人民卫生出版社, 2002.
[29] 刘洪岩, 辛乃宏. β-胡萝卜素的研究进展[J]. 盐业与化工, 2013(1):18-21.
[30] 王雪. β-胡萝卜素的研究进展[J]. 中国化工贸易, 2013, 5(5): 193.DOI:10.3969/j.issn.1674-5167.2013.05.183.
[31] 姚建花, 黄百芬, 任一平, 等. 高效液相色谱法同时测定果蔬中五种类胡萝卜素[J]. 营养学报, 2012, 34(3): 282-285.
[32] 张彩凌, 牛春芳, 葛兴信, 等. 高效液相色谱法测定栅藻中5 种类胡萝卜素的含量[J]. 分析科学学报, 2016, 32(2): 269-272.DOI:10.13526/j.issn.1006-6144.2016.02.025.