我国鸭骨资源非常丰富,但是大部分鸭骨被丢弃或者被加工成骨粉、骨泥等低价值产品,鸭骨利用率很低[1]。鸭骨汤是将鸭骨高温高压蒸煮后得到的骨精华,主要富含胶原蛋白、氨基酸和一些风味物质,属于一种有效利用鸭骨的高值化产品。工业生产上一般利用骨素或者肉汤酶解后进行美拉德反应[2],以此来制备香气浓郁的肉味香精[3],而利用鸭骨汤制备香精的研究尚少见报道。
美拉德反应作用主要体现在生香反应[4]和改善颜色2 个方面,能够改善整个肉品的色泽,从而使产品受到消费者的喜爱。因此对于畜禽骨抽提物进行美拉德反应处理的研究主要集中于产物的颜色和风味上[5-8]。美拉德反应制备的香精颜色评定指标主要表现在产物的褐变程度上,反应过程中颜色由淡黄色变成深棕色[9],颜色越深则表明褐变程度越大;美拉德反应制备的肉味香精的风味评价包括感官评价和仪器分析,其中感官评价是通过视觉、味觉等感觉器官所引起的反应,常用于食品的风味质量评价上。但是,感官评定的数据具有一定的主观性和模糊性,使得感官评定的结果具有不确定性和不稳定性[10],而模糊数学用数学研究和处理模糊现象,能够建立一个反映其本质特征和动态的理论化评价模式,因此模糊数学的方法能够有效避免单纯感官评价少数评价员错误信息,使得评价结果具有可靠性,从而得到更加准确、客观和科学的评价[11]。
目前关于美拉德反应条件如反应温度、反应时间、pH值和水分含量对美拉德反应产物的特性的研究较多[12-14],但是不同的底物往往会使结果有所差异。本实验以高温高压蒸煮后的鸭骨汤为基本原料,通过加入风味蛋白酶进行酶解后,添加一定量的L-半胱氨酸盐酸盐、硫胺素[15-16]和D-木糖,进行美拉德反应。pH值、反应时间和反应温度是影响美拉德反应的主要因素,因此本实验通过单因素试验和正交试验结合来研究3 个因素对美拉德反应液色泽和风味的影响,并且通过Friedman排序检验法和模糊数学处理数据的方法来确定最优的反应条件,使制备的反应液具有较好的风味和色泽,为工业上制备香精提供工艺参考。
1 材料与方法
1.1 材料与试剂
鸭骨架购于山东新希望六和有限公司,经过高温高压蒸煮得到鸭骨汤(蛋白质质量浓度为3.12 g/100 mL),再用风味蛋白酶进行酶解后离心去除沉淀即得到酶解后的鸭骨汤,水解度为30.12%;风味蛋白酶(分析纯)南京瑞翼特生物科技有限公司;L-半胱氨酸盐酸盐(分析纯) 上海百灵威化学技术有限公司;硫胺素(分析纯) 青岛生泉化学试剂有限公司;D-木糖(分析纯)南京晶格化学科技有限公司;所用水为超纯水。
1.2 仪器与设备
智能恒温数显水箱 江苏南京科尔仪器设备有限公司;FE-20型pH计 瑞士Mettler Toledo公司;HVE-50立式高压灭菌锅 日本Hirayama公司;酶标仪 美国Molecular Devices公司;20、100、1 000 μL微量可调移液枪 德国Eppendorf公司;AUY120分析天平日本岛津公司;HYQ-2121A旋涡混匀器 美国Crystal Industries公司;DSQⅡ型气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪 美国Thermo公司。
1.3 方法
1.3.1 鸭骨汤酶解液美拉德反应工艺
首先将酶解后的鸭骨汤解冻,在前期预实验和参考文献的基础上,建立骨汤酶解液的美拉德反应基本体系。取一定量的骨汤酶解液作为反应底物,加入4 g/100 mL的L-半胱氨酸盐酸盐、4 g/100 mL的硫胺素和12 g/100 mL的D-木糖,然后用10 mol/L的NaOH溶液调节pH值,用4 层铝箔纸包裹瓶口,穿刺一定量的小孔,并用8 层纱布再次封闭瓶口后用橡皮筋扎住。最后使其在一定的反应温度和时间进行美拉德反应,反应结束后,冷却至室温于4 ℃冰箱保存。
1.3.2 单因素试验
首先控制反应时间60 min、pH 7.0,设置反应温度为80、90、100、110、120 ℃,分别进行美拉德反应,并确定最佳的反应温度;然后控制最佳反应温度、反应时间60 min,设置pH值为4.0、5.0、6.0、7.0、8.0,分别进行美拉德反应,确定最佳的反应pH值;选取最佳反应温度和pH值,设置反应时间为30、45、60、75、90 min,分别进行美拉德反应,确定最佳的反应时间。其中反应温度、pH值和反应时间的单因素试验结果以美拉德反应产物(Maillard reaction products,MRPs)吸光度和感官评定为指标,其中感官评定通过Friedman排序检验法来评判最佳反应条件,将样品随机呈现给由8 名有感官评定知识背景的评价小组,要求评定员评定前12 h不吸烟、不饮酒,不吃刺激性食物,评定过程中禁止交谈,评定员对样品的总体风味的可接受度进行排序并计算序列和,再用Friedman排序检验法进行分析各样品之间是否存在显著差异,并采用多重比较和分组的方法确定样品之间的差异度。
1.3.3 MRPs吸光度测定
参考文献[17-18]将MRPs稀释10 倍,以蒸馏水为参照,使用酶标仪测定在420 nm波长处的吸光度。
1.3.4 正交试验
在单因素试验的基础上,确定反应温度、pH值和反应时间3 个因素的水平值,设计L9(34)正交表进行美拉德反应优化试验,结束后将样品稀释5 倍,再次选择10 名感官评定员进行评定。
1.3.5 正交试验感官评定方法
1.3.5.1 因素集的建立
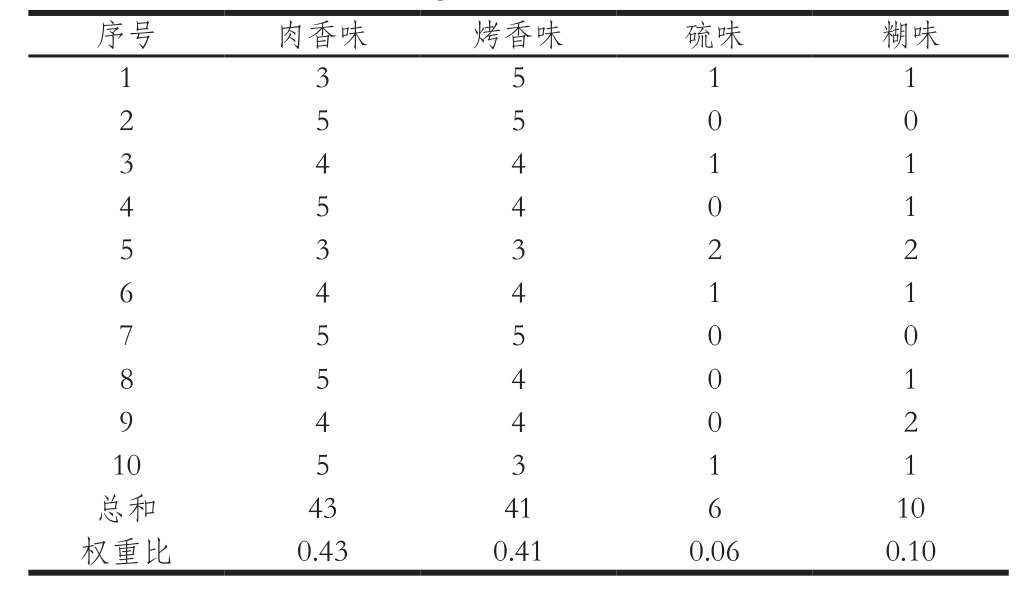
因素集是指感官评定的组成因素的集合,即指标域U=(u1,u2,…,ui,…,um)。本实验由4 项指标组成因素集,即U=(肉香味u1,烤香味u2,硫味u3,糊味u4)。
1.3.5.2 评语集的确立
评语集定义为被评价的对象所处质量级别的集合,将其表示为V=(v1,v2,…,vi,…,vm),其中,vi表示第i级评语。本实验确定MRPs的评语集为V=(极优v1,优v2,良v3,中v4,差v5,极差v6),具体评分见表1。
表1 MRPs感官评定等级
Table1 Rating scales for sensory evaluation of MRPs
1.3.5.3 感官评定因素权重集的确立
因素权重是指感官评定的各个因素在被评价因素整体所占的比重,将其表示为X=(x1,x2,…,xi,…,xm),并且各元素总和为1。本实验对MRPs各因素的权重采用用户调查法,选取10 名感官评价员对MRPs的肉香味、烤香味、硫味和糊味4 个因素在整体质量因素的权重进行打分,4 个因素总分为10 分,评价员认为占的比重大,则评分越高。将结果统计后,每个因素所得总分数除以所有因素总和100,即为该因素的权重。从表2可知,MRPs感官评定因素的权重因子为X=(肉香味0.43,烤香味0.41,硫味0.06,糊味0.10)。
表2 MRPs感官评定的因素权重得分
Table2 Weighed sensory scores of MRPs
1.3.5.4 模糊矩阵及模糊变换
10 个感官评定员对MRPs的每个因素进行等级评定及打分,统计各个因素在每个等级的票数分布,将各个等级的票数除以总人数就得到样品的质量评价模糊矩阵。采用模糊数学的方法处理MRPs的评定结果,根据模糊矩阵变换原理,各个样品的结果为权重集X与所得模糊矩阵A合成,即结果Y=XA。最后比较各个样品的结果,峰值最大的样品即为其风味质量模糊感官评分最高者,则在此条件下的工艺即为最佳工艺条件。
1.3.6 最佳工艺的验证实验
1.3.6.1 感官评价
取一定量的鸭骨架酶解液,在最佳工艺条件下进行美拉德反应,所得产物稀释5 倍后进行感官评定。
1.3.6.2 挥发性成分的检测
采用固相微萃取(solid phase micro extraction,SPME)结合GC-MS的方法[19-20]检测挥发性风味成分,待SPME头(75 μm CAR/PDMS萃取头)老化完成,取5 mL反应液放置于20 mL样品瓶中,在自动进样器上进行分析。
GC条件:TR-5MS弹性石英毛细管柱(30 m×0.25 mm,1 μm);载气为高纯氦气,载气流速为0.9 mL/min;程序升温:第1阶段初始温度为40 ℃,保持2 min,然后以5 ℃/min的速率升至60 ℃,再以6 ℃/min的速率升至120 ℃;第2阶段以12 ℃/min的速率升至250 ℃恒定保持10 min。
MS条件:电子电离源;发射电流350 μA;电子能量70 eV;检测器电压350 V;离子源温度200 ℃;接口温度250 ℃。利用计算机比较离子图和Manilib、Nsitdemo、Replib、Wliley 4 个标准谱库进行成分鉴定,以相似系数大于700作为定性依据,挥发性风味成分的相对含量按照峰面积归一化法进行计算。
1.4 数据分析
排序检验统计量的计算和分组以及正交试验的设计均采用SPSS 13.0进行统计分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 反应温度对美拉德反应的影响
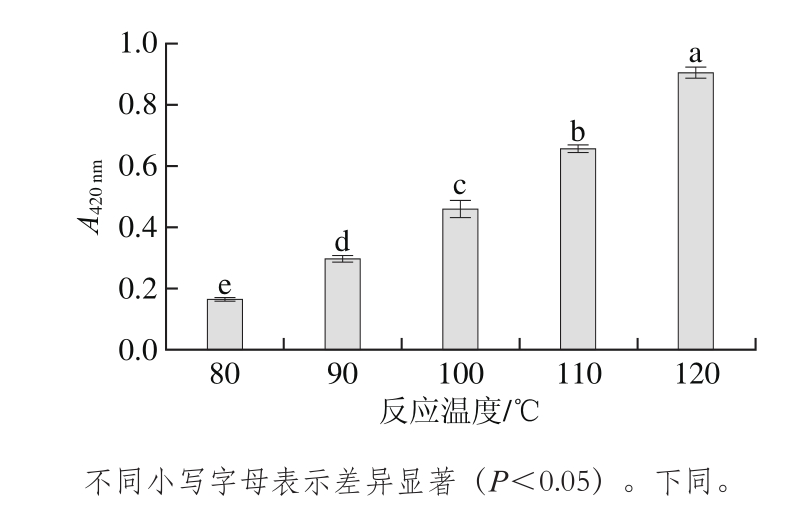
图1 反应温度对MRPs褐变程度的影响(n=3)
Fig. 1 Effect of temperature on browning degree of MRPs (n = 3)
从图1可以看出,随着温度的升高,MRPs在420 nm波长处的吸光度增加,美拉德反应在第3阶段产生的类黑精物质也越来越多,褐变程度呈显著上升趋势[21],不同温度结果之间在420 nm波长处的吸光度均有显著差异。
表3 反应温度对MRPs影响的感官评定结果
Table3 Sensory scores for flavor of MRPs obtained at different temperatures

反应温度对MRPs影响的感官评定结果见表3,利用SPSS软件计算出统计量F值为25.3大于临界值13.28(P=0.01),即样品间差异极显著,通过多重比较和分组的方法将样品划分3组:D、C,B,E、A。这说明在0.01显著水平上,样品D和样品C的风味最好,B次之,E和A的风味最差,样品A(80 ℃)肉香味很淡,而样品E(120 ℃)焦糊味很重。D(110 ℃)和C(100 ℃)没有显著差异,但是样品D(110 ℃)褐变程度最高,因此选择110 ℃为最佳的反应温度。
2.1.2 pH值对美拉德反应的影响

图2 pH值对MRPs褐变程度的影响(n=3)
Fig. 2 Effect of pH on browning degree of MRPs (n = 3)
从图2可以看出,随着pH值的升高,MRPs在420 nm波长处的吸光度越大,美拉德反应产生的类黑精物质越来越多,褐变程度呈显著上升趋势,不同pH值结果均有显著性差异(P<0.05)。
pH值对MRPs影响的感官评定结果见表4。利用SPSS软件计算出统计量F值为18.5,大于临界值13.28(P=0.01),即样品间差异极显著,通过多重比较和分组的方法将样品划分3 组:D,C,B、E、A。说明在0.01的显著水平上,D样品的风味最好,C次之,B、E和A样品的风味最差,因此选择pH值为7.0时为最佳的反应pH值。这可能因为美拉德反应在过低的pH值条件下,产生的H2S较多,而过高pH值条件下产生较多的NH3,因此两者均不能产生良好的风味。
表4 pH值对MRPs影响的感官评定
Table4 Sensory scores for flavor of MRPs obtained at different pH values

2.1.3 反应时间对美拉德反应的影响

图3 反应时间对MRPs褐变程度的影响(n=3)
Fig. 3 Effect of reaction time on browning degree of MRPs (n = 3)
从图3可以看出,随着反应时间的延长,MRPs在420 nm波长处的吸光度逐渐增大,因此美拉德反应产生的类黑精物质越来越多,褐变程度同样呈显著上升趋势,不同反应时间结果均存在显著性差异(P<0.05)。
反应时间对MRPs影响的感官评定结果见表5。利用SPSS软件计算统计量F值为23.3大于临界值13.28(P=0.01),即样品间差异极显著,通过多重比较和分组的方法将样品划分2 组:C、B,D、A、E。这说明在0.01的显著水平上,C和B样品的风味最好,D、A和E样品的风味最差,这可能是反应时间太长可能使反应过度,产生焦糊味。而C组的褐变程度要高于B组,因此选择C组,即反应时间60 min为最佳反应时间。
表5 反应时间对MRPs影响的感官评定结果
Table5 Sensory scores for flavor of MRPs obtained different reaction times

2.2 正交试验结果
2.2.1 水平表的确立
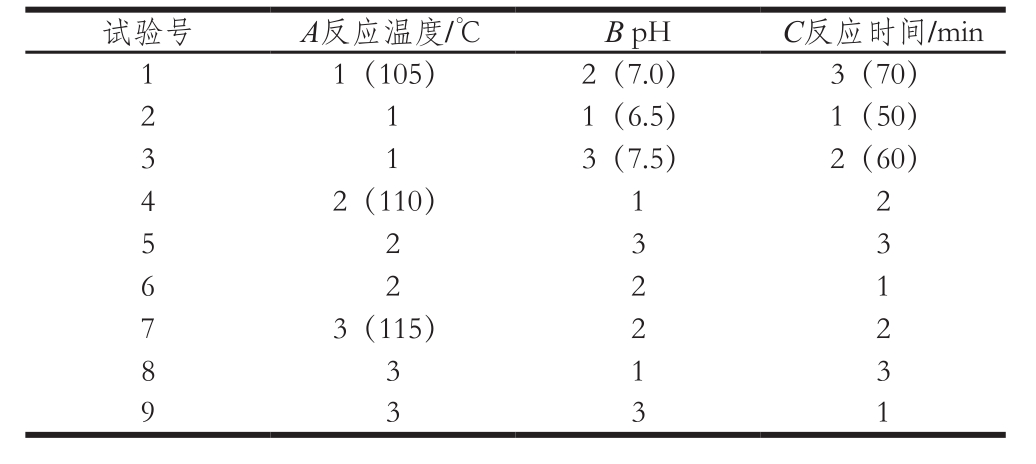
根据单因素试验结果,确定反应温度、pH值和反应时间3 个水平值,利用SPSS软件做L9(34)正交试验,试验设计与结果见表6。
表6 美拉德反应正交试验设计与结果
Table6 Orthogonal array design with experimental results
2.2.2 模糊感官评定结果
将得到的样品1~9随机打乱编号,10 名感官评价员分别对样品的肉香味、烤香味、硫味和糊味4个因素进行评价,将各个等级的票数分布进行整理见表7。
表7 MRPs的感官评定票数分布
Table7 Vote distribution for sensory evaluation of MRPs

把各样品的各个等级总票数除以总人数即为该等级的比率,综合各样品的4 个因素的评价结果,即可得到模糊矩阵Aj,其中j为样品的编号。各组样品得到的模糊矩阵如下:

根据模糊变换原理,综合评价的结果Y=XA,以第1组的样品感官评定结果为例:

上述结果说明,在实验1的条件下,制备得到的MRPs通过感官评定有3.2%的评定员认为其等级为极优,有9.2%的评定员认为其等级为优,有35.1%的评定员认为其等级为良,有52.5%的评定员认为其等级为中,无人认为其等级为差和极差。根据同样的算法就可以得到其他样品的评定等级结果,具体情况见表8。
表8 各样品的综合感官评价
Table8 Overall sensory scores of nine samples from orthogonal array design
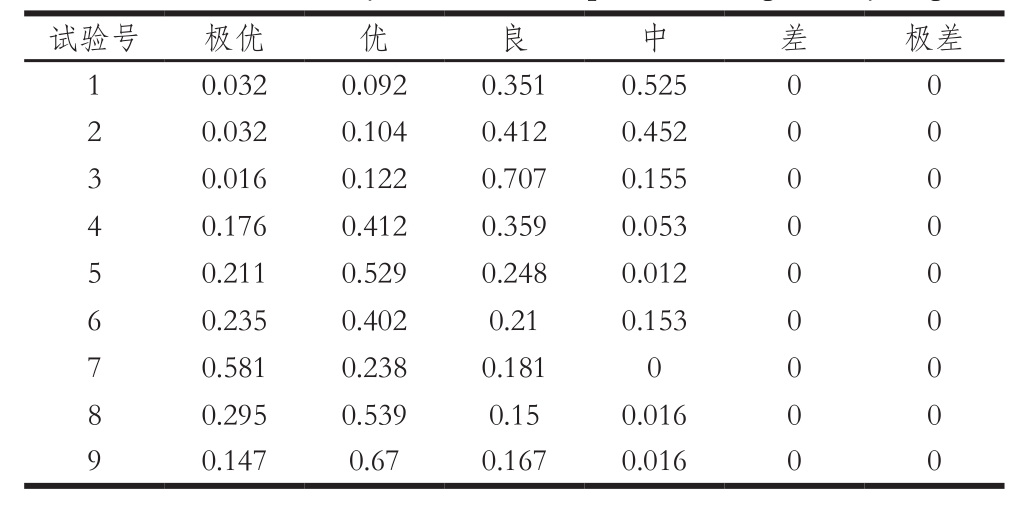
从表8可以看出,样品第1、2、3组评价等级在良和中之间,第4、5、6、8、9组评定等级均为优,而第7组评定等级为极优,峰值为0.581,因此实验第7组的结果最好,选择为最佳的工艺条件,其条件为反应温度115 ℃、pH 7.0、反应时间60 min。
2.2.3 最佳工艺的验证结果
2.2.3.1 感官评价
取适量的酶解液,加入4 g/100 mL的L-半胱氨酸盐酸盐,4 g/100 mL的硫胺素和12 g/100 mL的D-木糖,用10 mol/L的NaOH溶液调节pH值为7.0,在115 ℃的条件下反应60 min,冷却至室温,将得到的MRPs样品稀释5倍,进行感官评价,结果见表9。
表9 MRPs最佳工艺感官评价票数
Table9 Vote distribution for sensory evaluation of optimized MRPs
根据投票结果,可以得到最佳条件下的模糊矩阵:

经过模糊矩阵变换后得到最佳工艺下的评价结果:

结果表明,在最佳工艺条件下MRPs评定等级为极优(0.553),这与正交试验的结果一致,证明该条件为最佳条件。
2.2.3.2 挥发性风味成分检测结果
表10 MRPs中的主要挥发性风味成分
Table10 Main volatile compounds in optimized MRPs
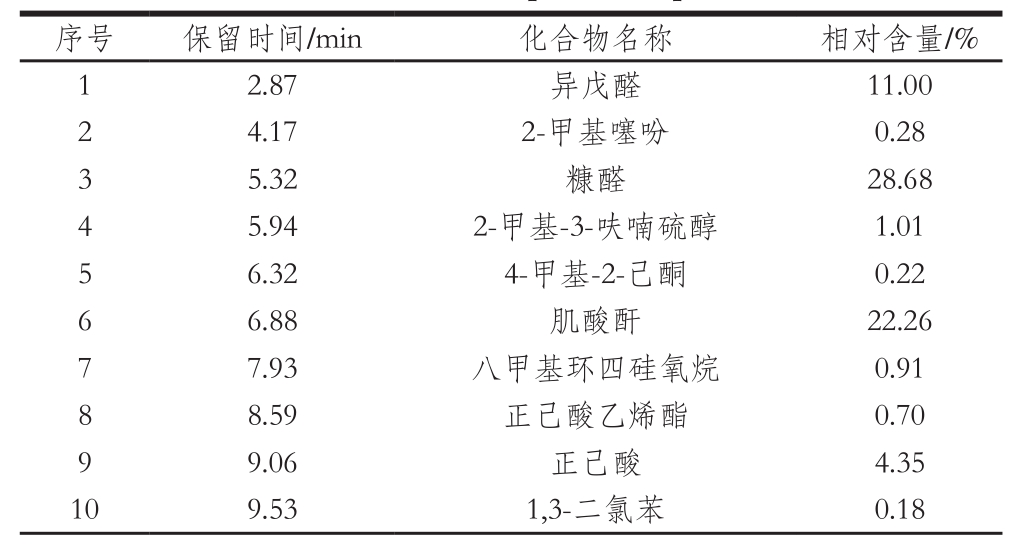
续表10

由表10可知,MRPs中的挥发性风味成分主要有醛类、醇、酮、烷烃、噻吩、噻唑、酯类等物质,其中醛类占很大的比例[22-23]。它们共同构成了MRPs的特征性风味,使制得的MRPs具有浓厚的香气。
3 讨 论
美拉德反应颜色物质的产生主要发生在中间阶段[24-25],主要是一些不饱和棕色含氮聚合物和共聚物的生成[26]。在本实验中,温度越高、pH值越大会导致美拉德反应速率加快,褐变加剧,相关研究也有报道类似的结论[27]。反应时间的延长也会使褐变程度加剧,这可能是因为呈色物质在一定时间范围内随着时间延长而累积。
风味是评价食品质量和可接受度的重要指标[28]。美拉德反应对于风味物质的形成是极为重要的,但同时脂类物质的降解也是产生风味物质的重要来源[29]。到目前为止,已经有100多种挥发性风味成分被定义为肉类及其产品的特征性风味成分,包括特征性含硫化合物、醛类、酮类、酯类和烃类等物质[30]。制得的MRPs中大量的糠醛主要由1,2-烯醇化反应和戊糖环化产生[31],虽然对风味贡献很小,但它会对MRPs总体风味具有协同效应;吡嗪、呋喃和酮类是产生烤香味的主要物质;含硫化合物(2-甲基-3-呋喃硫醇)是典型的肉香味物质[32],因此使MRPs具有浓厚的香气。
4 结 论
本实验利用酶解后的鸭骨汤为原料,添加4 g/100 mL的L-半胱氨酸盐酸盐、4 g/100 mL的硫胺素和12 g/100 mL的D-木糖作为美拉德反应前体物质,通过单因素试验结合Friedman排序检验法和正交试验结合模糊数学的方法进行优化反应条件,得到鸭骨汤酶解液进行美拉德反应的最佳工艺,即为反应温度115 ℃、pH 7.0、反应时间60 min。采用的模糊数学的方法能够有效避免单纯感官评价少数评价员错误信息,使得评价结果具有可靠性,挥发性成分的检测结果也证明了MRPs具有浓郁的风味,可以为高质量鸭骨架衍生化产品的开发提供一定的参考。
参考文献:
[1] MORIMURA S, NAGATA H, UEMURA Y, et al. Development of an effective process for utilization of collagen from livestock and fish waste[J]. Process Biochemistry, 2002, 37(12): 1403-1412. DOI:10.1016/S0032-9592(02)00024-9.
[2] LIESKE B, KONRAD G. Protein hydrolysis-the key to meat flavoring systems[J]. Food Reviews International, 1994, 10(3): 287-312.DOI:10.1080/87559129409541004.
[3] VARAVINIT S, SHOBSNGOB S. Production of meat-like flavor[J].Science Asia, 2000, 26(26): 214-219.
[4] MARTINS S I F S, JONGEN W M F, BOEKEL M A J S V. A review of Maillard reaction in food and implications to kinetic modelling[J]. Trends in Food Science & Technology, 2001, 11(9/10): 364-733. DOI:10.1016/S0924-2244(01)00022-X.
[5] SUN W, ZHAO M, CUI C, et al. Effect of Maillard reaction products derived from the hydrolysate of mechanically deboned chicken residue on the antioxidant, textural and sensory properties of Cantonese sausages[J].Meat Science, 2010, 86(2): 276-282. DOI:10.1016/j.meatsci.2010.04.014.
[6] ROLDÁN M, RUIZ J, DEL PULGAR J S, et al. Volatile compound profile of sous-vide cooked lamb loins at different temperaturetime combinations[J]. Meat Science, 2014, 100: 52-57. DOI:10.1016/j.meatsci.2014.09.010.
[7] WANG B H, LEI S, LI H, et al. Optimization of peach blossom cake formula based on fuzzy mathematics sensory evaluation and orthogonal experiment[J]. Food Science & Technology, 2015, 10: 46.
[8] PRASAD K, NATH N. Comparison of sugarcane juice based beverage optimisation using response surface methodology with Fuzzy method[J].Sugar Technology, 2002, 4(3/4): 109-115. DOI:10.1007/BF02942691.
[9] RIVAS-CAÑEDO A, JUEZ-OJEDA C, NUÑEZ M, et al. Volatile compounds in ground beef subjected to high pressure processing: a comparison of dynamic headspace and solid-phase microextraction[J].Food Chemistry, 2011, 124(3): 1201-1207. DOI:10.1016/j.foodchem.2010.07.045.
[10] MADRUGA M S, ELMORE J S, DODSON A T, et al. Volatile flavour profile of goat meat extracted by three widely used techniques[J]. Food Chemistry, 2009, 115(3): 1081-1087. DOI:10.1016/j.foodchem.2008.12.065.
[11] MORALES F J, MAJSVAN B. A study on advanced Maillard reaction in heated casein/sugar solutions: colour formation[J]. International Dairy Journal, 1999, 7(11): 675-683. DOI:10.1016/S0958-6946(99)00014-X.
[12] CERNY C, BRIFFOD M. Effect of pH on the Maillard reaction of[13C5]xylose, cysteine, and thiamin[J]. Journal of Agricultural & Food Chemistry, 2007, 55(4): 1552-1556. DOI:10.1021/jf062874w.
[13] LAN X H, LIU P, XIA S Q, et al. Temperature effect on the nonvolatile compounds of Maillard reaction products derived from xylosesoybean peptide system: further insights into thermal degradation and cross-linking[J]. Food Chemistry, 2010, 120(4): 967-972. DOI:10.1016/j.foodchem.2009.11.033.
[14] JISANG K, YOUNGSOON L. Study of Maillard reaction products derived from aqueous model systems with different peptide chain lengths[J]. Food Chemistry, 2009, 116(4): 846-853. DOI:10.1016/j.foodchem.2009.03.033.
[15] WERKHOFF P, BRUENING J, EMBERGER R, et al. Isolation and characterization of volatile sulfur-containing meat flavor components in model systems[J]. Journal of Agricultural & Food Chemistry, 2002, 38(3):777-791. DOI:10.1021/jf00093a041.
[16] RUTHER J, BALTES W. Sulfur-containing furans in commercial meat flavorings[J]. Journal of Agricultural & Food Chemistry, 1994, 42(10):2254-2259. DOI:10.1021/jf00046a032.
[17] JIANG Z, WANG L, WU W, et al. Biological activities and physicochemical properties of Maillard reaction products in sugar-bovine casein peptide model systems[J]. Food Chemistry, 2013, 141(4): 3837-3845. DOI:10.1016/j.foodchem.2013.06.041.
[18] PALOMBO R, GERTLER A, SAGUY I. A simplified method for determination of browning in dairy powders[J]. Journal of Food Science,2010, 49(6): 1609. DOI:10.1111/j.1365-2621.1984.tb12855.x.
[19] GUO X, TIAN S, DARRYLM S. Generation of meat-like flavourings from enzymatic hydrolysates of proteins from Brassica sp.[J]. Food Chemistry, 2010, 119(1): 167-172. DOI:10.1016/j.foodchem.2009.05.089.
[20] MEINERT L, SCHÄFER A, BJERGEGAARD C, et al. Comparison of glucose, glucose 6-phosphate, ribose, and mannose as flavour precursors in pork; the effect of monosaccharide addition on flavour generation[J].Meat Science, 2009, 81(3): 419-245. DOI:10.1016/j.meatsci.2008.08.018.
[21] WANG W Q, BAO Y H, CHEN Y. Characteristics and antioxidant activity of water-soluble Maillard reaction products from interactions in a whey protein isolate and sugars system[J]. Food Chemistry, 2013,139(1/2/3/4): 355-361. DOI:10.1016/j.foodchem.2013.01.072.
[22] ELMORE J S, MOTTRAM D S, HIERRO E. Two-fibre solid-phase microextraction combined with gas chromatography-mass spectrometry for the analysis of volatile aroma compounds in cooked pork[J]. Journal of Chromatography A, 2001, 905(1/2): 233-240. DOI:10.1016/S0021-9673(00)00990-0.
[23] XIE J, SUN B, ZHENG F, et al. Volatile flavor constituents in roasted pork of Mini-pig[J]. Food Chemistry, 2008, 109(3): 506-514.DOI:10.1016/j.foodchem.2007.12.074.
[24] HURRELL R F, FINOT P A, FORD J E. Storage of milk powders under adverse conditions. Ⅰ. losses of lysine and of other essential amino acids as determined by chemical and microbiological methods[J]. British Journal of Nutrition, 1983, 49(3): 343-354. DOI:10.1079/BJN19830043.
[25] PELLEGRINO L, RESMINI P, LUF W, et al. Assessment (indices)of heat treatment of milk[J]. Brussels, International Dirly Federation,1995(a): 409-453.
[26] AMES J M. The Maillard reaction[M]. New York: Springer Us, 1992: 99-153. DOI:10.1007/978-1-4684-9895-0_4.
[27] AJANDOUZ E H, DESSEAUX V, TAZI S, et al. Effects of temperature and pH on the kinetics of caramelisation, protein cross-linking and Maillard reactions in aqueous model systems[J]. Food Chemistry, 2008,107(3): 1244-1252. DOI:10.1016/j.foodchem.2007.09.062.
[28] ZHAO J, WANG M, XIE J, et al. Volatile flavor constituents in the pork broth of black-pig[J]. Food Chemistry, 2017, 226: 51-60. DOI:10.1016/j.foodchem.2017.01.011.
[29] MOTTRAM D S. Flavor formation in meat and meat products: a review[J]. Food Chemistry, 1998, 62(4): 415-424. DOI:10.1016/S0308-8146(98)00076-4.
[30] SHAHIDI F. Flavor of meat, meat products and seafood[M]. New York:Springer Us, 1998: 429.
[31] YAHYA H, LINFORTH R S T, COOK D J. Flavour generation during commercial barley and malt roasting operations: a time course study[J]. Food Chemistry, 2014, 145(4): 378-387. DOI:10.1016/j.foodchem.2013.08.046.
[32] LOTFY S N, FADEL H H, EL-GHORAB A H, et al. Stability of encapsulated beef-like flavourings prepared from enzymatically hydrolysed mushroom proteins with other precursors under conventional and microwave heating[J]. Food Chemistry, 2015, 187(7): 7-13.DOI:10.1016/j.foodchem.2015.04.027.