烘焙食品是世界主流食品,其中小麦面包在烘焙食品行业占有重要地位。荞麦富含蛋白质、脂肪、维生素、膳食纤维和黄酮类化合物,营养价值丰富,加工利用前景广阔,但目前综合利用率较低[1-3]。荞麦粉的添加能显著增加小麦面包的抗氧化性等营养功效[4-6],但会破坏面团面筋网络结构导致面包品质下降[6-8]。
酸面团技术的应用不仅能提升面包营养价值,赋予面包特殊风味,还能改善面包比容和质构,延长面包货架期[9-10]。乳酸菌产生的积极影响主要与酸面团发酵过程中产生的有机酸、酶和胞外多糖(exopolysaccharide,EPS)等有关[11-12]。其中,乳酸菌EPS是乳酸菌在生长代谢过程中产生的荚膜多糖或分泌到细胞壁外的黏液多糖的总称[13-14]。作为一种天然的生物聚合物,EPS可以替代或减少用作面包改良剂的亲水胶体[15-17],改善面团流变和面包质地,延长面包货架期,从而降低生产成本,并满足消费者对绿色、天然食品的需求[18-19]。
因此,本实验以从酒曲和酸面团筛选出的2 株不同高产EPS魏斯氏菌作为研究对象,发酵荞麦酸面团制作荞麦酸面团面包,比较研究2 株菌发酵荞麦酸面团的代谢情况,并进一步探讨当荞麦酸面团添加量为30%时,2 株菌产生的EPS对面团面筋网络结构和面包烘焙品质的影响,为开发高产EPS乳酸菌作为天然发酵剂改善荞麦面包品质提供一定理论参考价值。
1 材料与方法
1.1 材料与试剂
实验菌株为分离自酒曲的食窦魏斯氏菌(T5)和融合魏斯氏菌(J28);荞麦粉产于吉林省吉林市的荞麦米,经磨粉80目过筛制成;小麦粉 鹏泰(秦皇岛)面粉有限公司;即发活性干酵母 广东省梅山马利酵母有限公司;起酥油 中粮东海粮油工业(张家港)有限公司;MRS肉汤培养基 杭州百思生物技术有限公司;改良的MRS培养基为mMRS培养基,即MRS培养基中的葡萄糖用质量分数为5%的蔗糖代替。
1.2 仪器与设备
SPX-150C型恒温恒湿培养箱 上海博迅实业有限公司医疗设备厂;TDL-5SM-25搅拌机、SPC-40SP醒发箱、SM-503烤箱、SM-302切片机 新麦机械(无锡)公司;CT3质构仪 美国Brookfield公司;DAWN HELEOSⅡ型多角度激光光散射凝胶色谱系统 美国怀雅特技术公司;H1850R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;Quanta-200扫描电子显微镜荷兰FEI公司;2515高效液相色谱仪(配2414示差折光检测器和Empower工作站) 美国Waters公司。
1.3 方法
1.3.1 EPS的提取和理化性质的测定
1.3.1.1 EPS的提取
经活化后的菌株T5和J28,接种至mMRS液体培养基30 ℃发酵60 h,沸水浴10 min,加入80%的三氯乙酸溶液至终质量分数为4%,4 ℃静置过夜,离心(10 000×g,20 min)取上清液,然后加入3 倍体积95%乙醇溶液,4 ℃静置过夜,离心(10 000×g,20 min)取沉淀。将沉淀复溶于水,利用透析袋(8 000~14 000 Da)透析48 h,冻干后贮存于干燥器中备用。
1.3.1.2 EPS单糖组成的测定
称取20 mg多糖样品,加入2 mL 2 mol/L H2SO4沸水浴水解3 h,用2 mol/L NaOH溶液中和,离心取上清液过0.45 μm膜,然后以岩藻糖、氨基葡萄糖、鼠李糖、阿拉伯糖、氨基半乳糖、半乳糖、葡萄糖、木糖、甘露糖、核糖为标准样品通过高效液相色谱进行单糖分析[20]。色谱条件:色谱柱为Waters Sugar-Pak1(300 mm×7.8 mm),流动相为水,等度洗脱,流速为0.4 mL/min,柱温为85 ℃,进样量为10 μL。
1.3.1.3 多糖分子质量的测定
将多糖溶液用流动相配制成1 mg/mL溶液,过0.45 μm滤膜,然后用多角度激光光散射凝胶色谱系统测定其分子质量。色谱柱条件:色谱柱为WAT011540 UltrahydrogelTM2000(300 mm×7.8 mm),流动相为0.1 mol/L NaNO3溶液,等度洗脱,流速为0.5 mL/min,柱温为40 ℃,dn/dc为0.146,进样量为100 μL,检测器为示差折光检测器和20角度激光光散射检测器。
1.3.2 荞麦酸面团基本性质测定
1.3.2.1 荞麦酸面团的制作
取培养至对数后期的乳酸菌经离心(5 000 r/min,10 min)取菌泥。将菌泥加入到等质量的荞麦粉和水中搅拌均匀,使酸面团初始接种量达到107CFU/g酸面团,放入30 ℃培养箱培养24 h。以产EPS酸面团(T5+/J28+)作为实验组,以不产EPS酸面团(T5-/J28-)和空白荞麦面包作为对照组。对于产EPS酸面团,用蔗糖替代10%的荞麦粉。
1.3.2.2 荞麦酸面团菌落数、pH值和总可滴定酸度(total titratable acidity,TTA)的测定
分别取10 g发酵0 h和24 h的酸面团用灭过菌的生理盐水进行10 倍梯度稀释,然后选取合适的梯度,取100 μL涂布于MRS固体平板上,37 ℃培养48 h进行计数,同时根据AACC法测定酸面团的pH值和TTA[9]。
1.3.3 荞麦酸面团的糖代谢
1.3.3.1 荞麦酸面团中EPS产量和低聚糖含量测定
EPS产量:取10 g酸面团溶解于2 倍体积蒸馏水中,经离心(8 000×g,10 min)取上清液,然后按照1.3.1节方法进行EPS的提取纯化和含量测定。
低聚异麦芽糖含量的测定:取10 g产EPS酸面团溶于2 倍体积的蒸馏水,80 ℃水浴2 h,经离心过0.45 μm滤膜,参照GB/T 20881—2007《低聚异麦芽糖》[21]利用高效液相色谱法进行含量测定。
1.3.3.2 酸面团中可溶性糖含量的测定
取1.3.2.1节获得的酸面团上清液,定容至100 mL,过0.45 μm滤膜。以葡萄糖、蔗糖、果糖、麦芽糖作为标准样品,采用高效液相色谱仪测定其含量。色谱条件:色谱柱为Waters Sugar Pak I,流动相为重蒸水,等度洗脱,流速0.4 mL/min,柱温为90 ℃,检测器为Waters 400型折光检测器,进样量为10 μL。
1.3.3.3 酸面团中有机酸含量的测定
取1.3.2.1节得到的酸面团上清液样品,以乳酸和乙酸为标准样品,利用高效液相色谱测定酸面团中有机酸含量。色谱条件:色谱柱为Diamonsil C18(4.6 mm×250 mm),流动相为甲醇-0.05%磷酸溶液(5∶95,V/V),柱温30 ℃,等度洗脱,流速为0.8 mL/min,进样量为10 μL,检测器为紫外检测器。
1.3.4 荞麦酸面团面包的制作
以制作面包所用荞麦粉和小麦粉总质量分数计算,空白组面包即不添加荞麦酸面团的荞麦-小麦混合粉面包的配方为:小麦粉(80%)、荞麦粉(20%)、水(55%)、酵母(1.5%)、盐(1%)、白砂糖(6.5%)、黄油(4%);4 种不同的酸面团面包分别为添加30%产EPS酸面团的面包(分别为T5+组和J28+组)和添加30%不产EPS酸面团的面包(分别为T5-组和J28-组)。为了减少实验误差,面包面团样品保持恒定的水/小麦粉/荞麦粉比。按上述配方,将除黄油外的所有原料加入搅拌机搅拌成团,然后加入黄油,慢搅1.5 min,快搅2.3 min。取出面团,室温下覆膜静置10 min,分割成型(90 g/个),然后在醒发箱(34 ℃,相对湿度85%)内醒发60 min 后,放入烤箱(上火170 ℃,下火210 ℃)烘烤20 min。
1.3.5 EPS对面包面团微观结构影响的测定[22]
挑取2 g面团置于青霉素瓶中用5%戊二醛固定,然后用0.1 mol/L磷酸缓冲液漂洗,再次用1%四氧化二锇进行固定,然后用0.1 mol/L磷酸缓冲液进行反复冲洗后,再用不同体积分数的乙醇进行梯度洗脱,临界点干燥后将样品黏贴在样品台上,离子溅射仪镀膜后置于扫描电子显微镜下观察,放大倍数为600 倍。
1.3.6 EPS对荞麦酸面团面包烘焙品质影响的测定
1.3.6.1 面包比容的测定
烘焙完成的面包在室温下冷却1 h后,测定面包质量,并用油菜籽替代法测定面包体积,重复3 次取平均值。按下式计算比容:
1.3.6.2 面包全质构的测定
取烘焙后冷却1 h的面包切片,选取中间两片面包叠加,采用质构仪在TPA模式下测定面包全质构,每个样品重复4 次取平均值。参数设置:探头型号P/36,测试前速率3.0 mm/s,测试速率1.0 mm/s,测试后速率3.0 mm/s,压缩程度50%,感应力8 g,压缩时间间隔1 s。
1.3.6.3 面包感官评定
选取20 位经过训练的人员通过九分嗜好评分法[23]对面包外观、色泽、风味、口感及整体可接受度进行感官评定。
1.4 数据分析
采用SPSS 16.0及Microsoft Oきce Excel 2013分析软件进行数据统计分析,运用方差分析法(ANOVA)进行显著性分析,显著差异水平取P<0.05。
2 结果与分析
2.1 2 株菌产EPS理化性质的结果
表1 2 种多糖的单糖组成和分子质量
Table 1 Monosaccharide composition and molecular weight of EPS produced by two strains

从表1可以看出,2 种多糖都是仅由葡萄糖组成,因此2 种多糖都是葡聚糖。2 种多糖分子质量均高达107Da,并且J28所产EPS是T5的2.5 倍左右。2 种葡聚糖的分子质量分布指数均接近1.0,说明这2 种葡聚糖的分子质量分布集中、均一。
2.2 荞麦酸面团指标测定结果
表2 荞麦酸面团中菌落总数和酸化能力
Table 2 Microbial quantity and acidification properties of unfermented and fermented sourdoughs

注:同列不同小写字母表示差异显著(P<0.05),表3、4同。
为了确保2 种乳酸菌在酸面团中成为优势菌株,使其初始接种量都达到107CFU/g酸面团。由表2可知,经过24 h发酵不同样品中菌落总数均可达到108CFU/g;4 种酸面团的TTA具有显著差异:T5-组>T5+组>J28-组>J28+组;4 种酸面团的pH值显著性差异不同,其中,T5+组酸面团的pH值显著高于T5-组。
2.3 荞麦酸面团中糖代谢结果
2.3.1 酸面团中EPS和低聚糖含量的变化

图1 酸面团中EPS含量的变化
Fig. 1 Content of EPS in sourdoughs
分别以T5-组、J28-组酸面团样品作为对照组,以T5+组、J28+组酸面团样品作为实验组,研究2 种产EPS酸面团的产糖能力以及对酸面团中有机酸和低聚异麦芽糖含量的影响。从图1可以看出,T5+组酸面团和J28+组酸面团的EPS产量差异显著,分别为9.36、11.87 g/kg。这2 株菌的EPS产量都远大于Weissella cibaria MG1在荞麦酸面团中的EPS产量[24]。T5+组和J28+组荞麦酸面团中仅少量的低聚异麦芽糖被检测到,其中T5+组酸面团产生的麦芽三糖、潘糖和异麦芽三糖含量分别为10.11、0.15、0.20 mg/kg,而J28+组酸面团产生的这3 种异麦芽糖含量分别为4.84、0.02、0.03 mg/kg。这与Wolter等[27]研究一致,主要和荞麦粉中含有少量的麦芽糖有关。
2.3.2 酸面团中可溶性糖含量的变化
表3 酸面团发酵前后可溶性糖含量的变化
Table 3 Soluble sugar contents in unfermented and fermented sourdoughs

由表3可知,T5和J28都能有效利用添加到酸面团中的蔗糖,并伴随大量果糖的生成。但2 株菌对蔗糖的利用效率差异显著。J28在产EPS酸面团中对蔗糖的利用率(99.71%)是T5(63.87%)的1.56 倍,这与2 株菌发酵荞麦酸面团产生EPS的能力以及果糖增加幅度差异相一致。初始酸面团中仅检测到少量的麦芽糖,说明荞麦粉麦芽糖含量较少,并且发酵后麦芽糖大量减少,因此仅有极微量的低聚异麦芽糖产生。除了T5+组,发酵后所有酸面团样品中的葡萄糖含量均有所下降。
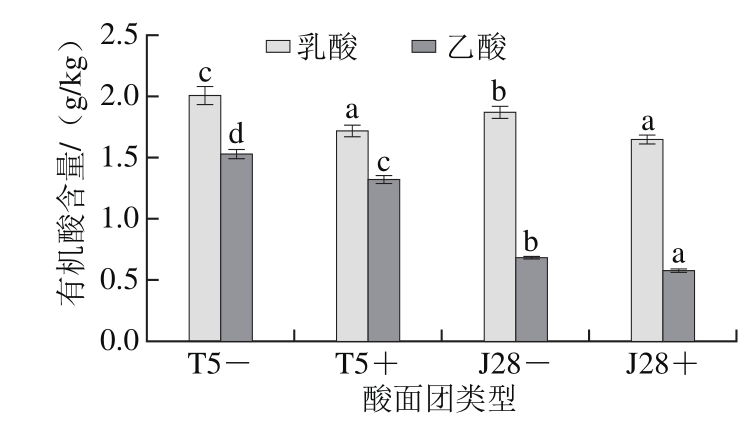
图2 酸面团中有机酸含量的变化
Fig. 2 Contents of organic acids in sourdoughs
2.3.3 酸面团中有机酸含量的变化研究表明专性异型发酵乳酸菌在蔗糖代谢过程中会产生大量乙酸,而过量的乙酸通常会影响EPS对面包的改善作用[25-26]。2 株菌发酵产生的有机酸特别是乙酸含量差异很大。由图2可知,T5+和T5-组产生的乙酸含量显著高于J28+和J28-酸面团的,说明T5发酵荞麦产酸能力显著高于J28,与酸面团中测定的TTA值相一致。通过分别对比T5+酸面团和J28+酸面团有机酸含量,表明2 种EPS的产生不仅没有促进乙酸产生,反而降低了乙酸的含量,这与Katina等[27]的研究一致。
2.4 EPS对面包面团微观结构的影响

图3 不同配方面团的扫描电镜图(×600)
Fig. 3 Scanning electron micrographs of unfermented and fermented sourdoughs (× 600)
面包面团的三维面筋网络结构是面团在搅拌过程中麦谷蛋白和麦醇溶蛋白通过二硫键以及氢键相互作用形成的,它赋予面团黏弹性和良好持气率;其中的淀粉颗粒镶嵌在面筋网络结构内外,共同构成面团体系,影响面团和面包的品质[28]。
从图3A可以看出,添加荞麦粉的空白面包面筋网络结构严重断裂,同时变得稀疏而不均匀,淀粉颗粒大量暴露在面筋网络结构之外。对比T5-和J28-组面团的扫描电镜图(图3B和3D)可看出,J28-组面团的面筋网络结构改善效果更加显著,呈现出片状的面筋蛋白,而淀粉颗粒较少裸露;而T5-组改善效果不明显,可能与2 株菌的产酸能力有关,因为当酸化过强时,面筋蛋白、淀粉和阿拉伯木聚糖等会产生解聚和水解,进而弱化面包结构[29]。
由图3C和3E可知,从T5+组和J28+组的面团扫描电镜图中都可以看到许多粗细不同的面筋束,而淀粉颗粒也大都镶嵌在面筋网络中,并且J28+组面团的面筋束更细更密集,因此说明2 种EPS对面团网络结构都具有较强的改善作用,这可能是因为EPS和面筋蛋白以及淀粉相互作用,改善了面筋网络结构。而T5产生的EPS可以掩盖酸面团过度酸化带来的不利影响,进而赋予面团较好的黏弹性和持气性结构,但J28产生的EPS对面筋网络结构作用力更强,因为EPS在酸面团中的功能不仅与多糖产量、类型有关,还受到有机酸等代谢产物的影响[30]。
2.5 面包比容

图4 不同配方面包的比容
Fig. 4 Specific volumes of different breads
由图4可知,空白组面包比容最小,主要是因为荞麦粉的添加严重破坏了面团面筋网络结构,导致其持气率变差[31]。J28-组面包比容显著高于T5-组面包,这可能与2 株菌的产酸能力有关。研究表明乳酸菌的酸化程度对面包比容有一定的影响,酸化过度会使面包比容降低[32]。
当酸面团添加量为30%时,与各自的添加不产EPS酸面团面包相比,添加产EPS酸面团面包的比容均有所增加。并且T5+组面包比容增加了10.60%,而J28+组面包比容仅增加了2.62%,这可能是因为T5产生的EPS可以抵消过度酸化带来的不利影响[18,28]。因此EPS可以改善面包的比容,这与Di Cagno等[19]的研究结果一致。EPS具有亲水胶体的作用,可以改善面团面筋网络结构,进而提高了面团的持气率,增加了面包的比容。
2.6 面包全质构
表4 不同面包的全质构
Table 4 The whole textures of different breads
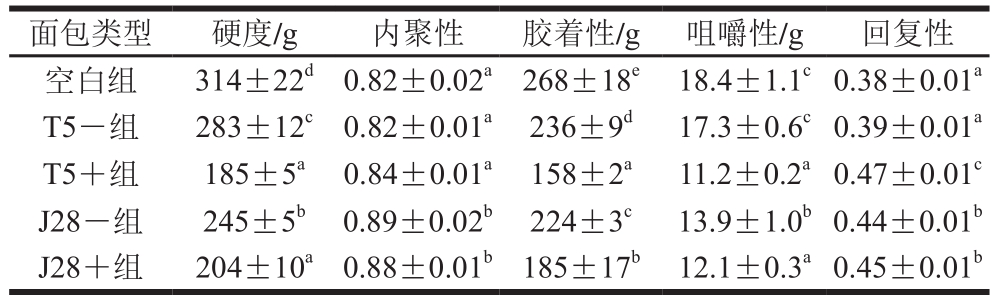
质构是面包产品品质和可接受度的重要指标,其中硬度、胶着性和咀嚼性与面包的品质成负相关,内聚性和回复性与面包的品质成正相关[10]。从表4可以看出,酸面团的添加显著降低了面包的硬度、胶着性和咀嚼性。当添加30%的不产EPS酸面团时,T5-组的硬度显著高于J28-组面包,这与它具有较差的面筋网络结构相关;当添加30%的产EPS酸面团时,T5+组和J28+组面包的柔软度都显著增加了,但显著性差异不大。这表明EPS可以改善面包的质构,这可能是因为EPS和面筋蛋白相互作用,改善了面团的面筋网络结构,增加了面包的柔软性。
2.7 面包感官品质

图5 不同面包的感官品质
Fig. 5 Sensory evaluation of different breads
如图5所示,酸面团特别是产EPS酸面团的添加显著提升了面包的各项评分,主要是因为添加荞麦粉的面包面筋网络结构变差,体积减少,面包芯硬度增加;而酸面团特别是EPS的引入能显著改善面团面筋网络结构,增强面包的风味,减弱荞麦粉苦味,进而提升了面包品质。对比2株乳酸菌可知,当添加30%的产EPS酸面团时,T5+组和J28+组整体接受度都有改善,但J28+组面包更受欢迎。
3 结 论
菌株T5和J28发酵产生的EPS都是高分子葡聚糖,分子质量均高达107Da,但菌株J28产生的葡聚糖重均分子质量为菌株T5的2.5倍。T5和J28发酵荞麦酸面团产EPS能力具有显著性差异;T5发酵荞麦酸面团乙酸含量显著强于J28。T5和J28发酵产生的EPS都能增强面团面筋网络结构,增加面包比容和柔软度以及面包整体可接受度,但T5产生的EPS改善作用更明显。与空白组面包相比,除了T5-组面包,其他酸面团面包品质都得到明显改善;J28+组面包品质最佳,并且整体接受度更高。T5和J28发酵产生的EPS都能通过增强面团面筋网络结构改良荞麦酸面团面包烘焙品质,但其改良效果不仅与EPS产量和性质有关,还受到发酵过程中有机酸等代谢产物的影响。
参考文献:
[1] 陶纯洁, 袁鹏, 王辛, 等. 荞麦产品开发利用与发展的研究[J]. 粮食与食品工业, 2014, 21(1): 52-54.
[2] 阎红. 荞麦的应用研究及展望[J]. 食品工业科技, 2011(1): 363-365.DOI:10.13386/j.issn1002-0306.2011.01.081.
[3] 侯雪梅, 袁仲. 荞麦的营养保健功能与开发利用[J]. 农产品加工(创新版), 2014(1): 73-75.
[4] SEDEJ I, SAKAČ M, MANDIĆ A, et al. Assessment of antioxidant activity and rheological properties of wheat and buckwheat milling fractions[J]. Journal of Cereal Science, 2011, 54(3): 347-353.DOI:10.1016/j.jcs.2011.07.001.
[5] GAWLIKDZIKI U, DZIKI D, BARANIAK B, et al. The effect of simulated digestion in vitro on bioactivity of wheat bread with Tartary buckwheat flavones addition[J]. LWT-Food Science and Technology,2009, 42(1): 137-143. DOI:10.1016/j.lwt.2008.06.009.
[6] 张思佳, 张薇, 苏晓琴, 等. 乳杆菌发酵对荞麦面包抗氧化及烘焙特性影响[J]. 食品工业科技, 2015, 36(19): 49-53. DOI:10.13386/j.issn1002-0306.2015.19.001.
[7] GALLAGHER E, GORMLEY T R, ARENDT E K. Recent advances in the formulation of gluten-free cereal-based products[J]. Trends in Food Science & Technology, 2004, 15(3/4): 143-152. DOI:10.1016/j.tifs.2003.09.012.
[8] GALLE S, SCHWAB C, BELLO F D, et al. Influence of in-situ synthesized exopolysaccharides on the quality of gluten-free sorghum sourdough bread[J]. International Journal of Food Microbiology, 2012,155(3): 105-112. DOI:10.1016/j.ijfoodmicro.2012.01.009.
[9] 钟京, 王凤, 刘娜, 等. 乳酸菌发酵麸皮酸面团对高纤维面包面团流变发酵学及烘焙特性的影响[J]. 食品工业科技, 2013, 34(9): 49-54.DOI:10.13386/j.issn1002-0306.2013.09.035.
[10] 苏晓琴, 张可欣, 黄卫宁, 等. 高γ-氨基丁酸绿豆酸面团面包营养与烘焙特性[J]. 食品工业科技, 2016, 37(13): 340-345. DOI:10.13386/j.issn1002-0306.2016.13.062.
[11] CORSETTI A, SETTANNI L. Lactobacilli in sourdough fermentation[J]. Food Research International, 2007, 40(5): 539-548.DOI:10.1016/j.foodres.2006.11.001.
[12] ARENDT E K, RYAN L A, DAL B F. Impact of sourdough on the texture of bread[J]. Food Microbiology, 2007, 24(2): 165-174.DOI:10.1016/j.fm.2006.07.011.
[13] 王辑. 产胞外多糖植物乳杆菌的分离筛选、分子表征及其应用研究[D]. 长春: 吉林大学, 2015.
[14] DERTLI E, COLQUHOUN I J, GUNNING A P, et al. Structure and biosynthesis of two exopolysaccharides produced by Lactobacillus johnsonii FI9785[J]. Journal of Biological Chemistry, 2013, 288(44):31938. DOI:10.1074/jbc.M113.507418.
[15] AHLBORN G J, PIKE O A, HENDRIX S B, et al. Sensory,mechanical, and microscopic evaluation of staling in low-protein and gluten-free breads[J]. Cereal Chemistry, 2005, 82(3): 328-335.DOI:10.1094/CC-82-0328.
[16] MOORE M M, SCHOBER T J, DOCKERY P, et al. Textural comparisons of gluten-free and wheat-based doughs, batters, and breads[J]. Cereal Chemistry, 2004, 81(5): 567-575. DOI:10.1094/CCHEM.2004.81.5.567.
[17] 刘彦, 黄卫宁, 贾春利, 等. 阿拉伯胶和羧甲基纤维素钠对荞麦面团发酵流变学及烘焙特性的影响[J]. 食品科学, 2013, 34(17): 5-9.DOI:10.7506/spkx1002-6630-201317002.
[18] TORRIERI E, PEPE O, VENTORINO V, et al. Eあect of sourdough at different concentrations on quality and shelf life of bread[J].Lebensmittel-Wissenschaft und Technologie, 2014, 56(2): 508-516.DOI:10.1016/j.lwt.2013.12.005.
[19] DI CAGNO R, DE A M, LIMITONE A, et al. Glucan and fructan production by sourdough Weissella cibaria and Lactobacillus plantarum[J]. Journal Agriculture Food Chemistry, 2006, 54(26):9873-9881. DOI:10.1021/jf061393+.
[20] 孟磊, 常军民, 孙莲, 等. 柱前衍生-HPLC分析天山花楸多糖中的单糖组成[J]. 食品科学, 2009, 30(24): 324-326.
[21] 国家质量监督检验检疫总局, 国家标准化管理委员会. 低聚异麦芽糖: GB/T 20881—2007[S]. 北京: 中国标准出版社, 2007.
[22] 王晓艳. 高膳食纤维对面包面团发酵烘焙及贮藏特性的影响研究[D].无锡: 江南大学, 2012: 1-37.
[23] 刘娜. 区域特色酸面团馒头及其优选乳酸菌发酵特性比较研究[D].无锡: 江南大学, 2014: 1-42.
[24] WOLTER A, HAGER A S, ZANNINI E, et al. Evaluation of exopolysaccharide producing Weissella cibaria MG1 strain for the production of sourdough from various flours[J]. Food Microbiology,2014, 37(2): 44-50. DOI:10.1016/j.fm.2013.06.009.
[25] SUSANNE K, MICHAEL S, CHRISTIAN H, et al. Performance of Lactobacillus sanfranciscensis TMW1.392 and its levansucrase deletion mutant in wheat dough and comparison of their impact on bread quality[J]. European Food Research and Technology, 2008,227(2): 433-442. DOI:10.1007/s00217-007-0738-1.
[26] SANDRA G, SCHWAB C, BELLO F D, et al. Comparison of the impact of dextran and reuteran on the quality of wheat sourdough bread[J]. Journal of Cereal Science, 2012, 56(3): 531-537.DOI:10.1016/j.jcs.2012.07.001.
[27] KATINA K, MAINA N H, JUVONEN R, et al. In situ production and analysis of Weissella confusa dextran in wheat sourdough[J]. Food Microbiology, 2009, 26(7): 734-743. DOI:10.1016/j.fm.2009.07.008.
[28] 刘彦. 高抗氧化荞麦面包面团发酵流变与烘焙学特性研究[D].无锡: 江南大学, 2013: 1-39.
[29] HAMMES W P, GÄNZLE M G. Sourdough breads and related products[M]. New York: Springer US, 1998.
[30] ROSS A S, MCMASTER G J, TOMLINSON J D, et al. Effect of dextrans of diあering molecular weights on the rheology of wheat flour doughs and the quality characteristics of pan and Arabic breads[J].Journal of the Science of Food & Agriculture, 1992, 60(1): 91-98.DOI:10.1002/jsfa.2740600115.
[31] ROSELL C M, SANTOS E, COLLAR C. Mixing properties of fibre-enriched wheat bread doughs: a response surface methodology study[J]. European Food Research and Technology, 2006, 223(3): 333-340. DOI:10.1007/s00217-005-0208-6.
[32] BARBER B, ORTOL C, BARBER S, et al. Storage of packed white bread III. Effects of sour dough and addition of acids on bread characteristics[J]. Zeitschrift für Lebensmittel-Untersuchung und Forschung, 1992, 194(5): 442-449.
 T5-(发酵0 h) 6.45±0.05
T5-(发酵0 h) 6.45±0.05 空白组 314±22
空白组 314±22