姜黄素是源自于姜科植物中的天然疏水性多酚,呈橙黄色结晶粉末,味稍苦,不溶于水。在食品生产中主要用于肠类制品、罐头、酱卤制品等产品的着色。医学研究表明姜黄素具有抗氧化、抗炎、抗癌、降血脂、抗肿瘤、利胆等多种生理活性作用,有较高的生物安全性[1-3],是一种较为理想的食品和药品原料。但因其耐光性、耐热性、耐铁离子性较差,此外其水溶性差、性质不稳定等多重因素使其极易发生降解[3],从而导致其生物利用率较低,难以在食品与药品的生产加工中直接应用[4-5]。如何提高姜黄素的生物利用度与稳定性,一直是食品加工业面临的一道难题。
天然生物大分子的输送系统因其安全无毒、生物相容性高及环境友好等特点已引起研究者广泛重视[6-8]。目前有关玉米醇溶蛋白[9-11]、大麦醇溶蛋白[12-14]等作为输送载体的报道较为多见。高粱醇溶蛋白与玉米醇溶蛋白在结构功能上极为相似,但有关将高粱醇溶蛋白作为输送载体的报道较少。Taylor等[15]通过将茶多酚和高粱浓缩单宁包封在高粱醇溶蛋白中,提高了多酚类物质释放的总抗氧化活性,为活性物质在消化系统的中末端的缓释提供可能。
高粱中含有6%~18%的蛋白质,包括清蛋白、球蛋白、醇溶谷蛋白和谷蛋白。醇溶蛋白占总蛋白质量分数的46.7%[16]。由于高粱蛋白的消化率低,大都利用其中的谷蛋白用于酿酒发酵,丢弃的残渣中含有大量醇溶蛋白,造成资源浪费。高粱醇溶蛋白是一种不溶于水而溶于50%~90%乙醇溶液的疏水性蛋白质,有良好的生物相容性和可降解性[16],易于制备微颗粒或纳米颗粒,可作疏水性药物或功能活性成分的理想载体。
本实验拟通过高粱醇溶蛋白作为输送系统包埋姜黄素将其制成颗粒,目的为增加姜黄素的稳定性,以延长其释放时间,提高姜黄素产品在食品和药品中的应用价值,同时为高粱醇溶蛋白的高值化利用提供理论参考。
1 材料与方法
1.1 材料与试剂
白高粱粉(含有极少酚类物质) 西安晋恒化工有限公司;姜黄素(纯度>98%,食品级),无水乙醇、氢氧化钠、盐酸、焦亚硫酸钠、二甲基亚砜(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
THZ-82恒温振荡器 常州国华电器有限公司;R-1001N旋转蒸发仪 郑州长城科工贸有限公司;SW-CJ-1F超净工作台 苏州安泰空气技术有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;S-3400N扫描电子显微镜 日本日立集团;Tensor27傅里叶变换红外光谱仪 德国Bruker公司;Zetasizer Nano ZS动态光散射粒度分析仪 英国Malvern公司。
1.3 方法
1.3.1 高粱醇溶蛋白的提取
取0.5 kg高粱粉加入2.5 kg体积分数70%的乙醇溶液,加入焦亚硫酸钠0.5%和氢氧化钠0.35%(以高粱粉质量为100%加入),搅拌均匀并加热至70 ℃。提取液中,70 ℃水浴条件下恒温振荡浸提1 h,悬浮液1 000 r/min离心5 min,去沉淀,取上清液于大烧杯中静置过夜。将少量预冷去离子水(低于10 ℃)缓慢加入提取液中,不断搅拌至提取液出现乳白色悬浮物;用1 mol/L的HCl溶液调节至pH 5左右,至絮状白色沉淀物逐渐析出,1 500 r/min离心10 min,去上清液,收集沉淀冷冻干燥。将所提粗蛋白用正己烷(1∶10,g/mL)浸泡脱脂,真空抽滤正己烷,并保持负压状态至正己烷完全挥发至净后,冷藏备用。依照GB/T 5009.5—2010《食品中蛋白质的测定》方法测定高粱醇溶蛋白含量。
1.3.2 样品的制备
1.3.2.1 高粱醇溶蛋白颗粒的自组装
参照Anastassiades等[17]的方法,略作修改。在50 ℃水浴条件下,将高粱醇溶蛋白逐渐添加至10 mL体积分数70%的乙醇溶液中搅拌溶解。将高粱醇溶蛋白终质量浓度为0.06 mg/mL的醇溶液置于自制反溶剂法颗粒制备装置(图1)中,以孔径为0.45 mm底部阀门,调节至30 滴/min的速率缓慢滴加到50 mL分散液(冷纯净水)容器中,分散液处于旋转流动状态(磁力搅拌速率1 000 r/min),高粱醇溶蛋白即可自组装成蛋白颗粒。经离心分离,去上清液,冷冻干燥即得粉末状高粱醇溶蛋白颗粒。

图1 反溶剂法制备高粱醇溶蛋白颗粒装置图
Fig. 1 Schematic of curcumin-kafirin composite microparticles prepared by anti-solvent method
1.3.2.2 姜黄素-高粱醇溶蛋白复合颗粒的自组装
以10 mL体积分数70%的乙醇溶液作为溶解高粱醇溶蛋白的溶剂,高粱醇溶蛋白质量浓度为0.06 mg/mL,50 ℃水浴中磁力搅拌至其完全溶解,以姜黄素为芯材,高粱醇溶蛋白为壁材,按芯壁比(质量比)分别为1∶5、1∶10、1∶15、1∶20、1∶25在高粱醇溶蛋白溶液中加入姜黄素,并持续恒温搅拌2~3 h,让其充分溶合,得姜黄素-高粱醇溶蛋白混合液。按照1.3.2.1节制备姜黄素-高粱醇溶蛋白复合颗粒(简称复合颗粒)。制备过程应避光,避免姜黄素见光分解。
1.3.3 复合颗粒的粒径与Zeta电位的测定
利用Xu Duoxia等[12]的方法测定粒子平均粒径,做适当改进,将高粱醇溶蛋白颗粒和复合颗粒适度稀释后,用Zetasizer Nano ZS动态光散射粒度分析仪测定,散射角90°,测定温度25 ℃,保温3 min,通过测定特定电场下粒子的运动速度和方向,测定其粒径与Zeta电位,测量3 次。
1.3.4 复合颗粒得率、包封率及负载率的测定
取冻干样品10 mg,溶于10 mL二甲基亚砜,置于黑暗环境中隔夜搅拌(500 r/min),离心(4 ℃,3 000 r/min,15 min),取上清液以二甲基亚砜稀释10 倍,用紫外分光光度计测定435 nm波长处的吸光度,同波长下测定不同浓度的姜黄素-二甲基亚砜溶液的吸光度,并绘制标准曲线(y=0.18x-0.004,R2=0.998,n=6)。由姜黄素标准曲线得样品中姜黄素含量,根据公式(1)~(3)计算复合颗粒的得率、负载率与包封率:

1.3.5 复合颗粒的微观结构形态
参照Emmambux等[18]的方法处理样品,以高粱醇溶蛋白颗粒为对照组,将干燥好的粉末状复合颗粒样品用双面导电胶带固定于载物台上,样品用真空离子溅射仪喷金,喷金条件为15.0 kV、15.0 mA处理1.5 min,将样品置于S-3400N扫描电子显微镜(加速电压10.0 kV、放大倍数11 000)下观察其微观结构形态。
1.3.6 复合颗粒傅里叶变换红外光谱分析
取0.01 g已冻干的样品颗粒与0.1 g KBr粉末于玛瑙研钵中,在红外灯照射下,研磨均匀,取适量样品置于压片槽中,经压片后进行衰减全反射傅里叶变换红外光谱分析,波数范围为400~4 000 cm-1,分辨率为4 cm-1,扫描次数为32 次。
1.3.7 复合颗粒的稳定性测定
1.3.7.1 复合颗粒光稳定性测定
参照管骁等[19]的方法,稍作修改。准确称取0.10 g的姜黄素与1.54 g复合颗粒(芯壁比1∶10),分别置于培养皿中用30 W紫外灯近距离(20 cm)照射,于0、1、2、3、4、5、6、18 h取样,分别用70%乙醇溶液溶解并定容至100 mL,取10 mL所制得的溶液,测定426 nm波长处的吸光度,测定3 次取平均值。
1.3.7.2 复合颗粒pH值稳定性测定
参照黄晓霞等[20]的方法,配制10 mmol/L磷酸盐-柠檬酸缓冲溶液,与复合颗粒乙醇溶液等体积混合,用1.0 mol/L的HCl或1.0 mol/L的NaOH溶液调节pH值分别为3、4、5、5.5、6、7,用Zetasizer Nano ZS动态光散射粒度分析仪检测其粒径和多分散性的变化。
1.3.7.3 复合颗粒储存稳定性
参照黄晓霞等[20]的方法,准确称取3.00 g复合颗粒,室内条件下放置30 d,每隔5 d取样一次,每次取样0.60 g溶于去离子水中,检测复合颗粒粒径和多分散性的变化。
1.4 数据处理
除颗粒自组装实验外,所有实验均重复3 次。采用SPSS数据处理软件,进行单因素方差分析,用Duncan多重比较进行显著性分析,显著水平P小于0.05有统计学意义,数据绘图使用Origin 9.0。
2 结果与分析
2.1 复合颗粒的芯壁比优化
2.1.1 芯壁比对复合颗粒粒径与Zeta电位的影响
粒径是衡量颗粒表征的一个重要指标,它表征着样品颗粒的直径大小;Zeta电位可以用来评价颗粒分散液的稳定性[18]。Zeta电位(或正或负)绝对值越大,说明颗粒之间的斥力越大,溶液体系稳定性越高。反之Zeta电位(或正或负)绝对值越小,即分子间的引力大于斥力,体系的分散稳定性被破坏,分子间更易于凝聚[19-20]。由表1可知,芯壁比对高粱醇溶蛋白复合颗粒的粒径与电位影响较大,分散液体系的电位均在15 mV左右,随着芯壁比的减小,Zeta电位与平均粒径呈下降趋势,这一结果与殷婷等[14]的研究结果相一致。当芯壁比1∶5变为1∶10时粒径变化最为明显,这可能是壁材质量过大时蛋白与姜黄素的结合过于饱和,致使大量姜黄素外露于颗粒表面,导致粒径过大[21-22]。当芯壁比为1∶10时,其粒径相对较小且Zeta电位绝对值最大,说明得到的样品分散液稳定性最高,样品最好。
表1 芯壁比对复合颗粒平均粒径与Zeta电位的影响
Table 1 Influence of core material to wall material ratio on average particle size and Zeta potential of curcumin-kafirin composite microparticles

注:同列字母不同表示差异显著(P<0.05)。下同。
2.1.2 芯壁比对复合颗粒的包封率与负载率的影响
表2 芯壁比对复合颗粒得率、包封率与负载率的影响
Table 2 Influence of core material to wall material ratio on yield,encapsulation efficiency and loading efficiency of curcumin-kafirin composite microparticles

复合颗粒的得率表征着原材料的利用率,包封率与负载率决定复合颗粒的应用价值。本实验中姜黄素-高粱醇溶蛋白不同芯壁比制得复合颗粒产品的得率、包封率和负载率结果如表2所示。在芯壁比在1∶10~1∶25范围内,复合颗粒随着壁材使用量的增加,其得率与包封率呈微弱的降低趋势,但整体无显著变化,得率在88%左右,包封率在65%左右;负载率呈上升趋势。Hu Kun等[22]研究壳-核复合材料输送体系中,随着壁材使用量的增大,负载率呈上升趋势;这一结论与Muthuselvi等[23]研究的玉米蛋白包埋药物吉妥辛结果相同,均与本实验研究结果具有一致性。但当芯壁比为1∶5时产品得率和包封率均有所下降,其中包封率下降较为明显。这可能是芯壁比1∶5时壁材使用量的过大,姜黄素已经处于过饱和状态,可能造成混合液的黏度增加,不利于复合颗粒的制备[24-26],使得复合颗粒的得率与包封率有下降趋势,而负载率呈上升趋势。从所得产品的得率、包封率以及负载率等因素综合考虑,认为芯壁比为1∶10时所得复合颗粒较好。
2.2 复合颗粒的微观结构

图2 高粱醇溶蛋白颗粒(A)和复合颗粒(B)的扫描电子显微镜图
Fig. 2 Scanning electron micrographs of kafirin microparticles (A) and curcumin-kafirin composite microparticles (B)
由图2可见,高粱醇溶蛋白颗粒呈规则的球状(图2A),表面较为光滑,颗粒之间没有黏连,粒径在5~10 μm之间;图2B中呈现出复合颗粒的粒径在15 μm左右,颗粒整体呈疏松多孔的形态,这与Taylor等[23]研究报道的高粱醇溶蛋白复合颗粒形态相似。这种结构形态具有面积较大的内壁褶皱,内部形成了疏松多孔的空间结构[23,27],较大的内部空间结构可为姜黄素提供较大存储空间,且在一定程度上起到了截留姜黄素的作用[28]。
2.3 复合颗粒的红外光谱分析

图3 姜黄素(A)、高粱醇溶蛋白颗粒(B)与复合颗粒(C)红外光谱图
Fig. 3 Infrared spectra of kafirin microparticles and curcumin-kafirin composite microoparticles
如图3所示,高粱醇溶蛋白的红外光谱图有几组特征吸收谱带:酰胺A峰(3 300~3 400 cm-1)、酰胺I带(1 600~1 700 cm-1)、酰胺II带(1 530~1 550 cm-1)和酰胺III(1 260~1 300 cm-1)带,其中酰胺I带的谱峰研究较为成熟。酰胺I带是由于蛋白质分子骨架肽链羰基收缩振动的红外吸收带,对蛋白的二级结构较敏感[20-21]。与对照组高粱醇溶蛋白颗粒相比,复合颗粒在1 655 cm-1及1 534 cm-1处的光谱强度及峰位均有所改变,1 655 cm-1处的波峰红移到1 563 cm-1处,同时1 539 cm-1处的波峰红移到1 530 cm-1处,复合颗粒在酰胺I带的吸收峰偏低,可能是由于高粱醇溶蛋白中的酰胺基数减少,说明侧链上的酰胺基与姜黄素的羟基间形成氢键,并作用于多位点[21]。此外,高粱醇溶蛋白的α-螺旋峰位向波数低端偏移,可推断蛋白的二级机构发生了改变[24],α-螺旋减少。酰胺II带1 534.1 cm-1处偏移到1 530.24 cm-1处可能是姜黄素与高粱醇溶蛋白之间的静电作用所致,或者由材料本身的疏水相互作用引起[22]。
酰胺I带是由蛋白质不同二级结构的谱峰叠加形成。1 650~1 660 cm-1处峰面积代表α-螺旋含量,1 600~1 640 cm-1处峰面积代表β-折叠含量,1 660~1 700 cm-1处峰面积代表β-转角含量,1 640~1 650 cm-1处峰面积代表无规则卷曲含量[23]。对样品的酰胺I带光谱进行傅里叶红外去卷曲,求二阶导数并进行高斯拟合分析得到1 600~1 700 cm-1处各二级结构的相对含量结果见表3。
表3 高粱醇溶蛋白复合颗粒与复合颗粒中蛋白质二级结构的相对含量( s,n= 3)
s,n= 3)
Table 3 Relative contents of protein secondary structures in kafirin microparticles and curcumin-kafirin composite microoparticles ± s, n = 3)%
± s, n = 3)%
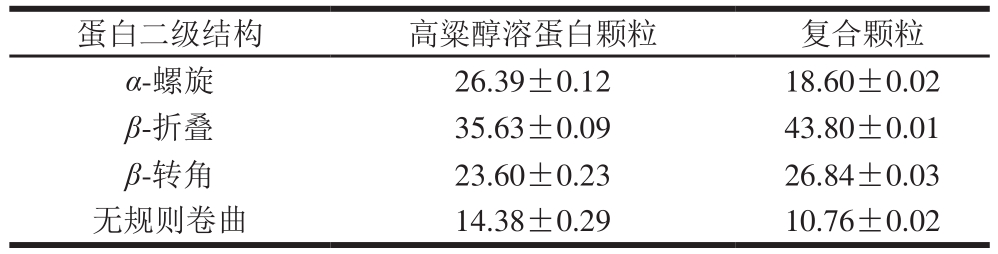
由表3可知,相比于高粱醇溶蛋白颗粒,复合颗粒样品中α-螺旋相对含量减少,β-折叠相对含量增加,这可能是由于蛋白质与多酚之间依靠氢键作用相结合,从而使α-螺旋结构解旋,使β-折叠结构增加[27-28]。另外对样品制备过程进行热处理也会促使α-螺旋结构展开形成β-折叠结构[31],这一结论也恰好验证了上述的峰位红移现象。α-螺旋结构的减少一般都伴随β-折叠结构的增加,而β-折叠结构的形成可能才是使复合颗粒稳定性增强的真正原因[29-31]。
2.4 复合颗粒的稳定性实验结果
2.4.1 复合颗粒的光稳定性
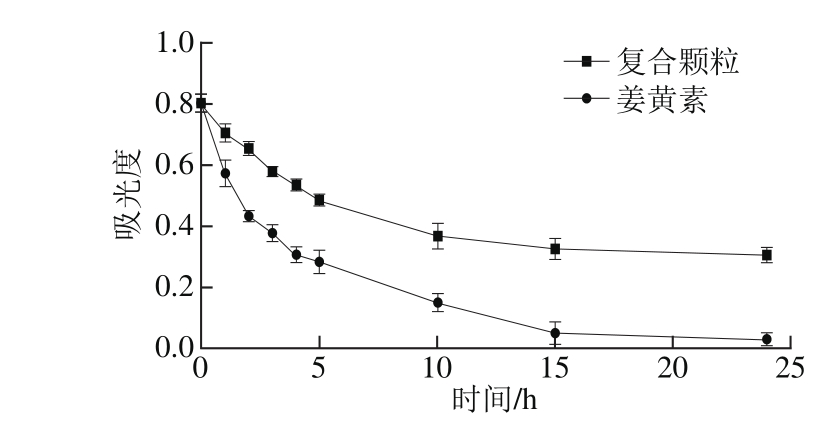
图4 姜黄素与复合颗粒光照结果分析
Fig. 4 Optical stability of free curcumin and curcumin-kafirin composite microparticles
如图4所示,紫外光的照射(照度不小于300 lx)导致姜黄素样品吸光度迅速下降,至第15小时降至0.053,随后下降速度放缓至第24小时下降至0.032;复合颗粒吸光度,紫外线照射至第5小时下降至0.485,随后下降速度放缓在第15小时和24小时,吸光度分别为0.327和0.307。经过24 h紫外照射后,姜黄素的吸光度下降95%,而复合颗粒的吸光度下降62%。由此说明复合颗粒可较快达到稳定状态且稳定性较好;24 h的紫外光照射使姜黄素光稳定性提高33%,并延长释放时间,这是因为姜黄素与高粱醇溶蛋白发生相互作用后,使醇溶蛋白在结构上对姜黄素分子起到保护作用[13],降低其对光的敏感度,从而在一定程度上提高了结合后姜黄素的光稳定性。本结果与管骁[13]、夏威[19]等研究的白藜芦醇复合颗粒的光稳定性的研究结果类似。
2.4.2 复合颗粒的pH值稳定性
高粱醇溶蛋白颗粒其本质是蛋白质,对酸碱性较敏感,因此有必要对其酸碱稳定性进行进一步研究。在不同pH值的磷酸盐-柠檬酸缓冲溶液中,加入复合颗粒,混匀1 h后检测其粒径和多分散性系数(polydispersity index,PDI)的变化如表4所示。pH值范围在5~6弱酸条件下,其平均粒径都相对较大,在中性或碱性条件下其粒径都较小,且实验过程中复合颗粒分体系在弱酸条件下肉眼可看到较大颗粒不断聚集沉降;而中性或者碱性条件下复合颗粒分散体系较为澄清。这是因为高粱醇溶蛋白的等电点在pH 5.3左右,在弱酸条件下,蛋白质之间的静电斥力作用较弱,颗粒因疏水相互作用而聚集[19],颗粒的粒径达到23 μm左右,PDI也达到较大值。而碱性或中性条件下,蛋白质比较稳定,不易聚集,且颗粒的粒径与PDI也都呈下降趋势[13,20]。因此,pH值在5~6时,颗粒易聚集且粒径较大,稳定性差。
表4 pH值对于姜黄素-高粱醇溶蛋白纳米复合颗粒平均粒径与PDI的影响
Table 4 Influence of pH value on average particle size and PDI of curcumin-kafirin composite microparticles

2.4.3 复合颗粒的储藏稳定性
表5 储藏时间对于复合颗粒平均粒径与PDI的影响
Table 5 Influence of storage time on average particle size and PDI of curcumin-kafirin composite microparticles

在食品的加工储藏过程中,延缓产品的腐败变质,对提高产品的货架期有重要意义。有必要对高粱醇溶蛋白复合颗粒进行进一步稳定性研究。如表5所示,室温条件下,通过对复合颗粒为期30 d的周期测定,复合颗粒的粒径大小略有增加,但整体变化不明显,其PDI也在增加,这说明复合颗粒的粒径分布更加集中[19]。因此,复合颗粒具有较好的储藏稳定性。
3 结 论
本实验采用反溶剂法制备复合颗粒,确定最佳芯壁比为1∶10,颗粒平均粒径为13.17 μm,电位为19.38 mV,得率为87.51%,包封率为62.61 %,负载率为6.51%。最佳条件下得的复合颗粒大小均一,表面多微孔结构;红外光谱结果显示,相较于高粱醇溶蛋白颗粒,复合颗粒中部分波峰均发生红移,α-螺旋含量减少,β-折叠含量增加,说明姜黄素分子与蛋白质分子间有较强的氢键、静电以及疏水相互作用。此外,复合颗粒姜黄素的紫外光稳定性提高了33%;30 d储藏期复合颗粒的粒径和PDI均无明显变化;但pH值在5~6时,复合颗粒易聚集。综上,用高粱醇溶蛋白对姜黄素进行包埋处理不仅可以增强其自身的抗氧化活性,有效地提高复合颗粒的稳定性,同时可以有效地改善姜黄素与高粱醇溶蛋白的生物利用度。本研究结果可为姜黄素和高粱醇溶蛋白的高值化利用提供理论依据。
参考文献:
[1] ANAND P, THOMAS S A, SUNDRARAM C, et al. Biological activities of curcumin and its analogues (Congeners) made by man and Mother Nature[J]. Biochemical Pharmacology, 2008, 76(11): 1590-1611. DOI:10.1016/j.bcp.2008.08.008.
[2] DUVOIX A, BLASIUS R, DELHALLE S, et al. Chemopreventive and therapeutic effects of curcumin[J]. Cancer Letters, 2005, 223(2):181-190. DOI:10.1016/j.canlet.2004.09.041.
[3] SINGH D K, JAGANNATHAN R, KHANDELWAL P, et al. In situ synthesis and surface functionalization of gold nanoparticles with curcum in and their antioxidant properties: an experimental and density functional theory investigation[J]. Nanoscale, 2013, 5(5): 1882-1893.DOI:10.1039/c2nr33776b.
[4] ANAND P, KUNNUMAKKARA A B, NEWMAN R A, et al.Bioavailability of curcum in problems and promises[J]. Molecular Pharmaceutics, 2007, 4(6): 807-818. DOI:10.1021/mp700113r.
[5] SUN J, BI C, CHAN H M, et al. Curcumin-loaded solid lipid nanoparticles have prolonged in vitro antitum our activity, cellular uptake and improved in vivo bioavailability[J]. Colloids and Surfaces B, 2013, 111C(6): 367-375. DOI:10.1016/j.colsurfb.2013.06.032.
[6] 印成霞. 纳米技术在药物制剂中的应用研究分析[J]. 中国医药指南,2013(23): 362-363. DOI:10.15912/j.cnki.gocm.2013.23.62.
[7] 高洁, 连潇嫣, 魏振平, 等. 纳米技术在药物制剂研究中的应用[J].化学工业与工程, 2012, 29(5): 64-69.
[8] WANG H, ZHANG C, ZHANG L H. Synthesis of nanoparticles of star-shaped mannitol-core PLA-TPGS copolymer for delivery of paclitaxel and activity of anti-prostate cancer[J]. Chinese Universities,2014, 35(10): 2239-2245. DOI:10.7503/cjcu20140504.
[9] LIU G J, WANG H D, JIANG Y B. Research progress of zein as carrier for drug delivery systems[J]. CIESC Journal, 2013, 64(10):3493-3504. DOI:10.3969/j.issn.0438-1157.2013.10.002.
[10] LIU X M, SUN Q S, WANG H J, et al. Microspheres of cornprotein,zein, for an ivermectin drug delivery system[J]. Biomaterials, 2005,26(1): 109-115. DOI:10.1016/j.biomaterials.2004.02.013.
[11] PATEL A, HU Y, TIWARI J K, et al. Synthesis and characterisation of zein-curcumin colloidal particles[J]. Soft Matter, 2010, 6(24): 6192-6199. DOI:10.1039/C0SM00800A.
[12] XU D X, AIHEMAITI Z, CAO Y P, et al. Physicochemical stability,microrheological properties and microstructure lutein emulsion stabilized by multilayer membranes consisting of whey protein isolate,flaxseed gum and chitosan[J]. Food Chemistry, 2016, 202: 156-164.
[13] 管骁, 殷婷, 韩飞. 白藜芦醇-大麦醇溶蛋白复合颗粒的光稳定性、缓释行为及抗氧化能力[J]. 高等学校化学学报, 2015, 36(9): 1707-1712. DOI:10.7503/cjcu20150115.
[14] 殷婷, 管骁. 大麦醇溶蛋白负载白藜芦醇自组装纳米颗粒及其性质研究[J]. 分析测试学报, 2015, 34(1): 67-72. DOI:10.3969/j.issn.1004-4957.2015.01.010.
[15] TALOR J, TALOR J R N, BELTON P S, et al. Kafirin microparticle encapsulation of catechin and sorghum condensed tannins[J].Journal of Agricultural & Food Chemistry, 2009, 57(16): 7523-7528.DOI:10.1021/jf 901592q.
[16] 张伟敏, 谭小蓉, 钟耕. 高粱蛋白质研究进展[J]. 粮食与油脂,2005(1): 7-9. DOI:10.3969/j.issn.1008-9578.2005.01.002.
[17] ANASTASSIADES M, LEHOTAY S J, STAJINBAHER D, et al.Fast easy multiresidue method employing acetonitrile extraction/partitioning, “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International,2003, 86(2): 412-431.
[18] EMMAMBUX N M, TAYLOR R. Sorghum kafirin interaction with various phenolic compounds[J]. Journal of the Science of Food &Agriculture, 2003, 83(5): 402-407. DOI:10.1002/jsfa.1379.
[19] 夏威. 白藜芦醇苷分子包合物的制备及其性能研究[D]. 保定: 河北农业大学, 2012. DOI:10.7666/d.y2143165.
[20] 黄晓霞, 黄旭琳, 胡坤. 负载姜黄素的玉米醇溶蛋白-果胶纳米颗粒制备及抗氧化活性研究[J]. 广东农业科学, 2015, 42(18): 88-92.DOI:10.16768/j.issn.1004-874x.2015.18.009.
[21] 黄旭琳, 黄晓霞, 钟南京, 等. 负载姜黄素的玉米醇溶蛋白-多糖纳米颗粒制备及生物活性研究[J]. 广东药学院学报, 2016, 32(5): 545-549. DOI:10.16809/j.cnki.1006-8783.2016062103.
[22] HU K, HUANG X X, GAO Y Q, et al. Core-shell biopolymer nanoparticle delivery systems: synthesis and characterization of curcumin fortified zein-pectin nanoparticles[J]. Food Chemistry, 2015,182: 275-281. DOI:10.1016/j.foodchem.2015.03.009.
[23] MUTHUSELVI L, DHATHATHREYAN A. Simple coacervates of zein to encapsulate Gitoxin[J]. Colloids & Surfaces B Biointerfaces,2006, 51(1): 39-43. DOI:10.1016/j.colsurfb.2006.05.012.
[24] LUO Y, WANG Q. Zein-based micro- and nano-particles for drug and nutrient delivery[J]. Journal of Applied Polymer Science, 2014,131(16): 1-12. DOI:10.1002/app.40696.
[25] 王思琦, 李律. 阿魏酸-大麦醇溶蛋白复合纳米粒子的制备及其性质的研究[J]. 食品与发酵科技, 2016, 52(3): 11-14. DOI:10.3969/j.issn.1674-506X.2016.03-003.
[26] WANG Y, PADUA G W. Formation of zein spheres by evaporationinduced self-assembly[J]. Colloid and Polymer Science, 2012, 290(15):1593-1598. DOI:10.1007/s00396-012-2749-0.
[27] AYLOR J, AYLOR J R N, BELTON P S, et al. Formation of kafirin microparticles by phase separation from an organic acid and their characterisation[J]. Journal of Cereal Science, 2009, 50(1): 99-105.
[28] CHEN J J, ZHENG J K, MCCLEMENTS D J, et al. Tangeretin-loaded protein nanoparticles fabricated fromzein/β-lactoglobulin: preparation,characterization, and functional performance[J]. Food Chemistry,2014, 158: 466-472. DOI:10.1016/j.foodchem.2014.03.003.
[29] WANG Y, PADUA G W. Nanoscale characterization of zein selfassembly[J]. Langmuir, 2012, 28(5): 2429-2435. DOI:10.1021/la204204j.[30] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011, 127(3):1046-1055. DOI:10.1016/j.foodchem.2011.01.079.
[31] HASNI I, BOURASSA P, HAMDANIS, et al. Interaction of milk α- and β-caseins with tea polyphenols[J]. Food Chemistry, 2011,126(65): 630-639. DOI:10.1016/j.food chem.2010.11.087.
 1∶5 82.86±0.19
1∶5 82.86±0.19 α-螺旋 26.39±0.12 18.60±0.02 β-折叠 35.63±0.09 43.80±0.01 β-转角 23.60±0.23 26.84±0.03无规则卷曲 14.38±0.29 10.76±0.02
α-螺旋 26.39±0.12 18.60±0.02 β-折叠 35.63±0.09 43.80±0.01 β-转角 23.60±0.23 26.84±0.03无规则卷曲 14.38±0.29 10.76±0.02 310.17±0.12
310.17±0.12 013.17±0.12
013.17±0.12