大豆蛋白是目前研究报道中唯一含有9 种必需氨基酸且含量满足人体需求的植物蛋白,是一种公认的全价蛋白质[1-2],由于其具有丰富的营养价值与优良的功能特性,大豆分离蛋白被广泛地应用于乳化剂、起泡剂等不同食品加工领域中。为拓宽其应用前景与开发价值,大豆分离蛋白的天然改性目前已经成为学者们的研究热点[3-4]。花青素作为一种黄酮类植物色素,由于其具有抗氧化、抗炎等多种性质,有助于预防心脑血管疾病和神经系统问题等疾病[5-6]。由于花青素是一种天然小分子活性化合物,可以将其引入蛋白质中发生相互作用,形成具有重要功能性质的复合体系,进而影响蛋白物化功能[7]。事实上,在食品加工、生产等环节中,蛋白质等生物大分子都不可避免的受到来自这类小分子物质的影响。蛋白可与多酚发生相互作用,其结合方式主要为共价/非共价结合。非共价作用主要包括疏水相互作用,范德华力和氢键等这些相对较弱的作用类型[8-9]。酚类物质与蛋白之间的共价作用主要是在碱性条件下,通过酚类化合物的氧化形成相应的醌类[10],这种醌类会进一步与蛋白质链中的氨基酸残基反应[11]。目前已有文献对多酚类物质与蛋白质相互作用体系进行了部分研究,但未能清晰地解释复合体系结构及功能性质之间的变化规律。多酚与蛋白质的非共价作用有助于不同的生物活性,并改变蛋白的界面性质与起泡稳定性[12-13]。Jia Zhenbao等[14]研究发现乳清蛋白可以在碱性条件下与儿茶素共价交联,酚类基团可以引起蛋白二级及三级结构的变化,并改善蛋白起泡和乳化性能。张冬[15]探究了矢车菊素-3-葡萄糖苷与牛血清白蛋白相互作用的机制,研究发现这种类黄酮物质易被蛋白“绑定”,从而提高植物蛋白的生理活性。茶多酚与大豆分离蛋白之间较强的相互作用会引起大豆分离蛋白构象发生改变[16]。然而,针对大豆蛋白与花青素相互作用对其功能特性的影响尚不清楚。
因此,本实验主要研究对比花青素与大豆分离蛋白经非共价结合/共价交联机制对其复合体系功能特性的影响,从而最大限度地发挥复合体系中大豆分离蛋白的功能特性。本实验采用2 种作用条件使大豆分离蛋白与花青素复合对起泡及乳化特性进行对比分析,对大豆蛋白在食品领域中的应用具有重要的指导意义。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白由实验室自制;葵花油 市购;花青素黑米提取物 山西太极唐代科技有限公司;大豆哈尔滨高科技有限公司;盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠(均为分析纯) 北京新光化工试剂厂;正己烷(分析纯) 天津北科化学品有限责任公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
AL204型分析天平 梅勒特-托利多仪器有限公司;F-4500荧光分光光度计 日本Hitachi公司;JJ-1增力电动搅拌器 江苏金城国胜仪器厂;Allegra64R台式高速冷冻离心机 美国贝克曼公司;BX41正置显微镜 日本奥林巴斯公司;E2695高效液相色谱 沃特世科技(上海)有限公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
参考Speroni等[17]的制备方法。将脱脂豆粕分散在去离子水中(1∶10,m/m),用2 mol/L NaOH溶液调节至pH 8,经搅拌2 h后,将悬浮液9 500×g离心30 min,取其上清液用2 mol/L盐酸溶液调节pH值至4.5得到蛋白沉淀物,将蛋白沉淀物水洗3 次后,经6 500×g离心30 min,用2 mol/L NaOH溶液调节至蛋白溶液中性即可,将此蛋白溶液冻干并研磨,即可获得大豆分离蛋白。
1.3.2 花青素的纯化与定量
根据Sui Xiaonan等[18]的方法进行花青素的纯化。首先将黑米提取物溶解在蒸馏水中,抽滤除去溶液中的不溶性杂质。随后将溶液通过固相萃取使花青素溶液被完全吸附,分别用2 个柱体积酸化水和2 个柱体积的乙酸乙酯去除糖、酸和多酚类化合物(如酚酸和黄酮),然后用酸化的甲醇洗脱吸附柱从而获得花青素溶液。经旋转蒸发器除去溶液中的甲醇,即可得到纯化的花青素提取物。利用高效液相色谱法测定花青素的含量[19],将纯化的花青素提取物过0.45 μm滤膜使用C18分析柱(250 mm×4.6 mm,5 μm)进行高效液相色谱分析,流量为1 mL/min,温度为25 ℃,梯度洗脱程序参考Sadilova等[20]的方法测定花青素质量分数为25%(为方便计算,本实验统一使用黑米中含量较多的矢车菊素-3-葡萄糖苷相对分子质量为花青素的相对分子质量近似处理)。
1.3.3 样品的配制
参考Nagy等[9]的方法稍作修改,将大豆分离蛋白粉末完全溶解于磷酸盐缓冲液中(10 μm,pH 7.4)配制成质量浓度为10 mg/mL的大豆分离蛋白溶液,将花青素质量浓度(0.5、1、2 mg/mL)按比例分别溶于蛋白溶液在室温条件下混合绝氧搅拌2 h,由此可得大豆分离蛋白-花青素非共价结合复合物。参考Kroll等[21]的方法稍作修改,将大豆分离蛋白粉末完全溶解于磷酸盐缓冲液中(10 μm,pH 7.4)配制成质量浓度为10 mg/mL的大豆分离蛋白溶液,用0.5 mol/L的NaOH溶液调节pH值至9.0,将花青素质量浓度(0.5、1、2 mg/mL)按比例分别溶于蛋白溶液在室温条件下混合搅拌24 h,由此可得大豆分离蛋白-花青素共价交联复合物。其中,未经处理的大豆分离蛋白溶液作为空白对照,各样品处理条件见表1。
表1 花青素与大豆分离蛋白复合物
Table 1 SPI and anthocyanin complexes

1.3.4 起泡性及起泡稳定性
参照Aewsiri等[22]的方法测定起泡性能并稍作修改。样品依次用高速均质机以17 500 r/min连续均质3 次,每次30 s,将泡沫迅速转入量筒中记录初始泡沫体积,在室温条件下静止10、20、30 min后记录其泡沫体积。其中所有实验平均测量3 次。其起泡特性和起泡稳定性按公式(1)、(2)计算:
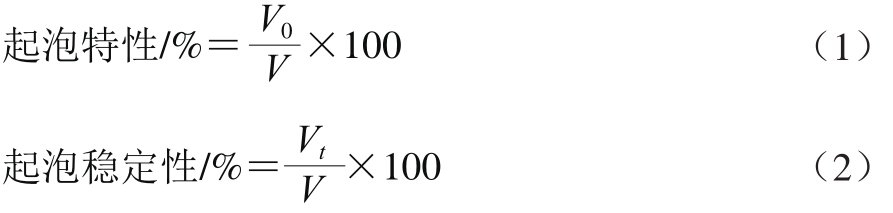
式中:V为均质前溶液体积/mL;V0为均质后初始泡沫体积/mL;Vt为静止10、20、30 min后泡沫体积/mL。
1.3.5 乳化性及乳化稳定性
参考Pearce等[23]的方法稍作修改。将上述样品溶液用磷酸盐缓冲液稀释(10 mmol/L,pH 7.0)至蛋白质量浓度为1 mg/mL,将稀释的样品以3∶1(V/V)溶解于葵花油中,使用高剪切均质机以10 000 r/min均质1 min形成乳状液,立即从其乳状液底部提取50 μL的乳液分散于0.1%的十二烷基硫酸钠溶液稀释至100 倍。经旋涡振荡后用分光光度法在波长500 nm处测定样品的吸光度A500nm,用相同浓度十二烷基硫酸钠溶液作为空白对照。经10 min后再次测量其吸光度。其中所有实验平均测量3 次。
乳化特性和乳化稳定性按公式(3)和(4)计算:

式中:DF为稀释倍数(100);θ为油相体积分数(1/4);L为比色杯厚度(1 cm);C为乳化液形成前蛋白质溶液中蛋白质质量浓度(10 g/mL);A0、A10为乳状液在0、10 min的吸光度;T10-T0=10 min。
1.3.6 正置显微镜观察
样品乳液制备后,用胶头滴管吸取一滴新鲜复合乳液样品,置于显微镜载物台上,将载玻片用乙醇浸泡后固定样品,在100 倍正置光学显微镜下进行观察,用CCD照相机截取图像,利用电脑数字图像软件处理图片。
1.3.7 巯基含量的测量
根据Ellman等[24]的方法稍做改动。在0.5 mL的样品溶液中加入2.5 mL含有8 mol/L尿素的Tris-甘氨酸缓冲液和0.02 mL含有1% 5,5’-二硫双-2-硝基苯甲酸的Tris-甘氨酸缓冲液,将其置于40 ℃水浴中保温25 min。利用双光束分光光度计在波长412 nm处测定吸光度。Tris-甘氨酸缓冲液作为空白对照。参考文献[25]计算巯基含量。
1.3.8 三维荧光光谱分析
大豆分离蛋白与花青素之间的相互作用利用三维荧光光谱测定,参照Zhang Yezhong等[26]的方法,将样品分别稀释50 倍,使蛋白质量浓度为0.2 mg/mL,取稀释样品分别置于石英比色皿中测定。其中,三维荧光光谱的连续扫描记录发射波长(λEm)为200~500 nm,起始激发波长(λEx)为200 nm,增长间隔为10 nm,扫描16 条曲线。
1.4 数据统计及分析
实验中每组数据重复3 次,利用Origin 8.0软件处理数据作图。利用SPSS V17.0软件进行ANOVA差异显著性分析及相关性分析,其中P值小于0.05为显著性差异。
2 结果与分析
2.1 起泡特性与起泡稳定性
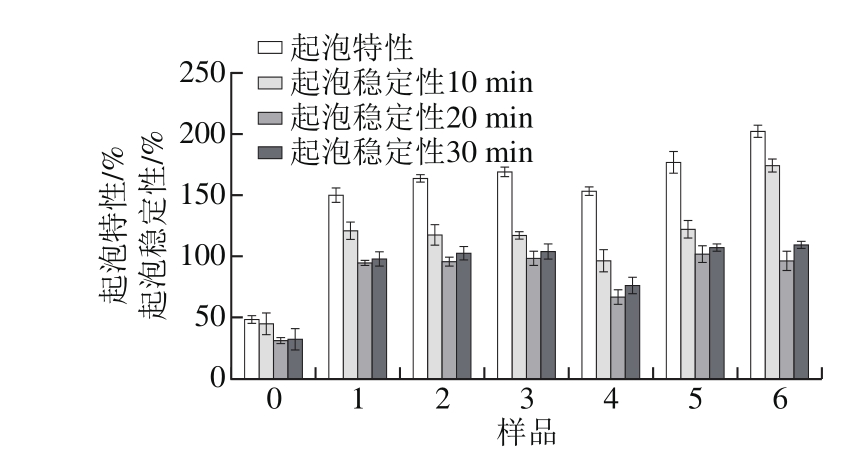
图1 花青素与大豆分离蛋白结合对蛋白起泡特性与起泡稳定性的影响
Fig. 1 Effects of anthocyanin binding to SPI on its foam expansion and foam stability
蛋白质溶液经快速打搅使大量气体进入溶液中,降低其表面张力后形成泡沫的能力称作蛋白的起泡性[27]。如图1所示,花青素的加入,对其起泡性和起泡稳定性都发生了显著的影响。未加入花青素的蛋白溶液其起泡特性和起泡稳定性较低,在非共价结合(pH 7.4、2 h)和共价交联(pH 9.0、24 h)处理条件下,随着花青素质量浓度的增大,复合液中蛋白的起泡特性和起泡稳定性均表现出一定程度的升高。该结果与Odríguez等[13]的研究结果类似,蛋白-多酚复合物可以表现出更高的固有黏度由此有效地降低排水速度,产生更稳定的泡沫。多酚类物质的加入降低了蛋白界面的表面压力,使得蛋白结构展开,并且与蛋白发生相互作用,使得界面薄膜变得更加稳定[27]。此外,样品6的起泡特性比样品3提高了16.52%,这可能是由于共价交联结构可以有效地提高蛋白在气/液表面的展开,形成更多泡沫网络结构并提高界面弹性,通过抑制蛋白聚集和歧化增强了泡沫的形成[28-29]。蛋白质分子颗粒的大小是影响起泡特性的关键因素之一,适当分子质量的可溶性聚合物有助于改善起泡特性[14]。
2.2 乳化特性与乳化稳定性
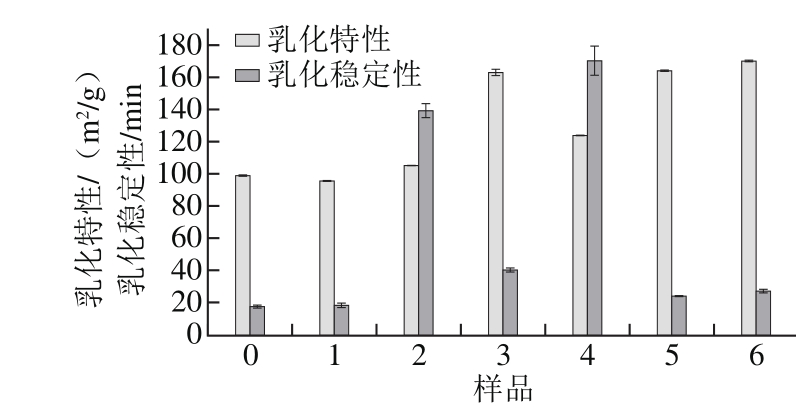
图2 花青素与大豆分离蛋白结合对蛋白乳化特性及乳化稳定性的影响
Fig. 2 Effects of anthocyanin binding to SPI on its emulsifying properties and emulsion stability
大豆分离蛋白的乳化特性是最重要的功能性质之一,主要包括乳化活性和乳化稳定性。乳化活性指蛋白质-花青素复合物在形成油水界面上促进形成稳定界面的能力,乳化稳定性是指蛋白质-花青素复合物乳状液维持形成小液滴的抗应变能力,可分别用乳化特性和乳化稳定性表达其测定结果[30]。如图2所示,与未经处理的蛋白溶液相比,在非共价结合(pH 7.4、2 h)和共价交联(pH 9.0,24 h)处理条件下,复合液的乳化特性明显逐步升高,其中,样品6的乳化特性相比于空白组增大了71.94 %,样品3的乳化特性相比于空白组增大64.93%,表明由于花青素的加入提升了溶液的乳化活性。这与胡思等[31]的研究结果一致,适量茶多酚的添加可增强小麦面筋蛋白在O/W界面上的牢固性,形成较稳定的界面膜。部分活化的多酚羟基与蛋白质残基结合从而提高了蛋白的乳化能力。并且在碱性条件下酚类小分子的出现,可以减少油相和水相之间的界面张力[14]。以上结果表明花青素可能改变了蛋白质表面性质,并且不可逆的共价结合更有助于多酚类物质对蛋白质的绑定,由此导致了相应乳化特性的提高。此外,花青素的加入使得乳化稳定性指数在不同程度上有所增加,这显示了花青素-蛋白复合物比空白样具有更好的乳化稳定性。多酚的加入会掩盖部分蛋白的解折叠,限制了蛋白质的运动,提高乳液稳定性并延长贮藏时间[32]。
2.3 复合物乳液光学显微镜结构观察结果
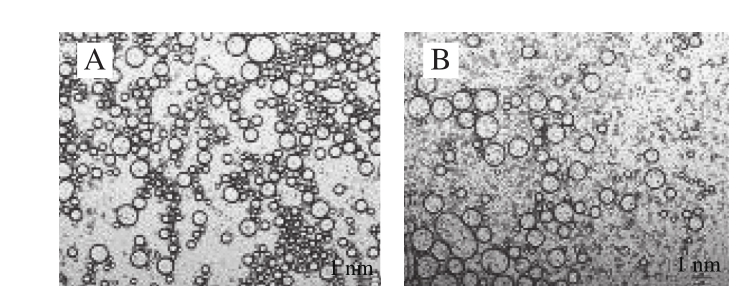
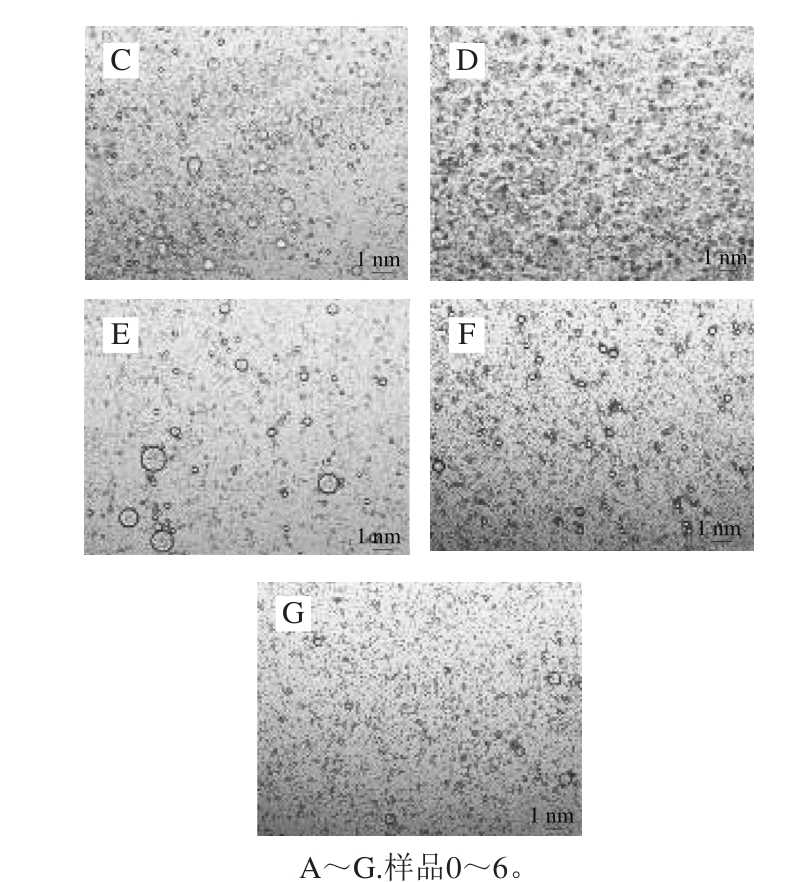
图3 复合物乳液光学显微镜结构图
Fig. 3 Microstructure of composite emulsions
如图3所示,未加入花青素的蛋白乳液体系中乳滴大小分布不均,图3中有部分乳滴发生聚集,这可能是在该条件下蛋白质在水相溶液中乳滴较大,极易产生不溶性聚集体。样品1、2、4乳液体系中乳滴形状相比于空白蛋白乳液体系有所减小,但仍有部分不均一的乳滴存在。样品3乳液体系中乳滴较为均一,但部分乳状液未被油脂包裹分散在外。样品5、6乳液体系中乳滴大小分散均匀且均一,油脂包裹乳液情况良好,乳液稳定。花青素的加入使得复合物中蛋白乳滴粒径减小,分布均匀,显示出了较好的乳化能力,有助于提高乳液的稳定性[33]。复合乳液体系微观结构的改变与乳化活性和稳定性的结果一致。
2.4 巯基含量的分析
表2 花青素与大豆分离蛋白结合对蛋白巯基含量的影响
Table 2 Effect of anthocyanin binding to SPI on its sulfhydryl content
巯基作为蛋白质中的重要功能基团之一,具有较高的生物活性,对蛋白质在面筋、凝胶的形成中起着重要的作用[34]。由表2可知,蛋白质中巯基含量经2 种相互作用随着花青素含量的增加而有所改变。与未加入花青素的蛋白相比,花青素的引入降低了大豆分离蛋白中的巯基含量,花青素作为水溶性物质含有大量的羟基基团,蛋白中的巯基基团可以与花青素中的羟基相结合,改变蛋白的化学结构[35]。并且在所有样品中,样品4~6复合物中的巯基含量下降尤为明显。随着花青素的加入,巯基基团含量不断下降,这可能是由于部分巯基被氧化成二硫键或是二硫键相互转换。此外,花青素与蛋白在碱性处理条件下产生的醌类物质也可直接与巯基发生相互作用形成C—S共价键,从而极大的降低了巯基在蛋白中的含量[36]。
2.5 三维荧光光谱分析
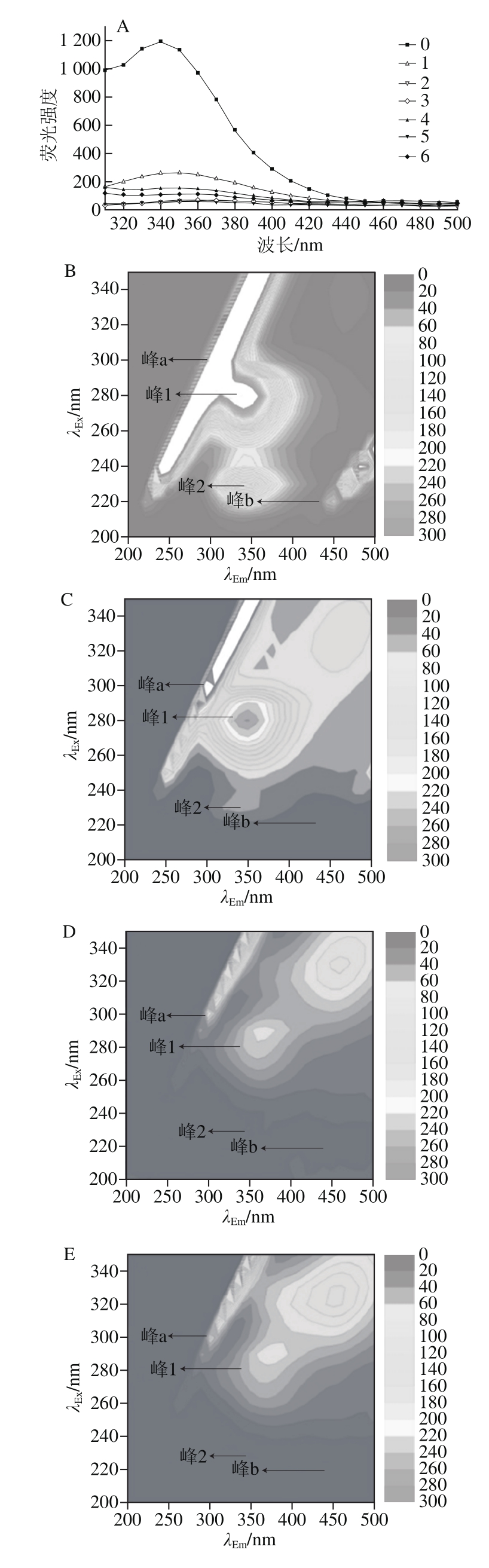

图4 花青素与大豆分离蛋白结合对蛋白影响的三维荧光光谱分析图
Fig. 4 Three dimensional fluorescence spectral analysis of the effect of anthocyanin binding to SPI on protein structure
三维荧光光谱可以通过表达蛋白的荧光信息,从而对蛋白质的结构进行研究[37]。峰a(λEx=λEm)为瑞利散射峰,峰b(λEm=2λEx)是二阶散射峰[38]。由图4可知,在λEx=280 nm,λEm=340 nm处主要是蛋白质中色氨酸(Trp)和酪氨酸(Tyr)残基的特征峰(峰1)[39]。加入花青素后特征峰处的颜色变浅,等高线逐渐稀疏,与未加入花青素的蛋白溶液相比,样品1的峰1处荧光强度降低了78.51%,样品4在此处的荧光强度降低了87.43%。这表示大豆分离蛋白荧光强度随着花青素的加入逐渐降低。该结果表明大豆分离蛋白和花青素之间具有较强的结合能力。表明蛋白质与花青素之间的相互作用在不断增强,蛋白质中部分Trp和Tyr残基的疏水基团被掩埋在花青素-花青素复合物的疏水区域中。此外,样品4~6中复合物对大豆分离蛋白的猝灭能力比样品1~3表现的更强,该结果表明花青素经碱性氧化生产的醌类物质与部分氨基酸残基结合,导致了大豆分离蛋白与花青素发生了额外的共价交联作用。此外,峰2(λEx=230 nm,λEm=350 nm),它主要代表了多肽链骨架结构的特征峰[39]。在添加花青素后复合物中该区域的面积逐渐减小,表明该复合物使得蛋白质多肽链解折叠随之结构发生改变。以上2 个特征峰荧光强度的降低表明多酚类物质与蛋白质的相互作用可以诱导蛋白质多肽链的轻微解折叠[26]。
3 结 论
采用共价及非共价处理手段探究其对大豆分离蛋白与花青素相互作用及复合物功能性质的影响。采用起泡特性及起泡稳定性、乳化特性及乳化稳定性分析方法,从宏观上测定蛋白质-花青素复合体系的功能性质,通过光学显微镜的观察微观分析复合乳化体系的结构,巯基含量的测定和三维荧光光谱分析对解析复合体系结构提供了重要的指导信息。
研究得出以下结论:花青素的加入能够改善大豆分离蛋白复合体系的乳化特性与起泡特性等功能性质,且大豆分离蛋白部分功能特性在共价处理条件下的提高程度高于非共价处理条件。复合乳液乳滴大小分散均匀,油脂包裹乳液情况有所改善,乳液均一稳定,提高了乳液的乳化稳定性。结果表明花青素的加入改变蛋白界面特性,使界面薄膜变得更加稳定。
蛋白质巯基基团结果表明,复合物中巯基含量经非共价/共价作用影响随着花青素质量浓度的增加而提高,并且在共价作用下产生的醌类物质极大降低了巯基在蛋白中的巯基含量。
随着花青素质量浓度的增加,复合物溶液的荧光强度明显降低。结果表明蛋白质与花青素之间的相互作用在不断增强,使得发色基团被不断猝灭,蛋白质多肽链解折叠随之结构发生改变。
以上结果表示多酚类物质对植物蛋白的起泡及乳化特性有不可忽视的影响。对于植物蛋白改性与深加工都有重要意义。参考文献:
[1] LEI M, BIN L, FENXIA H, et al. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk[J]. Food Chemistry, 2015, 173: 694-701. DOI:10.1016/j.foodchem.2014.10.096.
[2] 毕爽, 李杨, 隋晓楠, 等. 高压均质对大豆蛋白-磷脂复合体系结构及理化/功能性质的影响[J]. 食品科学, 2017, 38(5): 148-153.DOI:10.7506/spkx1002-6630-201705024.
[3] 王中江, 江连洲, 魏冬旭, 等. pH值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51.
[4] KATO A, OSAKA Y, MATSUDOMI N, et al. Changes in the emulsifying and foaming properties of proteins during heat denaturation[J]. Agricultural and Biological Chemistry, 1983, 47: 33-37. DOI:10.1271/bbb1961.47.33.
[5] KONCZAK I, ZHANG W. Anthocyanins-more than nature’s colours[J]. Journal of Biomedicine and Biotechnology, 2004, 5:239-240. DOI:10.1155/S1110724304407013.
[6] CHEN P N, CHU S C, CHIOU H L, et al. Mulberry anthocyanins,cyanidin 3-rutinoside and cyanidin 3-glucoside, exhibited an inhibitory effect on the migration and invasion of a human lung cancer cell line[J]. Cancer Letters, 2006, 235(2): 248-259. DOI:10.1016/j.canlet.2005.04.033.
[7] 刘夫国, 马翠翠, 王迪, 等. 蛋白质与多酚相互作用研究进展[J].食品与发酵工业, 2016, 42(2): 282-288. DOI:10.13995/j.cnki.11-1802/ts.201602048.
[8] JAKOBEK L. Interactions of polyphenols with carbohydrates, lipids and proteins[J]. Food Chemistry, 2015, 175: 556-567. DOI:10.1016/j.foodchem.2014.12.013.
[9] NAGY K, COURTET-COMPONDU M C, WILLIAMSON G, et al.Non-covalent binding of proteins to polyphenols correlates with their amino acid sequence[J]. Food Chemistry, 2012, 132(3): 1333-1339.DOI:10.1016/j.foodchem.2011.11.113.
[10] FRAZIER R A, DEAVILLE E R, GREEN R J, et al. Interactions of tea tannins and condensed tannins with proteins[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(2): 490-495.DOI:10.1016/j.jpba.2009.05.035.
[11] ALI M, HOMANN T, KREISEL J, et al. Characterization and modeling of the interactions between coffee storage proteins and phenolic compounds[J]. Journal of Agricultural and Food Chemistry,2012, 60(46): 11601-11608. DOI:10.1021/jf303372a.
[12] VESIC J, STAMBOLIC I, APOSTOLOVIC D, et al. Complexes of green tea polyphenol, epigalocatechin-3-gallate, and 2S albumins of peanut[J]. Food Chemistry, 2015, 185: 309-317. DOI:10.1016/j.foodchem.2015.04.001.
[13] RODRÍGUEZ S D, VON STASZEWSKI M, PILOSOF A M R.Green tea polyphenols-whey proteins nanoparticles: bulk, interfacial and foaming behavior[J]. Food Hydrocolloids, 2015, 50: 108-115.DOI:10.1016/j.foodhyd.2015.04.015.
[14] JIA Z B, ZHENG M, TAO F, et al. Effect of covalent modification by (−)-epigallocatechin-3-gallate on physicochemical and functional properties of whey protein isolate[J]. LWT-Food Science and Technology, 2016, 66: 305-310. DOI:10.1016/j.lwt.2015.10.054.
[15] 张冬. 花色苷与蛋白质作用对抗氧化性的影响[D]. 济南: 山东师范大学, 2013.
[16] 刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J]. 食品科学, 2015, 36(17): 43-47. DOI:10.7506/spkx1002-6630-201517009.
[17] SPERONI F, AÑÓN M C, DE LAMBALLERIE M. Effects of calcium and high pressure on soybean proteins: a calorimetric study[J].Food Research International, 2010, 43(5): 1347-1355. DOI:10.1016/j.foodres.2010.03.022.
[18] SUI X N, ZHOU W B. Monte carlo modelling of non-isothermal degradation of two cyanidin-based anthocyanins in aqueous system at high temperatures and its impact on antioxidant capacities[J]. Food Chemistry, 2014, 148: 342-350. DOI:10.1016/j.foodchem.2013.10.060.
[19] SUI X, DONG X, ZHOU W. Combined effect of pH and high temperature on the stability and antioxidant capacity of two anthocyanins in aqueous solution[J]. Food Chemistry, 2014, 163: 163-170. DOI:10.1016/j.foodchem.2014.04.075.
[20] SADILOVA E, STINTZING F C, CARLE R. Thermal degradation of acylated and nonacylated anthocyanins[J]. Journal of Food Science,2006, 71(8): C504-C512. DOI:10.1111/j.1750-3841.2006.00148.x.
[21] KROLL J, RAWEL H M, SASCHA R. Reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds[J]. Food Science and Technology Research, 2003,9(3): 205-218. DOI:10.3136/fstr.9.205.
[22] AEWSIRI T, BENJAKUL S, VISESSANGUAN W. Functional properties of gelatin from cuttlefish (Sepia pharaonis) skin as affected by bleaching using hydrogen peroxide[J]. Food Chemistry, 2009,115(1): 243-249. DOI:10.1016/j.foodchem.2008.12.012.
[23] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[24] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6.
[25] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3): 137-150.DOI:10.1016/S0141-8130(02)00016-8.
[26] ZHANG Y Z, ZHOU B, ZHANG X P, et al. Interaction of malachite green with bovine serum albumin: determination of the binding mechanism and binding site by spectroscopic methods[J]. Journal of Hazardous Materials, 2009, 163(2): 1345-1352. DOI:10.1016/j.jhazmat.2008.07.132.
[27] WU W, CLIFFORD M, HOWELL N K. The effect of instant green tea on the foaming and rheological properties of egg albumen proteins[J].Journal of the Science of Food and Agriculture, 2007, 87(10): 1810-1819. DOI:10.1002/jsfa.2809.
[28] PARTANEN R, PAANANEN A, FORSSELL P, et al. Effect of transglutaminase-induced cross-linking of sodium caseinate on the properties of equilibrated interfaces and foams[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2009, 344(1):79-85. DOI:10.1016/j.colsurfa.2009.02.004.
[29] KUAN Y H, BHAT R, KARIM A A. Emulsifying and foaming properties of ultraviolet-irradiated egg white protein and sodium caseinate[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8):4111-4118. DOI:10.1021/jf104050k.
[30] LIU C, WANG X, MA H, et al. Functional properties of protein isolates from soybeans stored under various conditions[J]. Food Chemistry,2008, 111(1): 29-37. DOI:10.1016/j.foodchem.2008.03.040.
[31] 胡思, 李华, 王斌, 等. 茶多酚对小麦面筋蛋白功能性质的影响[J].河南工业大学学报(自然科学版), 2015, 36(6): 16-20.
[32] ZHAO J, LV W, WANG J, et al. Effects of tea polyphenols on the post-mortem integrity of large yellow croaker (Pseudosciaena crocea) fillet proteins[J]. Food Chemistry, 2013, 141(3): 2666-2674.DOI:10.1016/j.foodchem.2013.04.126.
[33] LIU F, TANG C H. Emulsifying properties of soy protein nanoparticles:influence of the protein concentration and/or emulsification process[J].Journal of Agricultural and Food Chemistry, 2014, 62(12): 2644-2654.DOI:10.1021/jf405348k.
[34] 张来林, 黄文浩, 肖建文, 等. 不同储藏条件对大豆、稻谷蛋白中巯基和二硫键的影响研究[J]. 粮食加工, 2012, 37(3): 67-70.
[35] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782. DOI:10.1016/j.ijbiomac.2012.07.010.
[36] STRAUSS G, GIBSON S M. Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J]. Food Hydrocolloids, 2004, 18(1): 81-89. DOI:10.1016/S0268-005X(03)00045-6.
[37] ZHANG Y Z, ZHOU B, LIU Y X, et al. Fluorescence study on the interaction of bovine serum albumin with p-aminoazobenzene[J]. Journal of Fluorescence, 2008, 18(1): 109-118. DOI:10.1007/s10895-007-0247-4.
[38] ZHANG H X, HUANG X, MEI P, et al. Studies on the interaction of tricyclazole with β-cyclodextrin and human serum albumin by spectroscopy[J]. Journal of Fluorescence, 2006, 16(3): 287-294.DOI:10.1007/s10895-006-0087-7.
[39] DING F, LIU W, LI N, et al. Complex of nicosulfuron with human serum albumin: a biophysical study[J]. Journal of Molecular Structure,2010, 975(1): 256-264. DOI:10.1016/j.molstruc.2010.04.033.
