鸡蛋蛋清作为食品加工的重要配料应用十分广泛[1],冰蛋白是规模化生产应用的主要形式。冰蛋白需要解冻后方能使用,蛋液重新冻结后仍可继续贮藏,以便后续使用。在冰蛋白的使用过程中,水分出现冻结和融化交替发生的现象称为循环冻融。循环冻融现象在食品贮藏和加工过程中较常见。国内外已对水产品、肉制品、面制品的冻融现象进行了丰富的研究。循环冻融促使鲤鱼、鱿鱼、鳕鱼蛋白和脂肪发生氧化,品质下降[2-4]。循环冻融使牛肉蛋白质发生氧化,牛肉的嫩度和持水力降低[5],循环冻融也会使鸡肉、猪肉品质下降[6-7]。冻融过程中,冰晶破坏了肉的超微结构,导致可溶性物质浓缩,从而在细胞水平影响了生化反应,改变了肉的品质特性[8]。循环冻融会破坏麦谷蛋白结构,降低其功能特性,影响饺子皮的品质[9]。经冻融的面筋蛋白添加到面粉中,冻融时间越长,面粉特性下降越明显,这是由于面筋蛋白的二硫键在冻融过程中不断解聚,降低了面筋蛋白分子质量[10-11]。循环冻融对食品的营养、口感、风味产生诸多影响[12],多数研究者认为循环冻融对蛋白质、脂肪等营养素起到破坏作用,降低了食品品质。但Zhao Juyang等[13]却发现大豆蛋白经循环冻融后,蛋白质分子间作用力发生变化,其凝胶特性得到改善。目前关于循环冻融对蛋制品性质的影响却少有研究。蛋清不同于肉制品、面制品、水产品等固态食品,其水分含量较高,成分相对单一,循环冻融使蛋白质的性质发生变化,但其变化规律是否与其他食品一致需要深入研究。
蛋清蛋白的主要成分包括卵白蛋白、卵转铁蛋白、卵类黏蛋白、溶菌酶等[14],蛋清蛋白经过剪切处理后,蛋白质的功能性、结构等均发生显著变化[15]。循环冻融过程中存在的剪切、挤压、浓缩等效应,能够改变蛋白质的结构、分子间作用力及理化性质。Duan Xiang等[16]研究了循环冻融对蛋清泡沫性质的影响,发现循环冻融能够改善蛋清中各种蛋白的泡沫性质,但是关于冻融过程中蛋清蛋白的理化性质及凝胶特性没有研究。本实验以冻融处理的蛋清为研究对象,研究循环冻融过程中蛋清蛋白功能特性、理化性质、流变特性及二级结构的变化情况,确定循环冻融在冰蛋白的应用过程中的作用,为冰蛋白保藏及在食品加工中的应用提供理论指导。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋购于济南大润发超市;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)、8-苯氨基-萘酚-磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma-Aldrich试剂公司;其他化学试剂为分析纯。
1.2 仪器与设备
TA.XT Plus物性测试仪 英国Stable Micro System公司;Bohlin CVO旋转流变仪 英国Malvern公司;TU1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;F-4500荧光分光光度计 日立高新技术公司;AVATA360傅里叶变换红外光谱仪 美国Nicolet公司;90PlusPALS粒度分析仪 美国Brookhaven公司;BCD-290WDPK冰箱 海尔集团;DF-101S磁力搅拌器 巩义市予华仪器设备有限公司;T18分散机 德国IKA公司;TGL-16B高速离心机 上海安亭科学仪器厂;K9840自动凯氏定氮仪 济南海能仪器有限公司。
1.3 方法
1.3.1 蛋清的循环冻融处理
取新鲜鸡蛋若干,分蛋器分离蛋清与蛋黄,向蛋清中加入质量分数0.05%的叠氮钠,磁力搅拌器300 r/min搅拌15 min,用双层纱布过滤蛋清,然后置于-20 ℃的冰箱中冷冻,12 h后取出,在30 ℃条件下解冻3 h,此为一个冻融过程,相同方法分别制备2~5 次循环冻融处理的蛋清。
1.3.2 功能性分析
1.3.2.1 蛋清凝胶特性的测定
取20 mL蛋清于50 mL烧杯中,用0.1 mol/L氢氧化钠溶液或0.1 mol/L盐酸溶液将蛋清pH值调至7.0,然后用保鲜膜密封,在90 ℃水浴中加热30 min,取出后迅速冷却。
在室温条件下,使用物性仪测定凝胶硬度。物性仪的操作条件为:使用P/0.5的探头,测试前速率5 mm/s,测试速率2 mm/s,测试后速率2 mm/s,下压距离10 mm,停留时间2 s,触发力5 g,测试凝胶硬度。
取一定质量(W1)蛋清凝胶,在离心管中事先放入滤纸,然后在4 000 r/min离心20 min,取出凝胶用滤纸将表面水分吸干后称质量(W2),蛋清凝胶的持水性按公式(1)计算:
1.3.2.2 蛋清泡沫性质的测定
调节蛋清pH值至7.0,利用分散机2 000 r/min搅打蛋清1 min。记录未搅拌蛋清样品溶液的体积(A),搅拌结束时蛋清泡沫的体积(B),搅拌结束30 min后蛋清泡沫体积(C)。起泡性和泡沫稳定性按公式(2)、(3)计算:

1.3.2.3 蛋清溶解性的测定
将经过循环冻融处理的蛋清于10 000 r/min离心10 min,使不溶物沉淀,取上清液以微量凯氏定氮法测定其蛋白质含量。
1.3.3 理化性质分析
1.3.3.1 巯基含量的测定
表面巯基的测定:向1 mL稀释5 倍的蛋清中,加入4 mL、0.1 mol/L Tris-甘氨酸缓冲液(pH 8.5,含0.01 mol/L乙二胺四乙酸),40 ℃保温30 min,加入125 μL的DTNB试剂(20 mg DTNB溶于5 mL 0.1 mol/L、pH 8.0的Tris-甘氨酸缓冲液),在25 ℃显色10 min,测定波长412 nm处吸光度,以13 600/(mol·cm)消光系数计算巯基含量。
总巯基含量的测定:向1 mL稀释25 倍的蛋清中,加入4 mL、0.1 mol/L的Tris-甘氨酸缓冲液(pH 8.5,含0.01 mol/L乙二胺四乙酸及8 mol/L尿素),其余测定方法与表面巯基测定方法相同。
1.3.3.2 表面疏水性
用0.02 mol/L,pH 7.4磷酸缓冲液稀释至蛋白质量浓度在1~5 mg/mL之间,取不同质量浓度的稀释样品4 mL,加入20 μL的ANS溶液(采用0.02 mol/L,pH 7.4磷酸缓冲液)作为荧光探针并于室温条件下保持1 h。采用荧光分光光度计在370 nm的激发波长和470 nm的发射波长条件下测定样品的荧光强度,以荧光强度对蛋白质质量浓度作曲线,曲线斜率即为蛋白质分子的表面疏水性。
1.3.3.3 粒径分布
取冻融后的蛋清溶液,用0.1 mol/L pH 7.6的磷酸缓冲液稀释1 000 倍,0.45 μm微孔滤膜过滤后,利用激光粒度仪对样品进行粒径分析。仪器操作条件:观察角度为90°,测定波长为640 nm,折射指数为1.330,测量温度为30 ℃。
1.3.4 流变特性分析
取循环冻融的蛋清液样品置于流变仪载物台与圆形平板之间,载物台与平板间距为1 mm。采用0.l Hz的振动频率振动样品,应变为1%,从25 ℃以1 ℃/min的速率升温至90 ℃,测定样品的弹性模量(G’)、黏性模量(G”)的变化。
1.3.5 蛋白质二级结构的测定
利用傅里叶红外光谱仪全波段扫描400~4 000 cm-1,扫描次数32,采用OMNIC 6.0数据处理软件处理原谱,用Peak Fit v 4.12软件分析红外光谱图中属于酰胺I带1 600~1 700 cm-1特征峰的波段,校正基线后用Gaussian法去卷积,再利用二阶导数法进行多次拟合,计算各蛋白质二级结构的含量。
1.4 数据处理
所得数据均为3 次重复的平均值,采用SPSS Statistics进行数据分析,均数间比较采用Turkery检验进行分析(P=0.05)。
2 结果与分析
2.1 循环冻融对蛋清功能性的影响
蛋白质的功能性质是指其在食品加工、贮藏和销售过程中发生作用的那些物理化学性质。食品工业中,蛋清蛋白较为重要的功能性质包括溶解性、持水性、起泡性、凝胶性等[17]。本研究对循环冻融处理后的蛋清蛋白功能性质进行了测定,结果如表1所示。随着循环冻融次数的增加,凝胶硬度、凝胶持水性均呈现出先上升后下降的趋势,当循环冻融2 次时,凝胶硬度和凝胶持水性分别达到556.06 g和72.94%,相对未冻融的蛋清提高了29.92%和35.22%。而经过5 次循环冻融后,蛋清蛋白的凝胶硬度与凝胶持水性显著(P<0.05)降低到205.15 g和42.75%。Xia Xiufang等[18]发现猪肌原纤维蛋白的凝胶硬度随着冻融次数增加而不断下降,同时凝胶的其他质构特点(弹性、黏性、内聚性、持水性)也不同程度降低,认为冻融处理破坏了蛋白凝胶的微观结构,使得凝胶硬度与持水性都受到影响。而本研究中一定的循环冻融却能提高蛋清的凝胶硬度与持水性,这可能与蛋清蛋白浓度较低,且为球蛋白有关,与Zhao Juyang等[13]的研究结论相似。
表1 循环冻融对蛋清蛋白功能性质的影响
Table 1 Effects of freeze-thaw cycles on functional properties of EWP

注:同列不同字母表示差异显著(P<0.05)。表2、3同。
从表1可以看出,随着循环冻融次数的增加,蛋清蛋白的起泡性提高。当蛋清蛋白冻融处理5 次后,起泡性达到165.11%。而泡沫稳定性却呈现先上升后下降的趋势,相对未处理蛋清,泡沫稳定性均有不同程度的提高。冰晶的反复挤压使得蛋白质内部的疏水基团暴露出来,有利于形成较强的表面张力,从而在气-液界面吸附并形成坚韧的薄膜,使得冻融蛋清蛋白的起泡性不断增加[9]。良好的溶解性是蛋白质功能性质的重要保障,由表1可知,冻融处理降低了蛋清的溶解性,经过2 次冻融后其溶解性变化显著(P<0.05)。在循环冻融过程中,蛋清蛋白分子受到冰晶分子的挤压作用,会导致蛋白质变性,变性程度与蛋白质的种类及浓度有着密切联系。疏水基团的暴露会使蛋清蛋白的溶解性有所下降,从而导致泡沫稳定性有所下降[19]。
2.2 循环冻融对蛋清蛋白理化性质的影响
蛋白质是由氨基酸组成的具有空间结构的高分子聚合物,其理化性质与功能性质密切相关[20]。蛋白质功能性的变化来源于其理化性质的变化,因此本实验对循环冻融的蛋清进行了理化性质分析,从而解释蛋清蛋白功能性发生变化的原因,结果如表2所示。随着循环冻融次数的增加,蛋清蛋白表面巯基含量不断增加,而总巯基含量却不断降低,这表明在循环冻融过程中,反复形成的冰晶对蛋白质进行了挤压,蛋白质构象同时也发生了两方面的变化,一方面是蛋白质分子部分展开,将原来包含于内部的巯基暴露出来,另一方面游离的巯基在蛋白质分子间或分子内形成了二硫键,使得总巯基含量下降[11,21]。在循环冻融过程中,蛋清蛋白的表面疏水性不断增加,这主要是由于蛋白质内部的疏水性芳香族氨基酸(苯丙氨酸、色氨酸)暴露出来,从而体现出较强的疏水性[22]。随着循环冻融次数的增加,蛋清溶液的平均粒径不断增加,主要是由于挤压导致表面疏水性及表面巯基含量的增加,而浓缩作用又促进了蛋白质发生分子间聚集,这主要依赖于疏水相互作用以及分子间的二硫键来稳定。但当循环冻融为5 次时,平均粒径稍有降低,这可能是由于冰晶的挤压、剪切作用导致部分颗粒破碎。Noh等[23]也发现较大的冰晶能够引起大豆蛋白结构与粒度大小的变化,从而促进大分子质量的蛋白聚集体的形成。
表2 循环冻融对蛋清蛋白理化性质的影响
Table 2 Effects of freeze-thaw cycles on physicochemical properties of EWP

2.3 循环冻融对蛋清流变性能的影响
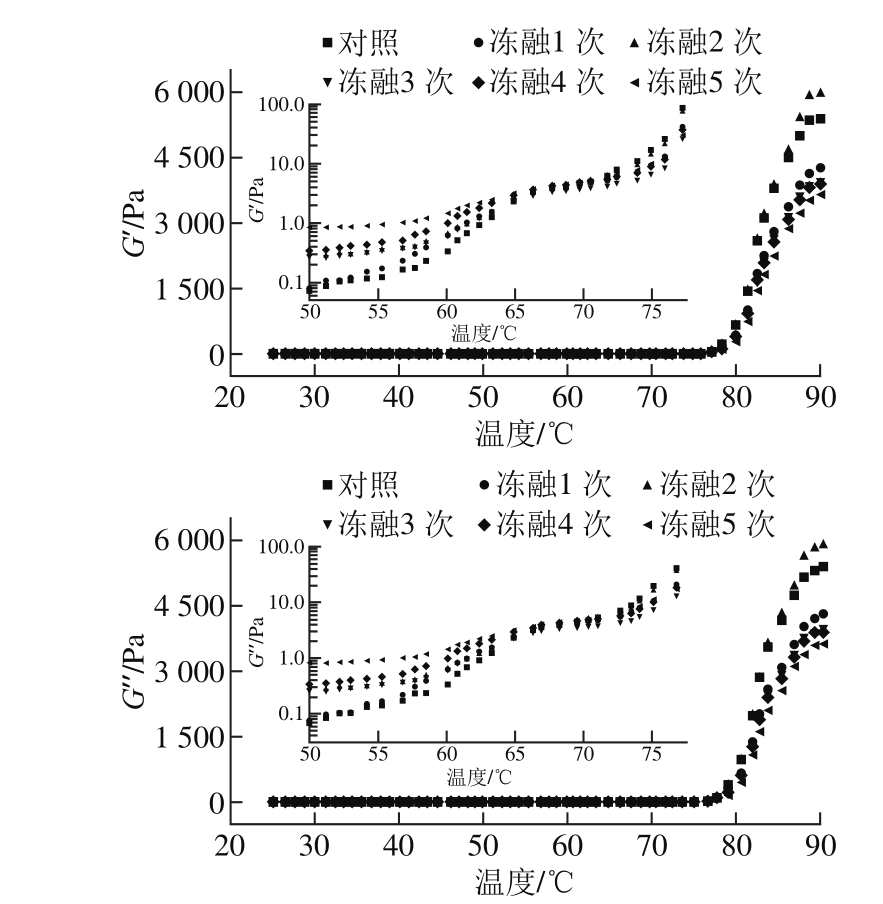
图1 循环冻融蛋清蛋白流变特性随温度的变化
Fig. 1 Changes in rheological properties of EWP with temperatures and freeze-thaw cycles
经循环冻融后,蛋清蛋白加热过程中,弹性模量(G’)、黏性模量(G’’)的变化情况如图1所示。50~75 ℃是蛋白质发生变性的主要区域,为清晰反映蛋清的流变特性,对50~75 ℃的数据转换为对数坐标并放大,从图1插图可以看出,在该温度范围内,蛋清蛋白发生了2 次弹性模量与黏性模量的跃变。在55~65 ℃范围内,卵伴清蛋白发生变性聚集。在70~75 ℃范围内,蛋清中的卵白蛋白发生变性聚集[24]。在25~60 ℃范围内,未经冻融处理及循环冻融1 次的蛋清呈现较低的弹性模量和黏性模量,随着冻融次数的增加,蛋清的弹性模量与黏性模量不断增加,这可能是由冻融处理后的蛋清蛋白分子间的疏水相互作用及二硫键加强所导致的。当加热温度到达90 ℃时,循环冻融2 次的蛋清样品呈现最大的弹性模量和黏性模量,其数值分别为5 982、5 874 Pa。终点弹性模量和黏性模量都是随着冻融次数的增加呈现先上升后下降的趋势,这与上述凝胶特性的分析是一致的。在低于70 ℃的条件下,蛋清主要以液态形式存在,由于冻融处理增加了分子间相互作用,当温度高于70 ℃,蛋清蛋白发生凝固,主要以凝胶状态为主,较大的分子间相互作用会降低凝胶网络结构的均一性,从而体现出随着循环冻融次数的增加,蛋清的终点流变特性均呈现先上升后下降的趋势。
2.4 循环冻融对蛋清蛋白二级结构的影响
采用傅里叶红外光谱对循环冻融处理的蛋清蛋白进行分析,以期能从中获得有用的结构信息,结果如图2所示。蛋白质的红外光谱中1 600~1 700 cm-1强而宽的吸收带是由形成肽键的C=O伸缩振动产生的,称为酰胺I带。酰胺I带的振动频率取决于C=O和N—H之间的氢键性质,即特征振动频率反映了多肽或蛋白质的特定二级结构(α-螺旋、β-折叠、β-转角和无规则卷曲)。
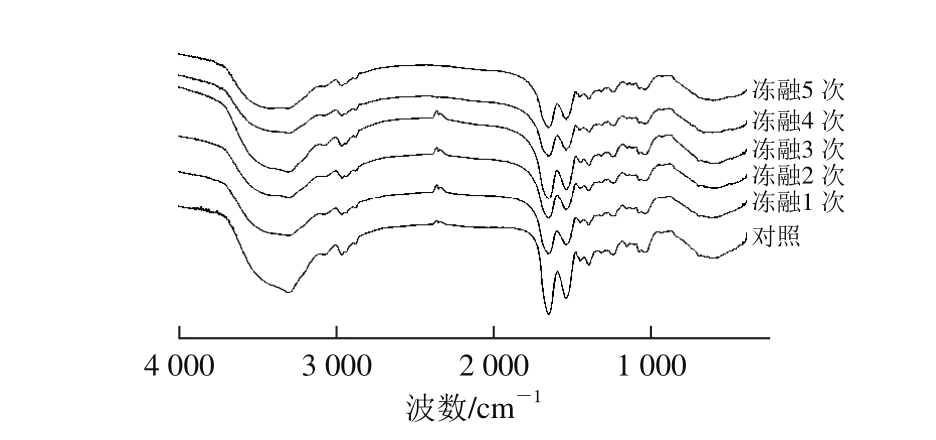
图2 循环冻融蛋清蛋白的傅里叶红外光谱图
Fig. 2 FT-IR spectra of EWP under different freeze-thaw cycles
将样品的红外光谱酰胺I带进行去卷积二阶导数拟合处理,计算出拟合的各种构象特征峰面积与总面积的比率,即为各二级结构所占的百分比[25],如表3所示。经过循环冻融处理,蛋清蛋白二级结构中α-螺旋和β-转角的含量随着循环冻融次数的增加而分别减少了3.43%和4.71%,而β-折叠和无规则卷曲的含量增加,这说明循环冻融处理破坏了维持蛋白质二级结构稳定的氢键,使得蛋白质的结构伸展,蛋白质的结构由有序结构变为无序构象[26]。循环冻融导致蛋清蛋白二级结构变化与蛋白质疏水性变化的结论是相一致的。
表3 循环冻融对蛋清蛋白二级结构的影响
Table 3 Influence of freeze-thaw cycles on secondary structure of EWP%

3 讨 论
本研究分析了循环冻融对蛋清蛋白功能性质、理化性质、流变性质及结构影响。蛋清蛋白经过循环冻融后,其二级结构受到破坏,空间结构变得较为松散,使得内部的疏水性基团暴露出来[27],使蛋白质表面疏水性随着循环冻融次数的增加而增加。巯基是维持蛋清蛋白结构稳定的重要因素,对于蛋白质的功能性有重要影响[28]。随着蛋白结构的伸展,内部巯基暴露出来,而总巯基减少,这表明已形成分子间的二硫键。这些二硫键的形成促使蛋白质聚集,形成粒径较大的蛋白质聚集体。这些现象说明蛋清蛋白在冻融过程中发生了变性[29]。经过冻融处理的蛋清蛋白具有较好的泡沫性,主要与蛋白质疏水性增加密切相关[30]。蛋清蛋白结构的适度伸展有利于提高其凝胶特性,而过度的冻融处理使得蛋白质发生变性聚集,降低了凝胶特性及溶解性,不利于蛋清蛋白凝胶性的保持。分子间作用力的增加及蛋白质聚集体的形成促使蛋清体现更高的弹性模量与黏性模量[31],改变了蛋清蛋白流变特性。
4 结 论
本实验研究了冻融循环过程中蛋清蛋白结构与性质的变化。循环冻融使得蛋清蛋白结构伸展,发生分子间聚集,增强了蛋白质间的疏水相互作用,促进二硫键的形成。这些结构的变化改变了蛋清蛋白的理化性质,从而体现出功能特性、流变特性的变化。但是蛋清液中含有多种蛋白质及非蛋白组分,这些组分在循环冻融过程中的变化是否与蛋清液的变化趋势一致,仍需进一步研究探讨。
参考文献:
[1] LI C P, HAYASHI Y, SHINOHARA H, et al. Phosphorylation of ovalbumin by dry-heating in the presence of pyrophosphate: effect on protein structure and some properties[J]. Journal of Agricultural &Food Chemistry, 2005, 53(12): 4962-4967. DOI:10.1021/jf047793j.
[2] 郭园园, 孔保华, 夏秀芳, 等. 冷冻-解冻循环对鲤鱼肉物理化学特性的影响[J]. 食品科学, 2011, 32(13): 125-130. DOI:10.13386/j.issn1002-0306.2015.08.072.
[3] 姜晴晴, 李珊, 刘文娟, 等. 循环冻融对秘鲁鱿鱼蛋白及肌肉品质的影响[J]. 现代食品科技, 2014, 30(7): 171-178. DOI:10.13982/j.mfst.1673-9078.2014.07.036.
[4] KORZENIOWSKA M, CHEUNG I W Y, LI-CHAN E C Y.Effects of fish protein hydrolysate and freeze-thaw treatment on physicochemical and gel properties of natural actomyosin from Pacific cod[J]. Food Chemistry, 2013, 138(2/3): 1967-1975. DOI:10.1016/j.foodchem.2012.09.150.
[5] 陈茜茜, 黄明, 邹玉峰, 等. 辐照和反复冻融对牛肉蛋白质氧化及食用品质的影响[J]. 食品科学, 2014, 35(19): 1-5. DOI:10.7506/Spkx1002-6630-201419001.
[6] ALI S, ZHANG W, RAJPUT N, et al. Effect of multiple freeze-thaw cycles on the quality of chicken breast meat[J]. Food Chemistry, 2015,173(8): 808-814. DOI:10.1016/j.foodchem.2014.09.095.
[7] NGAPO T M, BABARE I H, REYNOLDS J, et al. Freezing and thawing rate effects on drip loss from samples of pork[J]. Meat Science, 1999, 53(3): 149-158. DOI:10.1016/S0309-1740(99)00050-9.
[8] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2):93-98. DOI:10.1016/j.meatsci.2012.01.013.
[9] 治利, 邢仕敏, 张秀玲, 等. 反复冻融对麦谷蛋白结构及其功能性质的影响[J]. 中国食品学报, 2015, 15(9): 47-53. DOI:10.16429/j.1009-7848.2015.09.007.
[10] 赵雷, 胡卓炎, 刘国琴, 等. 冻融对面筋蛋白结构及面粉粉质特性的影响[J]. 华南师范大学学报(自然科学版), 2016, 48(3): 122-127.DOI:10.6054/j.jscnun.2016.05.037.
[11] ZHAO L, LI L, LIU G Q, et al. Effect of freeze-thaw cycles on the molecular weight and size distribution of gluten[J]. Food Research International, 2013, 53(1): 409-416. DOI:10.1016/j.foodres.2013.04.013.
[12] RAJI A O, AKINOSO R, RAJI M O. Effect of freeze-thaw cycles on the nutritional quality of some selected Nigerian soups[J]. Food Science & Nutrition, 2016, 4(2): 163-180. DOI:10.1002/fsn3.271.
[13] ZHAO J Y, SUN F, LI Y, et al. Modification of gel properties of soy protein isolate by freeze-thaw cycles are associated with changes of molecular force involved in the gelation[J]. Process Biochemistry,2017, 52(1): 200-208. DOI:10.1016/j.procbio.2016.09.026.
[14] AWADÉ A C, MOREAU S, MOLLÉ D, et al. Two-step chromatographic procedure for the purification of hen egg white ovomucin, lysozyme, ovotransferrin and ovalbumin and characterization of purified proteins[J]. Journal of Chromatography A,1994, 677(2): 279-288. DOI:10.1016/0021-9673(94)80156-8.
[15] LECHEVALIER V, JEANTET R, ARHALIASS A, et al. Egg white drying: influence of industrial processing steps on protein structure and functionalities[J]. Journal of Food Engineering, 2007, 83(3): 404-413. DOI:10.1016/j.jfoodeng.2007.03.033.
[16] DUAN X, LI Y, ZHANG Q, et al. Effect of a multiple freeze-thaw process on structural and foaming properties of individual egg white proteins[J]. Food Chemistry, 2017, 228(8): 243-248. DOI:10.1016/j.foodchem.2017.02.005.
[17] MANZOCCO L, PANOZZO A, NICOLI M C. Effect of ultraviolet processing on selected properties of egg white[J]. Food Chemistry,2012, 135(2): 522-527. DOI:10.1016/j.foodchem.2012.05.028.
[18] XIA X F, KONG B, XIONG Y, et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozenthawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science, 2010, 85(3): 481-486.DOI:10.1016/j.meatsci.2010.02.019.
[19] BAIER A K, KNORR D. Influence of high isostatic pressure on structural and functional characteristics of potato protein[J].Food Research International, 2015, 77(7): 385-390. DOI:10.1016/j.foodres.2015.05.053.
[20] HRJR B. Functional properties of chemically modified egg white proteins[J]. Journal of the American Oil Chemists’ Society, 1987,64(12): 1718-1725. DOI:10.1007/BF02542509.
[21] XUAN Y F, ZHANG Y, ZHAO Y Y, et al. Effect of hydroxypropylmethylcellulose on transition of water status and physicochemical properties of wheat gluten upon frozen storage[J]. Food Hydrocolloids, 2017, 63(3): 35-42. DOI:10.1016/j.foodhyd.2016.08.025.
[22] AZUAGA A I, CANET, D, SMEENK G, et al. Characterization of single-tryptophan mutants of histidine-containing phosphocarrier protein: evidence for local rearrangements during folding from high concentrations of denaturant[J]. Biochemistry, 2003, 42(17): 4883-4895. DOI:10.1021/bi027182p.
[23] NOH E J, PARK S Y, PAK J I, et al. Coagulation of soymilk and quality of tofu as affected by freeze treatment of soybeans[J].Food Chemistry, 2005, 91(4): 715-721. DOI:10.1016/j.foodchem.2004.06.050.
[24] HU Y, LIANG H, XU W, et al. Synergistic effects of small amounts of konjac glucomannan on functional properties of egg white protein[J]. Food Hydrocolloids, 2015, 52(3): 213-220. DOI:10.1016/j.foodhyd.2015.07.001.
[25] GE S Y, LIU M Y, ZHU J, et al. FTIR analysis of cosrelation between emulsifying properties and the secondary structure of the proteins in modified egg yolk powder[J]. Spectroscopy and Spectral Analysis, 2011, 31(8): 2090-2093. DOI:10.3964/j.is sn.1000-0593(2011)08-2090-04.
[26] BAIER D, PURSCHKE B, SCHMITT C, et al. Effect of high pressure-low temperature treatments on structural characteristics of whey proteins and micellar caseins[J]. Food Chemistry, 2015, 187(11):354-363. DOI:10.1016/j.foodchem.2015.04.049.
[27] WANG C, JIANG L, WEI D, et al. Effect of secondary structure determined by FTIR spectra on surface hydrophobicity of soybean protein isolate[J]. Procedia Engineering, 2011, 15(1): 4819-4827.DOI:10.1016/j.proeng.2011.08.900.
[28] JOHNSON T M, ZABIK M E. Egg albumen proteins interactions in an angel food cake system[J]. Journal of Food Science, 1981, 46(4):1231-1236. DOI:10.1111/j.1365-2621.1981.tb03029.x.
[29] WOOTTON M, HONG N T, THI H L P. A study of the denaturation of egg white proteins during freezing using differential scanning calorimetry[J]. Journal of Food Science, 1981, 46(5): 1336-1338.DOI:10.1111/j.1365-2621.1981.tb04167.x.
[30] PTASZEK P, KABZIŃSKI M, KRUK J, et al. The effect of pectins and xanthan gum on physicochemical properties of egg white protein foams[J]. Journal of Food Engineering, 2015, 144(1): 129-137.DOI:10.1016/j.jfoodeng.2014.07.017.
[31] CHEN Z, LI J, TU Y, et al. Changes in gel characteristics of egg white under strong alkali treatment[J]. Food Hydrocolloids, 2015, 45: 1-8.DOI:10.1016/j.foodhyd.2014.10.026.
 0 428.01±6.74
0 428.01±6.74