酪蛋白经酶解或消化后可得到螯合金属元素生物活性功能的肽段[1],具有促进钙、铁、锌等矿物质元素吸收的特性[2-3]。铁是人体必需的微量元素之一,它在机体代谢中有着重要作用。膳食中若长期缺铁,会影响红细胞的正常代谢,引起缺铁性贫血,同时降低人体免疫力[4]。铁螯合肽由于其独特的螯合结构和转运机制,比市场上流通的无机铁、有机酸铁更易于吸收[5-7]。已有不少学者采用离子交换[8-9]、凝胶过滤[10]、超滤[11]和高效液相色谱[12]对酪蛋白金属螯合肽进行分离纯化。固相金属亲和层析(immobilized metal affinity chromatography,IMAC)作为一种新型的分离技术,利用蛋白质表面某些氨基酸的残基与过渡金属离子Cu2+、Ni2+、Co2+、Zn2+等亲和能力的不同而进行分离[13],已被一些学者尝试应用在乳铁蛋白[14]、麦胚蛋白[15]、大豆蛋白[16]、乳清蛋白[17]、牛肉蛋白[18]等金属螯合肽的分离当中。在酪蛋白多肽纯化方面,离子交换法已大量使用,而关于IMAC的研究并不多见,Bernos等[19]曾利用此方法发现色氨酸、酪氨酸和组氨酸对蛋白多肽与金属具有螯合作用,Lin Fuyong等[20]则研究pH值、盐浓度对酪蛋白磷酸肽洗脱的影响。因此有必要对比这2 种方法对酪蛋白铁螯合肽的分离效果,并对螯合物的结构进行鉴定。基于铁螯合肽特殊的生理活性,可为营养保健食品、食品添加剂和营养强化剂等的开发与应用提供参考。
利用胰蛋白酶酶解酪蛋白得到多肽混合物,对比IMAC和阴离子交换层析结合Sephacryl S-100 HR凝胶层析法对酪蛋白铁螯合肽的分离纯化效果,从而获得铁螯合能力强的肽段,再通过质谱、紫外、红外光谱测定其氨基酸序列和结构,为酪蛋白多肽补铁剂的制备、结构解析和补铁机理研究提供一定实验支撑。
1 材料与方法
1.1 材料与试剂
酪蛋白(纯度92%)、菲啰嗪一钠 上海源叶生物有限公司;三羟甲基氨基甲烷(trismetyl aminomethane,Tris)(超纯)、二硫苏糖醇 北京索莱宝科技有限公司;无水乙酸钠、氯化钠(均为色谱纯) 上海麦克林生化科技有限公司;FeCl2·4H2O、无水乙醇、NaOH、HCl(均为分析纯)、胰蛋白酶 国药集团化学试剂有限公司;磷酸盐缓冲液(粉剂)、丝氨酸 合肥博美生物科技有限公司;邻苯二甲醛 美国Sigma公司;蒸馏水 广州屈臣氏有限公司;总蛋白定量测定试剂盒(BCA法) 南京建成生物工程研究所;牛血清白蛋白、细胞色素C、杆菌肽 中国食品药品检定研究院;乙氨酰乙氨酰乙氨酸 中国计量科学研究院。
1.2 仪器与设备
AKTA UPC10蛋白纯化平台 美国GE公司;UV-2102紫外-可见光分光光度计 美国Perkin Elmer公司;冷冻离心机 美国贝克曼公司;傅里叶红外光谱仪、LTQ XL线性离子阱质谱仪(配有纳喷电离源及SEQUEST数据处理系统) 美国Thermo Fisher公司;Gamma1-16 LSC冷冻干燥机 德国Marin Christ公司;分析天平(千分之一) 上海奥豪斯仪器有限公司;超纯水机 湖南科尔顿水务有限公司;pH计 梅特勒-托利多仪器(上海)有限公司;脱盐柱 美国Bio-Rad公司。
1.3 方法
1.3.1 酪蛋白的酶解及水解度的测定
称取50 g的酪蛋白,用超纯水配制成质量分数为5%的酪蛋白溶液,用1 mol/L NaOH溶液调节pH值至7.4,胰蛋白酶水解参考陈美姣[21]实验条件:温度58 ℃、pH 7.4、胰蛋白酶与酪蛋白质量比7∶1 000、时间2 h,酶解过程中用1 mol/L NaOH溶液调节pH值,并维持pH值恒定。酶解结束后将酶解液立即放置于100 ℃水浴锅中灭酶5 min,冷却至室温,蛋白水解度采用OPA法[22]测定。用1 mol/L的盐酸将冷却后的酶解液pH值调至4.6,5 000 r/min离心15 min,取上清液,向上清液中加入10%氯化钙至终体积的1%,再加95%乙醇溶液至终体积的50%,随后6 000 r/min离心10 min,将沉淀冷冻干燥,得到酪蛋白多肽粗品。
1.3.2 铁螯合活性的测定
参照Torres-Fuentes[23]、Guo Lidong[24]等的方法,菲啰嗪可与游离的亚铁离子形成铁-菲啰嗪络合物。将1.3.1节冷冻干燥后的多肽粉末用pH 5.5、0.1 mol/L乙酸-乙酸钠配制成0.2 mg/mL的溶液,吸取2.5 mL于玻璃管中,加入300 μL浓度为1 mmol/L的FeCl2·4H2O,在37 ℃水浴锅中反应60 min,反应结束后加入0.02 mol/L菲啰嗪200 μL,在562 nm波长下测定吸光度,以乙酸-乙酸钠的样品为空白对照,平行3 次。铁螯合活性为单位质量多肽能螯合的亚铁离子质量,以μg/mg表示。
1.3.3 酪蛋白铁螯合肽的分离
1.3.3.1 IMAC分离
洗脱条件参照Torres-Fuentes等[25]方法,固定金属为Cu2+。称取30 mg 1.3.1节冷冻干燥后的肽粉末溶解在1 mL缓冲液A(0.05 mol/L pH 7.4乙酸钠溶液-0.5 mol/L氯化钠溶液),上样前经0.22 μm膜过滤,色谱柱:Hitrap IMAC FF,柱体积:5 mL,上样后用缓冲液A洗脱至基线平稳,之后用缓冲液B(0.05 mol/L pH 4.0乙酸钠溶液-0.5 mol/L氯化钠溶液)线性梯度洗脱:0~40 min,100% A;40~90 min,0%~100% B;90~103 min,100% B。流速1 mL/min,3 min/管,收集洗脱峰,调节洗脱峰收集液pH值到5.5后用菲啰嗪络合比色法检测铁螯合力,肽浓度用BCA法测定,洗脱峰收集液冷冻干燥后备用。
1.3.3.2 阴离子交换层析
称取30 mg 1.3.1节冷冻干燥后的肽粉末溶解在1mL缓冲液C(0.02 mol/L pH 8.0 Tris-HCl缓冲液),上样前经0.22 μm膜过滤。色谱柱:Hitrap Q,柱体积:1 mL。上样后用缓冲液C洗至基线平稳,之后用缓冲液D(0.02 mol/L pH 8.0 Tris-HCl缓冲液,1.0 mol/L NaCl溶液)线性梯度洗脱:0~7 min,100% C;7~12 min,0%~25% D;12~42 min,65% D;42~47min,65%~100% D;47~49 min,100% D。流速1 mL/min,3 min/管,收集洗脱峰,调节洗脱峰收集液pH值到5.5后用菲啰嗪络合比色法检测铁螯合力,肽浓度用BCA法测定,洗脱峰收集液冷冻干燥后备用。
1.3.3.3 凝胶过滤层析分离
洗脱条件参考GE HiPrep 16/60 Sephacryl S-100 High Resolution手册的实验方法,利用相对分子质量标准物质牛血清白蛋白(66 700 Da)、细胞色素C(12 400 Da)、杆菌肽(1 423 Da)、乙氨酰乙氨酰乙氨酸(189 Da)进行肽分子质量的确定。取经IMAC和阴离子交换色谱分离出的铁螯合活性强的组分,冷冻干燥后用pH 7.3的0.01 mol/L磷酸缓冲液,0.15 mol/L NaCl缓冲液溶解后上样。色谱柱:GE HiPrep 16/60 Sephacryl S-100 High Resolution,柱体积:120 mL,柱规格:600 mm×16 mm,流速0.8 mL/min,3 min/管。洗脱峰肽浓度用BCA法测定,收集铁螯合能力最高峰洗脱液冷冻干燥后备用。
1.3.4 结构解析
1.3.4.1 质谱鉴定
将凝胶过滤层析铁螯合活性强的组分用Bio-Rad脱盐柱脱盐,使用液相色谱-质谱联用法测定,采用高效液相色谱系统分析鉴定。利用C18柱(100 µm×10 cm),通过Thermo LTQ XL线性离子阱质谱分析仪进行分析。流动相A:水(0.1%三氟乙酸);流动相B:乙腈(0.1%三氟乙酸),上样量2 μL,洗脱流速240 μL/min。洗脱条件:0~10 min,98% A;10~45 min,98%~75% A;45~60 min,75%~10% A;60~69 min,10% A;69~70 min,10%~95% A;70~75 min,95%~98% A;75~100 min,98% A。质谱结果用SEQUEST软件进行分析,SEQUEST软件中输出的两个主要的分值分别为Xcorr与DeltCn,用Xcorr(+1、+2、+3)分别大于1.9、2.5、3.75,DeltCn大于0.1的过滤条件去掉不正确的鉴定结果。
1.3.4.2 酪蛋白铁螯合肽的制备
将凝胶过滤层析铁螯合活性强的组分用0.5 mol/L盐酸调节pH值到5.5,按肽与铁质量比4∶1添加FeCl2·4H2O,37 ℃螯合反应60 min,结束后冷却至室温,冷冻干燥后保存[23]。
1.3.4.3 紫外光谱分析
取适量纯化后酪蛋白多肽与酪蛋白铁螯合肽冷冻干燥样品,用磷酸缓冲液溶解(同时以磷酸缓冲液作为对照),在200~400 nm波长范围内对纯化后酪蛋白多肽和铁螯合肽进行紫外光谱扫描,分辨率1 nm。
1.3.4.4 傅里叶变换红外光谱分析
分别将纯化后酪蛋白多肽与铁螯合肽固体样品2 mg放入玛瑙研钵中,加入干燥的KBr(光谱纯)200 mg混合研磨均匀(在红外灯下进行),使其粒度在2.5 μm以下,装入压片模具,抽气加压,28 MPa压力下维持3~5 min,获得透明的KBr样品片,放入测定室内,采用傅里叶变换红外光谱仪在400~4 000 cm-1区间扫描,得到红外光谱图。
2 结果与分析
2.1 酪蛋白铁螯合肽分离结果
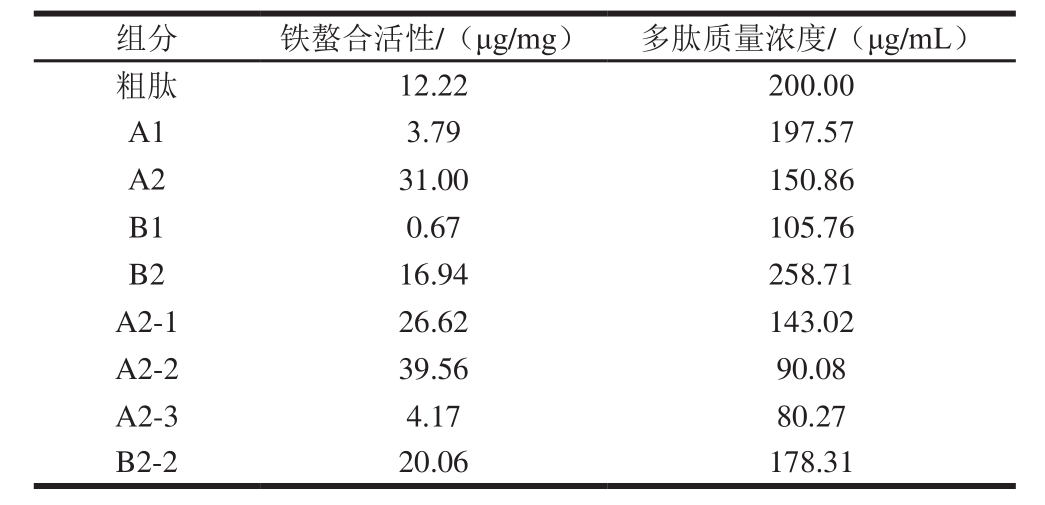
经胰蛋白酶酶解2 h后用OPA法测得酪蛋白水解度为9.65%,之后分别用IMAC法和离子交换法分离酪蛋白粗肽(图1),各得到两个组分,分别为A1、A2和B1、B2,其中A1、B1未与填料结合,快速洗脱下来。测定洗脱峰收集液的肽含量和铁螯合活性,IMAC分离组分A1、A2的铁螯合活性分别为3.79、31.00 μg/mg,离子交换分离得到的组分B1和B2铁螯合活性为0.67 μg/mg和16.94 μg/mg,IMAC的纯化效果优于离子交换,收集铁螯合活性高的A2、B2冷冻干燥,待凝胶过滤层析进一步分离。
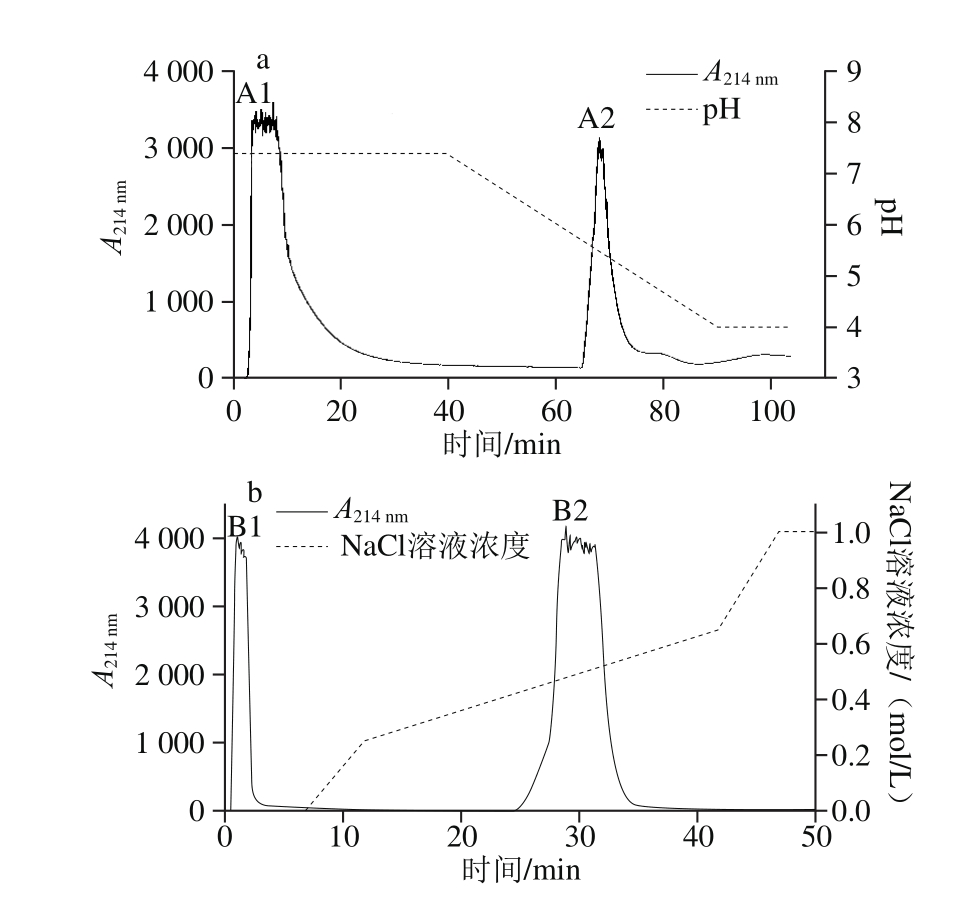
图1 酪蛋白多肽的IMAC(a)和离子交换(b)色谱图
Fig. 1 Immobilized metal affinity chromatography (a) and anion exchange chromatography (b) of casein peptides
经IMAC和离子交换纯化得到的组分A2和B2,通过Sephacryl S-100 HR凝胶过滤层析柱进一步分离,A2分离得到3 个组分(A2-1、A2-2和A2-3,见图2a),B2分离得到3 个组分(B2-1、B2-2和B2-3,见图2b)。根据分子质量标准物质(标准曲线方程为y=-0.025 7x+6.339 2,R2=0.996 8)凝胶过滤色谱图出峰时间,可知A2-1、A2-2和A2-3分子质量范围为20~200 kDa、766~2 000 Da和100~766 Da,A2-1为未完全水解的酪蛋白,测定A2-1、A2-2和A2-3铁螯合活性分别为26.62、39.56 μg/mg和4.17 μg/mg,A2-2与纯化前粗肽相比,铁结合量提高了3 倍。B2则主要分布在10~20 kDa范围内,其余组分肽含量较少,仅测定B2-2的铁螯合活性为20.06 μg/mg。IMAC法与阴离子交换相比,与凝胶过滤层析结合后,对酪蛋白铁螯合肽的分离效果优于后者。IMAC法常用的一些离子为第1列过渡金属离子Cu2+、Ni2+、Zn2+、Co2+,Swain等[18]研究发现经Cu2+亲和层析分离得到的牛肉蛋白多肽对铁的溶解和吸收具有促进作用,Bo[14]和Torres-Fuentes[23]等也曾先后使用Cu2+亲和层析对乳铁蛋白和鹰嘴豆铁螯合肽进行分离,本实验采用Cu2+分离得到的酪蛋白多肽同样表现出较强的铁螯合活性。因此多次洗脱收集A2-2组分,与氯化亚铁螯合后冷冻干燥保存,待进一步的结构鉴定。纯化前后螯合活性对比如表1所示。
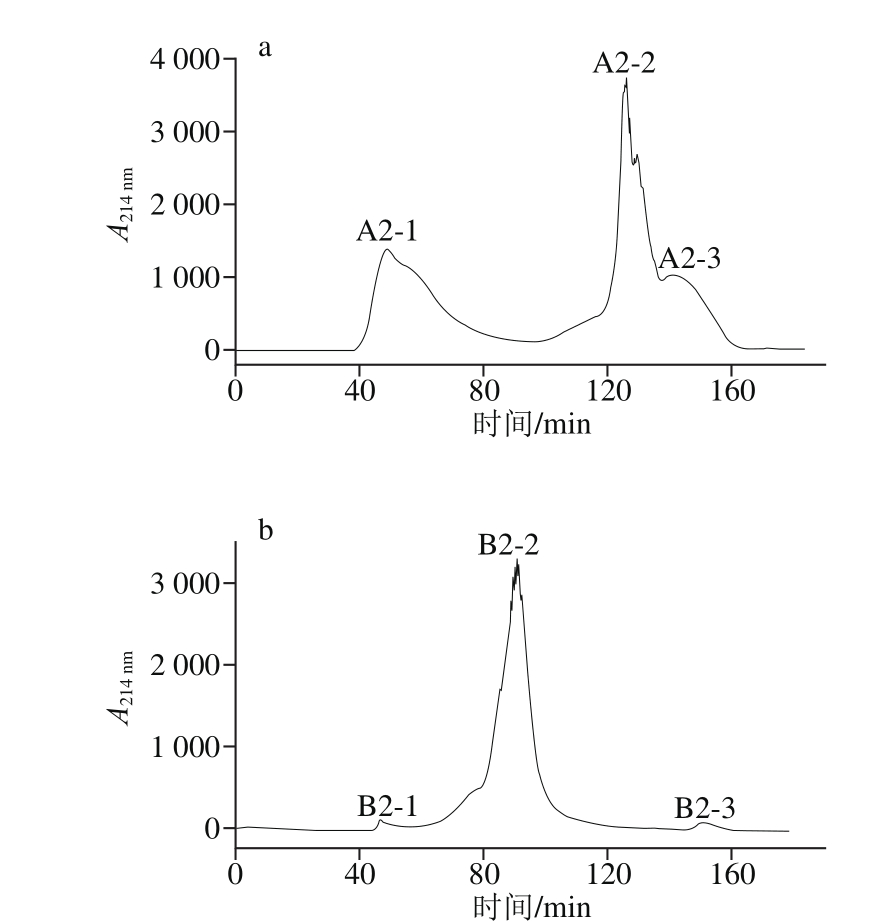
图2 Sephacryl S-100 HR凝胶过滤分离组分A2(a)和B2(b)的色谱图
Fig. 2 Sephacryl S-100 HR gel filtration chromatography of fraction A2 (a) and fraction B2 (b)
表1 纯化前后铁螯合肽活性
Table 1 Iron chelating activities of crude and purified samples
2.2 质谱鉴定结果
组分A2-2用Bio-Rad脱盐柱脱盐后用液相色谱串联质谱法进行分析结果见表2。
表2 组分A2-2的质谱鉴定结果
Table 2 Identification of fraction A2-2 using LC-MS/MS

由表2可知,A2-2峰段物质鉴定出3 种多肽氨基酸,其序列His-Ile-Gln-Lys-Glu-Asp-Val-Pro-Ser-Glu-Arg(HIQKEDVPSER)、Ile-Thr-Val-Asp-Asp-Lys-His-Tyr-Gln-Lys(ITVDDKHYQK)和Thr-Arg-Leu-His-Pro-Val-Gln-Glu-Arg(TRLHPVQER),比对酪蛋白氨基酸序列可知,3 种多肽应分别属于αs1(95-105)-casein、αs2(86-95)-casein和牛乳黄嘌呤氧化酶多肽的肽段。本实验鉴定出的3 条肽段包含的氨基酸种类及其高频率出现的氨基酸(Glu、Asp、His、Gln、Val)与其他相关研究基本一致。如大豆蛋白[16]、乳清蛋白[17,26]铁螯合肽含有较多的Asp、Glu、Pro、Lys,阿拉斯加狭鳕皮多肽[24,27]中Ser、Cys、His含量较高,芝麻蛋白[28]水解物中Asn、Cys、Ser含量最高。Torres-Fuentes等[23]用Cu2+亲和层析对鹰嘴豆铁螯合肽进行分离发现His与铁螯合率呈正相关关系,His含量大于20%的组分铁螯合率最高。
2.3 紫外光谱分析结果

图3 酪蛋白多肽及其铁螯合肽紫外吸收光谱图
Fig. 3 UV-Vis spectra of casein peptide and iron-peptide complex
由图3可知,螯合前后多肽紫外吸收光谱发生变化,多肽溶液的最大吸光度在207 nm波长处,加铁螯合后的最大吸光度波长为208 nm,产生了红移,且吸收强度增加。此外,铁螯合肽在275 nm波长处吸收峰高度比多肽有明显增高,结果与陆剑锋等[29]螯合前后紫外吸收光谱相似,表明有新物质生成,初步判断酪蛋白多肽与铁离子发生了螯合作用。
2.4 红外光谱分析结果
由图4可知,两者在酰胺N—H伸缩振动3 400 cm-1波数处和酰胺C=O伸缩振动1 650 cm-1波数处有明显的吸收峰,而1 540 cm-1波数处的吸收由于N—H变形振动引起,另外在1 200~1 000 cm-1波数间较大的吸收峰是由C—O—H的C—O伸缩振动所引起。多肽在螯合后,羧基的伸缩振动在1 407 cm-1波数的吸收峰转移到1 444 cm-1波数,原位消失,变化与Chaud[30]、Huang Guangrong[31]等研究结果相似,可能是酪蛋白多肽与Fe2+螯合引起偏移和变化,而在其他波数处的吸收峰较为一致。此外,质谱结果鉴定出的肽段中Glu、Asp、Gln含量较高,这3 种氨基酸的侧链上均带有C=O键,推测其可能参与了螯合作用。

图4 酪蛋白多肽及其酪蛋白铁螯合肽傅里叶变换红外光谱图Fig. 4 Infrared spectra of casein peptide and iron-peptide complex
3 结 论
酪蛋白经胰蛋白酶酶解,采用IMAC、Sephacryl S-100 HR凝胶过滤分离得到的多肽铁螯合活性强于阴离子交换与凝胶过滤层析的多肽铁螯合活性。紫外、红外光谱检测表明,多肽与铁发生螯合,羧基位点螯合前后发生变化。LTQ XL线性离子阱质谱仪对纯化后的组分共鉴定出3 种多肽,其氨基酸序列分别为HIQKEDVPSER、ITVDDKHYQK和TRLHPVQER,3 条肽段中Glu、Asp、Gln出现频率高,侧链均含有C=O键,推测多肽的羰基位是螯合铁离子的主要位点。
参考文献:
[1] PHELAN M, AHERNE A, FITZGERALD R J, et al. Casein-derived bioactive peptides: biological effects, industrial uses, safety aspects and regulatory status[J]. International Dairy Journal, 2009, 19(11):643-654. DOI:10.1016/j.idairyj.2009.06.001.
[2] PEREGO S, ZABEO A, MARASCO E, et al. Casein phosphopeptides modulate calcium uptake and apoptosis in Caco2 cells through their interaction with the TRPV6 calcium channel[J]. Journal of Functional Foods, 2013, 5(2): 847-857. DOI:10.1016/j.jあ.2013.01.032.
[3] GARCÍA-NEBOT M J, BARBERÁ R, ALEGRÍA A. Iron and zinc bioavailability in Caco-2 cells: influence of caseinophosphopeptides[J].Food Chemistry, 2013, 138(2/3): 1298-1303. DOI:10.1016/j.foodchem.2012.10.113.
[4] 杨真, 罗海吉. 缺铁性贫血及补铁剂研究进展[J]. 环境卫生学杂志,2006, 33(2): 90-93.
[5] 刘温, 楼乔明, 杨文鸽. 多肽金属元素螯合物研究进展[J]. 食品与发酵工业, 2014, 40(4): 142-146. DOI:10.13995/j.cnki.11-1802/ts.2014.04.006.
[6] 郑炯, 汪学荣, 阚建全. 血红蛋白多肽螯合铁的抗贫血功能研究[J]. 食品工业科技, 2009, 30(10): 312-313. DOI:10.13386/j.issn1002-0306.2009.10.096.
[7] 王淑红, 张静, 张亭. 多种铁制剂治疗缺铁性贫血患儿的效果差异研究[J]. 中国妇幼保健, 2015, 30(31): 5375-5377. DOI:10.7620/zgfybj.j.issn.1001-4411.2015.31.27
[8] WANG C, WANG B, LI B. Bioavailability of peptides from casein hydrolysate in vitro: amino acid compositions of peptides affect the antioxidant efficacy and resistance to intestinal peptidases[J].Food Research International, 2016, 81: 188-196. DOI:10.1016/j.foodres.2015.12.013.
[9] PLANK J, ANDRES P, KRAUSE I, et al. Gram scale separation of casein proteins from whole casein on a source 30Q anion-exchange resin column utilizing fast protein liquid chromatography (FPLC)[J].Protein Expression & Purification, 2008, 60(2): 176-181.DOI:10.1016/j.pep.2008.04.003.
[10] 冯凤琴, 王博诚. 酪蛋白磷酸肽的分离纯化及分子结构鉴定[J]. 食品与生物技术学报, 1999(4): 33-37.
[11] 王稳航, 沈登莱, 刘安军, 等. 酪蛋白酶解多肽-Fe2+的制备及性质研究[J]. 食品工业科技, 2004, 25(8): 53-56. DOI:10.13386/j.issn1002-0306.2004.08.006.
[12] MIQUEL E, ALEGRIA A, BARBERA R, et al. Casein phosphopeptides released by simulated gastrointestinal digestion of infant formulas and their potential role in mineral binding[J].International Dairy Journal, 2006, 16(9): 992-1000. DOI:10.1016/j.idairyj.2005.10.010.
[13] 景志刚, 杨春瑜, 杨春莉, 等. 固定化金属螯合亲和层析介质及其应用研究进展[J]. 农产品加工, 2015(11): 54-57. DOI:10.16693/j.cnki.1671-9646(X).2015.11.044.
[14] BO L, CARLSSON J, PORATH J. Isolation of lactoferrin from human milk by metal-chelate affinity chromatography[J]. Febs Letters, 1977,75(1): 89-92. DOI:10.1016/0014-5793(77)80059-8.
[15] 王晓萍, 郭晓娜, 彭伟, 等. 固定化金属亲和层析富集麦胚蛋白金属螯合肽的研究[J]. 中国粮油学报, 2015, 30(3): 101-105.
[16] LÜ Y, BAO X, LIU H, et al. Purification and characterization of caclium-binding soybean protein hydrolysates by Ca2+/Fe3+, immobilized metal affinity chromatography (IMAC)[J].Food Chemistry, 2013, 141(3): 1645-1650. DOI:10.1016/j.foodchem.2013.04.113.
[17] CRUZ-HUERTA E, MAQUEDA D M, HOZL D L, et al. Short communication: identification of iron-binding peptides from whey protein hydrolysates using iron (III)-immobilized metal ion affinity chromatography and reversed phase-HPLC-tandem mass spectrometry[J]. Journal of Dairy Science, 2015, 99(1): 77-82.DOI:10.3168/jds.2015-9839.
[18] SWAIN J H, TABATABAI L B, REDDY M B. Histidine content of low-molecular-weight beef proteins influences non-heme iron bioavailability in Caco-2 cells[J]. Journal of Nutrition, 2002, 132(2):245-251.
[19] BERNOS E, GIRARDET J M, HUMBERT G, et al. Role of the O-phosphoserine clusters in the interaction of the bovine milk alpha s1-, beta-, kappa-caseins and the PP3 component with immobilized iron (III) ions[J]. Biochimica et Biophysica Acta, 1997, 1337(1): 149-159. DOI:10.1016/S0167-4838(96)00159-8.
[20] LIN F Y, CHEN W Y, HUANG S Y. Selective separation of caseinophosphopeptides through immobilized metal ion affinity chromatography: eあect of pH values, salt concentrations and degree of phosphorylation[J]. Bioprocess and Biosystems Engineering, 2000,23(5): 467-471. DOI:10.1007/s004499900178.
[21] 陈美姣. 酪蛋白磷酸肽螯合铁的制备[D]. 合肥: 安徽农业大学,2010: 22.
[22] NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science,2001, 66(5): 642-646. DOI:10.1111/j.1365-2621.2001.tb04614.x.
[23] TORRES-FUENTES C, ALAIZ M, VIOQUE J. Iron-chelating activity of chickpea protein hydrolysate peptides[J]. Food Chemistry, 2012,134(3): 1585-1588. DOI:10.1016/j.foodchem.2012.03.112.
[24] GUO L, HOU H, LI B, et al. Preparation, isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J].Process Biochemistry, 2013, 48(5/6): 988-993. DOI:10.1016/j.procbio.2013.04.013.
[25] TORRES-FUENTES C, ALAIZ M, VIOQUE J. Aきnity purification and characterisation of chelating peptides from chickpea protein hydrolysates[J]. Food Chemistry, 2011, 129(2): 485-490. DOI:10.1016/j.foodchem.2011.04.103.
[26] CAETANO-SILVA M E, BERTOLDO-PACHECO M T, PAES-LEME A F, et al. Iron-binding peptides from whey protein hydrolysates:evaluation, isolation and sequencing by LC-MS/MS[J]. Food Research International, 2015, 71: 132-139. DOI:10.1016/j.foodres.2015.01.008.
[27] GUO L, HARNEDY P A, O’KEEFFE M B, et al. Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides[J]. Food Chemistry, 2015, 173: 536-542.DOI:10.1016/j.foodchem.2014.10.055.
[28] WANG C. Separation and identification of zinc-chelating peptides from sesame protein hydrolysate using IMAC-Zn2+and LC-MS/MS[J]. Food Chemistry, 2012, 134(2): 1231-1238. DOI:10.1016/j.foodchem.2012.02.204.
[29] 陆剑锋, 孟昌伟, 李进, 等. 斑点叉尾鱼骨胶原多肽螯合钙的制备及其特征[J]. 水产学报, 2012, 36(2): 314-320.
[30] CHAUD M V, IZUMI C, NAHAAL Z, et al. Iron derivatives from casein hydrolysates as a potential source in the treatment of iron deficiency[J]. Journal of Agricultural and Food Chemistry, 2002,50(4): 871-877. DOI:10.1021/jf0111312.
[31] HUANG G, REN Z, JIANG J. Separation of iron-binding peptides from shrimp processing by-products hydrolysates[J]. Food and Bioprocess Technology, 2011, 4(8): 1527-1532. DOI:10.1007/s11947-010-0416-3.