群体感应(quorum sensing,QS)是细菌利用自体诱导物又称信号分子进行信息交流的一种机制,细菌生长过程中将产生的信号分子分泌到细胞外,细菌自身通过感应胞外信号分子的数量感知菌体的密度,当达到一定阈值时调控特定基因的表达,参与菌体的生理行为[1]。QS系统可以调控包括胞外多糖产生、孢子形成、生物发光、生物膜形成以及初级代谢等在内的多种代谢过程[2-6]。一般来说,革兰氏阳性菌的信号分子为寡肽类物质,革兰氏阴性菌的信号分子为酰基高丝氨酸内脂类物质,而信号分子AI-2(autoinducer-2)是一种在革兰氏阳性、阴性菌都存在,可以用于不同细菌种间交流的信号分子[7]。目前发现,细菌主要是通过S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)代谢途径生产信号分子AI-2。SAM作为一种甲基的供体在S-腺苷甲硫氨酸酶的作用下脱去甲基生成了具有毒性的中间代谢产物S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH),S-腺苷高半胱氨酸核苷酶(S-adenosylhomocysteine nucleosidase,Pfs)迅速水解SAH形成S-核糖高半胱氨酸(S-ribosylhomocysteine,SRH)和腺嘌呤,SRH在S-核糖高半胱氨酸裂解酶(S-ribosylhomocysteine lyase,LuxS)的作用下生成4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)和高半胱氨酸,DPD结构不稳定,分子重排后形成呋喃硼酸二酯,即信号分子AI-2[8]。
屎肠球菌(Enterococcus faecium)是人和动物肠道中正常菌群的成员,其正常的代谢过程可以产生过氧化氢、有机酸和细菌素等物质,能够抑制和杀灭病原菌,具有益生菌特性[9]。随着微生态制剂的不断发展,屎肠球菌作为优选出的菌种,具有优良的生物学特性,通过生物拮抗等可以在宿主肠道中迅速形成优势菌群,进而增强宿主免疫功能,促进营养物质的转化,最终达到提高生长性能促进动物健康生长的目的[10]。有研究显示,饲粮中添加屎肠球菌可以降低仔猪平均日采食量、提高平均日增重、降低料重比,有改善仔猪生长性能的趋势,与添加抗生素效果相近[11]。在对E. faecium 83的研究中发现,其含有信号分子AI-2合成的关键基因luxS和pfs,通过克隆和表达LuxS和Pfs蛋白成功在体外合成了具有生物活性的信号分子AI-2[12]。在乳酸菌对酸适应的研究中发现luxS基因参与菌体的酸性应激,而这对菌体通过胃肠道定植、进行菌体间的相互交流具有一定作用[13]。同时,嗜酸乳杆菌(Lactobacillus acidophilus)黏附肠表皮细胞的过程也依赖于LuxS/AI-2 QS系统[14]。
尽管对于LuxS/AI-2 QS系统的研究比较多,但是对环境胁迫下乳酸菌LuxS/AI-2 QS系统的研究鲜有报道。本实验以酸马奶酒中分离出的一株高产信号分子AI-2的E. faecium 8-3为研究对象,通过改变pH值、温度、渗透压、营养条件研究菌株生长、信号分子AI-2产生以及luxS和pfs基因表达量的变化,为研究LuxS/AI-2 QS系统介导乳酸菌的应激过程提供理论依据。
1 材料与方法
1.1 菌株、培养基和试剂
内蒙古锡林郭勒盟地区酸马奶酒中分离得到的E. faecium 8-3,由内蒙古农业大学“内蒙古传统发酵乳制品中乳酸菌和酵母菌共生机理的研究”课题组提供;哈维氏弧菌BB170(Vibrio harveyi BB170)购自美国典型菌种保藏中心(BAA-1117)。
MRS培养基、AB培养基根据文献[15-16]方法配制,制备培养基使用的试剂均为国产分析纯。
RNAiso Plus、PrimeScript RT reagent kit with gDNA Eraser、SYBR Premix Ex TaqII 宝生物工程(大连)有限公司。
1.2 仪器与设备
HPS-250生化培养箱 哈尔滨市东明医疗仪器厂;PB-10 pH计 赛多利斯科学仪器有限公司;BCN-1360型生物超净工作台 哈尔滨市东联电子技术开发有限公司;T6新悦可见光分光光度计 北京普析通用仪器有限责任公司;5810R高速冷冻离心机 德国Eppendorf公司;Perkin Elmer victor X 酶标仪酶标仪 美国Perkin Elmer仪器有限公司;Multiskan FC酶标仪 美国Thermo公司;快速梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;GelDoc XR+凝胶成像仪、C1000 Thermal Cycler荧光定量PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 无细胞发酵上清液(cell-free fermentation supernatant,CFS)的制备
将培养24 h的二代E. faecium 8-3按2%接种比接入MRS培养基中37 ℃培养,菌液以6 000 r/min离心10 min弃去菌泥,上清液用0.22 μm滤菌器过滤除菌,得到E.faecium 8-3 CFS;将V. harveyi BB170接种于AB培养基,30 ℃、100 r/min振荡培养16 h,用相同方法收集CFS作为阳性对照;MRS培养基和AB培养基用0.22 μm滤菌器过滤分别作为介质对照和阴性对照。滤液-80 ℃保存。
1.3.2 生物学方法检测信号分子AI-2
将V. harveyi BB170接种到AB培养基中,30 ℃、100 r/min振荡培养至OD595nm为0.9~1.1,按1∶5 000(体积比)混合菌液和新鲜AB培养基,得到稀释后的V. harveyi BB170菌液。将1.3.1节制备的CFS与稀释后的V. harveyi BB170菌液以1∶100(体积比)进行混合,30 ℃ 100 r/min继续振荡培养,每隔30 min使用酶标仪的化学发光模式测定其荧光强度,在阴性对照荧光强度值达到最低(3.5 h)时对各个样品的相对荧光强度进行计算,其相对荧光强度用以代表信号分子AI-2产量。待测样品相对荧光强度=待测样品的荧光强度值/介质对照的荧光强度值[17]。
1.3.3 不同环境胁迫对E. faecium 8-3产信号分子AI-2的影响
1.3.3.1 酸碱胁迫对E. faecium 8-3产信号分子AI-2的影响
用1 mol/L的HCl和NaOH分别将MRS培养基pH值调至4.5、5.5、7.5和8.5,将二代活化培养24 h的E. faecium 8-3按2%接种比接入不同pH值的MRS培养基中作为实验组,相同比例接种E. faecium 8-3至pH 6.5的MRS培养基中作为对照组,37 ℃继续培养,4~25 h的培养过程中每隔3 h测定发酵液OD595nm,同时按1.3.1节方法收集实验组和对照组的CFS,测定信号分子AI-2产量。
1.3.3.2 温度胁迫对E. faecium 8-3产信号分子AI-2的影响
将活化二代培养24 h的E. faecium 8-3按2%接种比接入MRS培养基中,分别置于23、30 ℃和44 ℃培养作为实验组,相同比例接种E. faecium 8-3至MRS培养基中37 ℃培养作为对照组。4~25 h的培养过程中每隔3 h测定发酵液OD595nm,同时按1.3.1节方法收集实验组和对照组的CFS,测定信号分子AI-2产量。
1.3.3.3 渗透压胁迫对E. faecium 8-3产信号分子AI-2的影响
通过在MRS培养基中添加不同质量的NaCl,制备NaCl质量分数分别为1.5%、3.0%、4.5%的培养基,将活化二代培养24 h的E. faecium 8-3按2%接种比接入不同渗透压的MRS培养基中作为实验组,相同比例接种E. faecium 8-3至NaCl质量分数为0%的MRS培养基中作为对照组,37 ℃继续培养,4~25 h的培养过程中每隔3 h测定发酵液OD595nm,同时按1.3.1节方法收集实验组和对照组的CFS,测定信号分子AI-2产量。
1.3.3.4 营养胁迫对E. faecium 8-3产信号分子AI-2的影响
使用生理盐水对MRS培养基进行稀释至终体积分数为原液的20%、40%、60%、80%,将活化二代培养24 h的E. faecium 8-3按2%接种比接入不同营养条件的MRS培养基中作为实验组,相同比例接种E. faecium 8-3至100% MRS培养基中作为对照组,37 ℃继续培养,4~25 h的培养过程中每隔3 h测定发酵液OD595nm,同时按1.3.1节方法收集实验组和对照组的CFS,测定信号分子AI-2产量。
1.3.4 不同环境胁迫对luxS和pfs基因表达量的影响
选取16S rRNA基因作为相对荧光定量PCR的内参基因。根据GenBank中E. faecium luxS和pfs基因全序列,利用引物设计软件Primer Premier 5.0(PREMIER Biosoft International,美国),设计扩增16S rRNA、luxS和pfs基因的引物(表1)。引物由上海生工生物有限公司合成。
将培养24 h的二代E. faecium 8-3按2%接种比接入经过不同处理的MRS培养基中或不同温度进行培养,选取对数期7 h收集菌体。使用TaKaRa RNA Plus对菌体总RNA进行提取,利用琼脂糖凝胶电泳检测RNA质量,使用微量紫外分光光度计检测RNA纯度和浓度。以总RNA为模板,使用PrimeScript RT reagent kit with gDNA Eraser试剂盒对RNA中的DNA进行去除,同时进行反转录。以反转录得到的cDNA为模板使用SYBR Premix Ex TaqII进行荧光定量PCR,采用25 μL体系(cDNA 2 μL,上、下游引物各1 μL,Taq酶12.5 μL,ddH2O 8.5 μL),PCR条件为:95 ℃ 4 min;95 ℃ 5 s,57 ℃ 30 s,72 ℃ 30 s,35个循环。根据2-ΔΔCT法计算基因表达量。
表1 E. faecium 8-3所用引物相关信息
Table 1 Primers used for PCR amplification of total RNA from E. faecium 8-3 and sizes of PCR products
1.4 数据处理
每个实验3 个平行,用数据用 ±s表示,用软件SPSS 19.0进行数据分析。
±s表示,用软件SPSS 19.0进行数据分析。
2 结果与分析
2.1 酸碱胁迫对E. faecium 8-3 LuxS/AI-2 QS的影响

图1 培养基pH值对E. faecium 8-3菌体密度的影响
Fig. 1 Effect of medium pH on optical density of E. faecium 8-3
如图1所示,随着pH值的不断升高菌体生长能力不断增强,当pH值达到8.5时生长能力最为旺盛,说明菌株在碱性环境的生长能力要优于酸性环境。同时,在pH 5.5时菌体生长能力最弱,在pH 4.5时菌体并不生长,说明酸性胁迫会抑制E. faecium 8-3的生长。
由表2可知,在4~10 h的培养过程中,E. faecium 8-3在pH 8.5的培养基中产信号分子AI-2产量显著高于其他实验组和对照组,在13~25 h的培养过程中,显著高于对照组和pH 5.5中培养,而E. faecium 8-3在pH 4.5的培养基中却不产信号分子AI-2。结合图1可知,在碱性环境下,pH 7.5和pH 8.5培养菌体密度显著大于对照组,说明在菌体生长旺盛时,信号分子AI-2产量也会有所增加,这时信号分子AI-2会随着菌体密度的增加而增加。在13~25 h的培养过程中,pH 7.5和pH 8.5的培养条件信号分子AI-2产量没有显著差异,可能是因为E. faecium 8-3在生长的过程中产生乳酸中和培养基,使得培养基的pH值相近,从而使信号分子AI-2产量没有显著差异。在酸性环境下,pH 5.5培养菌体的密度显著低于对照组,但信号分子AI-2产量却显著高于对照组。当培养基pH值降到4.5时,菌体生长受到了严重影响,此时菌体无法产生信号分子AI-2。结果说明,在轻度酸胁迫条件下会诱导E. faecium 8-3产生更多的信号分子AI-2,而重度酸胁迫时菌体生长受到严重抑制将无法释放信号分子AI-2。Moslehi-Jenabian等[13]研究了益生乳杆菌在酸性胁迫条件下菌株的存活率及信号分子AI-2的产生情况,发现菌株在逐步适应酸性环境的条件下存活率要高于直接进行酸处理,信号分子AI-2的产生低于直接进行酸胁迫,且信号分子AI-2产量均随pH值的不断下降而增加,但是却未对碱性条件下菌株的生长和信号分子AI-2的产生进行研究。
表2 培养基pH值对E. faecium 8-3产信号分子AI-2的影响Table 2 Effect of medium pH on AI-2 production
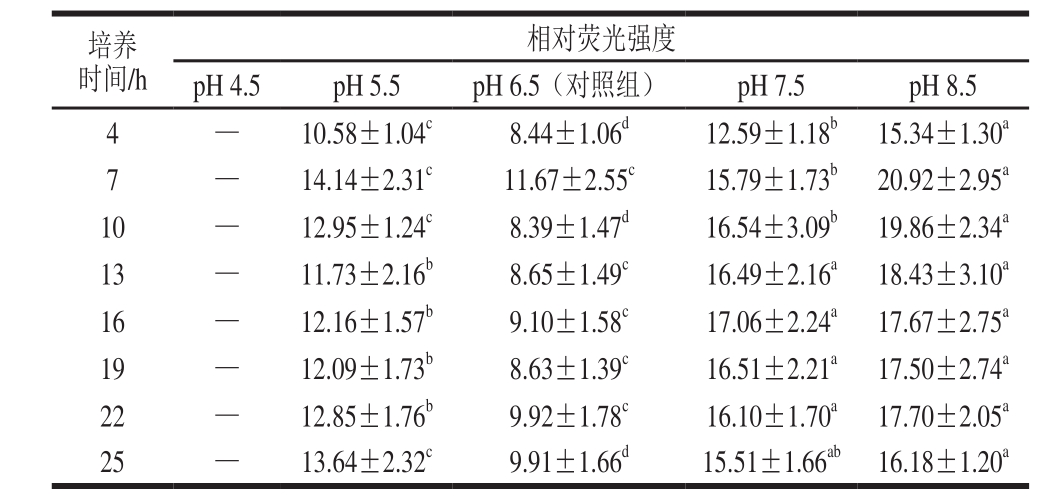
注:同行不同肩标字母表示差异显著(P<0.05),下同;—.无数据。
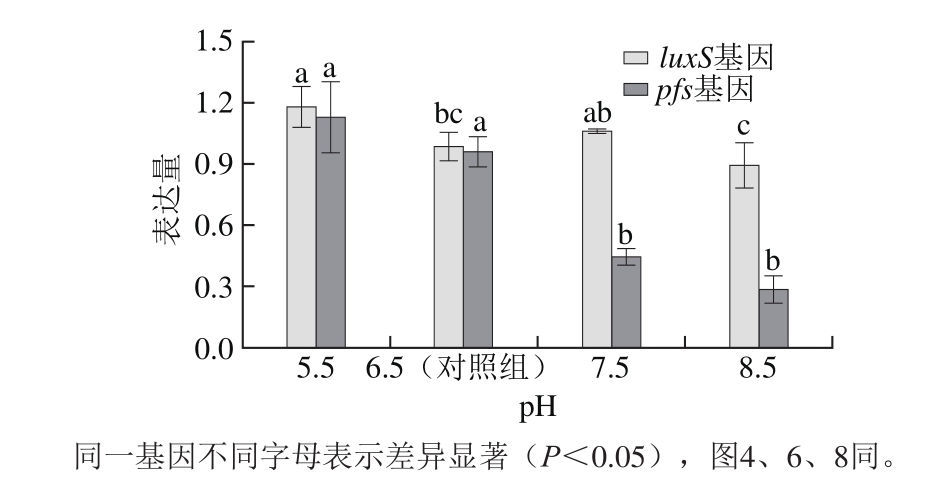
由图2可知,E. faecium 8-3 luxS基因的表达量在pH 5.5时最高,pH 8.5时表达量最低;pfs基因表达量随pH值的升高而降低。在酸性条件下,信号分子AI-2产量增加,luxS和pfs基因表达量均有所增加。但是在碱性条件下,pH 7.5时luxS基因表达量与对照组无显著差异,pH 8.5时luxS基因表达量显著低于对照组,而信号分子AI-2产量却高于对照组,可能因为pH值的增加导致E. faecium 8-3的生长曲线发生改变,结合图1发现,pH 7.5和pH 8.5时E. faecium 8-3的对数期均有所提前。L. rhamnosus GG和L. acidophilus NCFM的luxS基因表达量在酸性胁迫1 h时显著增加,且不同菌株表达量存在差异[13]。Rogers等[18]研究发现,肺炎链球菌在受到低剂量青霉素刺激时luxS基因会过表达以进行自我保护。对酸性应激反应的不同蛋白质组学研究表明,在酸性胁迫期间菌株会诱导各种基因和蛋白质的表达[19-20]。在变形链球菌中,luxS基因参与耐酸性调节也已经得到证实[21]。L. rhamnosus GG的luxS基因缺失株在模拟胃液中的存活率下降进而导致在小鼠体内的耐受性降低,这表明luxS基因在L. rhamnosus GG中对胃应激的过程具有关键作用[22]。
2.2 温度胁迫对E. faecium 8-3 LuxS/AI-2 QS的影响
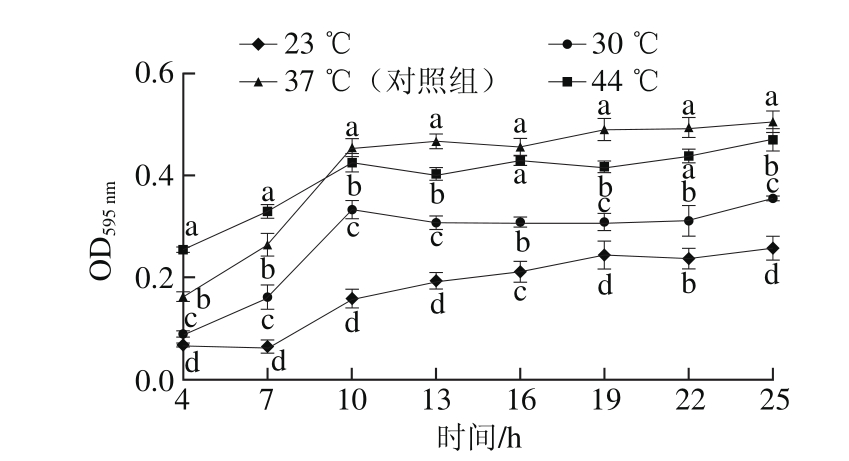
图3 培养温度对E. faecium 8-3菌体密度的影响
Fig. 3 Effect of culture temperature on optical density of E. faecium 8-3
由图3可知,E. faecium 8-3在23、30 ℃培养时生长能力显著低于对照组,且在23 ℃时生长最为缓慢;在44 ℃培养时4~7 h生长速度大于对照组,10~25 h低于对照组,说明E. faecium 8-3的最适生长温度为37 ℃。
表3 培养温度对E. faecium 8-3产信号分子AI-2的影响
Table 3 Effect of culture temperature on AI-2 production
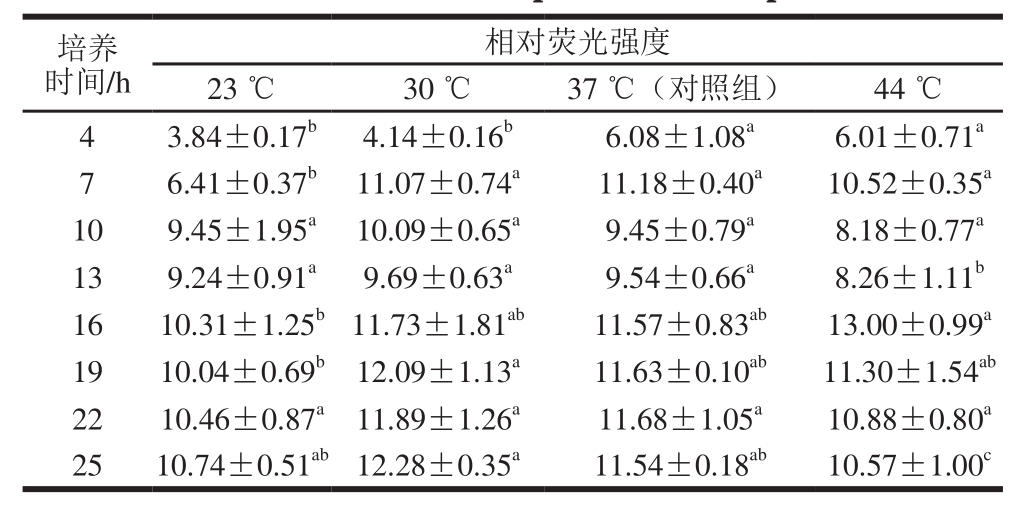
由表3可知,在4~7 h E. faecium 8-3在23、30 ℃培养时信号分子AI-2产量低于对照组,说明随着培养温度的下降,E. faecium 8-3在生长初期信号分子AI-2产量会随着菌体生长被抑制而显著降低;在44 ℃培养时,信号分子AI-2产量仅在13 h和25 h显著低于对照组,其他时间与对照组无显著差异,这可能是因为菌体在37 ℃和44 ℃生长菌体密度相近,导致信号分子AI-2产量无显著差异。在对4 株乳酸杆菌的研究中发现,25 ℃培养时L. rhamnosus GG、L. rhamnosus BFE5264以及L. plantarum 299v的信号分子AI-2产量下降,而L. plantarum NR74的信号分子AI-2反而显著增加;在43 ℃和50 ℃培养时,L. rhamnosus GG信号分子AI-2产量显著增加,L. plantarum NR74的信号分子AI-2反而显著降低,其他菌株出现抑制或促进作用,这说明信号分子AI-2对于温度的反应具有菌株特异性[23]。

图4 培养温度对E. faecium 8-3 luxS和pfs基因表达量的影响
Fig. 4 Effect of culture temperature on the expression of luxS and pfs genes in E. faecium 8-3
由图4可知,E. faecium 8-3的luxS和pfs基因表达量在23、30、44 ℃培养时显著高于对照组,其中在23 ℃时表达量最高,说明温度胁迫会诱导luxS和pfs基因的表达量增加,且低温胁迫对于信号分子AI-2的影响要大于高温胁迫。有研究显示,菌株的不同生长阶段luxS基因的表达存在差异[24],温度胁迫下改变了菌株的生长阶段,从而引起基因表达量的变化,同时,信号分子在培养环境中存在积累的过程,所以基因表达和信号分子AI-2的产生存在一定差异。
2.3 渗透压胁迫对E. faecium 8-3 LuxS/AI-2 QS的影响

图5 渗透压对E. faecium 8-3菌体密度的影响
Fig. 5 Effect of osmotic pressure on optical density of E. faecium 8-3
由图5可知,随着NaCl质量分数的增加,培养基的渗透压也不断增大,菌体的生长会受到不同程度的抑制。同时,菌体在生长过程中到达稳定期的时间也随之延长,实验组的菌体密度显著小于对照组,且在NaCl质量分数为4.5%时菌体密度最小。
由表4可知,对照组信号分子AI-2的相对荧光强度最大值为58.25,处理组1.5%、3.0%、4.5%信号分子AI-2的相对荧光强度最大值分别为55.62、39.62、37.31,说明随着渗透压的不断增大,E. faecium 8-3产信号分子AI-2受到抑制。同时结合图5可知,NaCl质量分数为3.0%和4.5%时培养菌体,菌体生长速度减慢,进入稳定期的时间延长,可能导致了信号分子AI-2产生速度的降低。说明在渗透压胁迫的条件下,E. faecium 8-3生长受到抑制的同时信号分子AI-2的产生也会受到抑制。而在Yeo等[23]的研究中发现,4 株乳酸杆菌的信号分子AI-2产量均会随培养基中NaCl含量的增加而增加。这可能是因为菌株之间对于渗透压的耐受作用具有差异性。在黏质沙雷氏菌的培养基中添加少量硼酸会诱导信号分子AI-2的合成,而增大硼酸的添加计量会抑制其生长同时减少信号分子AI-2的产生[25],在对肺炎克雷伯菌的研究中也发现类似结果[26-27],这说明添加物的不同添加量对菌株信号分子AI-2也存在差异影响。
表4 培养基渗透压对E. faecium 8-3产信号分子AI-2的影响
Table 4 Effect of osmotic pressure on AI-2 production

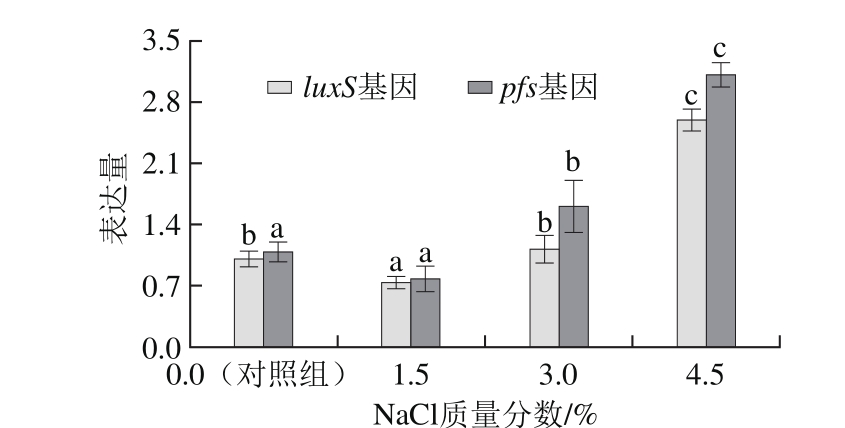
图6 渗透压对E. faecium 8-3 luxS和pfs基因表达量的影响
Fig. 6 Effect of osmotic pressure on the expression of luxS and pfs genes in E. faecium 8-3
由图6可知,E. faecium 8-3的luxS基因表达量在NaCl质量分数为1.5%时,显著低于对照组和其他实验组,且在NaCl质量分数为4.5%时表达量最大。pfs基因表达量在NaCl质量分数为1.5%时和对照组无显著差异且显著低于其他实验组,同时在NaCl质量分数为4.5%时表达量最大,说明在低浓度NaCl质量分数时,渗透压对于luxS和pfs基因表达量的影响比较小,随着NaCl质量分数的增加,培养基渗透压不断增加进而诱导luxS和pfs基因表达量升高,说明luxS和pfs基因在菌体抗高渗透压胁迫的过程中发挥作用。
2.4 营养胁迫对E. faecium 8-3 LuxS/AI-2 QS的影响

图7 营养胁迫对E. faecium 8-3菌体密度的影响
Fig. 7 Effect of nutritional stress on optical density of E. faecium 8-3
由图7可知,随着MRS培养基体积分数的降低,菌体生长受到影响,在培养末期培养基稀释度越大,抑制作用越显著且在MRS培养基体积分数稀释至20%时菌体的生长能力最弱。
表5 营养胁迫对E. faecium 8-3产信号分子AI-2的影响
Table 5 Effect of nutritional stress on AI-2 production
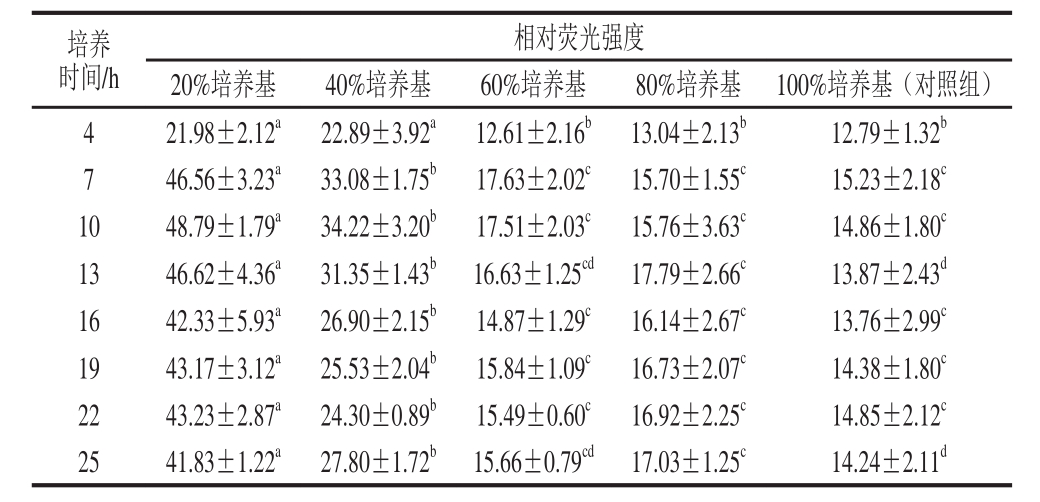
由表5可知,培养7 h后E. faecium 8-3在培养基体积分数为20%时信号分子AI-2产量最高,显著高于其他实验组和对照组。在培养基体积分数为40%时,信号分子AI-2产量显著高于在60%、80%、100% MRS培养基中培养。在培养基体积分数为60%和80%的条件下培养,E. faecium 8-3的信号分子AI-2产量与对照组几乎无显著差异。结果说明,在营养物质缺乏的条件下,低营养胁迫才是诱导E. faecium 8-3产信号分子AI-2的主要因素。以添加2%半乳糖作为对照培养乳酸杆菌发现,半乳糖添加量为0%、0.5%和1%时L. rhamnosus BFE5264、L. plantarum 299v以及L. plantarum NR74的信号分子AI-2产量会显著增加,且L. plantarum 299v和L. plantarum NR74信号分子AI-2随半乳糖浓度的减少而显著增加[23]。不同碳源(葡萄糖、蔗糖、甘油)对于黏质沙雷氏菌的生长没有影响,但是对信号分子AI-2却不同,在以葡萄糖为碳源时菌体信号分子AI-2的产生在对数中期达到最大值,同时,随着葡萄糖浓度的降低信号分子AI-2产量也随之下降[25]。
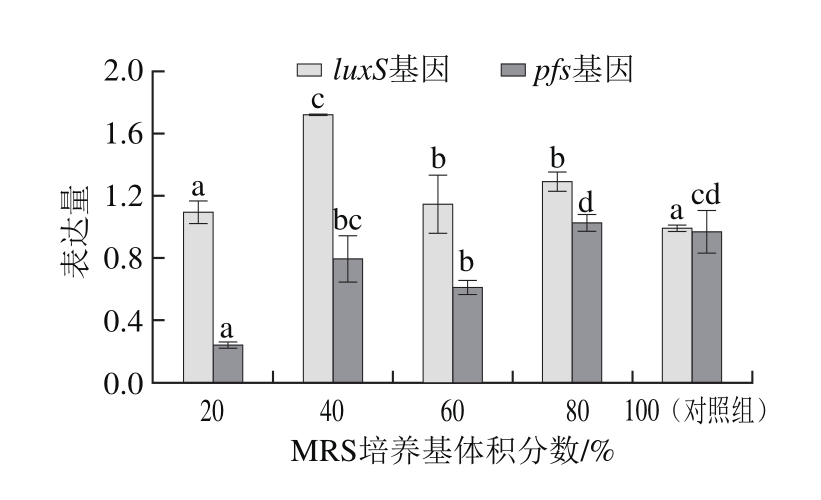
由图8可知,E. faecium 8-3的luxS基因在MRS培养基体积分数为20%时的表达量与对照组无显著差异,其他实验组luxS基因的表达量均显著大于对照组,而实验组pfs基因的表达量除MRS培养基体积分数为80%组外均低于对照组,结果说明在低营养胁迫的条件下会诱导luxS基因的过表达。He Zhiyan等[29]研究发现粪肠球菌生物膜的形成随培养基中葡萄糖添加量的增加而增加,同时,粪肠球菌luxS基因缺失株的生长速率不变但生物膜形成能力、细胞表面疏水性以及生物膜形成相关基因表达量均升高。同时,在对Streptococcus mutans的luxS基因研究中也有类似的结果[30]。Riemerella anatipestifer基因组中缺乏luxS基因,含有pfs基因,但是却不能够合成信号分子AI-2,而R. anatipestifer的pfs基因可以恢复avian pathogenic Escherichia coli(APEC)pfs基因缺失株合成信号分子AI-2的能力,说明pfs基因具有合成信号分子AI-2的功能[31]。
信号分子AI-2与菌体的具体应激过程直接相关,即使不考虑肠道微生态环境,在标准生长条件和环境胁迫下菌株信号分子AI-2的作用也截然不同[28]。信号分子AI-2是LuxS和Pfs蛋白催化SAH进行甲基循环的副产物,但是在Streptococcus suis中过量表达的luxS基因却不能引起pfs基因的高表达和信号分子AI-2的过量合成,相反,导致了菌体生长速率减慢,这说明在S. suis中信号分子AI-2的产生与luxS基因的转录没有对应性,pfs基因的转录可能与信号分子AI-2的产生有关[32]。但是,在Serratia plymuthica和Edwardsiella tarda中luxS基因过表达却可以使信号分子AI-2活性增强[33-34]。这可能是因为在不同菌株中luxS和pfs基因参与甲基代谢的过程存在差异,信号分子AI-2的合成与二者的转录存在联系,但是却并非是一一对应的关系。
3 结 论
E. faecium 8-3通过信号分子AI-2介导的QS系统调控菌体适应环境胁迫的过程。轻度酸性胁迫条件会诱导菌体产生信号分子AI-2,而在碱性胁迫条件下菌体生长旺盛,介导信号分子AI-2产生的主要因素是菌体密度;在渗透压胁迫时,E. faecium 8-3的生长随渗透压增大受到抑制,信号分子AI-2的产生也随菌体密度的降低而减少;低温胁迫时,E. faecium 8-3菌体密度减少,信号分子AI-2的产生也同时受到抑制,温度胁迫影响了菌体密度进而调控信号分子AI-2的产生;低营养胁迫可以诱导E. faecium 8-3产信号分子AI-2。不同环境胁迫条件下E.faecium 8-3的luxS和pfs基因表达量均有不同程度的变化,说明菌体在不同环境胁迫生长时luxS和pfs基因参与菌体的代谢,结合信号分子AI-2的变化进一步说明LuxS/AI-2 QS系统参与E. faecium 8-3的抗逆过程。
参考文献:
[1] MILLER M B, BASSLER B L. Quorum sensing in bacteria[J]. Annual Review of Microbiology, 2001, 55: 165-199. DOI:10.1146/annurev.micro.55.1.165.
[2] SLATER H, CROW M, EVERSON L, et al. Phosphate availability regulates biosynthesis of two antibiotics, prodigiosin and carbapenem,in Serratia via both quorum sensing-dependent and -independent pathways[J]. Molecular Microbiology, 2003, 47(2): 303-320.DOI:10.1046/j.1365-2958.2003.03295.x.
[3] BODMAN S B V, MAJERCZAK D R, COPLIN D L. A Negative regulator mediates quorum-sensing control of exopolysaccharide production in Pantoea stewartii subsp. stewartii[J]. Proceedings of the National Academy of Sciences, 1998, 95(13): 7687-7692.DOI:10.1073/pnas.95.13.7687.
[4] DE ARAUJO C, BALESTRINO D, ROTH L, et al. Quorum sensing affects biofilm formation through lipopolysaccharide synthesis in Klebsiella pneumonia[J]. Research in Microbiology, 2010, 161(7):595-603. DOI:10.1016/j.resmic.2010.05.014.
[5] STEENACKERS H P, LEVIN J, JANSSENS J C, et al. Structureactivity relationship of brominated 3-alkyl-5-methylene-2(5H)-furanones and alkylmaleic anhydrides as inhibitors of Salmonella biofilm formation and quorum sensing regulated bioluminescence in Vibrio harveyi[J]. Bioorganic & Medicinal Chemistry, 2010, 18(14):5224-5233. DOI:10.1016/j.bmc.2010.05.055.
[6] LI J, CHEN J, VIDAL J E, et al. The Agr-like quorum-sensing system regulates sporulation and production of enterotoxin and beta2 toxin by Clostridium perfringens type A non-food-borne human gastrointestinal disease strain F5603[J]. Infection and Immunity, 2011, 79(6): 2451-2459. DOI:10.1128/IAI.00169-11.
[7] WATERS C M, BASSLER B L. Quorum sensing: cell-to cell communication in bacteria[J]. Annual Review of Cell and Developmental Biology, 2005, 21: 319-346. DOI:10.1146/annurev.cellbio.21.012704.131001.
[8] ASCENSO O S, MARQUES J C, SANTOS A R, et al. An efficient synthesis of the precursor of AI-2, the signalling molecule for interspecies quorum sensing[J]. Bioorganic & Medicinal Chemistry, 2011,19(3): 1236-1241. DOI:10.1016/j.bmc.2010.12.036.
[9] FRANZ C M A P, HOLZAPFEL W H, STILES M E. Enterococci at the crossroads of food safety?[J]. International Journal of Food Microbiology, 1999, 47(1/2): 1-12. DOI:10.1016/S0168-1605(99)00007-0.
[10] 王前光, 高惠林, 刘秋. 微生态制剂的研究进展及其在养猪生产上的应用[J]. 饲料广角, 2010(24): 45-46.
[11] 王永, 杨维仁, 张桂国. 饲粮中添加屎肠球菌对断奶仔猪生长性能、肠道菌群和免疫功能的影响[J]. 动物营养学报, 2013, 25(5):1069-1076. DOI:10.3969/j.issn.1006-267x.2013.05.023.
[12] 顾悦, 廉雪花, 吴荣, 等. 高产信号分子AI-2乳酸菌的筛选及其Pfs基因的克隆和表达[J]. 微生物学通报, 2017, 44(3): 1-9. DOI:10.13344/j.microbiol.china.160475.
[13] MOSLEHI-JENABIAN S, GORI K, JESPERSEN L. AI-2 signalling is induced by acidic shock in probiotic strains of Lactobacillus spp.[J].International Journal of Food Microbiology, 2009, 135(3): 295-302.DOI:10.1016/j.ijfoodmicro.2009.08.011.
[14] BUCK B L, AZCARATEPERIL M A, KLAENHAMMER T R.Role of autoinducer-2 on the adhesion ability of Lactobacillus acidophilus[J]. Journal of Applied Microbiology, 2009, 107(1): 269-279. DOI:10.1111/j.1365-2672.2009.04204.x.
[15] 沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999: 214-222.
[16] GREENBERG E P, HASTINGS J W, ULITZUR S. Induction of luciferase synthesis in Beneckea harveyi by other marine bacteria[J].Archives of Microbiology, 1979, 120(2): 87-91. DOI:10.1007/BF00409093.
[17] SURETTE M G, BASSLER B L. Quorum sensing in Escherichia coli and Salmonella typhimurium[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(12): 7046-7050.DOI:10.1073/pnas.95.12.7046.
[18] ROGERS P D, LIU T T, BARKER K S, et al. Gene expression profiling of the response of Streptococcus pneumoniae to penicillin[J].Journal of Antimicrobial Chemotherapy, 2007, 59(4): 616-626.DOI:10.1093/jac/dkl560.
[19] COTTER P D, HILL C. Surviving the acid test: responses of grampositive bacteria to low pH[J]. Microbiology and Molecular Biology Reviews, 2003, 67(3): 429-453. DOI:10.1128/MMBR.67.3.429-453.2003.
[20] VAN DE G M, SERROR P, CHERVAUX C, et al. Stress responses in lactic acid bacteria[J]. Antonie Van Leeuwenhoek, 2002, 82(1): 187-216. DOI:10.1023/A:1020631532202.
[21] WEN Z T, BURNE R A. LuxS-mediated signaling in Streptococcus mutans is involved in regulation of acid and oxidative stress tolerance and biofilm formation[J]. Journal of Bacteriology, 2004, 186(9): 2682-2691. DOI:10.1128/JB.186.9.2682-2691.2004.
[22] LEBEER S, CLAES I J, VERHOEVEN T L, et al. Impact of luxS and suppressor mutations on the gastrointestinal transit of Lactobacillus rhamnosus GG[J]. Applied and Environmental Microbiology, 2008,74(15): 4711-4718. DOI:10.1128/AEM.00133-08.
[23] YEO S, PARK H, JI Y, et al. Influence of gastrointestinal stress on autoinducer-2 activity of two Lactobacillus species[J]. FEMS Microbiology Ecology, 2015, 91(7): 1-9. DOI:10.1093/femsec/fiv065.
[24] 姜黎明. AI-2/LuxS群体感应系统介导植物乳杆菌益生特性的初步研究[D]. 昆明: 昆明理工大学, 2014.
[25] SUN S J, LIU H J, WENG C H, et al. The response of Serratia marcescens JG to environmental changes by quorum sensing system[J]. Archives of Microbiology, 2016, 198(6): 585-590.DOI:10.1007/s00203-016-1213-9.
[26] ZHU H, LIU H J, NING S J, et al. A luxS-dependent transcript profile of cell-to-cell communication in Klebsiella pneumoniae[J]. Molecular Biosystems, 2011, 7(11): 3164-3168. DOI:10.1039/c1mb05314k.
[27] ZHU H, LIU H J, NING S J, et al. The response of type 2 quorum sensing in Klebsiella pneumoniae to a fluctuating culture environment[J]. DNA & Cell Biology, 2011, 31(4): 455-459.DOI:10.1089/dna.2011.1375.
[28] VAN KESSEL J C, RUTHERFORD S T, CONG J P, et al. Quorum sensing regulates the osmotic stress response in Vibrio harveyi[J]. Journal of Bacteriology, 2015, 197(1): 73-80. DOI:10.1128/JB.02246-14.
[29] HE Z, LIANG J, ZHOU W, et al. Effect of the quorum-sensing luxS gene on biofilm formation by Enterococcus faecalis[J]. European Journal of Oral Sciences, 2016, 124(3): 234-240. DOI:10.1111/eos.12269.
[30] HE Z, LIANG J, TANG Z, et al. Role of the luxS gene in initial biofilm formation by Streptococcus mutans[J]. Journal of Molecular Microbiology Biotechnology, 2015, 25(1): 60-68.DOI:10.1159/000371816.
[31] HAN X, LEI L, FAN G, et al. Riemerella anatipestifer, lacks luxS, but can uptake exogenous autoinducer-2 to regulate biofilm formation[J].Research in Microbiology, 2015, 166(6): 486-493. DOI:10.1016/j.resmic.2015.06.004.
[32] WANG Y, LI Y, ZHANG Z, et al. Overexpression of luxS cannot increase autoinducer-2 production, only affect the growth and biofilm formation in Streptococcus suis[J]. Scientific World Journal, 2013,2013(2): 924276. DOI:10.1155/2013/924276.
[33] HOUDT R V, MOONS P, AN J, et al. Isolation and functional analysis of luxS in Serratia plymuthica RVH1[J]. FEMS Microbiology Letters,2006, 262(2): 201-209. DOI:10.1111/j.1574-6968.2006.00391.x.
[34] ZHANG M, SUN K, SUN L. Regulation of autoinducer 2 production and luxS expression in a pathogenic Edwardsiella tarda strain[J]. Microbiology, 2008, 154(Pt 7): 2060-2069. DOI:10.1099/mic.0.2008/017343-0.









 5.5 6.5(对照组) 7.5 8.5 pH aa a bc c ab b b luxS基因pfs基因同一基因不同字母表示差异显著(P<0.05),图4、6、8同。
5.5 6.5(对照组) 7.5 8.5 pH aa a bc c ab b b luxS基因pfs基因同一基因不同字母表示差异显著(P<0.05),图4、6、8同。







 2.0 1.6 1.2 0.8 0.4 0.0 20 40 60 80 100(对照组)MRS培养基体积分数/%表达量a a c bc acd b d
2.0 1.6 1.2 0.8 0.4 0.0 20 40 60 80 100(对照组)MRS培养基体积分数/%表达量a a c bc acd b d
 b b luxS基因 pfs基因
b b luxS基因 pfs基因