心脑血管疾病如冠心病、动脉粥样硬化等已经成为严重威胁人类健康的常见病。据报道,长期食用乳酸菌及其制品可降低血清中低密度胆固醇含量,降低心脑血管病的发病率[1]。因此研究乳酸菌的降胆固醇性能及其机理具有重要的现实意义。研究表明,乳酸菌发挥作用取决于细菌能否通过胃肠道而在肠道中发挥作用,即其耐酸性和胆盐耐受性。疏水性是决定细菌非特异性黏附到各种生物和非生物界面的最重要动力之一,因而菌体的细胞表面疏水性与其能否在肠道内定殖息息相关[2]。胆盐水解酶是微生物生长、繁殖过程中产生的一种胞内酶,多存在于革兰氏阳性菌,包括乳杆菌、双歧杆菌、屎肠球菌等,胆盐水解酶可将体内结合型胆盐水解为游离型胆盐,而游离型胆盐不参与肝肠循环,随粪便排出体外[3],因而胆盐水解酶活性是降低体内胆固醇的关键因素。
胆固醇主要是在肝脏内合成,由乙酰辅酶A开始经过一系列的酶促反应合成的,其中3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reducase,HMGCR)是合成反应的限速酶,Chiu等[4]研究乳酸菌能够降低其活性或影响其合成来降低胆固醇的合成,从而降低血清胆固醇水平。目前临床上应用于治疗高胆固醇血症的药物主要是HMGCR竞争性抑制剂,如他汀类药物具有与HMGCR相似的化学结构,使其对HMGCR具有加强的亲和力,因而竞争性抑制HMGCR对胆固醇合成反应的限速步骤的催化活性,减少内源性胆固醇合成来达到降胆固醇功效[5]。这些结果引起了国内外研究人员的普遍关注,目前国内对于降胆固醇乳酸菌的研究尚处于起步阶段,大多数研究集中于菌株的筛选及其特性研究,但对作用机理探讨多基于体外实验,筛选出的具有高效降胆固醇功效的乳酸菌对于体内HMGCR的影响机理研究也很少。因此本实验旨在从开菲尔粒和陈年泡菜水中分离筛选高效降胆固醇的乳酸菌,通过饲喂高血脂动物模型大鼠,检测大鼠血清中胆固醇降解情况以及肝脏中HMGCR基因mRNA表达量,在基因水平分析植物乳杆菌Lactobacillus plantarum DMDL 9010对胆固醇合成代谢相关基因的调控从而推断其可能的机理。
1 材料与方法
1.1 材料、试剂与培养基
开菲尔粒 华南理工大学食品科学与工程学院;陈年泡菜水 广东广州市售。
实验动物:8 周龄SPF级Sprague Dawley(SD)大鼠50 只,体质量160~200 g,购于南方医科大学动物实验中心,许可证号SYXK(粤)2012-0081,合格证编号440021000。
基础饲料:蛋白质20%,脂肪4.2%,碳水化合物50%,由中山大学动物实验中心提供。高脂饲料:猪油10%,胆固醇1%,胆盐0.2%,基础饲料88.8%,混匀造粒,在饲喂大鼠之前进行辐照杀菌。
琼脂糖、溴乙锭、胆固醇、牛胆盐(均为分析纯)广州卯林试剂有限公司;脱氧牛磺胆酸钠、巯基乙酸钠(均为分析纯) 阿拉丁公司;邻苯二甲醛、邻苯二甲醛显色剂、二甲苯、吐温80(均为分析纯) 天津市科密欧化学试剂开发中心;甘油三脂测定试剂盒、总胆固醇试剂盒 中生北控生物技术股份有限公司;引物溶液:HMGCR、LDL-R、CYP7A1和内参基因β-actin由英维捷基公司合成。
MRS-CHOL液体培养基:称取MRS培养基54 g,胆固醇1.0 g,吐温20 mL,牛胆盐3.0 g。将胆固醇置于吐温80中溶解,使其沸腾后充分溶解后趁热缓慢倒入培养基后,呈胶束溶液状态,此培养基的颜色呈不透明的淡黄色。配制好的培养基在121 ℃灭菌20 min后趁热将离心管晃动或上下颠倒振荡,以使该胶状物完全溶解,置于室温中自然冷却。
1.2 仪器与设备
YXQ-LS-18SI立式压力蒸汽灭菌锅 上海博迅公司;pHS-3C精密pH计 上海日岛科学仪器有限公司;EFGC-11155氮吹仪 美国Organomation Associates公司;Aplus mo-5L发酵罐 德国贝朗公司;MK3酶标仪 广东环凯微生物科技有限公司;7500荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国ABI公司。
1.3 方法
1.3.1 降胆固醇乳酸菌初筛
从开菲尔粒和泡菜水中接菌进行平板培养得单菌落,分别挑选单菌落于MRS液体培养基中,将体积分数5%二次活化的菌株接种至含1 mg/mL胆固醇的MRSCHOL培养基中,于37 ℃培养24 h后灭菌处理,经离心(3 000 r/min,10 min),取上清液用邻苯二甲醛比色法[6]于550 nm波长处测量吸光度A。按公式(1)计算胆固醇去除率:
1.3.2 降胆固醇乳酸菌复筛
1.3.2.1 菌株耐酸性测定
调MRS培养基的pH值分别为3.0、4.0、5.0,pH值为6.0的MRS培养基为对照组,分装至各试管。将二次活化后的菌种按体积分数5%接种于上述MRS培养基中,于37 ℃培养3 h后取样,测定OD600nm。按公式(2)计算菌株的耐酸性:
1.3.2.2 菌株耐胆盐测定
将5%二次活化的菌株接种于含有3 g/L胆盐的MRS液体培养基中,于37 ℃厌氧培养24 h。以不加胆盐的MRS肉汤培养基为对照组。倾注于平板在37 ℃厌氧培养48 h。按公式(3)计算菌株的胆盐耐受性:
式中:VC1、VC0分别为测试样品和对照样品中的活菌数/(CFU/mL)。
1.3.2.3 菌株疏水性测定
将5%二次活化的菌株接种于无菌MRS培养基中37 ℃培养16~18 h,离心(9 500 r/min,4 ℃,10 min)收集菌体,50 mmol/L磷酸盐缓冲液离心洗涤2 次,将沉淀用缓冲液悬浮。以缓冲液为空白对照,调整菌体浓度,使其初始浓度在600 nm波长处吸光度约为1。取4 mL调整浊度后的菌液,加入0.8 mL二甲苯,高速涡旋2 min,静置10 min分层,取下层水相在600 nm波长处测其吸光度。按公式(4)计算乳酸菌细胞表面疏水性:
式中:A0和A分别为与二甲苯混匀前、后菌液在600 nm波长处测得的吸光度。
1.3.2.4 菌株胆盐水解酶定性测定
在新鲜配制的MRS液体培养基中添加3 g/L脱氧牛磺胆酸钠、2 g/L巯基乙酸钠、0.37 g/L CaCl2和15 g/L琼脂,121 ℃灭菌15 min,倾倒入无菌平板中,待凝固后把无菌滤纸片均匀放入平板中,在每个滤纸片上滴加10 μL菌液(108~109CFU/mL),于37 ℃厌氧培养72 h。若滤纸片周围有白色沉淀物则认为有胆盐水解酶活性。
1.3.3 菌种鉴定
根据生理生化鉴定、16S rDNA分子鉴定以及乳酸脱氢酶1的上下游DNA序列鉴定菌株的菌种[6-7],并送至广东省保藏中心进行保藏。
1.3.4 大鼠肝组织细胞HMGCR的表达检测
1.3.4.1 菌种预处理
将L. plantarum DMDL 9010按体积分数5%接种于200 mL液体MRS培养基中活化,放置37 ℃培养箱中培养24 h,再次按体积分数为5%接种于发酵罐中进行高密度厌氧培养,在37 ℃、pH 6.8的条件下培养18 h后在8 000 r/min、4 ℃条件下离心15 min,弃去上清液,收集菌泥,按海藻糖(保护剂)与菌泥的体积比为1.5∶1的比例加入,于-40 ℃条件下预冻5 h,使其均匀冻结在容器内壁上,然后进行真空冷冻干燥,干燥18~20 h后,用生理盐水复水后,洗涤两次,测得L. plantarum DMDL 9010菌粉中活菌数为9.30×109CFU/g。
1.3.4.2 大鼠饲养
将50 只8 周龄SPF级SD大鼠按照平均体质量无显著差异随机分为正常组、模型组、阳性组、9010高组、9010低组5组。正常组:普通饲料+无菌生理盐水;模型组:高脂饲料+无菌生理盐水;阳性组:高脂饲料+1 mg/mL阿托伐他汀钙片水溶液;9010高组:高脂饲料+109CFU/mL L. plantarum DMDL 9010菌悬液;9010低组:高脂饲料+107CFU/mL L. plantarum DMDL 9010菌悬液。每组10 只,每只SD大鼠灌胃1 mL/次。在第28、70天将大鼠禁食一夜,腹腔采血。采血后分离血清,2 500 r/min离心10 min取血清。分别参照试剂盒说明,采用酶标仪测定血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)的含量并对比各组间血清指标的差异。第70天时分离肝脏,取其肝组织细胞HMGCR进行实时荧光逆转录PCR检测。
1.3.4.3 引物设计
在基因库中查到HMGCR基因库编号为NM_013134,引物序列为GACCAACCTTCTACCTCAGCAAG和ACAACTCACCAGCCATCACAGT和管家基因β-actin的全长cDNA序列,应用软件进行设计,由英维捷基公司合成。
1.3.4.4 实时荧光定量PCR
用SYBR Green I荧光染料进行定量PCR。按照Ultra SYBR Mixture(with ROX)试剂盒说明书建立25 μL的反应体系,并以无酶水作空白对照。
1.4 数据统计处理与分析
所有实验均重复3次,实验结果表示为 ±s。采用SPSS 19.0统计软件进行统计学分析,数据间的分析采用单因素方差分析(one way ANOVA)和Duncan多重比较法,显著性水平均设定为P小于0.05。采用ABI7500型荧光定量PCR仪计算Ct值、阈值,如公式(5)、(6)所示,用2-ΔΔCt计算各组大鼠肝脏中HMGCR的表达水平,经2-ΔΔCt校正后,将 设为1,其余各组相对正常组含量为2-ΔΔCt。
式中:ACt为待测样品的目的基因Ct均值;BCt为对应内参基因的Ct均值;ΔCt为样品的目的基因Ct值;ΔΔCt为校正值;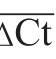 为对照组(正常组)基因Ct值。
为对照组(正常组)基因Ct值。
2 结果与分析
2.1 降胆固醇乳酸菌初筛
表1 分离菌株的体外初步筛选
Table 1 Preliminary screening of lactic acid bacterial isolates in vitro

注:“大”指菌落平均直径大于2 mm;“中等”指菌落平均直径在1~2 mm之间;“小”指菌落平均直径小于1 mm。
从开菲尔粒和陈年泡菜水中分离得29 株菌分别编号为1~18(泡菜水)和S1~S11(开菲尔粒),如表1所示,其胆固醇去除率的范围为0.84%~37.58%,可见不同菌株间胆固醇降解能力差异大,与郭翔等[7]研究结果类似。14株乳酸菌降低介质中胆固醇能力小于10%,占48.28%;胆固醇去除率超过30%的仅有1 株(18号菌株),其胆固醇去除率高达37.58%,即培养基中375.8 μg/mL胆固醇被降解,与李婷婷等[8]研究结果(424.7~583.2 μg/mL)一致,明显高于于志会等[9]的研究结果(14.38~22.40 μg/mL)和王巍等[10]的研究结果(126.2~162.2 μg/mL),可能与培养条件、胆固醇含量、乳酸菌接种量及乳酸菌个体差异等因素有关。最后,初筛结果选取为4、12、14、16、18、S3、S9、S11这8 株降胆固醇能力较强的菌株。
2.2 降胆固醇乳酸菌复筛
2.2.1 菌株的耐酸性
乳酸菌制品通常由食物或以制剂的形式口服,要到达肠道并具有良好的活性就必须能通过胃肠道传输,这就要求乳酸菌能耐受胃液的酸度及胃蛋白酶的作用,并能耐受胆汁、胆盐和胰蛋白酶的作用[11],保证其在胃肠道内具有良好的存活能力,并能持续增长和繁殖。正常人空腹时胃中的pH值在0.9~1.8之间,而食用奶制品或其他食物后,其胃液pH值的波动范围为1.8~5.0,如表2所示,8 株菌的耐酸性随着pH值的降低而不断下降,各菌株的耐酸性存在较大差异。在pH值为3.0时,8 株菌都能生长。此结果与Wang Shuchen等[12]采用平板计数法检测乳酸菌株的耐酸性的结论相似。正常人食用奶制品或其他食物后,其胃液的pH值一般认为3.0左右,故益生菌应具有耐酸性并能够在酸性环境中生长繁殖的特性。由此说明8 株菌可以随食物通过胃并到达小肠。其中,18号菌株表现出最好的耐酸性,其次是S11和S3。
表2 不同菌株的耐酸性(
 s,n= 10)
s,n= 10)
Table 2 Acid tolerance of selected strains ± s, n= 10)%
± s, n= 10)%

2.2.2 菌株的胆盐耐受性
正常人体的小肠的胆盐含量的波动范围在0.03%~0.3%且消化的时间一般为3h[13],测定0.3%胆盐条件下的菌株耐受性,判断乳酸菌是否能在小肠中发挥作用。从表3可看出,菌液在不含胆盐的培养基中生长良好,菌体浓度达到108~109CFU/mL。8 株菌株在含0.3%的胆盐环境中生长3 h后,其活菌数仍能达到106CFU/mL以上,高于菌体发挥功能特性的活菌数临界值[14]。由此表明,8株菌株都能够耐受消化道的高胆盐环境,顺利通过小肠到达大肠。其中18号菌株的胆盐耐受性最强,高达35.48%,其次是S9、S3号菌株。
表3 菌株的胆盐耐受性( s,n=10)
s,n=10)
Table 3 Bile acid tolerance of selected strains s, n= 10)
s, n= 10)

注:同列字母不同表示差异显著(P<0.05),下同。
2.2.3 菌株的疏水性
人体对胆固醇的吸收主要在小肠部位,因此菌体对机体产生调节作用的前题条件是益生菌必须黏附到肠黏膜的表面并定殖在小肠,从而抑制病原菌的黏附和侵袭,提高机体免疫力[15]。乳酸菌黏附到肠细胞是定殖的首要条件,这类黏附既可以是基于物理化学因素的非特异性黏附,也可以是细菌表面含有的脂磷壁酸、肽聚糖和细胞壁蛋白等与肠黏膜细胞的特异性黏附[16]。乳酸菌对小肠细胞的黏附过程与多种因素相关,主要包括疏水作用、静电相互作用或特殊菌体结构[17]。菌株的疏水性如图1所示。根据菌株在水相和二甲苯相中发生的疏水分配来比较其疏水性,结果表明:疏水性10%~20%和20%~30%之间分别有5 株和2 株菌,超过30%的仅1株菌株,其中18号菌株的疏水性最强,高达40%。不同菌株的疏水性差别较大,这与Slim等[18]研究的一致。由此可见18号菌株对二甲苯的吸附能力比较强,其次是S3、S9号菌株。
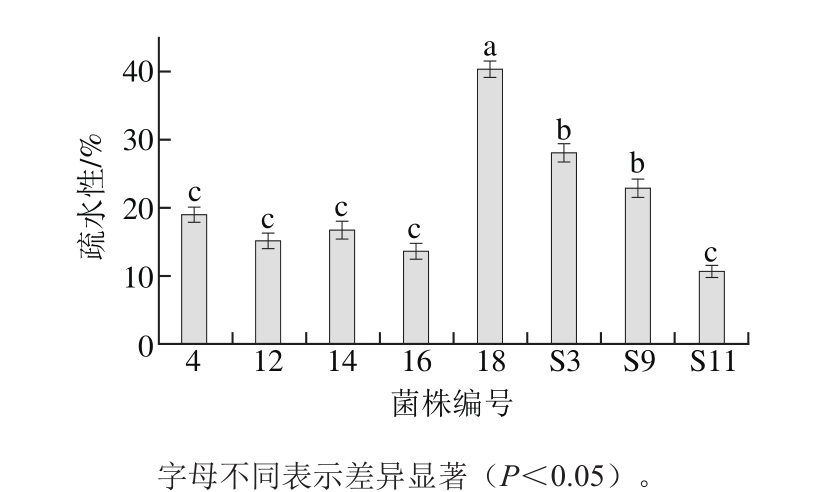
图1 菌株的疏水性
Fig. 1 Hydrophobicity property of selected strains
2.2.4 菌株的胆盐水解酶活性
研究表明,干酪乳杆菌、植物乳杆菌都可以产生胆盐水解酶,具有降低介质和血清中胆固醇的能力[19],胆盐水解酶活性已经成为体外筛选降胆固醇乳酸菌的一个重要指标。菌株的胆盐水解酶活性如图2所示,37 ℃培养72 h后,18号、S3菌株的滤纸片周围有白色沉淀,S9菌株的滤纸片周围无白色沉淀,而对照组滤纸片周围无白色沉淀,说明18号和S3号菌株可能具有胆盐水解酶,它能将结合态胆盐水解为游离胆酸,而游离胆酸与培养基中的CaCl2产生白色沉淀。

图2 菌株的胆盐水解酶活性
Fig. 2 Determination of bile salt hydrolase activity in solid MRS medium
综合以上结果,18号菌株的胆固醇去除率达37.58%,pH 3.0时存活率达80.12%,胆盐耐受性高达35.48%,疏水性高达40%,并且具有胆盐水解酶活性。因此根据生理生化鉴定、16S rDNA分子鉴定以及乳酸脱氢酶1的上下游DNA序列鉴定菌株的菌种[20-21],保藏于中国微生物菌种保藏管理委员会普通微生物中心,简称CGMCC,保藏编号为CGMCC NO.5172,于2011年其首次被鉴定为戊糖乳杆菌DMDL 9010,其16S rDNA 基因库登录序列号为KJ 917253。
2.3 大鼠血清中血脂指标测定结果
表4 各组血脂检测结果比较(x±s,n=10)
Table 4 Serum lipid levels of experimental rats (x ± s, n = 10)mmol/L

如表4所示,饲喂28 d时,模型组的血清TC(1.47±0.23)mmol/L较正常组(1.18±0.19)mmol/L有明显升高,具有统计学意义(P<0.05),且模型组血清LDL-C(0.44±0.11)mmol/L相对于正常组(0.27±0.08)mmol/L显著升高,这说明经过28 d的高脂饲料的饲喂,实验动物的高脂模型成功建立。相比正常组,模型组的血清TC、LDL-C水平较正常组有明显升高,具有统计学意义(P<0.05),说明经过70 d高脂饲料饲喂,导致大鼠体内TC和LDL-C增多,增大了大鼠患心血管疾病的风险。相对模型组,阳性组和9010高组、9010低组的TC、LDL-C均有一定程度的降低,其中阳性组和9010高组有显著性降低(P<0.05),且9010高组能显著降低高脂大鼠血清TC(23.03%)和LDL-C(28.00%),说明连续70 d灌胃阿托伐他汀和乳酸菌对高脂大鼠均具有降低血清胆固醇的效果,且9010高组的效果优于阿托伐他汀。在模型组、阳性组、9010高组、9010低组中,灌胃高剂量乳酸菌的实验组(9010高组)大鼠血清70 d TG含量最低,但是各组之间并无显著性差异(P>0.05)。相对正常组,模型组的血清HDL-C含量显著降低,阳性组和乳酸菌组相对模型组的HDL-C有一定程度的升高,但没有显著性差异(P>0.05),说明连续70 d灌胃阿托伐他汀和乳酸菌对大鼠血清TG和HDL-C的作用不显著。
2.4 大鼠肝组织HMGCR基因mRNA的表达变化
表5 实验组大鼠肝脏中HMGCR mRNA相对表达量
Table 5 Relative expression level of HMGCR mRNA in liver of experimental rats
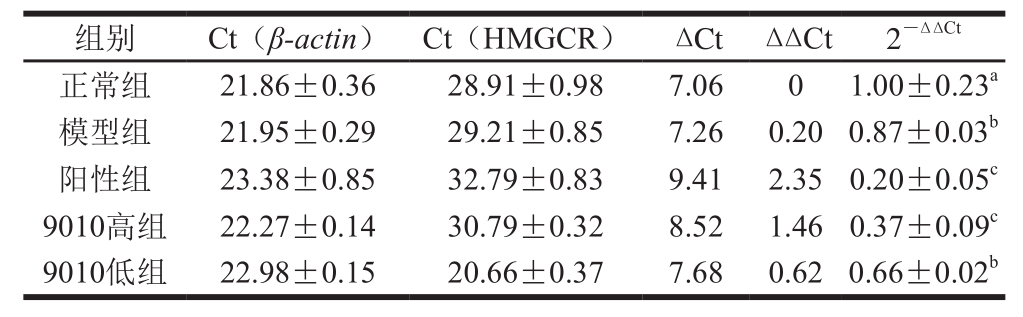
如表5所示,设定正常组的HMGCR基因相对表达量为基准水平1,其余各高脂饲料喂养组HMGCR基因与正常组作对比。相对普通饲料喂养的正常组,各高脂饮食喂养组的HMGCR基因mRNA表达量显著降低,说明饮食来源中过高的胆固醇会减少体内胆固醇的内源性合成,从而抑制胆固醇合成限速酶HMGCR的活性。相对模型组,阳性组的HMGCR基因mRNA表达量降低79.92%(P<0.05),说明阿托伐他汀类药物对HMGCR有明显的抑制作用,可能是因为阿托伐他汀是与HMGCR产生竞争性抑制,与Takeda等[22]研究结果一致。相对模型组,9010高组下调肝脏中HMGCR基因mRNA的表达(62.86%)(P<0.05),说明高剂量DMDL 9010能通过降低HMGCR活性来降低胆固醇合成,因此导致血清胆固醇水平降低。
3 讨论与结论
许多流行病学调查及临床实验证实,心脑血管疾病的主要病理基础是动脉粥样硬化,如LDL-C水平的升高是动脉粥样硬化和冠状动脉粥样硬化性心脏病(冠心病)发生与发展的主要危险因素[23]。国内外大量研究发现乳酸菌在体内外具有降低胆固醇的益生功能,其主要从乳制品和发酵制品中筛选[24-25]。与目前所报道的文献相比较,本实验成功从开菲尔粒和陈年泡菜水中分离筛选出1 株高效降解胆固醇的乳酸菌,经鉴定为L. plantarum DMDL 9010,其胆固醇降解率达37.58%,pH 3.0时存活率达80.12%,胆盐耐受性高达35.48%,疏水性高达40%,并且具有胆盐水解酶活性,是为数不多的满足进入胃肠道存活率高同时高效降胆固醇的乳酸菌。但不同菌株的降胆固醇能力存在一定差异,Anderson等[26]采用随机双盲和安慰剂对照的设计对胆固醇水平为5.40~8.32 mmol/L的48 位志愿者进行研究,发现每天饮用200 g含嗜酸乳杆菌L. acidophilus L1的酸奶10 周后,其血清胆固醇水平比服用安慰剂组显著降低2.4%。Kiebling等[27]对年龄在19~56 岁的29 名健康女性进行研究,发现每天饮用300 g含嗜酸乳杆菌和长双歧杆菌的酸奶21 周后,能显著升高HDL-C水平(P<0.002),并升高了LDL-C与HDL-C的比例。以上结果的差异性由多种因素引起的,包括乳酸菌菌株的差异、乳酸菌的使用剂量、实验周期、样本量大小等因素[28]。本实验将分离的菌株应用到高脂动物模型中进行了验证,结果进一步证明L. plantarum DMDL 9010的降胆固醇效果。
本实验通过给高脂动物模型灌胃L. plantarum DMDL 9010,相对模型组,阳性组和9010高组、9010低组的TC、LDL-C均有一定程度的降低,其中阳性组和9010高组有显著性降低(P<0.05)(表4),且9010高组TC、LDL-C含量最低,说明连续10 周灌胃阿托伐他汀和乳酸菌对高脂大鼠均具有降低血清胆固醇的效果,且高剂量DMDL 9010的效果优于阿托伐他汀。这与Xu Hu等[1]研究发现相一致,L. plantarum NS5能明显降低SD大鼠TC、TG和LDL-C水平。实时荧光逆转录PCR结果显示L. plantarum DMDL 9010和阿托伐他汀能显著下调肝脏中胆固醇合成HMGCR基因mRNA的表达(62.86%和79.92%)(P<0.05)(表5),这一结果与血清中血脂指标相互验证,说明L. plantarum DMDL 9010和阿托伐他汀降低胆固醇途径也可能与抑制胆固醇合成限速酶的表达有关。Fukushima等[29]研究发现给成功建立高脂模型的大鼠饲喂用嗜酸乳杆菌和粪链球菌发酵的米糠后,降低了肝脏中HMGCR的活性,进而降低了血清胆固醇水平。Jungae等[30]研究植物乳杆菌L. plantarum KCTC3928菌体的死活对HMGCR的调控起不同作用,活的植物乳杆菌能够下调HMGCR的表达,而死的菌体则能上调HMGCR的表达,这一发现也验证了高剂量的L. plantarum DMDL 9010能下调肝脏中HMGCR基因mRNA的表达,因而胆固醇水平有一定程度的下降。而Simons等[31]研究发现,46 名受试者被随机分为两组,每天服用4 颗含发酵乳杆菌的胶囊(含2×109CFU)和安慰剂10 周后,受试者的血脂水平没有显著改善。目前,乳酸菌降胆固醇机制包括乳酸菌同化吸收或吸附胆固醇作用、共沉淀作用、同化吸收与共沉淀二者结合等理论。存在这样的争议说明菌株之间具有差异性,其降解胆固醇的机理有很多方面。
本实验结果说明从开菲尔粒和陈年泡菜水中分离筛选的L. plantarum DMDL 9010具有高效降胆固醇能力,其降胆固醇机理可能是影响胆固醇合成限速酶HMGCR的活性,从而影响胆固醇的生成,进一步降低血清中胆固醇的含量。其进一步开发为预防和治疗高胆固醇血症的益生菌制剂提供了可能,但是其降胆固醇的机理仍有待进一步的研究。
参考文献:
[1] XU H, TAO W, WEI L, et al. Effects of NS Lactobacillus strains on lipid metabolism of rats fed a high-cholesterol diet[J]. Lipids in Health and Disease, 2013, 12(7): 890-897. DOI:10.1186/1476-511X-12-67.
[2] LOOSDRECHT M V, LYKLEMA J, NORDE W, et al. The role of bacterial cell wall hydrophobicity in adhesion[J]. Applied and Environmental Microbiology, 1987, 53(8): 1893-1897.
[3] DE S I, DE B P, VERSTRATE W. Cholesterol lowering in pigs through enhanced bacterial bile salt hydrolase activity[J]. British Journal of Nutrition, 1998, 79(2): 185-194.
[4] KANNEL W B, DOYLE J T, OSTFELD A M, et al. Optimal resources for primary prevention of atherosclerotic diseases. Atherosclerotic study group[J]. Circulation, 1984, 70(1): 155A-205A.
[5] 汪维, 童坦君. 胆固醇合成途径的关键酶: HMG辅酶A还原酶和疾病[J]. 生理科学进展, 1999, 43(1): 7-11.
[6] GOPAL P K, PRASAD J, SMART J, et al. In vitro adherence properties of Lactobacillus rhamnosus DR20 and Bifidobacterium lactis DR10 strains and their antagonistic activity against an enterotoxigenic Escherichia coli[J]. International Journal of Food Microbiology, 2001,67(3): 207-216. DOI:10.1016/S0168-1605(01)00440-8.
[7] 郭翔, 艾连中, 吴艳, 等. 植物乳杆菌Lactobacillus plantarum GUO安全性研究[J]. 食品科学, 2009, 30(23): 436-438.
[8] 李婷婷, 张洋, 林超, 等. 降胆固醇优良菌株的筛选及其胆盐水解酶特性研究[J]. 食品工业科技, 2012, 33(24): 191-194. DOI:10.13386/j.issn1002-0306.2012.24.072.
[9] 于志会, 张雪, 李盛钰, 等. 植物乳杆菌C88发酵乳对高脂血症小鼠降胆固醇的作用[J]. 中国乳品工业, 2013, 41(8): 17-19.DOI:10.3969/j.issn.1001-2230.2013.08.004.
[10] 王巍, 邹积宏, 袁杰利. 具有降胆固醇功能益生菌的筛选研究[J].中国微生态学杂志, 2009, 21(4): 297-300. DOI:10.13381/j.cnki.cjm.2009.04.010.
[11] HOOD S K, ZOITOLA E A. Effect of low pH on the ability of Lactobacillus acidophilus to survive and adhere to human intestinal cells[J]. Journal of Food Science, 1988, 53: 1514-1516. DOI:10.1111/j.1365-2621.1988.tb09312.x.
[12] WANG S C, CHANG C K, CHAN S C, et al. Effects of lactic acid bacteria isolated from fermented mustard on lowering cholesterol[J].Asian Pacific Journal of Tropical Biomedicine, 2014, 4(7): 523-528.DOI:10.12980/APJTB.4.201414B54.
[13] 陈梦娜, 尹军霞, 沈国娟. 东北虎肠道降胆固醇乳杆菌的分离鉴定[J].黑龙江畜牧兽医, 2012, 55(19): 142-145. DOI:10.13881/j.cnki.hljxmsy.2012.19.006.
[14] 李岩岩. 鼠李糖乳杆菌与干酪乳杆菌纯种发酵豆乳产品贮藏稳定性及菌体肠道耐受性研究[D]. 保定: 河北农业大学, 2012.
[15] 宣佳, 贾慧, 陈责, 等. 膳食混合胶粒在胆固醇等脂类转运吸收中的作用的研究进展[J]. 食品工业科技, 2017, 38(3): 376-379; 385.DOI:10.13386/j.issn1002-0306.2017.03.066.
[16] HOLZAPFEL W H, HABERER P, SNEL J, et al. Overview of gut flora and probiotics[J]. International Journal of Food Microbiology,1998, 41(2): 85-101. DOI:10.1016/S0168-1605(98)00044-0.
[17] SERVIN A L, COCONNIER M H. Adhesion of probiotic strains to the intestinal mucosa and interaction with pathogens[J]. Best Practice & Research Clinical Gastroenterology, 2003, 17(5): 741-754.DOI:10.1016/S1521-6918(03)00052-0.
[18] SLIM S, LOBNA E, WACIM B, et al. Inhibition of fungi and gramnegative bacteria by bacteriocin BacTN635 produced by Lactobacillus plantarum sp. TN635[J]. Applied Biochemistry & Biotechnology,2010, 162(4): 1132-1146. DOI:10.1007/s12010-009-8821-7.
[19] KUMAR R, GROVER S, BATISH V K. Bile salt hydrolase (Bsh)activity screening of lactobacilli: in vitro selection of indigenous Lactobacillus strains with potential bile salt hydrolysing and cholesterol-lowering ability[J]. Probiotics & Antimicrobial Proteins,2012, 4(3): 162-172. DOI:10.1007/s12602-012-9101-3.
[20] FEI Y, LIU D, LUO T, et al. Molecular characterization of Lactobacillus plantarum DMDL 9010, a strain with efficient nitrite degradation capacity[J]. PLoS ONE, 2014, 9(11): e113792.DOI:10.1371/journal.pone.0113792.
[21] 费永涛. 一株植物乳杆菌的分子鉴定及其亚硝酸盐降解相关基因敲除[D]. 广州: 华南理工大学, 2015.
[22] GIL R A, CAZ V, SMIDERLE F R, et al. Water-soluble compounds from Lentinula edodes influencing the HMG-CoA reductase activity and the expression of genes involved in the cholesterol metabolism[J].Journal of Agricultural and Food Chemistry, 2016, 64(9): 1910-1920.DOI:10.1021/acs.jafc.5b05571.
[23] HUANG Y, WANG J, CHENG Y, et al. The hypocholesterolaemic eあects of Lactobacillus acidophilus American type culture collection 4356 in rats are mediated by the down-regulation of Niemann-Pick C1-like 1[J]. British Journal of Nutrition, 2010, 104(6): 807-812.DOI:10.1017/S0007114510001285.
[24] KUDA T, YAZAKI T, ONO M, et al. In vitro cholesterollowering properties of Lactobacillus plantarum AN6 isolated from ajinarezushi[J]. Letters in Applied Microbiology, 2013, 57(3): 187-192. DOI:10.1111/lam.12094.
[25] 汪晓辉, 于平, 励建荣. 泡菜、传统腊肠中降胆固醇乳酸菌的筛选及鉴定[J]. 微生物学报, 2009, 49(11): 1438-1444. DOI:10.3321/j.issn:0001-6209.2009.11.005.
[26] ANDERSON J, GILLILAND S. Effect of fermented milk (yogurt)containing Lactobacillus acidophilus L1 on serum cholesterol in hypercholesterolemic humans[J]. Journal of the American College of Nutrition, 1999, 18(1): 43-50. DOI:10.1080/07315724.1999.10718826.
[27] KIESSLING G, SCHNEIDER, JAHREIS G. Long-term consumption of fermented dairy products over 6 months increases HDL cholesterol[J]. European Journal of Clinical Nutrition, 2002, 56(9): 95-111. DOI:10.1038=sj.ejcn.1601399.
[28] MIN-TZE L. Probiotics: a critical review of their potential role as antihypertensives, immune modulators, hypocholesterolemics, and perimenopausal treatments[J]. Nutrition Reviews, 2007, 65(7): 316-328. DOI:10.1111/j.1753-4887.2007.tb00309.x.
[29] FUKUSHIMA M, NAKANO M. Effects of a mixture of organisms,Lactobacillus acidophilus or Streptococcus faecalis on cholesterol metabolism in rats fed on a fat- and cholesterol-enriched diet[J].British Journal of Nutrition, 1996, 76(6): 857-867.
[30] JUNGAE J, SUKYUNG K, SUNG Y C, et al. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice[J]. Nutrition, 2010, 26(3): 321-330.DOI:10.1016/j.nut.2009.04.011.
[31] SIMONS L A, AMANSEC S G, CONWAY P. Eあect of Lactobacillus fermentum on serum lipids in subjects with elevated serum cholesterol[J]. Nutrition Metabolism & Cardiovascular Diseases, 2006,16(8): 531-535. DOI:10.1016/j.numecd.2005.10.009.