剁辣椒是我国独具特色的一种发酵辣椒制品[1]。在目前剁辣椒的工业化生产中,其生产方式主要是自然发酵和盐胚脱盐发酵。自然发酵周期长、生产不稳定[2]。盐胚脱盐发酵虽然成本低,加工工艺简单,但风味、滋味和营养物质在较长的贮存期和水洗脱盐过程中损失严重。同时,在发酵过程中所用的原料、加工方式、环境条件、气候条件和菌种不同都会对发酵结果产生影响。而采用乳酸菌接种发酵,不仅缩短发酵时间,而且加工条件简单可控,产品品质稳定,是剁辣椒产业未来的发展方向[3]。
对自然发酵剁辣椒中乳酸菌的分离鉴定,表明剁辣椒中的乳酸菌主要是植物乳杆菌、短乳杆菌等,而采用植物乳杆菌进行纯种发酵可以取得比较好的产品品质[4-8]。酸味是剁辣椒的一个非常重要的滋味品质,其中对酸味起主要作用的有机酸是柠檬酸、乳酸、乙酸等[9]。在蔬菜的自然发酵过程中,菌群的变化导致产生不同的代谢产物。如同型发酵乳酸菌主要产生乳酸,而异型乳酸发酵可产生乙酸、乙醇等物质[10]。乳酸菌利用这些代谢产物,通过丙酮酸激酶等途径,生成额外的ATP,以提高菌体耐环境胁迫的能力[11]。
目前关于剁辣椒发酵过程中微生物菌群及有机酸变化的研究鲜见报道。因此,本实验利用课题组前期筛选到的一株发酵性能优良的植物乳杆菌W-4作为发酵剂菌株进行纯种发酵,以自然发酵剁辣椒为对照,考察发酵过程中剁辣椒中微生物菌群及有机酸的变化规律,为进一步阐明植物乳杆菌在剁辣椒发酵过程中的作用机制提供一定的理论依据。
1 材料与方法
1.1 菌种、培养基与试剂
红线椒、生姜、大蒜籽均购自湘桦连锁超市。植物乳杆菌W-4为本课题组前期分离获得。
马铃薯葡萄糖琼脂(PDA)培养基、平板计数琼脂(PCA)培养基、MRS肉汤培养基 北京陆桥技术有限责任公司;结晶紫中性红胆盐葡萄糖琼脂(VRBA)培养基广东环凯微生物科技有限公司;苹果酸、乙酸、柠檬酸(均为色谱纯) 美国Supelco公司;其他试剂(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
DNP-9272BS-III生化培养箱 上海新苗医疗器械制造有限公司;SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司;普光HH-8数显恒温水浴锅 上海浦东物理光学仪器厂;LDZX-50FBS立式压力蒸汽灭菌器 上海申安医疗器械厂;雷磁pHs-3C pH计 上海精科仪器有限公司;1510型全波长酶标仪 赛默飞世尔科技有限公司;Avanti J-26XP型高速离心机 美国贝克曼库尔特公司;WP-UP-WF-20型微量分析超纯水机四川沃特尔水处理设备有限公司;KQ-700DE型数控超声波清洗器 昆山市超声仪器有限公司;Acquity UPLC H-Class型超高效液相色谱仪 沃特世(Waters)科技(上海)有限公司。
1.3 方法
1.3.1 剁辣椒的制备
工艺路线:
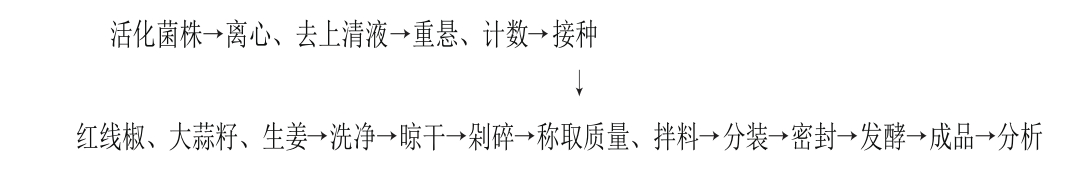
剁辣椒的制备:活化菌株:从斜面挑取植物乳杆菌W-4至MRS液体培养基,37 ℃活化12 h,重复活化一次。将活化菌液按1%的接种量接种MRS液体培养基中,37 ℃恒温培养24 h;接种细胞悬液制备:将植物乳杆菌W-4的培养液4 000 r/min离心5 min,去上清液,再加入无菌生理盐水,调节细胞数为107CFU/mL,密封后放入4 ℃冰箱备用;分别将所有用具(砧板、菜刀、不锈钢盆、汤匙、筷子和具盖玻璃瓶)沸水浴10 min杀菌,烘干备用;将红线椒去蒂、洗净、自然风干,生姜洗净去皮,大蒜籽去皮,剁碎备用;按表1中配方称取原料,先将食盐、白酒、大蒜籽、生姜和氯化钙粉末混合均匀,再将上述混合物拌入碎鲜辣椒(红线椒晾干剁碎制得)中拌匀。分装密封后置于30 ℃恒温培养箱进行发酵,于发酵的不同时间点取样进行检测。
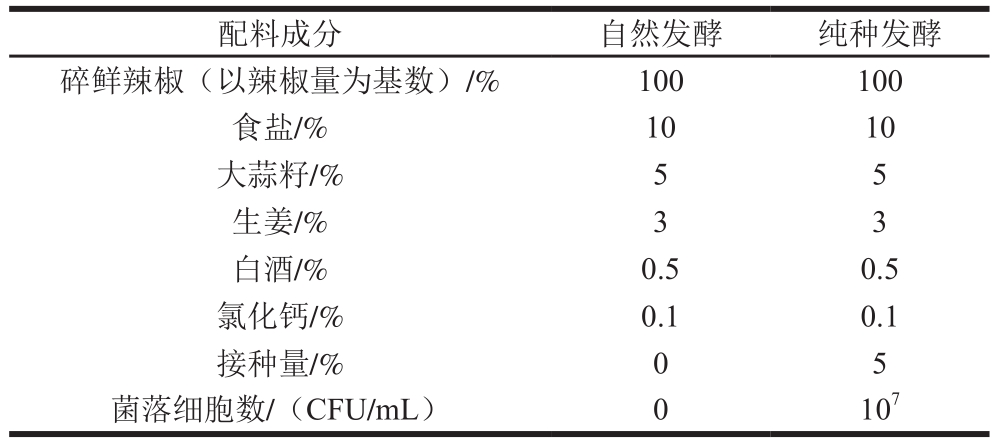
表1 剁辣椒配料
Table 1 Ingredients of chopped pepper
1.3.2 剁辣椒样品的前处理
将蒸馏水煮沸5~10 min,冷水浴快速降温备用(煮沸后30 min内使用);称取剁辣椒样品30 g,加入蒸馏水30 g,研磨成匀浆。
1.3.3 剁辣椒发酵过程中pH值的测定
参照GB 10468—1989《水果和蔬菜产品pH值的测定方法》[12],于发酵第0天、第2天、第4天、第6天、第8天、第10天、第12天分别取自然发酵及植物乳杆菌W-4纯种发酵的剁辣椒样品,粉碎打浆后用pH计直接测定匀浆的pH值。
1.3.4 剁辣椒发酵过程中有机酸含量的测定
1.3.4.1 剁辣椒发酵过程中总酸含量的测定
参照GB/T 12456—2008《食品中总酸的测定》[13]中的方法测定发酵第0天、第2天、第4天、第6天、第8天、第10天、第12天不同剁辣椒样品中的总酸含量。
1.3.4.2 剁辣椒发酵过程中有机酸含量的测定[14-15]
分别称取发酵第2天、第4天、第6天、第8天、第10天的自然发酵及植物乳杆菌W-4纯种发酵的剁辣椒样品25 g,并加入25 g超纯水(放置于4 ℃冰箱过夜以保持较低温度)混匀;用料理机研磨3 min(匀浆30 s,停15 s循环6 次)至匀浆完全粉碎(颗粒均匀且粒度小);准确称取2.000 0 g匀浆至50 mL离心管中,再加入约18 g超纯水,盖上离心管盖,超声提取30 min(25 ℃),期间振摇3 次使提取完全;称量离心管质量,并加入超纯水平衡后,离心(10 000 r/min,15 min,15 ℃)。取上清液至25 mL容量瓶,超纯水定容;溶液过0.2 μm亲水系微孔膜至2 mL安瓿瓶,分别编号后上机测定有机酸浓度,每个样品做3 次平行实验。
标准曲线的绘制:分别取柠檬酸、乳酸、乙酸、苹果酸色谱纯标准品配制质量浓度为500 μg/mL的溶液,再分别稀释成质量浓度为25、50、100、200、300、400 μg/mL的标准溶液。每种质量浓度为400 μg/mL的标准溶液取100 μL混匀后过膜,得到每种标准溶液质量浓度均为100 μg/mL的混和标准样品。
色谱条件:流动相:A:准确称取磷酸二氢钾1.360 9 g,加超纯水定容至1 L,用磷酸调至pH值为2.2。再用砂芯过滤装置真空抽滤溶液过0.20 μm滤膜后备用。B:100%色谱纯级甲醇。洗脱方式:等度洗脱(A:97%,B:3%);流速:0.2 mL/min;进样体积:1 μL;测量波长:210 nm;柱温:37 ℃;运行时间:15 min。
1.3.5 剁辣椒发酵过程中的微生物菌群的检测
参照GB 4789—2010《食品微生物学检验》[16]中霉菌和酵母计数、菌落总数测定、大肠杆菌计数(第二法)、乳酸菌检验中的方法进行微生物菌群的测定。
用经沸水浴15 min灭菌的药匙从密封发酵的分装玻璃瓶中取样,分别称取自然发酵及植物乳杆菌W-4纯种发酵第2天、第4天、第6天、第8天、第10天的剁辣椒样品25.0 g,转至盛有225 mL无菌生理盐水的锥形瓶中。剧烈振摇锥形瓶20 min,使样品中微生物充分分散于溶液体系中;将该溶液进行梯度稀释,选择合适稀释度,分别取1 mL稀释液转接至无菌平板中,分别倒入融化后的MRS培养基、PDA培养基、PCA培养基、VRBA培养基。PDA平板置于28 ℃恒温培养箱,其余3 种菌种平板培养基置于37 ℃恒温培养箱,恒温培养24~48 h,观察培养结果并进行平板计数。
2 结果与分析
2.1 不同发酵方式剁辣椒发酵过程中的pH值变化
由图1可知,在剁辣椒发酵过程中pH值随发酵的进行而降低,2 种剁辣椒的起始pH值均在4.95左右。随发酵时间的延长,接种发酵的剁辣椒pH值逐步降低至4左右并趋于平稳,而自然发酵剁辣椒从发酵初期开始pH值就呈现缓慢降低的趋势,且变化不明显。原因是接种发酵接入的植物乳杆菌W-4数量较大,主导了整个发酵的过程,因而发酵产酸速度更快、pH值变化更大。而自然发酵至12 d pH值依旧未降至4左右,表明其发酵过程中产酸较慢,发酵过程慢。pH值的快速降低能有效抑制一些腐败微生物的生长,提高发酵蔬菜的安全性[17]。
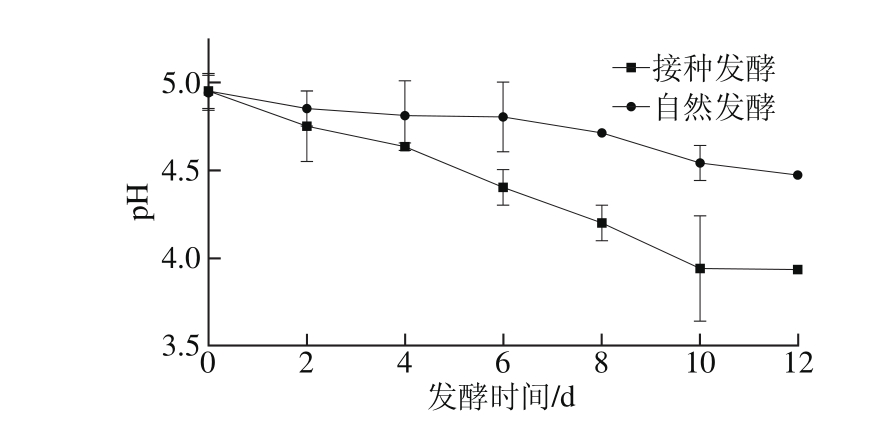
图1 剁辣椒发酵过程中pH值的变化
Fig. 1 Change in pH value during the fermentation of chopped pepper
2.2 剁辣椒发酵过程中总酸含量的变化
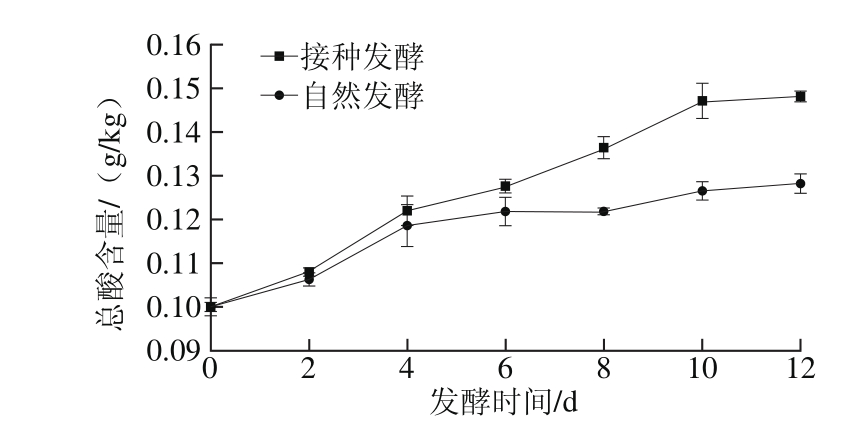
图2 剁辣椒发酵过程中总酸含量的变化
Fig. 2 Change in total acid content during the fermentation of chopped pepper
由图2可知,在剁辣椒发酵过程中总酸含量随发酵时间的延长而增加,相对而言,接种发酵的总酸含量变化更明显,产酸量更大。接种发酵中总酸含量则是从第0天开始一直呈快速增长趋势,从第10天开始总酸含量趋于平稳。原因是接种发酵中人工转接了优良乳酸菌纯菌种,使得瓶内乳酸菌初始菌浓度远高于其他微生物,具有竞争优势。故而发酵初期乳酸菌能快速增长、产酸使得剁辣椒中总酸含量高于自然发酵。
2.3 剁辣椒发酵过程中有机酸的变化规律
2.3.1 苹果酸含量的变化
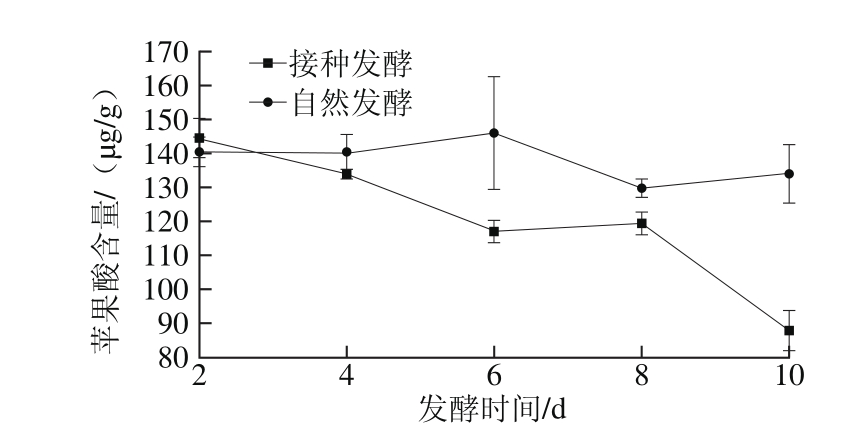
图3 剁辣椒发酵过程中苹果酸含量的变化
Fig. 3 Change in malic acid content during the fermentation of chopped pepper
从图3可以看出,自然发酵剁辣椒中的苹果酸含量随发酵进程降低缓慢。接种发酵剁辣椒中的苹果酸含量随发酵进程不断下降,在第10天时大幅降低。发酵剁辣椒中苹果酸含量整体呈现下降趋势的原因可能是由于苹果酸可以在烟酰胺腺嘌呤二核苷酸存在条件下,生成丙酮酸,随后生成乙酰辅酶A进入三羧酸循环[18-19]。
2.3.2 柠檬酸含量的变化
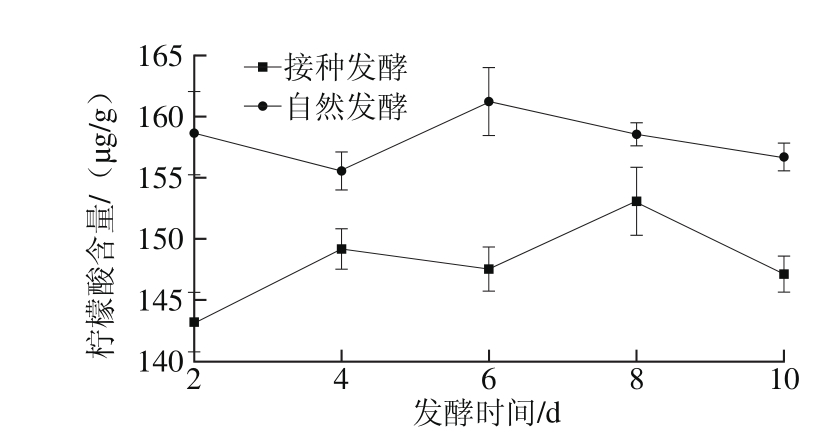
图4 剁辣椒发酵过程中柠檬酸含量的变化
Fig. 4 Change in citric acid content during the fermentation of chopped pepper
由图4可知,自然发酵剁辣椒中柠檬酸含量明显高于接种发酵。自然发酵剁辣椒的柠檬酸含量在第6天时达到峰值161.2 μg/g。而接种发酵中柠檬酸含量则在第8天时达到峰值153.0 μg/g。柠檬酸作为辣椒产生青气味的主要来源之一,在发酵熟化过程中会被微生物所代谢。同时,乳酸菌等微生物发酵也会产生少量柠檬酸,因此造成发酵过程中柠檬酸含量呈现波动变化。
2.3.3 乳酸含量的变化
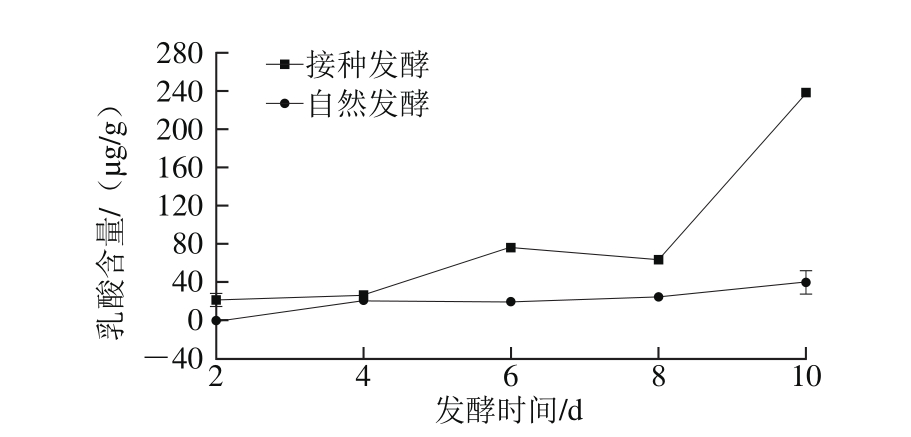
图5 发酵过程中乳酸含量的变化
Fig. 5 Change in lactic acid content during the fermentation of chopped pepper
从图5可以看出,接种发酵剁辣椒中乳酸含量随发酵时间变化呈不断上升趋势,第8~10天增长最为迅速,且整体含量明显高于自然发酵剁辣椒。相比较于自然发酵,接种发酵由于接入了优良乳酸菌,乳酸菌的初始活菌数远高于自然发酵,因而在接种发酵中乳酸菌能尽早成为优势菌群,代谢营养物质并大量产生乳酸。在自然发酵中,因发酵时间短,乳酸菌在发酵环境中需要与大量其他微生物竞争生长,因此数量较低,产生的乳酸少。
2.3.4 乙酸含量的变化
通过测定发酵第2天、第4天、第6天、第8天、第10天时剁辣椒中乙酸的含量时发现,接种发酵在整个发酵过程中均未检出乙酸。而在自然发酵第2天时,剁辣椒中乙酸含量为(20.21±0.56)μg/g,而在随后几个发酵时间点的样品中,均未检出乙酸。可能的原因是自然发酵中一些异型发酵的乳酸菌代谢产生少量的乙酸,随着发酵的进行,乙酸可与酵母代谢所产生的醇类等物质产生酯化反应,生成了其他的物质[20]。而植物乳杆菌作为同型乳酸发酵乳酸菌,接种发酵产生的乙酸含量较自然发酵要少[21]。
2.4 剁辣椒发酵过程中的菌群变化规律
将植物乳杆菌W-4活化发酵、自然发酵,置于30 ℃恒温发酵。采用稀释平板法,分别对发酵第2天、第4天、第6天、第8天、第10天发酵剁辣椒中的菌落总数、乳酸菌、真菌(霉菌和酵母菌)和大肠杆菌这4 个微生物指标进行计数。
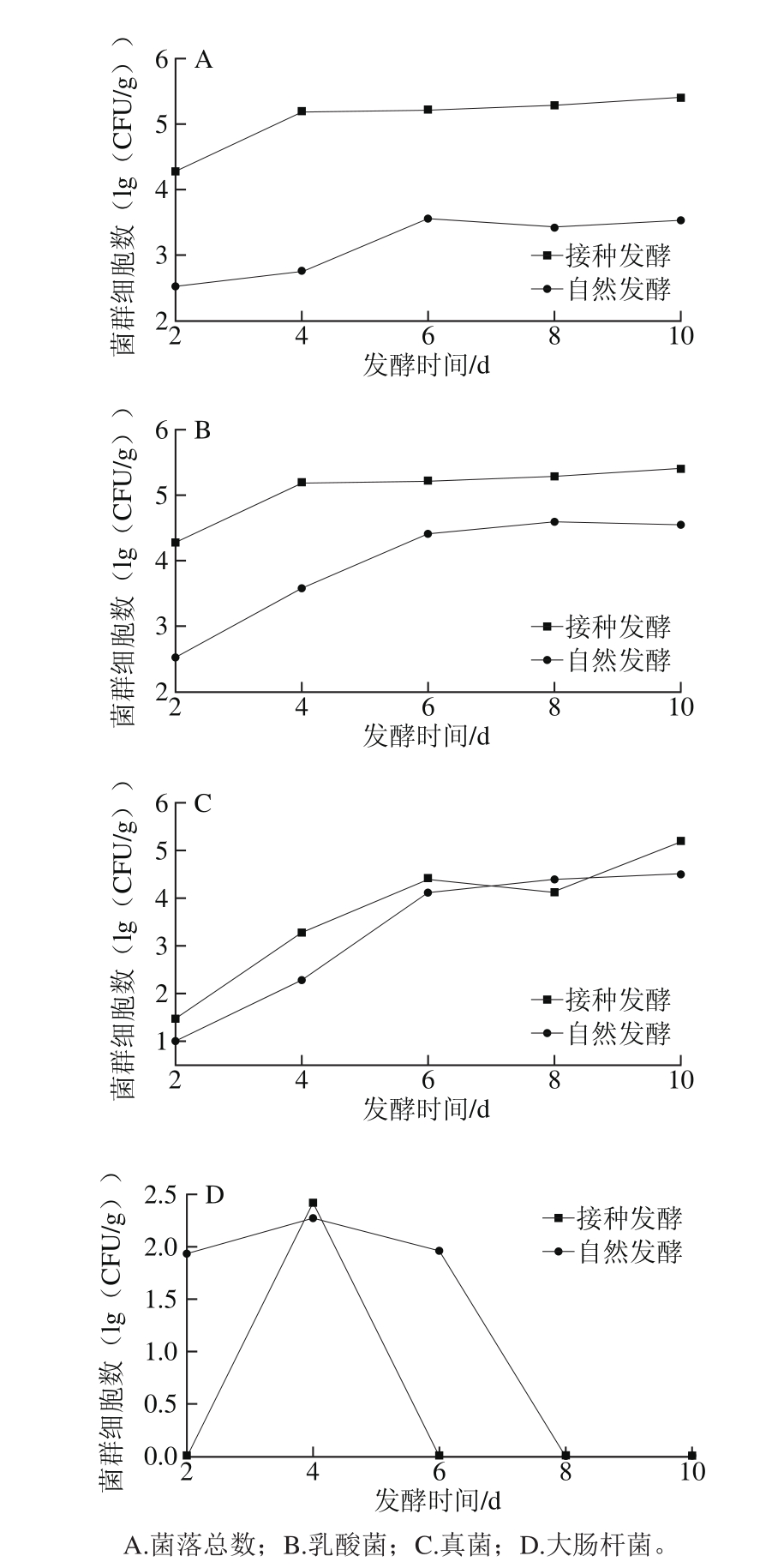
图6 剁辣椒发酵过程中菌群变化曲线
Fig. 6 Change in microflora during the fermentation of chopped pepper
由图6A和6B可知,自然发酵和接种发酵整体的菌落总数和乳酸菌数量呈先升后平缓的趋势。接种发酵的菌落总数和乳酸菌数量在发酵的整个过程中均高于自然发酵,这与接入大量植物乳杆菌W-4有关。接种发酵从第4天后,菌落总数和乳酸菌数量基本趋于稳定。自然发酵则在发酵第6天后基本维持不变。曲线所呈现的趋势主要因为在发酵初期,养分充足,微生物在适应环境后能快速生长。随发酵的不断进行,微生物代谢所产生的乳酸、乙醇等具有抗菌活性的物质,改变了环境条件,使得菌株生长放缓,微生物数量逐渐趋于稳定。
由图6C可知,2 种发酵方式下霉菌、酵母菌(检出菌株主要是酵母菌)等真菌初始菌种浓度相近,随发酵的进行其数量也在不断上升。发酵0~6 d内,环境营养丰富,酸度适宜,霉菌、酵母菌等真菌数量快速增长。发酵6~8 d内,pH值持续降低,大量乳酸菌生长均对霉菌、酵母菌有抑制作用,其生长速度减缓。第8天后,随着pH值进一步降低,环境对乳酸菌的抑制作用开始显现,相对受到影响更小的酵母菌则逐步成为优势菌株生长速度再次提升,活菌数变大直至趋于最大值。
由图6D可知,大肠杆菌在发酵初期因为辣椒本身或者用具携带使得密封辣椒被少量污染。随着剁辣椒发酵不断进行,乳酸菌会通过代谢产生的乳酸、腌制中的盐抑制大肠菌群的生长,至发酵中后期时大肠杆菌已无法检出[22]。
3 结论与讨论
由于微生物的作用,辣椒在发酵过程中会产生大量的有机酸,赋予发酵辣椒适宜的酸味,同时这些有机酸与其他物质相互作用,增加了发酵辣椒的风味。不同有机酸具有不同的酸味特征,如柠檬酸有爽快的酸味,苹果酸具有温和和爽快的酸味,略有苦味,而乳酸的酸味则较为尖利。发酵辣椒中主要的有机酸为乳酸、柠檬酸、苹果酸、乙酸等。
接种发酵产生的总酸含量要高于自然发酵,但与前人研究结果相比[23-24],本研究中总酸及有机酸的测定结果都偏小,这可能与辣椒原料本身有关。接种植物乳杆菌W-4发酵,能加快乳酸发酵的进程,剁辣椒中乳酸的含量要高于自然发酵,这与前人的研究结果一致[25]。相比较于接种发酵,自然发酵剁辣椒则具有较高含量的柠檬酸和苹果酸,在发酵过程中,柠檬酸与苹果酸含量的变化规律不明显,而接种发酵中苹果酸含量呈现下降趋势,可能与苹果酸生成丙酮酸参与三羧酸循环有关。乙酸只在自然发酵过程中检出,而在接种发酵中并未检出,可能的原因是乙酸在发酵剁辣椒中含量本身较低,低含量的乙酸较快地与短链的醇类物质进行酯化反应,而自然发酵过程中可能存在异型乳酸发酵的乳酸菌,生成了乙酸。
对发酵过程中微生物菌群的研究结果表明,随着剁辣椒发酵不断进行,大肠杆菌逐渐被抑制,直至消失,这说明剁辣椒具有较高的微生物安全性,这与发酵蔬菜中的酸度不断上升有直接的关系[26]。另外,实验结果也发现在剁辣椒发酵过程中,酵母菌也以较高的数量(约为105CFU/g)与乳酸菌一起生长。有研究表明在四川榨菜和泡菜发酵过程中,有乳酸菌和酵母菌的共同参与[27-28],但酵母菌主要存在于泡菜发酵的前期,随后逐渐减少直至消失[29]。徐浩等[30]也从高盐辣椒坯中分离得到1 株耐盐的鲁氏接合酵母,接种发酵结果表明高盐剁辣椒风味良好,色泽红艳,脆感较好。酵母菌作为发酵蔬菜中的常见微生物,其代谢产物乙醇等物质直接参与了风味物质的形成。而在剁辣椒发酵过程中,酵母菌是否参与了剁辣椒风味品质的形成,乳酸菌与酵母菌如何相互作用,其相互作用是否决定了剁辣椒的品质,仍不清楚,则需进一步研究酵母菌在剁辣椒品质形成中的作用机制。
参考文献:
[1] LI J Y, ZHAO F, LIU H H, et al. Fermented minced pepper by high pressure processing, high pressure processing with mild temperature and thermal pasteurization[J]. Innovative Food Science and Emerging Technologies, 2016, 36: 34-41. DOI:10.1016/j.ifset.2016.05.012.
[2] 胡博涵, 吴晖, 赖富饶, 等. 耐盐乳酸菌的筛选及其在剁辣椒发酵中的应用[J]. 食品与机械, 2014, 30(1): 51-54; 70.
[3] EDDY J S, CHRISTOPHE L. Microbe-microbe interactions in mixed culture food fermentations[J]. Current Opinion in Biotechnology,2013, 24: 148-154. DOI:10.1016/j.copbio.2012.11.007.
[4] 赵玲艳, 邓放明, 杨抚林, 等. 自然发酵辣椒中乳酸菌的分离及其发酵性能研究[J]. 食品科学, 2005, 26(10): 82-86. DOI:10.3321/j.issn:1002-6630.2005.10.014.
[5] 钟燕青. 自然发酵辣椒中乳酸菌分离筛选及香气成分分析[D].长沙: 湖南农业大学, 2012.
[6] 王兰, 赵玲艳, 陈思思, 等. 发酵辣椒中产亚硝酸盐还原酶短乳杆菌L5的选育及特性研究[J]. 中国酿造, 2014, 33(11): 25-29.DOI:10.11882/j.issn.0254-5071.2014.11.006.
[7] 王丽芳, 王修俊, 郑君花, 等. 发酵辣椒中一株乳酸菌的分离鉴定及其生长特性的研究[J]. 中国调味品, 2014, 39(6): 67-72.DOI:10.3969/j.issn.1000-9973.2014.06.016.
[8] 王修俊, 王丽芳, 郑君花, 等. 贵州发酵辣椒中优良乳酸菌的分离鉴定及生长特性研究[J]. 食品科技, 2014, 39(10): 17-21.
[9] 贾洪锋, 贺稚非, 李洪军, 等. 高效液相色谱法测定发酵辣椒中的有机酸[J]. 食品科学, 2008, 29(3): 374-379. DOI:10.3321/j.issn:1002-6630.2008.03.079.
[10] BLANDINO A, AI-ASEERI M E, PANDIELLA S S, et al. Cereal based fermented foods and beverages[J]. Food Research International,2003, 36: 527-543. DOI:10.1016/S0963-9969(03)00009-7.
[11] SCHMITT P, DIVIÈ C, CARDONA R. Origin of end-products from the co-metabolism of glucose and citrate by Leuconostoc mesenteroides subsp. cremoris[J]. Applied and Microbiological Biotechnology, 1992, 36: 679-683.
[12] 国家标准化管理委员会. 水果和蔬菜产品pH值的测定方法: GB 10468—1989[S]. 北京: 中国标准出版社, 1989.
[13] 国家质量监督检验检疫总局, 国家标准化管理委员会. 食品中总酸的测定: GB/T 12456—2008[S]. 北京: 中国标准出版社, 2009.
[14] LIU F X, FU S F, BI X F, et al. Physico-chemical and antioxidant properties of four mango (Mangifera indica L.) cultivars in China[J]. Food Chemistry, 2013, 138(1): 396-405. DOI:10.1016/j.foodchem.2012.09.111.
[15] 卢星军. 辣椒汁工业化生产技术研究及应用[D]. 长沙: 湖南农业大学, 2015.
[16] 卫生部. 食品微生物学检验: GB 4789—2010[S]. 北京: 中国标准出版社, 2010.
[17] PIATARINO E, ALIAKBARIAN B, CASAZZA A, et al. Combined eあect of starter culture and temperature on phenolic compounds during fermentation of Taggiasca black olives[J]. Food Chemistry, 2013,138(2/3): 2043-2049. DOI:10.1016/j.foodchem.2012.11.021.
[18] ANSANAY V, DEQUIN S, BLONDIN B, et al. Cloning, sequence and expression of the gene encoding the malolactic enzyme from Lactococcus lactis[J]. FEBS Letters, 1993, 332(1/2): 74-80.DOI:10.1016/0014-5793(93)80488-G.
[19] FLEMING H P, MCFEETERS R F, DAESCHEL M A. The lactobacilli, pediococci, and leuconostocs: vegetable products[M].Boca Raton: CRC Press, 1985: 97-118.
[20] XIONG T, LI J B, LIANG F, et al. Effects of salt concentration on Chinese sauerkraut fermentation[J]. LWT-Food Science and Technology, 2016, 69: 169-174. DOI:10.1016/j.lwt.2015.12.057.
[21] XIONG T, PEN F, LIU Y Y, et al. Fermentation of Chinese sauerkraut in pure culture and binary co-culture with Leuconostoc mesenteroides and Lactobacillus plantarum[J]. LWT-Food Science and Technology,2014, 59: 713-717. DOI:10.1016/j.lwt.2014.05.059.
[22] LI X F, NING Y W, LIU D, et al. Metabolic mechanism of phenyllactic acid naturally occurring in Chinese pickles[J]. Food Chemistry, 2015,186(1): 265-270. DOI:10.1016/j.foodchem.2015.01.145.
[23] 罗凤莲. 湖南剁椒腌制过程中风味及品质变化规律研究[D]. 长沙:湖南农业大学, 2014.
[24] 罗凤莲, 夏延斌, 文新昱. 不同发酵条件对剁辣椒中有机酸种类及含量的影响[J]. 食品科技, 2015, 40(11): 48-52. DOI:10.13684/j.cnki.spkj.2015.11.010.
[25] DI CAGNO R, SURICO R F, MINERVINI G, et al. Use of autochthonous starters to ferment red and yellow peppers (Capsicum annum L.) to be stored at room temperature[J]. International Journal of Food Microbiology, 2009, 130(2): 108-116. DOI:10.1016/j.ijfoodmicro.2009.01.019.
[26] YAN P M, XUE W T, TAN S S, et al. Eあect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J]. Food Control, 2008, 19(1): 50-55. DOI:10.1016/j.foodcont.2007.02.008.
[27] 付晓红. 榨菜腌制过程中微生物区系多样性分析及发酵剂研制[D].重庆: 重庆大学, 2009.
[28] 张蓓蓓, 王柱, 王宪斌, 等. 四川地区泡菜微生物的多样性分析[J].食品与发酵科技, 2016, 52(1): 1-5; 10. DOI:10.3969/j.issn.1674-506X.2016.01-001.
[29] 曾骏. 传统四川泡菜发酵过程中酵母菌的动态变化规律及发酵性能研究[D]. 成都: 四川农业大学, 2013.
[30] 徐浩, 刘素纯, 聂荣, 等. 用于发酵型风味剁辣椒耐盐酵母菌的筛选[J]. 现代食品科技, 2013, 29(5): 1076-1079; 1197. DOI:10.13982/j.mfst.1673-9078.2013.05.046.
 碎鲜辣椒(以辣椒量为基数)/% 100 100食盐/% 10 10大蒜籽/% 5 5生姜/% 3 3白酒/% 0.5 0.5氯化钙/% 0.1 0.1接种量/% 0 5菌落细胞数/(CFU/mL) 0 10
碎鲜辣椒(以辣椒量为基数)/% 100 100食盐/% 10 10大蒜籽/% 5 5生姜/% 3 3白酒/% 0.5 0.5氯化钙/% 0.1 0.1接种量/% 0 5菌落细胞数/(CFU/mL) 0 10