大豆是中国主要农作物之一,常被用来生产大豆蛋白,而大豆糖蜜是生产大豆浓缩蛋白过程中产生的副产物,据报道,每生产1 t醇法大豆浓缩蛋白将得到大约0.34 t大豆糖蜜[1],因大豆糖蜜黏稠度高、色泽深,处理起来有很大的难度,故大部分大豆加工厂将其作为废弃物或用作动物饲料低价出售,由于大豆糖蜜中大多数碳水化合物是结构多糖和含有半乳糖的低聚糖如水苏糖和棉子糖,动物可能缺乏必要的内源酶来消化这些碳水化合物,因此又在一定程度上造成了资源浪费等问题[2]。同时,大豆糖蜜的组分丰富,含有高浓度的碳水化合物、蛋白质、脂肪、氨基酸和矿物质等[3-5],所以大豆糖蜜是一种可以被再度利用的生物资源。近年来,关于大豆糖蜜中功能性成分的研究成果被大量报道,为大豆糖蜜资源的开发和利用提供了广阔的前景。因大豆糖蜜中含有丰富的营养成分,常作为微生物的生长发酵剂。据Siqueira等[4]研究,大豆糖蜜的碳水化合物主要是由水苏糖、棉子糖和蔗糖组成。目前,国内外大量学者研究以大豆糖蜜作为微生物的碳源来生产乳酸[6-7]、柠檬酸[8]、乙醇[9-10]等,且与常用的碳源葡萄糖相比,大豆糖蜜的价格仅为其20%,因此可以极大地节约成本并提高利润[11]。
乳酸又可称为α-羟基丙醇酸,广泛存在于人类、动物和微生物的代谢机制中。乳酸作为21世纪最具应用潜力的有机酸之一[12],既是重要的有机化工原料,又是重要的精细化学品,乳酸及其衍生物被广泛应用于食品、饲料、日用品、化工等行业[13-16]。乳酸在全球的生产量已超越柠檬酸和乙酸,位居第一[17],且为了大力开发环境友好型的生物可降解材料,乳酸将会逐渐替代石油基塑料产品。目前乳酸的生产方法主要有化学合成法、酶法及微生物发酵法[18]。国内外企业常用的生产乳酸方法是微生物发酵法,这主要是微生物发酵法可利用的原料来源广泛,成本也较低,且生产的乳酸光学纯度高,安全性好。
大豆糖蜜含有多种碳水化合物,主要含有的大量棉子糖和水苏糖,大部分酵母菌均难以利用,而乳酸菌在代谢过程中能够产生α-半乳糖苷酶水解水苏糖和棉子糖生成乳酸和乙酸[19-20]。因此,本实验选用6 株乳酸菌发酵大豆糖蜜生产乳酸,通过乳酸菌的生长特征、乳酸产量、大豆糖蜜的糖代谢来分析乳酸菌利用大豆糖蜜以及生产乳酸的能力,为大豆糖蜜的利用提供应用的理论基础。
1 材料与方法
1.1 材料与试剂
植物乳杆菌植物亚种(Lactobacillus plantarum subsp.plantarum)CICC23168 中国工业微生物菌种保藏管理中心;德氏乳杆菌保加利亚亚种(L. delbrueckii ssp.bulgaricus)KLDS1.8501、嗜酸乳杆菌(L. acidophilus)KLDS1.0327来自于乳品科学教育部重点实验室;嗜酸乳杆菌(L. acidophilus)ATCC11975、干酪乳杆菌(L. casei)ATCC393 美国典型培养物保藏中心;植物乳杆菌(L. plantarum)NAU322来自于实验室筛选菌株。大豆糖蜜购自大庆日月星有限责任公司,大豆糖蜜的主要成分测定结果如表1所示。
表1 大豆糖蜜的化学成分
Table 1 Chemical composition of soybean molasses
MRS肉汤活化培养基:酪蛋白胨10 g,牛肉膏10 g,酵母膏5 g,柠檬酸三铵2.0 g,葡萄糖20.0 g,吐温80 1 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸镁0.5 g,硫酸锰0.05 g,蒸馏水1 000 mL,121 ℃灭菌15 min。
大豆糖蜜培养基:酪蛋白胨10 g,牛肉膏10 g,酵母膏5 g,柠檬酸三铵2.0 g,吐温80 1 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸镁0.5 g,硫酸锰0.05 g,15 °Brix大豆糖蜜1 000 mL、pH 6.0、121 ℃灭菌15 min。种子培养基同大豆糖蜜发酵培养基。
1.2 仪器与设备
Alliance 2695高效液相色谱仪、XBridge Amide色谱柱 美国Waters公司;Allegra X-30R多功能台式离心机 美国贝克曼库特公司;超净工作台 哈尔滨市东联电子技术开发有限公司;HPX-87H色谱柱 美国伯乐有限公司。
1.3 方法
1.3.1 菌种的储存和活化
将冻干的菌株在MRS肉汤培养基活化,再将活化后的菌液接种于种子培养基中,于37 ℃恒温培养用于随后的实验。所有步骤都要求在无菌室操作进行。
1.3.2 乳酸菌发酵大豆糖蜜
分别将L. delbrueckii ssp. bulgaricus KLDS1.8501、L. acidophilus KLDS1.0327、L. acidophilus ATCC11975、L. plantarum subsp. plantarum CICC23168、L. casei ATCC393和L. plantarum NAU322接种于大豆糖蜜培养基。大豆糖蜜的可溶性固形物浓度通过加蒸馏水稀释调节至15 °Brix。大豆糖蜜发酵培养基pH值用1 mol/L的NaOH溶液调至6.0。菌株在MRS肉汤培养基被活化,接种到种子培养基中,然后将种子培养液转移到大豆糖蜜发酵培养基中,初始细胞浓度控制在1.05×107CFU/mL。在最佳温度下,每隔8 h取样,对发酵液中的乳酸菌活细胞数、碳水化合物含量及乳酸产量进行测定分析。
1.3.3 指标成分的测定
1.3.3.1 乳酸菌活细胞数的测定
按照1.3.2节操作,每隔8 h取样大豆糖蜜发酵液,稀释涂布平板测定活细胞数。
1.3.3.2 大豆糖蜜组成成分的测定
大豆糖蜜中的碳水化合物采用高效液相色谱法测定。蛋白质采用凯氏定氮法测定[21]。脂质经正己烷萃取后采用质量分析法测得[22]。大豆糖蜜样品在550 ℃燃烧后用质量分析法测定灰分[23]。大豆糖蜜在105 ℃干燥后通过质量分析法测得水分含量[24]。
1.3.3.3 碳水化合物消耗量的测定
采用高效液相色谱测定发酵液中蔗糖、棉子糖、水苏糖的含量。色谱条件为:Waters Alliance 2695色谱仪;色谱柱为Waters XBridge Amide(150 mm×4.6 mm,3.5 μm);检测器为Waters 2487示差检测器;流动相为75%乙腈溶液;柱温为55 ℃;流速为1 mL/min;进样量为10 μL。
以峰面积为纵坐标,分别以蔗糖、棉子糖及水苏糖含量为横坐标绘制标准曲线,得回归方程及相关系数:蔗糖:y=7 023.2x+1661.5,R2=0.995 6;棉子糖:y=6 014.7x-99.104,R2=0.999 8;水苏糖:y=2 580.6x-6 298,R2=0.992 4。碳水化合物消耗量和利用率分别按公式(1)和(2)进行计算:

1.3.3.4 乳酸产生量的测定
采用液相色谱测定发酵液中乳酸的含量。色谱条件为:色谱仪为Waters Alliance 2695;色谱柱为Bio-Rad HPX-87H(300 mm×7.8 mm,9 μm);检测器为Waters 2487示差检测器;流动相为5 mmol/L H2SO4溶液;柱温为40 ℃;流速为0.5 mL/min;进样量为20 μL。
以峰面积为纵坐标、乳酸产生量为横坐标绘制标准曲线,得回归方程及相关系数:y=9 034.9x+8 224.4,R2=0.999 8。乳酸产生量按公式(3)进行计算:
1.4 数据统计
每个实验重复3 次,采用Microsoft Excel软件计算平均值和标准差。方差分析采用SPSS软件中的One-Way ANOVA进行分析;相关性分析采用SPSS软件中的皮尔逊相关系数进行分析;采用Origin 9.0软件进行绘图;采用Microsoft Word进行表格制作。
2 结果与分析
2.1 乳酸菌菌株的生长特征
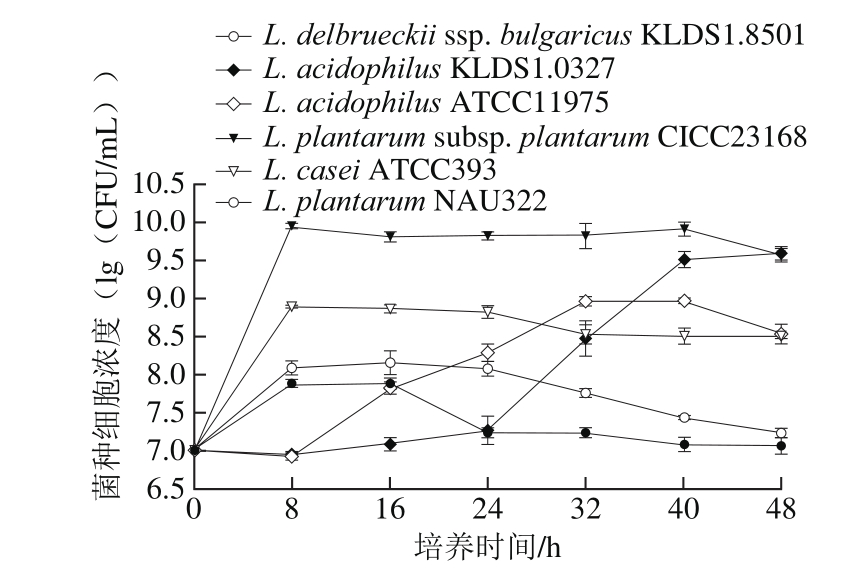
图1 6 种菌株在15 °Brix大豆糖蜜中的生长特征(37 ℃,pH 6.0)
Fig. 1 Growth characteristics of six different strains in soybean molasses at 15 °Brix (37 ℃, pH 6.0)
如图1所示,在15 °Brix的大豆糖蜜中,在37 ℃、pH 6.0条件下,L. plantarum subsp. plantarum CICC23168的迟滞期和对数期时间很短,8 h即进入到稳定期,其活细胞数达到最高值6.66×109CFU/mL,40 h以后进入衰亡期。L. acidophilus KLDS1.0327的最大活细胞数与L. plantarum subsp. plantarum CICC23168相似,其活细胞数也可达到3.98×109CFU/mL,但是需要48 h,且其迟滞期很长约24 h,因此其获得最大细胞数需要时间过长。L. casei ATCC393和L. acidophilus ATCC11975的活细胞数与前2 株相比较低,都分别达到7.75×108CFU/mL和9.25×108CFU/mL,前者8 h活细胞数就可达到最大量,而后者需要32 h才能达到。L. delbrueckii ssp. bulgaricus KLDS1.8501和L. plantarum NAU322很快达到最大活细胞数,但与其他菌株相比活细胞数很低,仅为1.5×108CFU/mL和7.75×107CFU/mL,且两株菌16 h后细胞开始衰亡,L. plantarum NAU322衰亡速率很快,8 h下降一个数量级,可能是因为耐酸能力较弱。
综上所述,L. plantarum subsp. plantarum CICC23168是活细胞数最快能达到6.66×109CFU/mL的菌株,且稳定时间长,虽然L. acidophilus KLDS1.0327的活细胞数也能达到3.98×109CFU/mL,但是其迟滞期太长,而其他4 株乳酸菌的最高活细胞数远远低于L. plantarum subsp.plantarum CICC23168,说明L. plantarum subsp. plantarum CICC23168在大豆糖蜜中生长旺盛。
2.2 乳酸菌对大豆糖蜜碳水化合物的利用情况
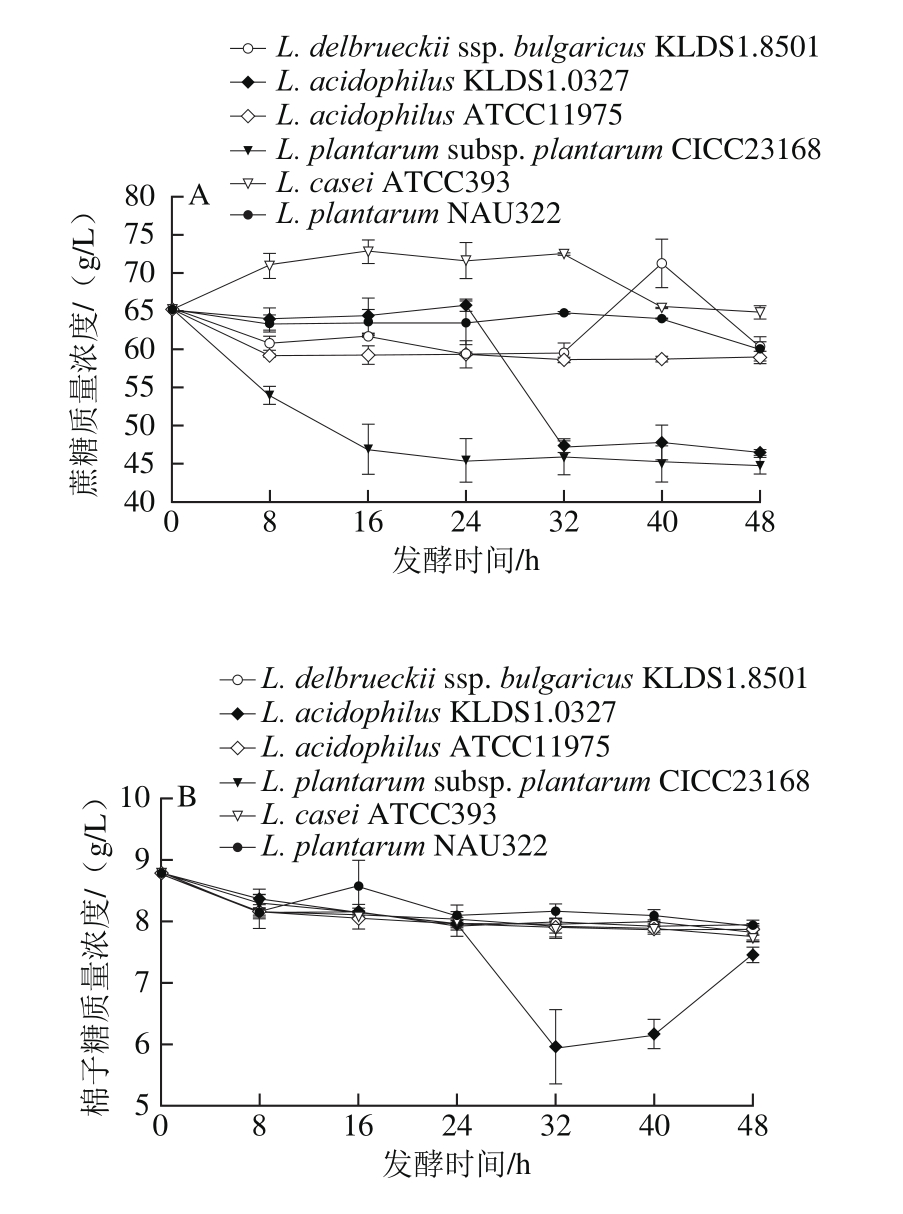
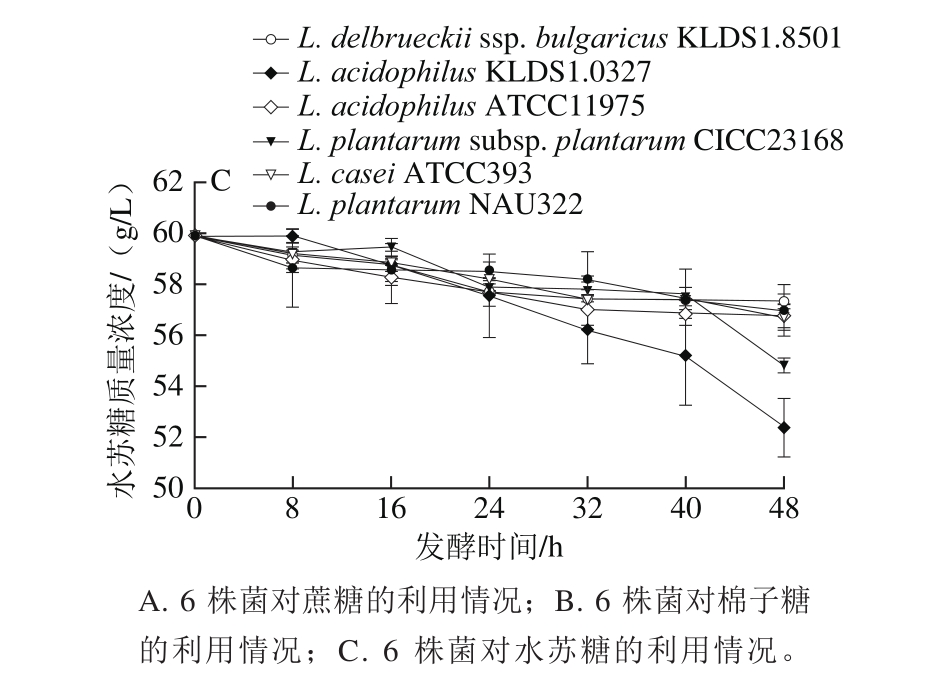
图2 6 株菌在48 h内对碳水化合物的利用
Fig. 2 Carbohydrate utilization by six different strains in soybean molasses at 15 °Brix during 48 h
如图2A所示,经过48 h发酵,L. acidophilus ATCC11975、L. acidophilus KLDS1.0327、L. plantarum subsp. plantarum CICC23168、L. delbrueckii ssp. bulgaricus KLDS1.8501和L. plantarum NAU322发酵底物中的蔗糖含量不断下降,表明该5 株菌均有利用大豆糖蜜中的蔗糖的能力。其中L. plantarum subsp. plantarum CICC23168在发酵开始就水解蔗糖,16 h内发酵液中蔗糖含量快速下降,且蔗糖利用率很高,这可能是因为该菌的蔗糖酶是固有酶,可以很快适应蔗糖环境,而大豆糖蜜蔗糖含量很高,因此在大豆糖蜜中可以快速生长(图1)[25-26]。L. acidophilus KLDS1.0327在发酵48 h内,发酵底物中的蔗糖含量先呈小幅度降低趋势,24 h后突然大量代谢蔗糖,由图2B和2C可知,在前8 h该菌对水苏糖和棉籽糖的代谢量很小,而24 h后代谢量急剧增加,说明该菌对3 种糖的代谢启动缓慢,可能是因为L. acidophilus KLDS1.0327中代谢这3 种糖所需要的酶是诱导酶,如蔗糖酶、α-半乳糖苷酶等。L. delbrueckii ssp. bulgaricus KLDS1.8501在发酵48 h内,大豆糖蜜中蔗糖含量呈降低趋势,表明该菌具有水解蔗糖的能力,但是在32~40 h,蔗糖含量急速上升,可能是L. delbrueckii ssp. bulgaricus KLDS1.8501在此期间产生了蔗糖合成酶或是由于水苏糖和棉子糖水解产生了部分蔗糖(图2B和2C)。L. acidophilus ATCC11975和L. plantarum NAU322在发酵48 h内,大豆糖蜜中蔗糖含量小幅度降低,说明该2 株菌株利用蔗糖的能力并不强。L. casei ATCC393对蔗糖的利用情况与其他5 株菌有很明显的差异,L. casei ATCC393在发酵48 h内,蔗糖含量呈现先上升后下降的趋势,可能是由于L. casei ATCC393在发酵初始阶段产生棉子糖系列寡糖水解酶活力大于蔗糖水解酶活力导致。
如图2B所示,在发酵48 h内,6 株乳酸菌的发酵液中棉子糖含量均呈降低趋势,说明6 株菌株均能利用大豆糖蜜中的棉子糖。其中L. delbrueckii ssp. bulgaricus KLDS1.8501、L. acidophilus ATCC11975、L. plantarum subsp. plantarum CICC23168和L. casei ATCC393在发酵48 h内,大豆糖蜜中的棉子糖含量呈小幅度降低趋势,说明该4 株菌株水解棉子糖的能力并不强。而L. acidophilus KLDS1.0327在发酵24~32 h,棉子糖含量大幅降低,可能是因为L. acidophilus KLDS1.0327诱导产生了大量可水解棉子糖的胞外酶。L. plantarum NAU322在8~16 h棉子糖含量呈上升趋势,可能是因为在此期间产生了棉子糖合成酶,因此棉子糖含量升高[27-28]。
如图2C所示,在发酵48 h内,6 种菌株的发酵液中水苏糖含量均呈降低趋势,说明6 株菌株均有利用大豆糖蜜中的水苏糖[29-30]的能力。其中,L. acidophilus KLDS1.0327对水苏糖的利用最大,在24~48 h产生大量可水解水苏糖的胞外酶,如α-半乳糖苷酶和β-半乳糖苷酶等[31]。
综上所述,该6 株乳酸菌均能利用大豆糖蜜中的主要碳水化合物,其中L. acidophilus KLDS1.0327和L.plantarum subsp. plantarum CICC23168较其他菌株糖代谢能力强,发酵48 h后,碳水化合物的总消耗量分别为27.47 g/L和26.40 g/L,说明该2 株菌更具有以大豆糖蜜为底物发酵生产乳酸的潜力。
2.3 大豆糖蜜发酵生产乳酸
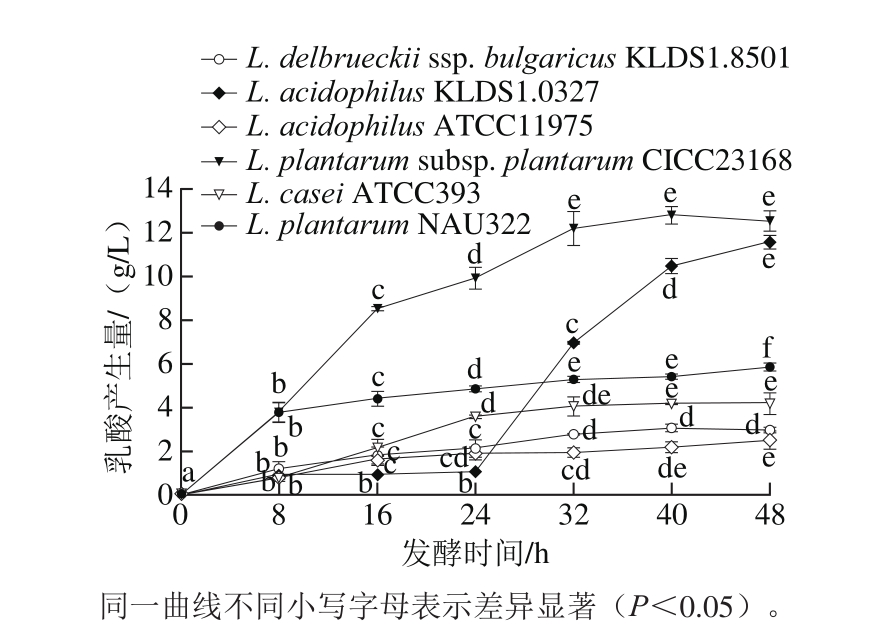
图3 6 株菌种在大豆糖蜜中生产乳酸的情况
Fig. 3 Lactic acid production of six different strains grown in soybean molasses at 15 °Brix during 48 h
由图3可见,以15 °Brix大豆糖蜜作为发酵底物,在发酵48 h内,6 株菌的发酵液中乳酸产生量都有所增加,其中L. delbrueckii ssp. bulgaricus KLDS1.8501、L.acidophilus ATCC11975、L. casei ATCC393和L. plantarum NAU322这4 株菌的乳酸产生量较低,发酵48 h后乳酸产生量仅为2.95、2.50、4.18 g/L和5.86 g/L。而L. delbrueckii ssp. bulgaricus KLDS1.8501在发酵8 h内乳酸产生量快速增加,最大乳酸产生率为0.48 g/(L·h)。L. acidophilus KLDS1.0327在发酵24 h内,乳酸产生量很低,是因为L. acidophilus KLDS1.0327处于延滞期,活细胞数仅为2×107CFU/mL(图1),几乎未水解大豆糖蜜中的碳水化合物(图2)。在发酵24 h后,乳酸产生量突然大幅度上升,因为该菌此时开始大量生长繁殖(图3),加速利用大豆糖蜜中的碳水化合物,代谢生成终产物乳酸,发酵48 h后积累乳酸质量浓度为11.57 g/L。L. plantarum subsp. plantarum CICC23168在发酵48 h内,乳酸产生量随着发酵的进行而逐渐升高,在发酵48 h时产生量为12.53 g/L,与其他5 株菌株相比较高;而在发酵24 h时,其乳酸产生量即可达12.18 g/L,相比48 h时虽差异显著(P<0.05 ),但24~48 h间仅合成乳酸0.35 g/L。
综上所述,虽然L. acidophilus KLDS1.0327的乳酸产生量较高,糖代谢能力较强,但因其发酵时间过长,因此,判定其为利用大豆糖蜜生产乳酸的非优势菌株。而L. plantarum subsp. plantarum CICC23168因其可以大量代谢大豆糖蜜中蔗糖,且在短时间内(8 h)生长量达到6.66×1010CFU/mL,且24 h内产生较高浓度乳酸,所以其具有作为利用大豆糖蜜生产乳酸的潜力。选择24 h作为L. plantarum subsp. plantarum CICC23168的最佳发酵时间,从而节省生产成本。
3 结 论
在利用大豆糖蜜生产乳酸的研究中,发现L. delbrueckii ssp. bulgaricus KLDS1.8501、L. acidophilus KLDS1.0327、L. acidophilus ATCC11975、L. plantarum subsp. plantarum CICC23168、L. casei ATCC393和L. plantarum NAU322六株乳酸菌菌株均能利用大豆糖蜜产生乳酸。其中,在发酵24 h时,L. plantarum subsp.plantarum CICC23168的活细胞数达到6.66×109CFU/mL,乳酸产生量为12.18 g/L,总糖消耗量为22.48 g/L,与其他菌株相比有明显优势。L. plantarum subsp. plantarum CICC23168具有发酵时间短,活细胞数高,总糖消耗量大,乳酸产生量高的特点。说明L. plantarum subsp. plantarum CICC23168是能利用大豆糖蜜发酵产乳酸的潜力菌株。
参考文献:
[1] 王校红, 田娟娟, 王丹. 大豆糖蜜的综合利用[J]. 粮油食品科技,2010, 18(1): 22-24. DOI:10.3969/j.issn.1007-7561.2010.01.009
[2] CHOCT M, DERSJANT-LI Y, MCLEISH J, et al. Soy oligosaccharides and soluble non-starch polysaccharides: a review of digestion, nutritive and anti-nutritive effects in pigs and poultry[J]. Asian Australasian Journal of Animal Sciences, 2010, 23(10): 1386-1398.
[3] SILVA F B D, ROMÃO B B, CARDOSO V L, et al. Production of ethanol from enzymatically hydrolyzed soybean molasses[J].Biochemical Engineering Journal, 2012, 69(2): 61-68. DOI:10.1016/j.bej.2012.08.009.
[4] SIQUEIRA P F, KARP S G, CARVALHO J C, et al. Production of bio-ethanol from soybean molasses by Saccharomyces cerevisicte at laboratory, pilot and industrial scales[J]. Bioresource Technology,2008, 99(17): 8156-8163.
[5] JÚNIOR W G D M, KAMIMURA E S, RIBEIRO E J, et al.Optimization of the production and characterization of lipase from Candida rugosa, and Geotrichum candidum, in soybean molasses by submerged fermentation[J]. Protein Expression & Purification, 2016,123: 26-34.
[6] MONTELONGO J L, CHASSY B M, MCCORD J D. Lactobacillus salivarius for conversion of soy molasses into lactic acid[J]. Journal of Food Science, 1993, 58(4): 863-866. DOI:10.1111/j.1365-2621.1993.tb09378.x.
[7] 孟陆丽, 刘胜, 许金蓉, 等. 乳酸杆菌发酵大豆糖蜜生产乳酸的研究[J].农业机械, 2011(29): 148-150.
[8] 程谦伟, 郑玉灵, 孟陆丽, 等. 利用大豆糖蜜发酵生产柠檬酸的研究[J].食品工业, 2015(1): 47-49.
[9] 陆杰光. 大豆糖蜜发酵生产酒精工艺探究[J]. 化学工程与装备,2012(11): 51-53.
[10] 高玉荣, 李大鹏, 李青川, 等. 以大豆糖蜜为原料高产乙醇酵母的筛选鉴定及其发酵特性研究[J]. 现代食品科技, 2014, 30(11): 43-47.
[11] 王义强, 王启业, 马国辉, 等. 植物乳杆菌植物亚种发酵产乳酸及高产菌株诱变选育[J]. 生物技术通报, 2014(11): 179-186.
[12] 丁涓, 魏敏, 张莉. 玉米浆发酵生产L-乳酸的工艺优化[J]. 食品科学,2011, 32(1): 127-130.
[13] 王博彦, 金其荣. 发酵有机酸生产与应用手册[M]. 北京: 中国轻工业出版社, 2000.
[14] MOO-YOUNG M. Comprehensive biotechnology[M]//Comprehensive Biotechnology: Pergamon Press, 1985: 761-776.
[15] WEE Y J, KIM J N, RYU H W. Biotechnological production of lactic acid and its recent applications[J]. Food Technology & Biotechnology,2006, 44(2): 163-172.
[16] MAZZOLI R, BOSCO F, MIZRAHI I, et al. Towards lactic acid bacteria-based biorefineries[J]. Biotechnology Advances, 2014, 32(7):1216-1236. DOI:10.1016/j.biotechadv.2014.07.005.
[17] 黄国昌, 熊大维, 张婷, 等. 发酵法生产乳酸的研究进展[J]. 江西科学, 2014, 32(5): 660-666.
[18] 刘鹏, 贾晓强, 杨春燕, 等. 德氏乳杆菌发酵生产乳酸工艺条件优化[J].化工进展, 2011, 30(6): 1332-1340.
[19] KARP S G, IGASHIYAMA A H, SIQUEIRA P F, et al. Application of the biorefinery concept to produce L-lactic acid from the soybean vinasse at laboratory and pilot scale[J]. Bioresource Technology, 2011,102: 1765-1772. DOI:10.1016/j.biortech.2010.08.102.
[20] 魏艳. 水苏糖—乳酸菌合生元的免疫调节功效及增菌机制研究[D].宁波: 宁波大学, 2013.
[21] 卫生部. 食品中蛋白质的测定: GB/T 5009.5—2010[S]. 北京: 中国标准出版社, 2010.
[22] 卫生部. 食品中脂肪的测定: GB/T 5009.5—2010[S]. 北京: 中国标准出版社, 2010.
[23] 卫生部. 食品中灰分的测定: GB/T 5009.5—2010[S]. 北京: 中国标准出版社, 2010.
[24] 卫生部. 食品中水分的测定: GB/T 5009.5—2010[S]. 北京: 中国标准出版社, 2010.
[25] AKSU Z, KUTSAL T. Lactic acid production from molasses utilizing Lactobacillus delbrueckii and invertase together[J]. Biotechnology Letters, 1986, 8(3): 157-160. DOI:10.1007/BF01029370.
[26] 黄谷亮, 秦菊霞, 李楠, 等. 以蔗糖为碳源的L-乳酸高产菌株的选育[J]. 食品科技, 2008, 33(3): 4-6. DOI:10.3969/j.issn.1005-9989.2008.03.002.
[27] 郝永伟. 植物乳杆菌的筛选、鉴定及制备工艺研究[D]. 济南: 齐鲁工业大学, 2014.
[28] 李芳, 汪晓峰. 植物中棉子糖系列寡糖代谢及其调控关键酶研究进展[J]. 西北植物学报, 2008, 28(4): 852-859. DOI:10.3321/j.issn:1000-4025.2008.04.034.
[29] 叶雪飞, 阮晖, 李青青, 等. 产α-半乳糖苷酶乳酸菌的筛选及酶学特性研究[J]. 中国食品学报, 2009, 9(4): 64-69. DOI:10.3969/j.issn.1009-7848.2009.04.011.
[30] 王听, 侯聚敏, 付丽丽, 等. 产β-半乳糖苷酶乳酸菌的筛选及其益生性研究[J]. 中国乳品工业, 2012, 40(8): 20-23. DOI:10.3969/j.issn.1001-2230.2012.08.005.
[31] 周宇, 李星鑫, 付一帆, 等. 嗜酸乳杆菌产β-半乳糖苷酶发酵条件的优化[J]. 食品科学, 2011, 32(23): 180-185.
