乳酸又名2-羟基丙酸,是一种重要的多用途有机酸,被广泛应用于食品、化妆品、医药及化工等行业[1-2]。乳酸按其构型和旋光性可分为D-型、L-型和DL-型3 种类型,由于人体只具有L-乳酸脱氢酶,因此只能代谢L-型的乳酸,若过量摄入D-型或DL-型的乳酸则会引起人体代谢功能紊乱、造成酸中毒等不良反应[3]。世界卫生组织明确规定,D-型或DL-型的乳酸不得加入到婴幼儿食品中,而成人每天摄入的D-型乳酸也不能超过100 mg/kg体质量[4]。目前工业生产的乳酸约70%作为酸浸剂、调味剂、防腐剂等功能用于食品行业中,因而,高光学纯L-乳酸的生产受到了越来越多的关注[5-6]。
微生物发酵法是L-乳酸的主要生产方法,所涉及的微生物主要包括一些丝状真菌、乳酸细菌和部分芽孢杆菌等,该方法具有产物光学纯度相对较高、生产工艺简单、副产物少、能耗小等优势[7-11]。尽管国内外众多学者多年来已经在发酵法生产L-乳酸取得了很多的研究成果,但目前研究中仍存在一些不足之处,或是乳酸的产酸量不高,糖酸转化率低[12-15];或是产物乳酸中含有较多的D-型乳酸,目标产物L-乳酸的光学纯度较低,造成下游L-乳酸的分离提纯较为困难[16];或是产生菌对营养物质要求较高,往往需要价格较贵的酵母粉或酵母膏作为氮源才能获得较高的乳酸产量,增加了发酵的成本[17-20],这些问题都不利于L-乳酸的工业化生产。因此,本研究旨在筛选获得1 株高产乳酸且L-乳酸光学纯度较高的菌株并对其进行生理生化和分子生物学鉴定,进而对培养基进行初步优化,寻求廉价氮源部分替代酵母粉或酵母膏,以期降低生产成本,并在5 L发酵罐中进行批式流加发酵以验证其发酵产L-乳酸的潜能,为乳酸发酵的工业化生产提供1 株可供选择的优良菌株及其发酵培养基的配方组成。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
市售酸奶、辣白菜、榨菜、奶酪、泡菜汁、新鲜水果、海水及从辽宁不同地方采集的下层土壤等样品共120余份。
1.1.2 试剂
L/D-乳酸检测试剂盒 爱尔兰Megazyme公司;CBC棒状杆菌鉴定卡 法国梅里埃公司;革兰氏染色液试剂盒 青岛海博生物技术有限公司;TaKaRa 16S rDNA Gene Bacterial Identification PCR Kit、TaKaRa Lysis Buffer for Microorganism to Direct PCR 宝生物工程(大连)有限公司;牛肉膏、蛋白胨、酵母粉、琼脂北京奥博星生物技术有限责任公司;其他试剂均为国产分析纯。
1.1.3 培养基
分离液体培养基:采用MRS培养基并添加溴甲酚紫0.1 g/L作为指示剂[21]。
分离平板培养基:为改良的MRS培养基,即CaCO3-溴甲酚紫MRS平板培养基,在MRS培养基中加入CaCO320 g/L、溴甲酚紫0.1 g/L作为指示剂,琼脂15 g/L[21]。
摇瓶种子培养基:葡萄糖20 g/L,其他同文献[21]。
基础发酵培养基:葡萄糖40 g、酵母粉10 g、CH3COONa 4 g、KH2PO41 g、MgSO40.1 g、MnSO40.4 g、吐温80 1 mL、CaCO320 g,充分溶解后用蒸馏水定容至1 L。
1.2 仪器与设备
VITEK 2 COMPACT全自动微生物鉴定仪、麦氏比浊仪法国梅里埃公司;SW-CJ-2FD洁净工作台 苏州安泰空气技术有限公司;UV-5800紫外-可见分光光度计上海元析仪器有限公司;SBA-40C生物传感分析仪山东省科学院生物研究所;HPX-9272MBE电热恒温培养箱、HPX-9272MBE电热恒温培养箱 上海博讯实业有限公司;ZWY-1102C恒温培养振荡器 上海智城分析仪器制造有限公司;N-300M荧光显微镜 宁波永新光学股份有限公司;BIOTECH-5BG发酵罐 上海保兴生物设备工程有限公司。
1.3 方法
1.3.1 菌株的筛选
取适量样品加入至30 mL无菌水中,充分振荡后静止片刻,取上层清液1 mL加放入到分离液体培养基中,37 ℃培养24 h。选取发酵液颜色变黄的样品,经稀释后涂布于分离平板培养基,待长出菌落,挑取能够水解CaCO3且变色圈较大的单菌落,接种到基础发酵培养基中,37 ℃、180 r/min培养24 h,选取产物浓度高的菌落,进一步划线纯化直至纯种,将其编号并保藏。
1.3.2 菌株的鉴定
1.3.2.1 形态学观察
肉眼直接观察菌落的外部形态,革兰氏染色后于显微镜下观察菌体形态。
1.3.2.2 生理生化鉴定
挑取纯化的菌株加至3 mL生理盐水中,振荡混匀后利用麦氏比浊仪测定菌悬液浊度达到2.7~3.3麦氏浓度,按照CBC棒状杆菌鉴定卡的操作说明书进行VITEK 2 COMPACT全自动微生物分析系统分析。
1.3.2.3 菌株16S rDNA序列扩增与分析
挑取培养基上的菌体于50 µL TaKaRa Lysis Buあer for Microorganism to Direct PCR(Code No.9164)中变性后离心取上清液作为模板,反应条件:80 ℃,15 min;然后使用TaKaRa 16S rDNA Bacterial Identification PCR Kit(Code No.RR176)进行PCR扩增目的片段;经琼脂糖凝胶电泳后,切胶回收目的片段;由大连宝生物工程有限公司进行测序,通过NCBI数据库在线BLAST系统进行序列比对,以确定种属。
1.3.3 发酵培养基的初步优化
1.3.3.1 培养基中初始碳源质量浓度的优化
在基础培养基的基础上,分别以40~140 g/L的葡萄糖为碳源,按2%的接种量转接到100 mL培养基中,于37 ℃、180 r/min恒温振荡培养,定期取样监测,考察初始糖质量浓度对发酵产L-乳酸的影响。
1.3.3.2 培养基中氮源的优化
在基础培养基的基础上,以40 g/L的葡萄糖为碳源,分别以20 g/L的酵母粉、牛肉膏、蛋白胨、棉籽饼粉、黄豆饼粉、玉米浆、硝酸铵、硫酸铵作为氮源,考察不同种类的氮源对发酵的影响,发酵时间为24 h,其他培养条件同1.3.3.1节。在此基础上,为进一步降低氮源成本,利用发酵效果相对较好的廉价氮源按照一定配比进行部分替代,考察不同配比的复合氮源对发酵产L-乳酸的影响。
1.3.3.3 培养基中无机盐的优化
在上述优化的基础上,以40 g/L的葡萄糖为碳源,10 g/L的酵母粉+15 g/L棉籽饼粉为氮源,分别考察不同质量浓度的CH3COONa、KH2PO4、MgSO4及MnSO4对发酵的影响,发酵时间为24 h,其他培养条件同1.3.3.1节。
1.3.4 5 L发酵罐中的批式流加发酵实验
根据上述摇瓶中的优化结果,进而在5 L发酵罐中进行了批式流加发酵,考察菌株的生长及L-乳酸的成情况。发酵条件如下:装液量2 L,接种量10%,发酵温度37℃,转速180 r/min,4 mol/L NaOH溶液维持pH 6.0,发酵通气量0.2 m3/min,发酵初始葡萄糖质量浓度80 g/L,中间补加葡萄糖使其质量浓度维持在30~80 g/L之间,发酵72 h。
1.3.5 分析方法
L-乳酸纯度的测定:利用L-/D-乳酸检测试剂盒测定乳酸的光学纯度,光学纯度的计算方法参照文献[22];L-乳酸质量浓度的测定:用SBA-40C生物传感分析仪测定[23];还原糖含量的测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicvlic acid,DNS)比色法[24];菌体浓度的测定:利用分光光度计测定OD600nm表示菌体的浓度。
2 结果与分析
2.1 高产L-乳酸菌株的筛选
利用分离液体培养基培养来源不同的120余份样品,其中16 份样品的发酵液变成黄色,经稀释后涂布于CaCO3-溴甲酚紫MRS分离平板培养基进行培养,其中有5 株产酸圈较大,将其转接到基础发酵培养基中,37 ℃、180 r/min培养24 h,检测发酵液中L-乳酸的产量,结果如表1所示。
从表1可知,从辣白菜样品中筛选获得的菌株LB-103在分离液体培养基中显色速度最快,并且在分离平板培养基中的产酸圈直径达10.5 mm,这些现象均说明该菌株具有较强的产酸能力,进一步通过液体发酵培养基培养,经检测证实,菌株LB-103的L-乳酸产量最高,达到15.40 g/L。更重要的是,采用L/D-乳酸检测试剂盒检测乳酸的光学纯度,结果表明,菌株LB-103只产生L-乳酸,无D-乳酸生成。因此,将该菌株进行进一步纯化直至纯种,保藏待用。
表1 不同菌株产L-乳酸的能力
Table 1 L-Lactic acid produced by different strains isolated from different sources

2.2 菌株的鉴定
2.2.1 形态学观察
将菌株LB-103在固体MRS培养基上培养48 h后,菌株在平板上的单菌落呈圆形,隆起,表面光滑,湿润,不透明,边缘整齐,颜色为乳白色(图1a)。细菌革兰氏染色呈阳性,短杆状(图1b)。
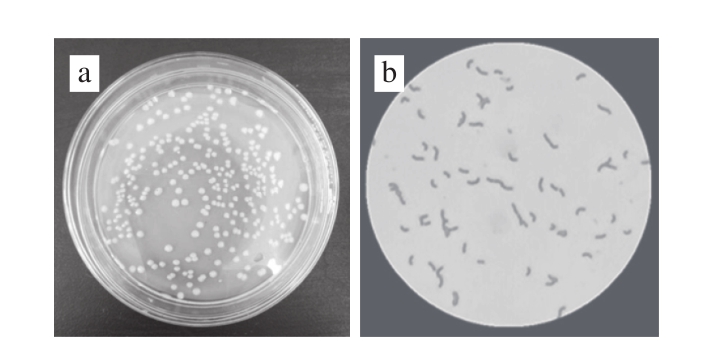
图1 LB-103菌株菌落形态(a)和革兰氏染色照片(b)
Fig. 1 Colony morphology (a) and gram staining (b) of strain LB-103
2.2.2 菌株生理生化鉴定
表2 LB-03菌株的主要生理学特征
Table 2 Physiological characteristics of strain LB-03
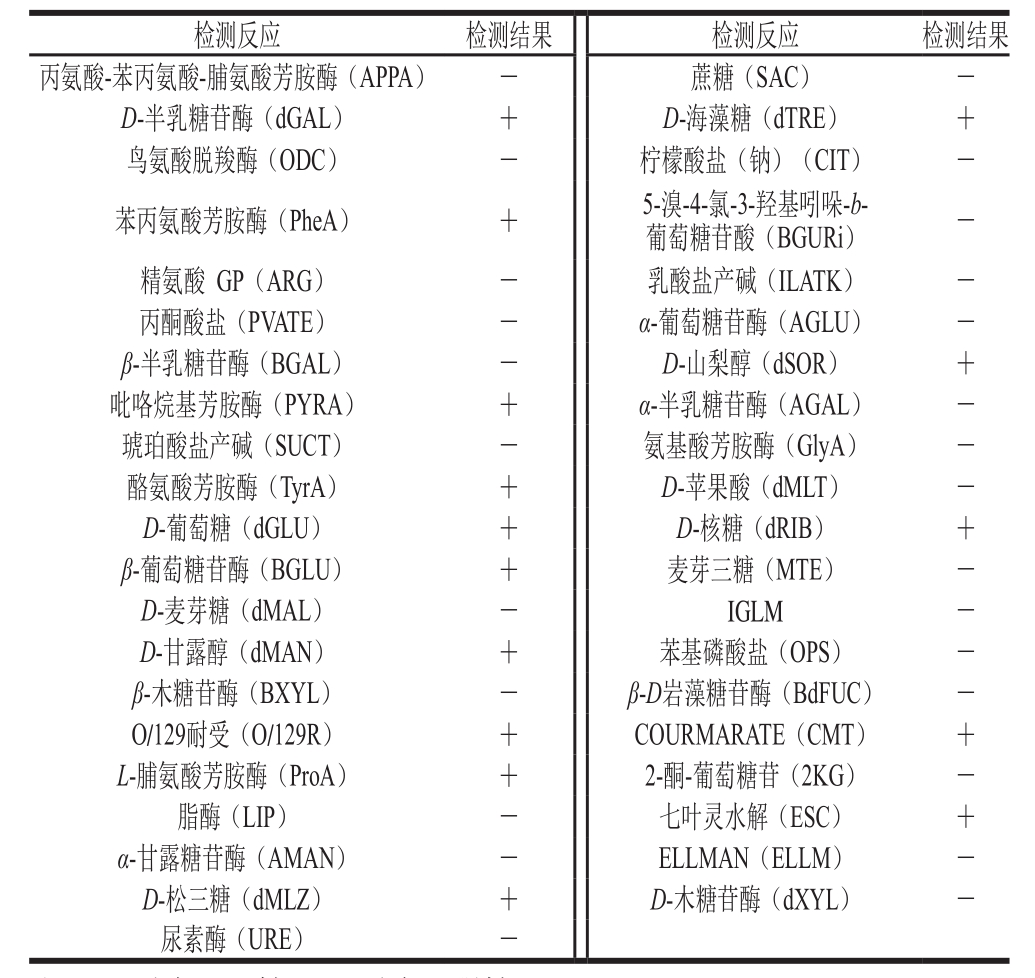
注:+.反应呈阳性;-.反应呈阴性。
经过纯化的菌株LB-103利用VITEK 2 COMPACT全自动微生物分析系统进行生理生化鉴定,鉴定的结果为鼠李糖乳酸杆菌(Lactobacillus rhamnosus),可信度达95%,结果评价为Excellent identification(极好的鉴定)。具体生化反应结果见表2。
2.2.3 菌株16S rDNA序列扩增
以菌株LB-103基因组DNA为模板经过PCR扩增后进行1%琼脂糖凝胶电泳,目的片段大约为1 500 bp(图2),将PCR产物回收纯化后测序,确定该片段实际长度为1 337 bp。该序列已提交至GenBank,登记号为No.KY750318。将该序列在NCBI中BLAST比对发现,菌株LB-103与L. rhamnosus的同源性极高,序列相似性达到100%。结合上述生理生化鉴定结果,可确定该菌株为鼠李糖乳酸杆菌,并将其命名为鼠李糖乳酸杆菌DLF-15038(L. rhamnosus DLF-15038)。
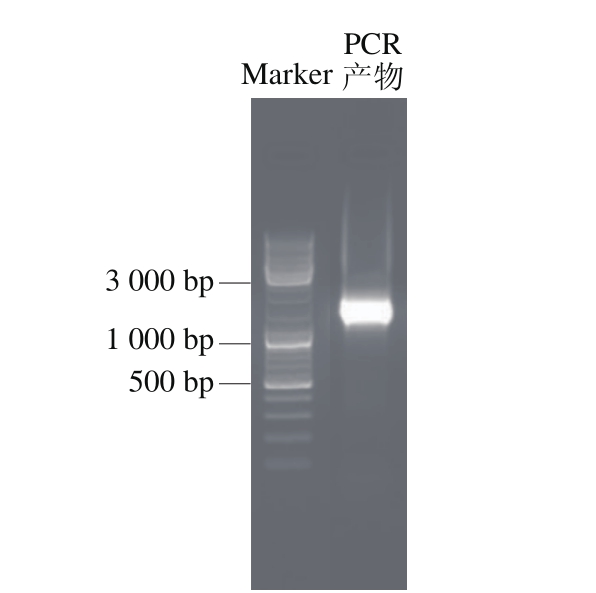
图2 菌株LB-103的16S rDNA凝胶电泳图
Fig. 2 Gel electrophoresis pattern of PCR amplified product of 16S rDNA from strain LB-103
2.3 发酵培养基的初步优化
2.3.1 碳源质量浓度对L. rhamnosus DLF-15038发酵产L-乳酸的影响
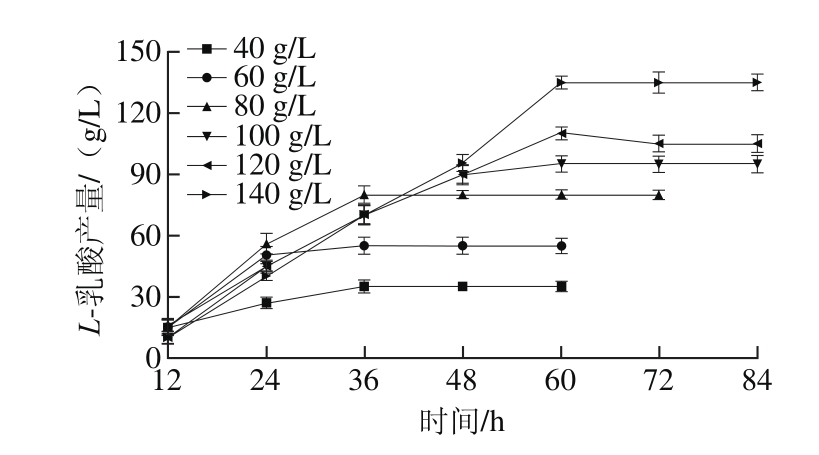
图3 葡萄糖质量浓度对发酵产L-乳酸影响
Fig. 3 Effects of glucose concentration on the production of L-lactic acid
如图3所示,随着糖质量浓度的增加,发酵液中L-乳酸产量逐渐增加。然而在初始糖质量浓度为80 g/L时L-乳酸的生成速率最高,这可能是由于在高质量浓度糖基质中,发酵液渗透压增加,从而对菌体生长及其代谢会造成一定的抑制作用。因此为获得较高的L-乳酸产量,避免高糖质量浓度对微生物造成的抑制作用,可以考虑选择发酵初始糖质量浓度为80 g/L,采用流加补料的方式进行发酵培养。
2.3.2 氮源对L. rhamnosus DLF-15038发酵产L-乳酸的影响
不同微生物对氮源的利用能力也不同,实验选择了文献中发酵L-乳酸产量较高的几种有机氮源如酵母粉、牛肉膏、蛋白胨[4,21-22,25-26],同时又选择了几种廉价的有机氮源如棉籽饼粉、黄豆饼粉、玉米浆和无机氮源硝酸铵、硫酸铵,考察氮源种类对发酵产L-乳酸的影响,结果如图4所示。
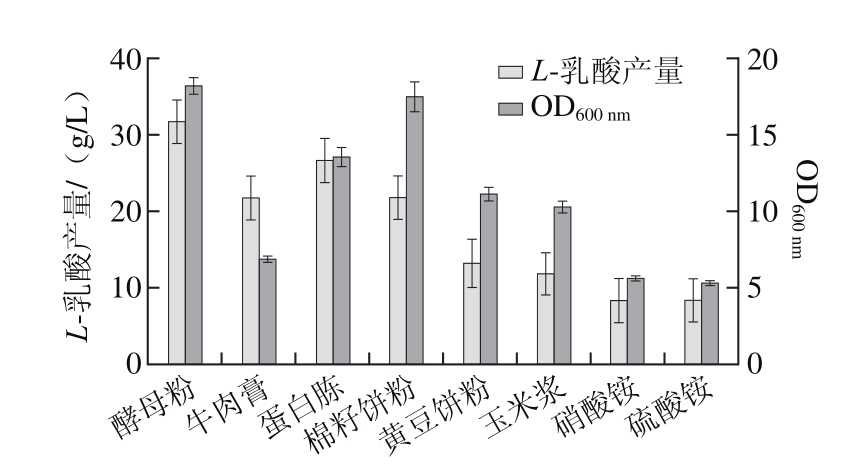
图4 不同氮源种类对L-乳酸产量的影响
Fig. 4 Effects of different nitrogen sources on the production of L-lactic acid
由图4可以看出,在相同发酵条件下,有机氮源的发酵效果明显好于无机氮源,这可能是由于有机氮源中除了含有蛋白质、肽及游离的氨基酸以外,往往还含有少量的维生素和生长因子,可以满足微生物生长和代谢的需要[17-18,25]。本实验中以酵母粉作为氮源时L-乳酸产量最高,蛋白胨次之,该实验结果与Kwon[26]、Nancib[27]、于雷[17]等的报道一致,且目前文献中报道的高产L-乳酸所用的氮源也多为酵母粉[25]。然而酵母粉和蛋白胨都是价格昂贵的氮源,对于生产用途广且用量大的L-乳酸产品来说,在获得高产量和高转化率的同时,也必须使用相对廉价的培养基成分,产品才更具有市场竞争力。本实验中以廉价的棉籽饼粉作为氮源,L-乳酸产量虽然较酵母粉或蛋白胨低,但明显好于黄豆饼粉和玉米浆,并且菌体生长情况与酵母粉作为氮源的发酵结果相当。因此,为减少酵母粉用量,降低发酵培养基成本,进一步考察利用棉籽饼粉部分替代酵母粉发酵产L-乳酸的情况,结果如表3所示。
表3 复合氮源对L-乳酸产量的影响
Table 3 Effects of complex nitrogen sources on the production of L-lactic acid
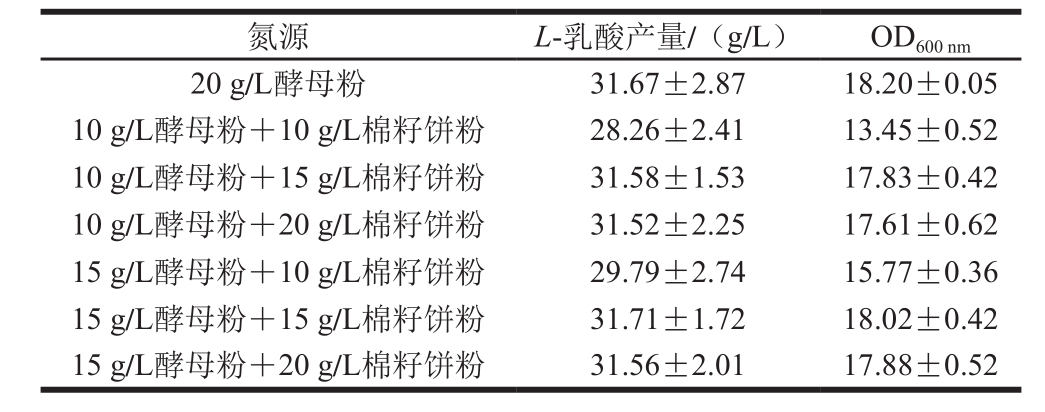
从表3可以看出,10 g/L酵母粉分别添加15 g/L或20 g/L棉籽饼粉与15 g/L酵母粉分别添加15 g/L或20 g/L棉籽饼粉作为氮源,L-乳酸产量与单独使用20 g/L酵母粉相当。可见,利用棉籽饼粉部分替代酵母粉是可行的。当以10 g/L酵母粉+15 g/L棉籽饼粉作为复合氮源时,在此基础上无论是增加酵母粉或是棉籽饼粉的用量,L-乳酸产量均无明显变化。因此,考虑培养基的成本,选择以10 g/L酵母粉+15 g/L棉籽饼粉作为复合氮源最为合适。
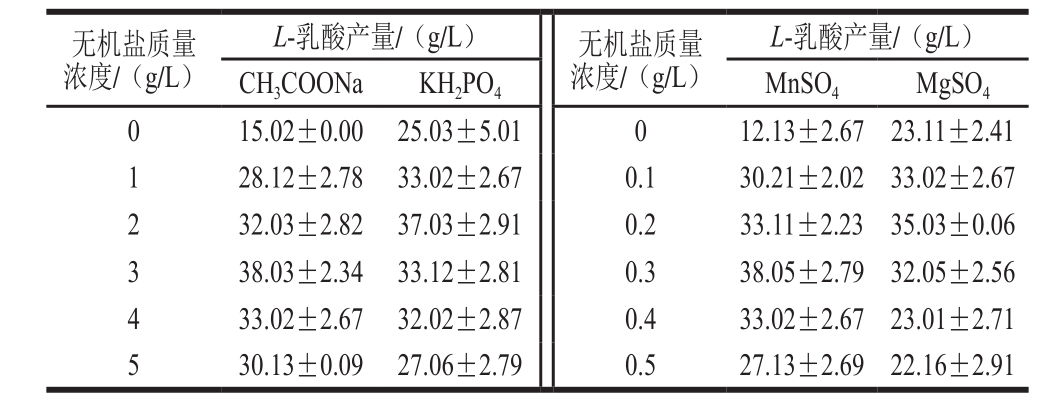
2.3.3 无机盐对L. rhamnosus DLF-15038发酵产L-乳酸的影响
微生物的生长及其代谢产物合成过程中需要无机盐和一些微量元素,很多无机盐中的金属离子是作为某些酶的激活剂,这些物质往往在低质量浓度时会促进微生物生长和代谢产物合成,但在高质量浓度时却会表现出明显的抑制现象。本实验考察了不同质量浓度的CH3COONa、KH2PO4、MgSO4及MnSO4对发酵的影响,结果如表4所示。最佳无机盐质量浓度分别为CH3COONa 3 g/L、KH2PO42 g/L、MnSO40.3 g/L和MgSO40.2 g/L。
表4 不同质量浓度的无机盐对L-乳酸产量的影响
Table 4 Effects of different concentrations of inorganic salts on the production of L-lactic acid
2.4 5 L发酵罐中的批式流加发酵实验
通过上述培养基优化,确定发酵培养基为初始葡萄糖质量浓度80 g/L、棉籽饼粉15 g/L、酵母粉10 g/L、CH3COONa 3 g/L、KH2PO42 g/L、MnSO40.3 g/L、MgSO40.2 g/L、吐温80 1 mL/L。在该条件下,在5 L发酵罐中进行了批式流加发酵,考察菌株的生长及L-乳酸的成情况,结果如图5所示。发酵72 h,L-乳酸产量可达165.15 g/L,生产强度为2.29 g/(L·h),葡萄糖总消耗量为176.94 g/L,糖酸转化率为93.34%。
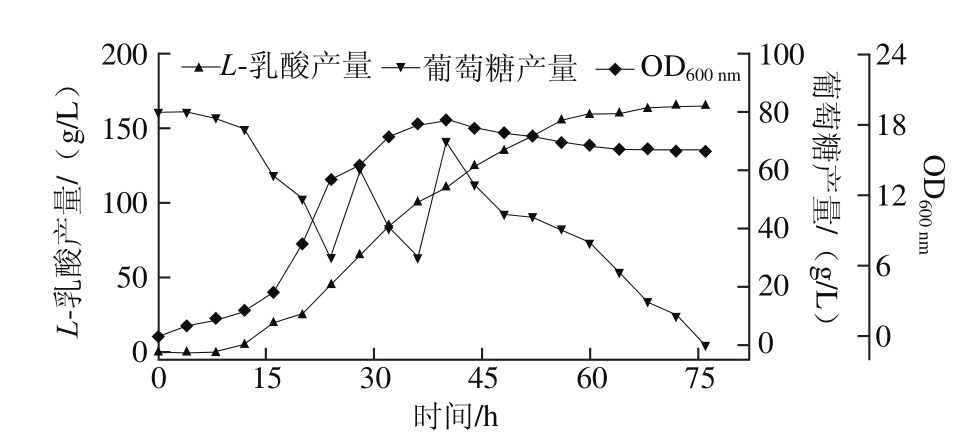
图5 分批补料发酵过程曲线
Fig. 5 Time course curve of fed-batch fermentation
3 讨论与结论
本实验从辣白菜样品中筛选出1 株高产乳酸的菌株LB-103,通过生理生化鉴定和16S rDNA序列分析,确定该菌株为鼠李糖乳酸杆菌(L. rhamnosus),将其命名为鼠李糖乳酸杆菌DLF-15038。经L-/D-乳酸试剂盒检测该菌株发酵产L-乳酸的光学纯度为100%。纯L-乳酸应用于食品行业中可以保证食品安全性,此外纯L-乳酸还可以生产高质量的聚乳酸。但目前国内外关于利用细菌发酵产乳酸的报道中,产物大多都混有D-型的乳酸[12,16],产纯L-乳酸的报道较少。周颖等[22]对Lactococcus lactis KLDS 4.0325发酵产光学纯度为100% L-乳酸的培养基优化;高江婧等[28]从土壤样品中筛选到1 株凝结芽孢杆菌,发酵产L-乳酸的光学纯度达99%以上;Laopaiboon等[29]利用L. lactis IO-1发酵甘蔗渣生产光学纯度为100% L-乳酸;Ramchandran等[30]利用L. lactis ssp. cremoris ASCC 930119生产光学纯度为100% L-乳酸。本实验筛选获得的L. rhamnosus DLF-15038不仅发酵产L-乳酸的光学纯高,而且还具有非常好的产乳酸能力,在5 L发酵罐中进行批式流加发酵实验,发酵72 h,L-乳酸产量为165.15 g/L,生产强度为2.29 g/(L·h),糖酸转化率为93.34%。
对L. rhamnosus DLF-15038发酵产L-乳酸的培养基进行了优化,结果表明,廉价的棉籽饼粉可以部分替代酵母粉,采用15 g/L棉籽饼粉和10 g/L的酵母粉为复合氮源,L-乳酸的产量得以维持并显著降低成本。Kwon等[24]曾在L-乳酸发酵培养基中用19.3 g/L大豆粉替代15 g/L的酵母粉,同样可以获得理想的发酵结果,但是需要在培养基中额外添加7 种维生素,Nancib等[27]也发现采用廉价氮源部分替代酵母粉,并补充B族维生素,可以获得较好的发酵水平,这些研究在获得廉价原料部分替代酵母粉的同时,都需要额外补充维生素,因此对于降低成本的幅度有限。而本实验中使用廉价的棉籽饼粉部分替代酵母粉,无需维生素的额外添加,对于降低发酵培养基的成本效果更为显著。此外,本研究对培养基中几种无机盐浓度进行了考察,确定了最适无机盐质量浓度分别为CH3COONa 3 g/L、KH2PO42 g/L、MnSO40.3 g/L、MgSO40.2 g/L。本研究为L-乳酸发酵的工业化生产提供了1 株可供选择的优良菌株及其发酵培养基的配方组成,若对该菌株的发酵培养基的组成及发酵条件进一步优化,产物L-乳酸的产量还会有提升的空间。
参考文献:
[1] MA K, HU G, PAN L, et al. Highly efficient production of optically pure L-lactic acid from corn stover hydrolysate by thermophilic Bacillus coagulans[J]. Bioresource Technology, 2016, 219(11): 114-122. DOI:10.1016/j.biortech.2016.07.100.
[2] MAZUMDAR S, BLANKSCHIEN M D, CLOMBURG J M, et al.Efficient synthesis of L-lactic acid from glycerol by metabolically engineered Escherichia coli[J]. Microbial Cell Factories, 2013, 12: 7.DOI:10.1186/1475-2859-12-7.
[3] JIANG X, XUE Y F, WANG A Y, et al. Efficient production of polymer-grade L-lactate by an alkaliphilic Exiguobacterium sp. strain under nonsterile open fermentation conditions[J].Bioresource Technology, 2013, 143(9): 665-668. DOI:10.1016/j.biortech.2013.06.049.
[4] 潘道东. 产L-乳酸之乳杆菌的筛选[J]. 食品科学, 2007, 28(8): 310-313. DOI:10.3321/j.issn:1002-6630.2007.08.074.
[5] WANG Y, CHEN C, CAI D, et al. The optimization of L-lactic acid production from sweet sorghum juice by mixed fermentation of Bacillus coagulans and Lactobacillus rhamnosus under unsterile conditions[J]. Bioresource Technology, 2016, 218(10): 1098-1105.DOI:10.1016/j.biortech.2016.07.069.
[6] DAN C V, FRANCISC V D, OANA L P, et al. L (+)-Lactic acid production by pellet-form Rhizopus oryzae NRRL 395 on biodiesel crude glycerol[J]. Microbial Cell Factories, 2013, 12: 92.DOI:10.1186/1475-2859-12-92.
[7] ABDEL-RAHMAN M A, TASHIRO Y, SONOMOTO K. Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria: overview and limits[J]. Journal of Biotechnology, 2011,156(4): 286-301. DOI:10.1016/j.jbiotec.2011.06.017.
[8] FU Y Q, YIN L F, ZHU H Y, et al. High-efficiency L-lactic acid production by Rhizopus oryzae using a novel modified one-step fermentation strategy[J]. Bioresource Technology, 2016, 218(7): 410-417. DOI:10.1016/j.biortech.2016.06.127.
[9] MARCELA P B, LUCIANA F C, DAIANE C S, et al. L-(+)-Lactic acid production by Lactobacillus rhamnosus B103 from dairy industry waste[J]. Industrial Micorbiology, 2016, 47(3): 640-646. DOI:10.1016/j.bjm.2015.12.001.
[10] ZHENG J, GAO M, WANG Q, et al. Enhancement of L-lactic acid production via synergism in open co-fermentation of Sophora flavescens residues and food waste[J]. Bioresource Technology, 2017,225(2): 159-164. DOI:10.1016/j.biortech.2016.11.055.
[11] REDDY G, ALTAF M, NAVEENA B J, et al. Amylolytic bacterial lactic acid fermentation: a review[J]. Biotechnology Advances, 2008,26(1): 22-34. DOI:10.1016/j.biotechadv.2007.07.004.
[12] ABDEL-RAHMAN M A, TASHIRO Y, SONOMOTO K. Recent advances in lactic acid production by microbial fermentation processes[J]. Biotechnology Advances, 2013, 31(6): 877-902.DOI:10.1016/j.biotechadv.2013.04.002.
[13] 杨萍, 徐忠. 产L-乳酸的菌种的筛选及L-乳酸生产新途径[J]. 食品科学, 2009, 30(3): 184-187. DOI:10.3321/j.issn:1002-6630.2009.03.041.
[14] PETROV K, POPOVA L, PETROVA P. High lactic acid and fructose production via Mn2+-mediated conversion of inulin by Lactobacillus paracasei[J]. Applied Microbiology and Biotechnology, 2017, 3: 1-13.DOI:10.1007/s00253-017-8238-0.
[15] KARI T K, MARJA I, MARILYN G W, et al. L-Lactic acid production from D-xylose with Candida sonorensis expressing a heterologous lactate dehydrogenase encoding gene[J]. Microbial Cell Factories,2014, 13: 1-14. DOI:10.1186/s12934-014-0107-2.
[16] WU J C, JUTURU V. Microbial production of lactic acid: the latest development[J]. Critical Reviews in Biotechnology, 2016, 36(6): 967-977. DOI:10.3109/07388551.2015.1066305.
[17] 于雷, 雷霆, 裴晓林, 等. L-乳酸发酵培养基中氮源的优化[J]. 食品科技, 2007, 32(6): 49-53. DOI:10.3969/j.issn.1005-9989.2007.06.014.
[18] NGUYEN C M, KIM J S, HWANG H J, et al. Production of L-lactic acid from a green microalga, hydrodictyon reticulum, by Lactobacillus paracasei LA104 isolated from the traditional Korean food, makgeolli[J]. Bioresource Technology, 2012, 110(4): 552-559.DOI:10.1016/j.jbiotec.2012.01.079.
[19] MOON S K, WEE Y J, CHOI G W. A novel lactic acid bacterium for the production of high purity L-lactic acid, Lactobacillus paracasei subsp. paracasei CHB2121[J]. Journal of Bioscience and Bioengineering, 2012, 114(2): 155-159. DOI:10.1016/j.jbiosc.2012.03.016.
[20] ZHAO B, WANG L M, MA C Q, et al. Repeated open fermentative production of optically pure L-lactic acid using a thermophilic Bacillus sp. strain[J]. Bioresource Technology, 2010, 101(16): 6494-6498.DOI:10.1016/j.jbiotec.2010.03.051.
[21] 丁涓, 魏敏, 张莉. 玉米浆发酵生产L-乳酸的工艺优化[J]. 食品科学,2011, 32(1): 127-130. DOI:10.7506/spkx1002-6630-201101031.
[22] 周颖, 高晓峰, 周晶, 等. 一株仅产L-乳酸的乳酸乳球菌发酵培养基的优化[J]. 食品科学, 2015, 36(9): 84-88. DOI:10.7506/spkx1002-6630-201509016.
[23] QIN J, WANG X, ZHENG Z, et al. Production of L-lactic acid by a thermophilic Bacillus mutant using sodium hydroxide as neutralizing agent[J]. Bioresource Technology, 2010, 101(19): 7570-7576.DOI:10.1016/j.jbiotec.2010.04.037.
[24] 赵凯, 许鹏举, 谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008, 29(8): 534-536. DOI:10.3321/j.issn:1002-6630.2008.08.127.
[25] MARK A E, SUBRAMANIAN R, Microbial production of lactic acid[J]. Biotechnology Letters, 2015, 37(5): 955-972. DOI:10.1007/s10529-015-1769-5.
[26] KWON S, LEE P C, LEE E G, et al. Production of lactic acid by Lactobacillus rhamnosus vitamin-supplemented soybean hydrolysate[J]. Enzyme and Microbiology Technology, 2000,26(2/3/4): 209-215. DOI:10.1016/S0141-0229(99)00134-9.
[27] NANCIB A, NANCIB N, MEZIANECHERIF D, et al. Joint effect of nitrogen sources and B vitamin supplementation of date juice on lactic acid production by Lactobacillus casei subsp. rhamnosus[J].Bioresource Technology, 2005, 96(1): 63-67. DOI:10.1016/biortech.2003.09.018.
[28] 高江婧, 严群, 阮文权. 一株产L-乳酸菌株的筛选、鉴定及营养条件的初步研究[J]. 食品与生物技术学报, 2010, 29(3): 453-457.DOI:10.3969/j.issn.1673-1689.2010.03.026.
[29] LAOPAIBOON P, THANI A, LEELAVATCHARAMAS V, et al.Acid hydrolysis of sugarcane bagasse for lactic acid production[J].Bioresource Technology, 2010, 101(3): 1036-1043. DOI:10.1016/biortech.2009.08.091.
[30] RAMCHANDRAN L, SANCIOLO P, VASILJEVIC T, et al.Improving cell yield and lactic acid production of Lactococcus lactis ssp. cremoris by a novel submerged membrane fermentation process[J]. Journal of Membrane Science, 2012, s403/404(3): 179-187.DOI:10.1016/j.memsci.2012.02.042.