在食品加工过程中,添加食品防腐剂是防止食品腐败变质、保证食品安全卫生、降低经济损失的一种有效措施[1]。随着化学防腐剂的致癌、致畸等副作用逐渐被认识,人们开始研究开发高效安全的天然防腐剂。其中抗菌肽因具有抗细菌、真菌、病毒等多种生物活性且不会使微生物产生耐药性,有望成为化学防腐剂和抗生素的理想替代品,应用于食品、化妆品、动物饲料等产品中[2-5]。
2012年,我国淡水鱼总产量达2 334.11万 t,其中鱼鳞约占3%~5%,且每年以一定比例增长,这意味着每年产生大量的淡水鱼鱼鳞下脚料,这些鱼鳞富含蛋白质、脂类及矿物质等,若没有得到合理的开发与利用,不仅会造成蛋白质资源的极大浪费,还会导致环境的严重污染[6-7]。目前,国内外关于鱼源抗菌肽的制备已有较多报道,如以大黄鱼[8]、罗非鱼鱼鳃[9]、鱿鱼皮[10]、鲃鱼鱼肉[11]等为原料制备抗菌肽,但是关于鲫鱼鱼鳞抗菌肽的研究尚鲜见报道。
酶法制备抗菌肽酶解条件易控制且环保,被认为是抗菌肽大批量生产最有前途的方法[12]。因此本研究以鲫鱼鱼鳞为原料,采用双酶酶解法制备抗菌肽,以酶解液的抑菌性为指标,采用单因素试验和Box-Behnken响应面试验设计确定最佳用酶和最适酶解条件,并用葡聚糖凝胶G-25柱层析分离酶解液,分析有效抑菌成分对多种菌的最小抑菌浓度(minimum inhibitory concentration,MIC),为鱼鳞抗菌肽的制备和应用提供理论依据,实现低值原料高值化的同时为减少鱼鳞对环境的污染提供有益思路。
1 材料与方法
1.1 材料与试剂
鲫鱼鱼鳞,收集于杭州市屏风街菜场。
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、沙门菌(Salmonella choleraescens)、副溶血性弧菌(Vibrio parahemolyticus)、枯草芽孢杆菌(Bacillus subtilis)、假单胞菌(Pseudomonas spp.)、希瓦氏菌(Shewanella putrefaciens)由浙江工商大学食品与生物工程学院微生物实验室保存。
胃蛋白酶(1∶3 000)、胰蛋白酶(1∶250) 美国Amresco公司;中性蛋白酶(200 000 U/g)、木瓜蛋白酶(800 000 U/g) 南宁庞博生物工程有限公司;碱性蛋白酶(200 000 U/g)、酸性蛋白酶(800 000 U/g)江苏锐阳生物科技有限公司;葡聚糖凝胶(Sephadex)G-25 台州路桥四甲生化塑料厂。
1.2 仪器与设备
FE20型pH计 上海梅特勒-托利多仪器有限公司;H1850R高速冷冻离心机 湖南湘仪离心机仪器有限公司;ZX98-1旋转蒸发仪 上海豫康科教仪器设备有限公司;SW-CJ-1D单人净化工作台 上海苏净实业有限公司;Versmax酶标仪 美国Molecular Devices公司。
1.3 方法
1.3.1 鱼鳞预处理
参考吴林泽[13]的方法,稍作修改进行鱼鳞预处理。取15 g清洗风干后鱼鳞于100 mL 5%氢氧化钠溶液中浸泡10 min,在除去鱼鳞上油脂的同时使鱼鳞膨胀;用清水清洗鱼鳞至中性后,于100 mL蒸馏水中磁力搅拌30 min,蒸馏水清洗至无悬浮物存在;再用100 mL 10%的柠檬酸溶液浸泡过夜,取出用蒸馏水清洗至中性,保存备用。
1.3.2 鱼鳞抗菌肽的制备工艺
参考姜绍通等[14]的方法,稍作修改制备鱼鳞抗菌肽。称取预处理后鱼鳞于50 mL蒸馏水中,添加0.2 g/100 mL碱性蛋白酶,在pH 9.5、55 ℃条件下酶解后灭酶(80 ℃,10 min);加入不同蛋白酶,调整相应pH值,进行再次酶解,灭酶后4 000 r/min低温离心20 min;取上清液旋蒸浓缩至25 mL,所得酶解液于4 ℃贮藏备用。
1.3.3 抑菌性能测定
以浓缩后的酶解液对沙门菌、副溶血性弧菌、大肠杆菌和金黄色葡萄球菌的抑菌圈直径为指标,采用牛津杯法[15]考察酶解液的抑菌能力,每组做3 个平行实验。以酶解液对4 种菌的抑菌效果为依据,选择一种菌,作为酶解工艺优化的指示菌。
1.3.4 酶的筛选
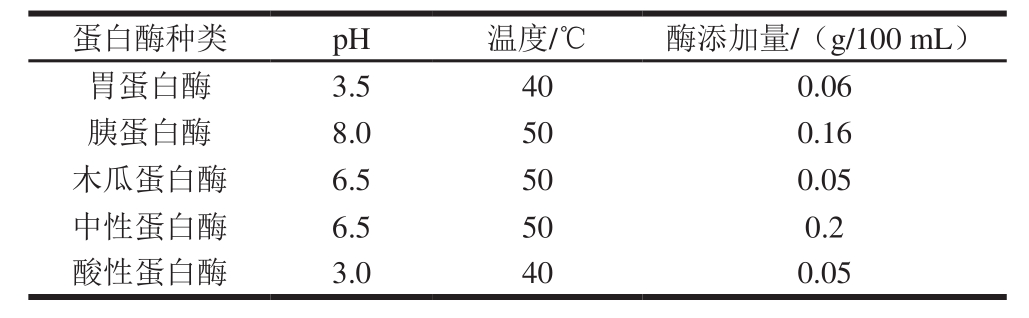
碱性蛋白酶特异性较弱,可作用于色氨酸、丙氨酸、苯丙氨酸、亮氨酸和异亮氨酸参与形成的多种肽键,能较彻底地水解底物蛋白,因此选择碱性蛋白酶对鱼鳞蛋白进行初步酶解[16]。在预实验基础上,选用酸性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶和胰蛋白酶等分别与碱性蛋白酶分步酶解鲫鱼鱼鳞。在碱性蛋白酶酶解(酶解pH 9.5、温度55 ℃)1 h并灭酶后,将酶解液pH值、温度调至后续用酶的最适条件再次酶解4 h,操作步骤参考1.3.2节。各酶的酶解条件及添加量见表1。
表1 5 种蛋白酶的酶解条件及添加量
Table 1 Hydrolysis conditions and dosages of five proteases
1.3.5 单因素试验
按照1.3.2节方法制备鱼鳞抗菌肽,考察底物质量浓度(10、15、20、25、30、35 g/100 mL),碱性蛋白酶酶解时间(20、40、60、80、100 min),酸性蛋白酶酶解温度(30、35、40、45、50 ℃)、酶解pH(2.5、3.0、3.5、4.0、4.5)以及酶解时间(2、3、4、5、6 h)对浓缩后的酶解液抑菌性的影响,并确定各酶解条件的最适范围。
1.3.6 响应面试验设计
根据单因素试验结果,在底物质量浓度30 g/100 mL、酸性蛋白酶酶解pH 3.0的条件下,根据Box-Behnken原理,采用Design-Expert 8.0.5进行三因素三水平试验,确定鲫鱼鱼鳞酶解的最佳条件。以酶解液对副溶血性弧菌的抑菌圈直径为指标,碱性蛋白酶酶解时间、酸性蛋白酶酶解时间及酶解温度为自变量,试验因素及水平设计见表2。
表2 Box-Behnken设计试验因素与水平
Table 2 Factors and their levels used for Box-Behnken design

1.3.7 水解度测定
水解度可用于衡量蛋白质的水解程度。分别采用甲醛滴定法[17]和凯氏定氮法[18]测定氨基态氮含量和原料中的总氮含量。计算公式如式(1)所示:
1.3.8 蛋白质含量测定
采用考马斯亮蓝法[19]测定酶解液中蛋白质浓度,每组做3个平行实验。
1.3.9 葡聚糖凝胶G-25柱层析
将最适条件下酶解获得的酶解液浓缩、离心、过滤后上样,上样量为5 mL,用去离子水洗脱。洗脱过程中,控制流速为0.5 mL/min,每2 mL收集一管,280 nm波长处测定每管洗脱液的吸光度,收集洗脱峰进行抑菌实验。
1.3.10 MIC测定
采用二倍稀释法[20]配制质量浓度为200、100、50、25、12.5、6.25、3.125、1.562 5、0.781 2、0.390 6 μg/mL的抗菌肽溶液,测定其对大肠杆菌、金黄色葡萄球菌、沙门菌、枯草芽孢杆菌、副溶血性弧菌、假单胞菌和希瓦氏菌的MIC,以不添加抗菌肽为阴性对照,以添加50 μg/mL氯霉素为阳性对照(各菌悬液的浓度为106CFU/mL)。将含副溶血性弧菌、假单胞菌和希瓦氏菌的96 孔板置于28 ℃培养,其余菌于37 ℃培养,18 h后利用酶标仪测定600 nm波长光密度值,根据公式(2)计算抑菌率,抑菌率大于95%的最小质量浓度定义为MIC[21-22]。
式中:Y为抑菌率/%;OD阴为阴性对照的光密度值;OD阳为阳性对照的光密度值;OD样为待测样品的光密度值。
1.4 数据处理
利用Excel 2010、Design-Expert 8.0.5进行数据处理及统计分析,并用Origin 8.0作图。
2 结果与分析
2.1 蛋白酶的筛选

图1 不同蛋白酶的酶解液对4 种菌的抑菌效果
Fig. 1 Antibacterial activity of enzymatic hydrolysates produced with different proteases
碱性蛋白酶与其他5 种蛋白酶分步酶解鲫鱼鱼鳞制备所得的酶解液对4 种菌的抑菌性见图1。抑菌性最强的酶解液由碱性蛋白酶和酸性蛋白酶分步酶解所得,对4 种菌的抑菌圈直径均大于16.00 mm,尤其对副溶血性弧菌的抑菌圈直径更是接近于25.00 mm。其次为碱性蛋白酶与胃蛋白酶的酶解液,其对沙门菌以外的3 种菌的抑菌圈直径均大于13.00 mm。而其余3 种蛋白酶的酶解液对各菌的抑菌性则较弱甚至无抑菌性。以不同酶解液对4 种菌的抑菌效果为依据,本实验选用碱性蛋白酶和酸性蛋白酶进行分步酶解制备抗菌肽,并以副溶血性弧菌作为指示菌,对双酶酶解法制备鱼鳞抗菌肽的工艺进行优化。
2.2 单因素试验结果
2.2.1 底物质量浓度对抑菌性的影响
在碱性蛋白酶酶解时间60 min,酸性蛋白酶酶解pH 3.0、温度40 ℃、时间4 h条件下,底物质量浓度对酶解液抑菌性的影响见图2。

由图2可知,当底物质量浓度从10 g/100 mL增加至30 g/100 mL时,抑菌圈直径也相应地从19.78 mm增大至24.83 mm,这是因为底物含量的增加导致具抑菌活性的多肽片段也随之增加。但继续增大底物质量浓度至35 g/100 mL对酶解液的抑菌性影响并不大,这可能是因为底物含量过高,则缺少与底物结合的酶[23]。因此,确定最适底物质量浓度为30 g/100 mL。
2.2.2 碱性蛋白酶酶解时间对抑菌性的影响
在底物质量浓度30 g/100 mL,酸性蛋白酶酶解pH 3.0、温度40 ℃、时间4 h条件下,碱性蛋白酶酶解时间对酶解液抑菌性的影响见图3。
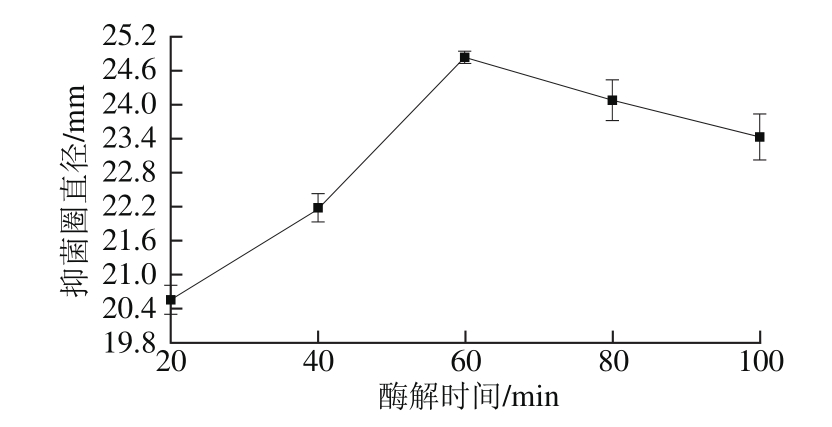
图3 碱性蛋白酶酶解时间对酶解液抑菌性的影响
Fig. 3 Effect of hydrolysis time on antibacterial activity of enzymatic hydrolysate
由图3可知,当碱性蛋白酶酶解时间从20 min延长至60 min时,抑菌圈直径增至最大24.82 mm。而当酶解时间继续延长至100 min时,抑菌圈直径则呈下降趋势,原因可能是鱼鳞蛋白被过度水解成为小分子短肽,多肽的结构受损导致在酸性蛋白酶酶解阶段无法酶解生成具抑菌活性的多肽[24]。因此,确定最适碱性蛋白酶酶解时间为60 min。
2.2.3 酸性蛋白酶酶解pH值对抑菌性的影响
在底物质量浓度30 g/100 mL,碱性蛋白酶酶解时间60 min,酸性蛋白酶酶解温度40 ℃、时间4 h条件下,酸性蛋白酶酶解pH值对酶解液抑菌性的影响见图4。环境pH值可直接影响酶活力,只有在特定pH值条件下,酶分子才会与底物蛋白更快更好结合[25]。由图4可知,当pH 3.0时,酶解液的抑菌性最大,pH值升高或降低都使酶解液的抑菌性降低。因此,确定最适酶解pH 3.0。
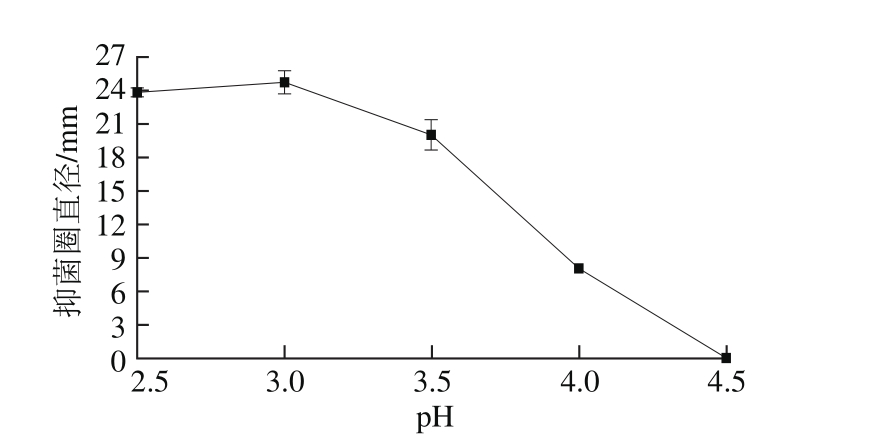
图4 酸性蛋白酶酶解pH值对酶解液抑菌性的影响
Fig. 4 Effect of hydrolysis pH value on antibacterial activity of enzymatic hydrolysate
2.2.4 酸性蛋白酶酶解温度对抑菌性的影响
在底物质量浓度30 g/100 mL,碱性蛋白酶酶解时间60 min,酸性蛋白酶酶解pH 3.0、时间4 h条件下,酸性蛋白酶酶解温度对酶解液抑菌性的影响见图5。
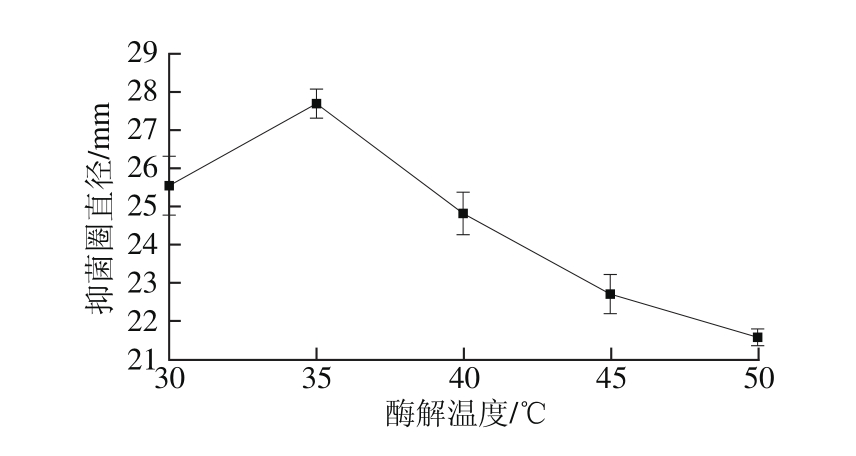
图5 酸性蛋白酶酶解温度对酶解液抑菌性的影响
Fig. 5 Effect of hydrolysis temperature on antibacterial activity of enzymatic hydrolysate
图5 显示,在30~35 ℃范围内,抑菌圈直径逐渐增大,而当继续升高温度时,抑菌圈直径则迅速下降。原因可能是温度的上升加大了酶与底物蛋白之间发生碰撞的概率,从而促进了酶促反应,但当温度过高时,酶分子结构遭到破坏而丧失或部分丧失活性,酶促反应下降,进而导致酶解液抑菌活性下降[26]。因此,确定最适酸性蛋白酶酶解温度为35 ℃。
2.2.5 酸性蛋白酶酶解时间对抑菌性的影响
在底物质量浓度30 g/100 mL,碱性蛋白酶酶解时间60 min,酸性蛋白酶酶解pH 3.0、温度40 ℃条件下,酸性蛋白酶酶解时间对酶解液抑菌性的影响见图6。

图6 酸性蛋白酶酶解时间对酶解液抑菌性的影响
Fig. 6 Effect of hydrolysis time with acid protease on antibacterial activity of enzymatic hydrolysate
图6 表明,在酶解时间处于2~4 h范围内时,酶解液的抑菌性先增后减,当酶解时间大于4 h时,酶解液的抑菌性基本保持不变。其中,酶解时间为3 h的酶解液抑菌圈直径最大,为26.60 mm。这可能是因为具抑菌活性的氨基酸序列随酸性蛋白酶酶解时间的延长不断暴露出来,而酶解时间继续延长时,有抑菌性的多肽片段被水解成无抑菌性的更小分子片段,引起抑菌效果的减弱[27]。酶解4 h后,底物蛋白中的酶切位点已被全部酶解并达到饱和,故抑菌性保持稳定。因此,确定最适酸性蛋白酶酶解时间为3 h。
2.3 响应面试验结果
2.3.1 响应面设计方案与试验结果
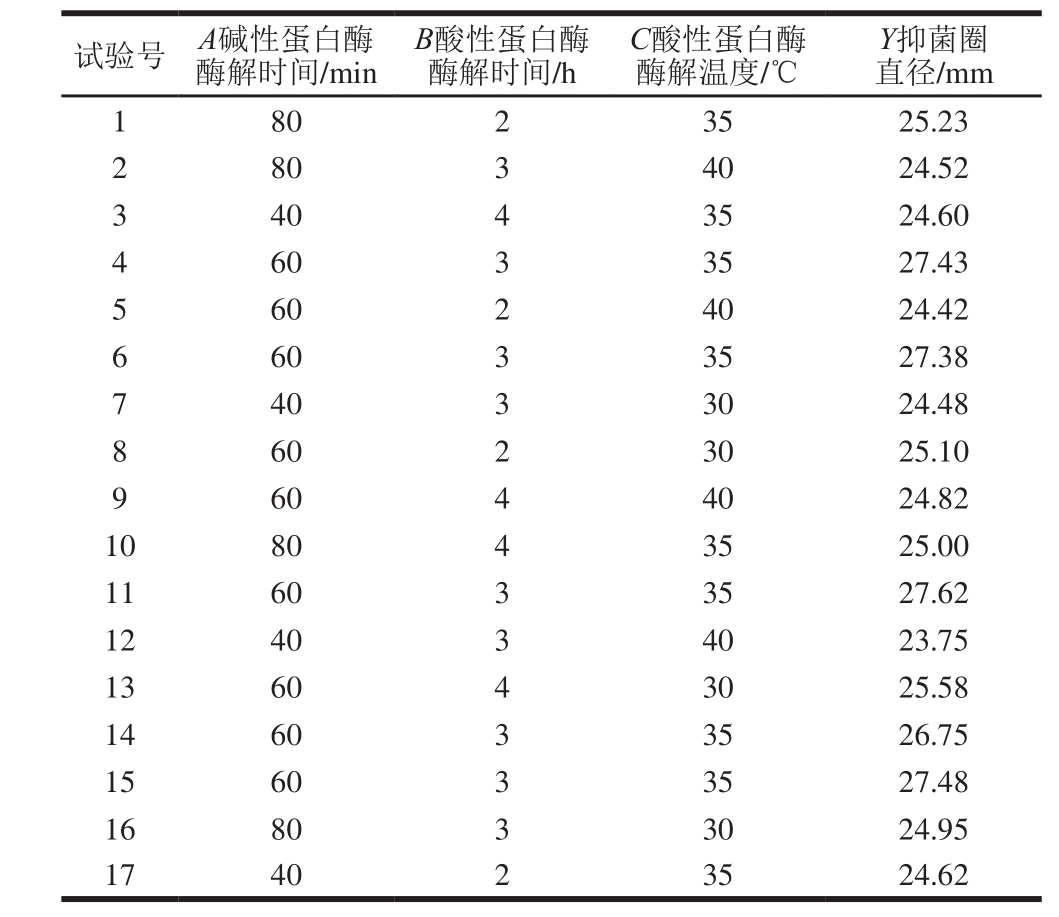
综合单因素试验结果,选择碱性蛋白酶酶解时间、酸性蛋白酶酶解时间和酸性蛋白酶酶解温度为考察因素,选择底物质量浓度30 g/100 mL、酸性蛋白酶酶解pH 3.0,根据Box-Behnken设计原理进行响应面试验,其设计方案和结果见表3。
表3 响应面试验设计方案与结果
Table 3 Experimental design scheme with experimental results for response surface analysis
2.3.2 回归方程的建立及方差分析
根据Design-Expert 8.0软件进行多元回归拟合后,得到回归方程为:
Y=-61.394+0.449A+6.102B+3.810C-2.604×10-3AB+7.500×10-4AC-3.750×10-3BC-3.781×10-3A2-0.956B2-0.056C2
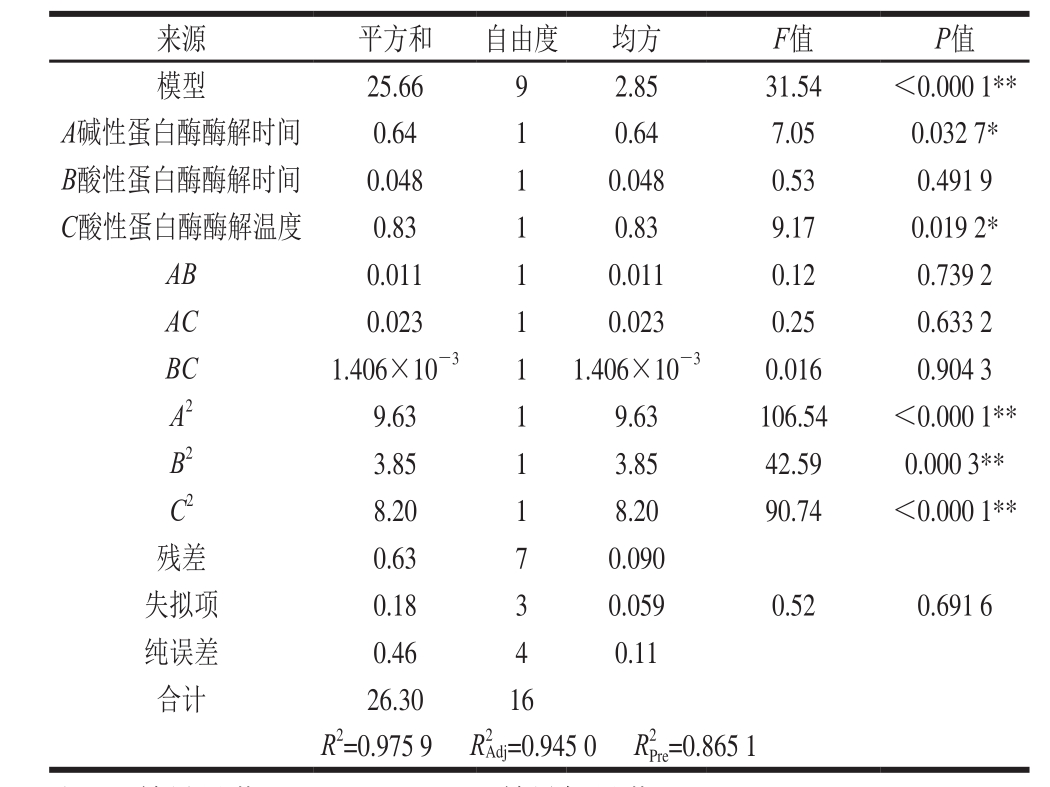
式中各项系数的绝对值表示单因素对抑菌圈直径的影响程度,正负则反映影响的方向。对回归方程进行方差分析,结果见表4。
表4 回归模型方差分析
Table 4 Analysis of variance (ANOVA) of regression equation
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
从表4可知,回归模型极显著(P<0.000 1)。而失拟项中F值为0.52,P值为0.691 6(P>0.05),不显著,这表明模型拟合度良好,可以较好地解释响应中的变异。模型的回归系数 为0.975 9,
为0.975 9,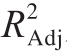 为0.945 0,
为0.945 0,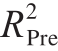 为0.865 1,证明该回归模型能很好地预测鲫鱼鱼鳞酶解工艺的结果。
为0.865 1,证明该回归模型能很好地预测鲫鱼鱼鳞酶解工艺的结果。
在该模型中,回归系数的显著性检验显示,除B(P>0.05)不显著外,一次项A、C对酶解液抑菌性的影响均达到显著水平(P<0.05),比较A、B、C 3 个因素的F值大小可得,3 个因素对酶解工艺的影响依次为:酸性蛋白酶酶解温度>碱性蛋白酶酶解时间>酸性蛋白酶酶解时间。二次项(A2、B2、C2)对试验结果的影响极显著(P<0.01);交互项(AB、AC、BC)对酶解液的抑菌性影响均不显著(P>0.05)。
图7是以3个因素中任意两个因素与抑菌圈直径所作的三维响应面图,直观地反映了各因素间的相互影响[28]。根据响应面分析,得到最大抑菌圈直径为27.37 mm,对应的酶解条件为:碱性蛋白酶酶解时间61.80 min、酸性蛋白酶酶解时间3.04 h、酸性蛋白酶酶解温度34.43 ℃。

图7 酶解液对抑菌圈直径影响的响应面分析
Fig. 7 Response surface plots for diameter of inhibition zone of enzymatic hydrolysate
2.3.3 最佳酶解条件的验证
鉴于实验的可操作性,调整酶解条件为碱性蛋白酶酶解时间62 min、酸性蛋白酶酶解时间3 h、酸性蛋白酶酶解温度34.4 ℃,得到实际抑菌圈直径平均值为27.72 mm,与优化预测结果相差1.3%,由此可见该模型具有一定的可靠性。此外,经测定此条件下酶解液中蛋白质质量浓度为0.5 mg/mL,水解度为26.21%。
2.4 Sephadex G-25柱层析分离结果

图8 葡聚糖凝胶G-25柱层析分离结果
Fig. 8 Chromatographic separation of antimicrobial peptide on Sephadex G-25 column
酶解液经Sephadex G-25层析分离后,用紫外分光光度计测定各管在280 nm波长处的吸光度,以管数为横坐标,吸光度为纵坐标作图,结果见图8。结果显示,酶解液层析分离后有3 个波峰,分别在第6、11、25管。以副溶血性弧菌为受试菌,测定波峰及相邻管数溶液的抑菌性,结果表明仅第11和12号收集管中溶液具有抑菌性,合并第11、12号收集管,记为G2,经测定得G2组分的蛋白质质量浓度为0.2 mg/mL。
2.5 MIC测定结果
表5 抗菌肽对各菌的MIC测定
Table 5 MICs of G2

测定G2组分对各菌的MIC,结果见表5。G2对假单胞菌和希瓦氏菌的MIC为1.56 μg/mL,优于对其他实验菌种的抑菌效果,这可能是因为该抗菌肽来自淡水鱼鱼鳞,因此对鱼自身的优势腐败菌(假单胞菌、希瓦氏菌)的抑菌作用更明显。相比较于芫荽叶抗菌肽对金黄色葡萄球菌和铜绿假单胞菌的MIC为1.3、3.2 mg/mL,鸡蛋蛋清抗菌肽对大肠杆菌和肠膜明串珠菌的MIC为355.64、442.25 μg/mL而言,G2组分的抑菌效果更强,具有极大的应用前景[29-30]。
3 结 论
本实验对鲫鱼鱼鳞酶解液的抑菌性进行了研究,并且对酶解条件进行了优化。比较研究碱性蛋白酶与5 种蛋白酶分步酶解鲫鱼鱼鳞所得酶解液的抑菌性,筛选出酸性蛋白酶为理想的再次酶解蛋白酶。针对酶解过程中影响较大的碱性蛋白酶酶解时间、酸性蛋白酶酶解时间及酶解温度进行了深入的研究,在最佳酶解条件下,获得酶解液对副溶血性弧菌的抑菌圈直径高达27.72 mm。最佳酶解条件下制备的酶解液经G-25层析分离后,其中主要抑菌成分G2对假单胞菌和希瓦氏菌的MIC为1.56 μg/mL,对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门菌及副溶血性弧菌的MIC为6.25 μg/mL,抑菌性较强。
本研究仅对鱼鳞抗菌肽的抑菌性和制备进行了初步探索,关于抗菌肽对其他代表性细菌和真菌的抑菌性及抑菌机理仍有待进一步研究。以此实验结果为基础,不断深入研究鱼鳞抗菌肽并将其开发成为健康食品、天然食品防腐剂等,用于健康食品生产及食品保鲜将具有广阔的应用前景。
参考文献:
[1] RODGERS S. Potential applications of protective cultures in cookchill catering[J]. Food Control, 2003, 14(1): 35-42. DOI:10.1016/S0956-7135(02)00050-6.
[2] JI H B, SI H L. Isolation and molecular cloning of venom peptides from Orancistrocerus drewseni (Hymenoptera: Eumenidae)[J].Toxicon, 2010, 55(4): 711-718. DOI:10.1016/j.toxicon.2009.10.023.
[3] HOOD J L, JALLOUK A P, CAMPBELL N, et al. Cytolytic nanoparticles attenuate HIV-1 infectivity[J]. Antiviral Therapy, 2013,18(1): 95-103. DOI:10.3851/IMP2346.
[4] MARÓTI G, KERESZT A, KONDOROSI É, et al. Natural roles of antimicrobial peptides in microbes, plants and animals[J].Research in Microbiology, 2011, 162(4): 363-374. DOI:10.1016/j.resmic.2011.02.005.
[5] YANG P, RAMAMOORTHY A, CHEN Z. Membrane orientation of MSI-78 measured by sum frequency generation vibrational spectroscopy[J]. Langmuir the ACS Journal of Surfaces & Colloids,2011, 27(12): 7760-7767. DOI:10.1021/la201048t.
[6] 国家大宗淡水鱼产业技术研发中心. 2013年国内外大宗淡水鱼养殖业现状及技术研发进展[J]. 科学养鱼, 2014, 30(4): 81-84.DOI:10.14184/j.cnki.issn1004-843x.2014.04.046.
[7] 胡建平. 鱼胶原蛋白的开发与应用[M]. 成都: 四川大学出版社,2014: 48.
[8] NIU S F, JIN Y, XU X, et al. Characterization of a novel piscidinlike antimicrobial peptide from Pseudosciaena crocea and its immune response to Cryptocaryon irritans[J]. Fish & Shellfish Immunology,2013, 35(2): 513-524. DOI:10.1016/j.fsi.2013.05.007.
[9] ACOSTA J, MONTERO V, CARPIO Y, et al. Cloning and functional characterization of three novel antimicrobial peptides from tilapia(Oreochromis niloticus)[J]. Fish & Shellfish Immunology, 2013,372/373/374/375(6): 9-18. DOI:10.1016/j.fsi.2013.03.171.
[10] 杨娜, 王鸿飞, 林燕, 等. 鱿鱼皮酶解产物抑菌及对血管紧张素酶的抑制作用[J]. 中国食品学报, 2015, 15(1): 92-98. DOI:10.16429/j.1009-7848.2015.01.015.
[11] SILA A, NEDJAR-ARROUME N, HEDHILI K, et al. Antibacterial peptides from barbel muscle protein hydrolysates: activity against some pathogenic bacteria[J]. LWT-Food Science and Technology,2014, 55(1): 183-188. DOI:10.1016/j.lwt.2013.07.021.
[12] BOLSCHER J G, KRAAN M I, NAZMI K, et al. A one-enzyme strategy to release an antimicrobial peptide from the LFampin-domain of bovine lactoferrin[J]. Peptides, 2006, 27(1): 1-9. DOI:10.1016/j.peptides.2005.06.012.
[13] 吴林泽. 罗非鱼下脚料酶解产物中抗菌肽的初步研究[D]. 海口: 海南大学, 2007.
[14] 姜绍通, 罗蕾蕾, 潘牧, 等. 菜籽粕分步酶解制备水解产物的研究[J]. 食品科学, 2009, 30(10): 52-55. DOI:10.3321/j.issn:1002-6630.2009.10.007.
[15] 晏秀梅, 魏静, 许靖逸, 等. 茶多酚与茶皂素及其复配液的抑菌作用研究[J]. 食品工业科技, 2014, 35(22): 159-161. DOI:10.13386/j.issn1002-0306.2014.22.026.
[16] 徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 3版. 北京: 人民卫生出版社, 2002: 1612.
[17] 杨莉莉. 鱼鳞胶原肽的分步酶解法制备及其特性研究[D]. 武汉: 华中农业大学, 2011.
[18] 卫生部. 食品中蛋白质的测定: GB 5009.5—2010[S]. 北京: 中国标准出版社, 2010.
[19] 王永华. 食品分析[M]. 2版. 北京: 中国轻工业出版社, 2010: 128.
[20] SUN Y J, CHANG R, LI Q Y, et al. Isolation and characterization of an antibacterial peptide from protein hydrolysates of Spirulina platensis[J]. European Food Research & Technology, 2015, 242(5):685-692. DOI:10.1007/s00217-015-2576-x.
[21] 张建新, 孙长江. 黄粉虫抗菌肽的分离纯化及生物活性研究[J]. 现代食品科技, 2016, 32(1): 116-121. DOI:10.13982/j.mfst.1673-9078.2016.1.019.
[22] ROJO-BEZARES B, SÁENZ Y, ZARAZAGA M, et al. Antimicrobial activity of nisin against Oenococcus oeni, and other wine bacteria[J].International Journal of Food Microbiology, 2007, 116(1): 32-36.DOI:10.1016/j.ijfoodmicro.2006.12.020.
[23] 姜文鑫. 紫苏蛋白的性状表征及抗菌肽的制备[D]. 长春: 吉林农业大学, 2014.
[24] 姜太玲, 吴红洋, 王微, 等. 响应面法优化胃蛋白酶制备花椒籽蛋白抗菌肽的研究[J]. 食品工业科技, 2014, 35(20): 226-231.DOI:10.13386/j.issn1002-0306.2014.20.041.
[25] 王全林, 刘志洪, 蔡汝秀, 等. 血红蛋白的过氧化物酶催化特性研究[J]. 化学学报, 2003, 61(1): 34-39. DOI:10.3321/j.issn:0567-7351.2003.01.007.
[26] 龚吉军, 李振华, 李忠海, 等. 响应曲面法优化油茶粕抗菌肽制备条件[J]. 中国食品学报, 2012, 12(9): 137-143. DOI:10.16429/j.1009-7848.2012.09.017.
[27] LI G H, LE G W, SHI Y H, et al. Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J]. Nutrition Research, 2004, 24(7):469-486. DOI:10.1016/j.nutres.2003.10.014.
[28] QIU J Z, SONG F F, QIU Y F, et al. Optimization of the medium composition of a biphasic production system for mycelial growth and spore production of Aschersonia placenta using response surface methodology[J]. Journal of Invertebrate Pathology, 2013, 112(2): 108-115. DOI:10.1016/j.jip.2012.10.010.
[29] ZARDINI H Z. Biological activities of a new antimicrobial peptide from Coriandrum sativum[J]. Journal of Spices & Aromatic Crops,2014, 4(6): 89-99. DOI:10.12692/ijb/4.6.89-99.
[30] MEMARPOOR-YAZDI M, ASOODEH A, CHAMANI J K. A novel antioxidant and antimicrobial peptide from hen egg white lysozyme hydrolysates[J]. Journal of Functional Foods, 2012, 4(1): 278-286.DOI:10.1016/j.jff.2011.12.004.
 A碱性蛋白酶酶解时间/min 40 60 80 B酸性蛋白酶酶解时间/h 2 3 4 C酸性蛋白酶酶解温度/℃ 30 35 40
A碱性蛋白酶酶解时间/min 40 60 80 B酸性蛋白酶酶解时间/h 2 3 4 C酸性蛋白酶酶解温度/℃ 30 35 40