酱香型白酒是我国最为著名的白酒之一,主要以香气幽雅、酒体醇厚丰满、回味悠长、空杯留香持久的特点而闻名于世;一般来说,酱香型白酒的生产遵循“四高三长,一大一多”的传统酿造工艺,“四高三长”即表示生产过程经历高温制曲、高温堆积、高温发酵、高温馏酒4 个高温阶段,酿造过程具有制曲时间长、生产周期长、储藏时间久的特征,而“一大一多”则表明酱香白酒酿造还兼具用曲量大、可多轮次发酵取酒的鲜明特点。在如此复杂的酿造工艺中,高温制曲便为其中的一个重要环节,在完全开放的环境下,酱香大曲的制曲温度可以高达60~65 ℃,如此高热的环境也就为许多嗜热微生物的生长代谢提供了可能。已有研究表明,独特的高温制曲工艺造就了大曲特征性微生物区系,许多嗜热微生物尤其是嗜热细菌得到有效富集,经过不断生长、代谢赋予酱香大曲突出的生香能力,进而对酱香型白酒特征风味品质的形成有着重要贡献[1]。
目前,针对酱香大曲中嗜热功能微生物的研究多集中在以芽孢杆菌为代表的一类嗜热、耐热细菌上,在制曲工艺条件下,研究者们针对不同酱香高温大曲中分离得到的各种芽孢杆菌开展了产酶、产香特性方面的研究,发现该微生物类群均具有产高活性酸、中性蛋白酶的能力,同时代谢产生能够包括醛、醇、噻唑、呋喃、吡嗪、高级酸、烷烃等一系列特征风味化合物,从而证实了芽孢杆菌类群与酱香风味的产生有着密切的关系[2-6];但对于以耐热、高温放线菌为代表的另一类大曲嗜热微生物类群的研究则鲜有报道,高温放线菌类群被微生物学界认为是一类能够在极端环境下生长代谢的革兰氏阳性、化能异养菌[7],该菌从分类学上来看介于细菌和放线菌之间,在形态学上接近于放线菌,但从分子生物学上分析则更接近于细菌[8]。该类群下的大多数菌种均能够在50 ℃以上的高温环境下生长,在自然界中广泛分布于陆生性热泉、高温堆肥等环境中[9-10],内生孢子具有良好的抗性[11],是一类能够适应高温环境的极端资源微生物,拥有一般微生物所不具备的生理生化及代谢特性,具有巨大的潜在工业应用价值和理论意义。本课题组的王晓丹等[12]在之前通过构建大曲总微生物16S rDNA克隆文库,采用454 FLX+高通量测序平台对贵州3 种酱香型白酒高温大曲中细菌的群落结构及其多样性进行了深入研究,均发现高温放线菌类群为大曲细菌类群中的主要优势菌属,在属水平上其含量均占到大曲总生物量的34%以上,加之当今白酒稀有微生物资源发掘、绿色化生产趋势的增强,使得探究该菌属的分离筛选方法及其在酱香高温大曲中的功能性作用显得十分必要。
本研究拟采取合适的预处理、分离筛选方法,对酱香高温大曲中的高温放线菌类群进行分离,通过形态学、生理生化特征分析和16S rRNA基因序列鉴定明确菌种种类及特性,同时利用固态发酵实验分析菌种挥发性风味成分,从而为日后深入研究分析酱香型白酒中高温放线菌类群提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱香大曲由贵州某酿酒企业提供,该公司的酒厂坐落于贵州酒都茅台镇,与国酒茅台享有极为相似水土、气候条件和酿造微生物资源,其酱香大曲的制作完全沿用茅台酒传统制曲工艺。本研究所用酱香大曲是在白酒酿造车间取粉碎后待投料的陈曲粉,于曲堆中随机取20 个样品混匀包装,以保证所取样品的充分代表性,并于4 ℃保存。
1.1.2 试剂
正己烷(色谱纯) 德国Meker公司;GF 254薄层色谱硅胶 青岛海洋化工厂;细菌基因组DNA提取试剂盒 美国Biomiga公司;制霉菌素、新生霉素、琼脂糖、Tris、EDTA二钠 北京索莱宝科技有限公司;其他化学试剂均为国产分析纯。
1.1.3 培养基
分离筛选培养基采用改良高氏二号培养基[13]:葡萄糖1 g、蛋白胨0.5 g、胰蛋白胨0.3 g、氯化钠0.5 g、复合维生素2.75 mg(包括VB1、VB2、VB3、VB5、VB6各0.5 mg,VB70.25 mg)、琼脂 20.0 g、蒸馏水1 000 mL,pH 7.2~7.4,121 ℃灭菌20 min。
菌株纯化、保藏使用ISP2培养基[14]:酵母膏4 g、麦芽汁10.0 g、葡萄糖4.0 g、琼脂20.0 g、蒸馏水1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。
液体扩培培养基:葡萄糖10 g、小麦浸出物20 mL、氯化钠5 g、磷酸氢二钾4 g、磷酸二氢钾2 g、七水硫酸镁0.5 g、蛋白胨4 g、蒸馏水1 000 mL,pH 7.0~7.2,115 ℃灭菌30 min。
高粱小麦固态发酵培养基:见1.3.3.1节的描述。
1.2 仪器与设备
高速冷冻离心机 美国贝克曼库尔特有限公司;核酸凝胶电泳仪、凝胶成像仪 德国耶拿分析仪器股份公司;HP 7890/5975C气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪美国安捷伦公司;30 μm DVB/CAR/PDMS Stableflex固相微萃取头 美国Supelco公司;S-3400N型扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 高温放线菌的分离筛选
1.3.1.1 大曲样品的预处理
用灭菌三角瓶称取10 g大曲样品,封口置于烘箱里120 ℃加热1 h[15],取出后于无菌环境下加入1 g碳酸钙粉末,添加适量无菌水,在空气湿度饱和的条件下置于28 ℃培养箱中富集培养7 d[13],之后取1 g富集处理好的曲样放入带有玻璃珠的三角烧瓶中,混合2.5 g/L质量浓度的羧甲基纤维素缓冲液,于50 ℃恒温摇床中以200 r/min的转速振荡30 min,备用。
1.3.1.2 菌种的分离纯化
分离筛选培养基灭菌处理后,在其冷却凝固前加入新生霉素(30 mg/L)和制霉菌素(20 mg/L)两种抑制剂,随后将处理好的菌悬液视为10-1浓度,分别吸取1 mL菌悬液以10 倍为稀释单位进行稀释,逐次稀释到10-2、10-3、10-4、10-5倍,并从不同稀释倍数的菌悬液中各取0.2 mL涂布接种于分离筛选培养皿上,其中10-2、10-3倍各做3 个平行,其余浓度梯度做2 个平行,于45 ℃恒温培养箱中倒置培养进行分离筛选[16];待筛选平板上长出单菌落后,根据《伯杰氏细菌鉴定手册》[17]中对高温放线菌特征的描述,挑取目标菌落使用ISP2培养基进行平板划线分离直至得到单菌落,通过形态特征观察去除重复菌株,然后接种于ISP2斜面培养基上完成菌种保藏。
1.3.2 菌种鉴定
1.3.2.1 菌株形态学观察鉴定
将分离出的菌株分别接种于ISP2培养基上,于45 ℃恒温培养箱中倒置培养3 d后分别从菌落形状、基内菌丝、气生菌丝颜色及可溶性色素产生情况等方面观察并记录结果[18],同时经菌株插片培养后,制片于S-3400N型扫描电子显微镜下观察其菌丝体及孢子结构特征,并根据《伯杰氏细菌鉴定手册》[17]完成形态学鉴定。
1.3.2.2 菌株温敏性分析
将分离出的菌种接种于ISP2培养基上,分别置于30、37、45、50、55、60 ℃ 6 个温度梯度下培养48 h后,观察菌株生长状况。
1.3.2.3 菌株生理生化鉴定
针对高温放线菌菌种特性,设计明胶液化、碳源利用、牛奶凝固与胨化、淀粉水解、硝酸盐还原和纤维素分解等生理生化实验[14],进行观察和记录。
1.3.2.4 菌株分子生物学鉴定
利用细菌基因组DNA提取试剂盒提取目标菌株基因组DNA,具体操作步骤参见试剂盒说明书。同时分别采用细菌16S rDNA正向引物Primer A:5’-AGAGT TTGATCCTGGCTCAG-3’和反向引物Primer B:5’-AAGGAGGTGATCCAGCCGCA-3’进行扩增[19],反应体系包括(25 μL反应体系):2 μL DNA模板,12.5 μL聚合酶链式反应(polymerase chain reaction,PCR)MIX,上下游引物各1 μL,ddH2O 8.5 μL;扩增条件为:95 ℃预变性5 min,95 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,共30 个循环;最终72 ℃延伸10 min。纯化后的菌株基因组DNA采用0.8%的琼脂糖电泳后在凝胶成像仪上对DNA提取效果进行检测;PCR产物的测序由上海英潍捷基生物有限公司完成,采用16S rDNA测序方法对菌株进行分子鉴定。
测序结果运用美国国家生物信息技术中心(National Center of Biotechnology Information,NCBI)数据库以及EzTaxon比对服务(http://www.eztaxon.org/)进行BLAST比对,采用MEGA 5.0软件进行多序列比对,邻接法(Neighbor-Joining)构建菌株系统发育树。
1.3.3 高温放线菌固态发酵挥发性代谢产物分析
1.3.3.1 固态发酵培养基的配制
按照高粱与小麦总体质量比1∶1,小麦全粉碎,高粱整粒-细粉质量比为3∶1的原则混合均匀,每250 mL三角瓶装入40 g原料,加入60%的沸水润粮处理5~6 h,然后加入适量预先活化好的糖化酶搅拌均匀,使得其酶活力在200 U/g左右,于60 ℃水浴条件下糖化3~4 h,随后采用115 ℃灭菌30 min。
1.3.3.2 菌株GC-MS分析
将筛选鉴定出的高温放线菌接种到液体扩培培养基中,于45 ℃恒温振荡箱中以150 r/min培养至液体中长成许多菌丝球,完成菌株接种液的配制,并于无菌条件下,按照6%的接种量向固态发酵培养基中接入菌株接种液,搅拌均匀并封口,置于45 ℃恒温培养箱中发酵5 d后,均匀取样品10 g左右,置于固相微萃取仪采样瓶中,插入手动进样器,在60 ℃左右顶空萃取30 min后取出,快速移出萃取头并立即插入气相色谱仪进样口(温度250 ℃)中,热解吸3 min后进样,同时进行空白对照实验。GC-MS数据利用质谱计算机数据系统检索及核对Nist2005和Wiley275标准质谱图,确定挥发性化学成分,并采用峰面积归一化法测定各化学成分的相对含量,同时按类别针对主要挥发性物质的相对含量采用Origin作图以反映总体情况。
1.3.3.3 气相色谱条件
色谱柱:ZB-5MSI 5%Phenyl-95%DiMethylpolysiloxane(30 m×0.25 mm,0.25 μm)弹性石英毛细管柱。升温程序:柱温35 ℃(保留5 min),以4 ℃/min升温至135 ℃,保持2 min;再以8 ℃/min升温至180 ℃,保持5 min;汽化室温度250 ℃,载气为高纯He(99.999%),柱前压7.62 psi,载气流量1.0 mL/min,不分流进样,溶剂延迟时间为2 min。
1.3.3.4 质谱条件
离子源为电子电离源,离子源温度为230 ℃,四极杆温度150 ℃,电子能量70 eV,发射电流34.6 μA,倍增器电压1 350 V,接口温度280 ℃,分子质量范围为20~450 u。
2 结果与分析
2.1 菌种分离筛选及形态学特征鉴定
以改良高氏二号培养基[13]为分离筛选培养基,利用平板涂布分离方法,根据高温放线菌在培养基上的特征性菌落形态特征挑选出目标菌株,接入到ISP2培养基上进行多轮次菌株的分离纯化,最终分离得到1 株纯种菌株FBKL4.010,并保藏于贵州大学发酵重点实验室,有待进一步研究。
将分离得到的高温放线菌菌株FBKL4.010以单菌落点种法接种于ISP2培养基上,于45 ℃恒温培养箱中倒置培养3 d,发现该菌株生长良好,培养基正反两面呈现出不同生长趋势,菌落形状呈缺刻圆状、菌落突起、有较多皱褶且质地干燥致密,基内菌丝呈浅黄色、气生菌丝呈乳白色,其中气生菌丝较为发达,无可溶性色素产生,总体而言,该菌株菌落形态具有一定的高温放线菌培养特征,具体的菌株形态学培养特征见图1。

图1 菌株FBKL4.010在ISP2培养基上的单菌落
Fig. 1 Colony morphology of strain FBKL4.010 on ISP medium 2

图2 扫描电子显微镜下菌株FBKL4.010的形态特征(×15 000)
Fig. 2 Morphological characteristics of strain FBKL4.010 under scanning electron microscope (× 15 000)
菌株FBKL4.010在扫描电子显微镜下的特征如图2所示,结合《伯杰氏细菌鉴定手册》[17]观察,发现该菌株菌丝体呈细长棒状,以形成单个孢子为特征,分生孢子直接着生于菌丝体上,并零散的分布于菌丝体两侧,其中有分支的孢子梗长度较短。
2.2 最适生长温度的确定
根据菌株的温敏性实验结果可知,该大曲高温放线菌菌株FBKL4.010的最适生长温度为45 ℃,在50~60 ℃的超高温范围内仍然能够正常生长代谢,但在30 ℃常温条件下却无法生长,37 ℃时呈现出生长缓慢的特点。
2.3 生理生化特征鉴定结果
表1 菌株FBKL4.010的生理生化特征
Table 1 Physiological and biochemical characteristics of strain FBKL4.010
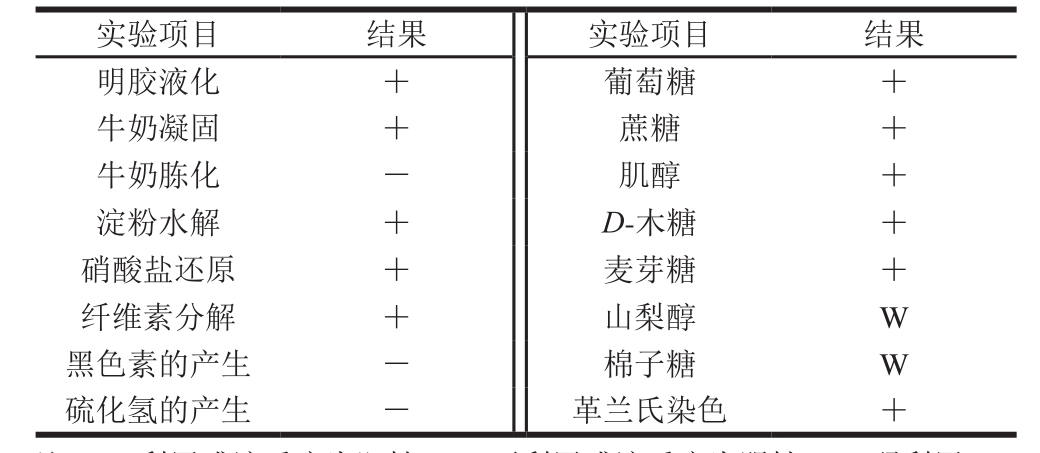
注:+.利用或该反应为阳性;-.不利用或该反应为阴性;W.弱利用。
如表1所示,通过菌株生理生化特征分析,发现菌株FBKL4.010为革兰氏阳性菌,能够代谢产酸使牛奶凝固,但不胨化,能使明胶产生液化现象并还原硝酸盐为亚硝酸盐,具有一定水解淀粉的能力,不能产生黑色素及硫化氢;在培养条件下能够利用葡萄糖、蔗糖、D-木糖、麦芽糖和肌醇5 种碳源生长代谢,对棉子糖、山梨醇两种碳源则呈现出弱利用特征,同时还能够利用纤维素生长。
2.4 16S rRNA基因系统发育分析
从菌株FBKL4.010中提取基因组的DNA片段长度约为23 kb,分别利用引物对Primer A:5’-AGAGTTTGATCCTGGCTCAG-3’和Primer B:5’-AAGGAGGTGATCCAGCCGCA-3’进行扩增得到菌株16S rRNA基因序列,其有效片段长度约为900 bp,将所得序列与GenBank、EzTaxon等数据库中较为相似且有效发表的菌株16S rRNA序列进行比对,在种分类学的水平进行序列相似性搜索,发现菌株FBKL4.010与莱斯氏属下的菌株呈现出高度相关性,其中与其相似性最高的有效种为糖莱斯氏菌(Laceyella sacchari)。通过菌株FBKL4.010与相关模式菌株系统发育树的构建(图3),发现菌株FBKL4.010与L. sacchari菌株KCTC 9790聚类在一个系统发育分支上,序列同源性为100%,确定该菌株属于Laceyella sp.,在种水平上为糖莱斯氏菌(L. sacchari)下的一个菌株。

图3 菌株FBKL4.010基于16S rRNA基因序列的系统发育树
Fig. 3 Neighbor-Joining phylogenetic tree based on 16S rRNA gene sequences of strain FBKL4.010
2.5 固态发酵挥发性代谢产物分析
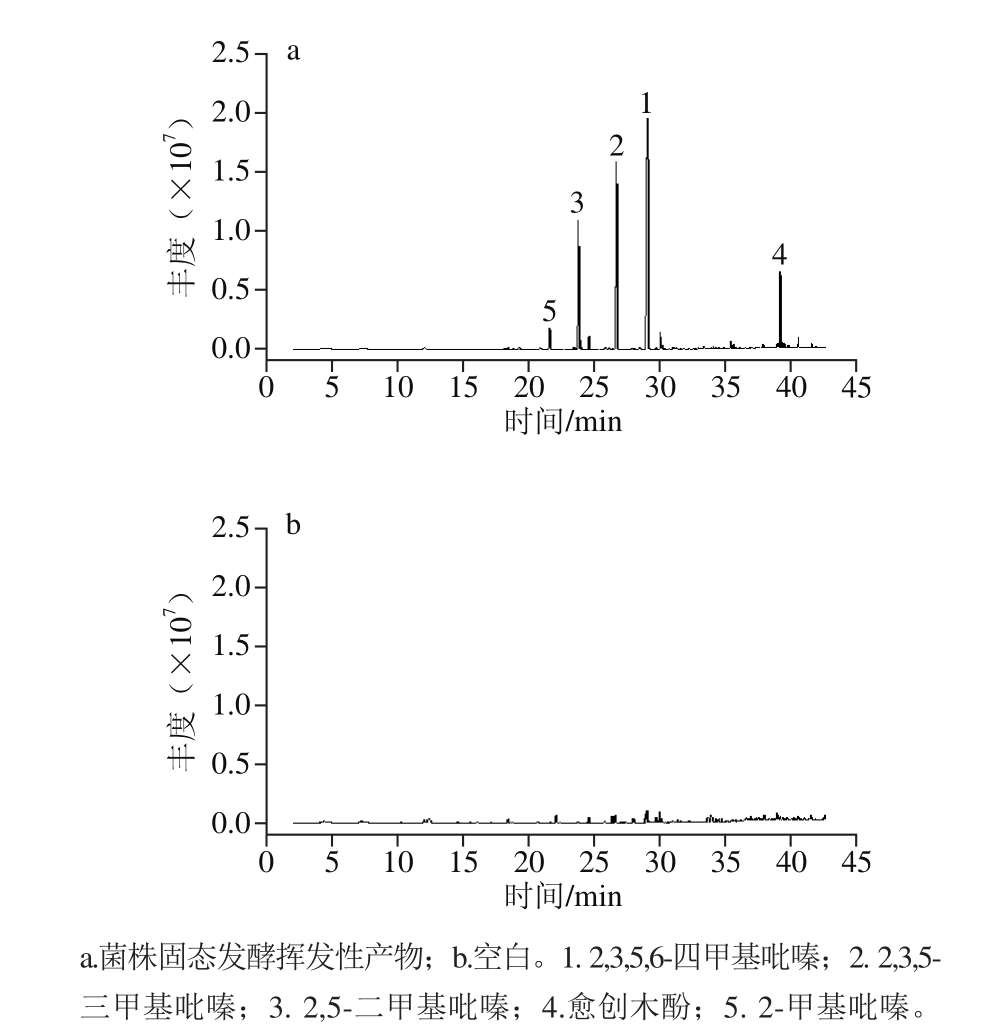
图4 菌株FBKL4.010固态发酵挥发性产物总离子色谱图
Fig. 4 Total ion current chromatograms of volatile compounds from strain FBKL4.010 in solid-state culture
将扩培合格的菌株接入固态发酵培养基中,并以糖化处理后且未接菌株固态发酵培养基为空白对照,置于45 ℃的恒温条件下发酵5 d后,通过固相微萃取与GC-MS技术对菌株固态发酵物进行风味成分分析,总离子流图见图4。结合表2,共发现挥发性成分40 种,除3 种未知物质外,其余物质均得到确定;其中发现待测菌株FBKL4.010固态发酵物中能够检测到9 种吡嗪类物质,相对含量占到总挥发性物质的83.094%,是菌株FBKL4.010最主要的风味代谢成分;7 种芳香类物质,占到总挥发性物质的5.885%;7 种醇类物质,占到总挥发性物质的2.133%;2 种醛类物质,占到总挥发性物质的1.343%;1 种酯类物质,占到总挥发性物质的0.40%;5 种酮类物质,占到总挥发性物质的0.395%;2 种烯类物质,占到总挥发性物质的0.069%以及6 种其他类挥发性物质,占到总挥发性物质的6.681%。
吡嗪类物质中四甲基吡嗪的丰度最高,高达43.318%,综合多年研究,四甲基吡嗪一直被看作是酱香风味的主体成分,过去曾一度认为来源于酿造体系中一系列美拉德反应,但随着高产四甲基吡嗪的芽孢杆菌类群代谢方面研究的深入,最终确定乙偶姻、氨为其发酵前体物质,主要由以芽孢杆菌类群为代表的嗜热菌群发酵代谢而非酶促反应产生,为今后酱香白酒酿造中风味物质的调控提供了重要指导[20-25]。对本研究而言,四甲基吡嗪由高温放线菌菌株在固态发酵条件下代谢产生还是首次发现,同时还证实该菌具有产其他类甲基吡嗪类物质的能力;此外,研究还发现菌株FBKL4.010能够代谢另一种酱香物质——愈创木酚,其相对含量达到5%以上。
表2 菌株FBKL4.010固态发酵物挥发性成分分析
Table 2 Analysis of volatile components produced by strain FBKL4.010 in solid-state fermentation

以上物质中吡嗪类物质主要呈现出豆豉、坚果风味,是发酵大豆制品特色风味的主要来源[26],该类物质阈值较低但气味强度很大,往往对红酒特征风味的呈现具有重要贡献[27],蛋白组学的研究同时显示该类物质中甲氧基吡嗪类物质的存在有助于红酒风味的改善[28-29],而在白酒中吡嗪类物质也具有同样的作用[30];愈创木酚主要呈现出烟熏风味,为酱香白酒中酚类风味物质中的主要成分,具有很好的抗氧化活性[31],是小麦啤酒、葡萄酒、酱油等酿造制品的主要呈香物质[32],而最新的发现也证实其少量存在于酿造用高粱蒸煮香气之中[33];由此可见菌株FBKL4.010在酱香型白酒的酿造过程中很可能是一株重要的产香功能菌,其具体的代谢机理值得日后深入研究。
3 结 论
本研究结合地方特色,选取贵州省赤水河流域的某酒厂酱香大曲为对象,设计出干热处理与钙离子富集的预处理手段,使用改良高氏二号培养基进行筛选,成功分离筛选出一株高温放菌株FBKL4.010,同时针对高温放线菌类群分类界定不明确的问题,采用形态学、生理生化及分子生物学等技术相结合的多相分类学技术来完成菌株的鉴定工作,初步确定其为1 株糖莱斯氏菌(L. sacchari)。通过菌株固态发酵挥发性产物进行GC-MS初步分析,进一步证实了菌株FBKL4.010具有一定的产酱香风味能力,其中尤以吡嗪类物质为主要成分,相对丰度高达80%以上,为今后进一步探究该菌株在酱香风味形成中的作用打下了良好的基础。
参考文献:
[1] 沈怡方. 白酒生产技术全书[M]. 北京: 中国轻工业出版社, 1998:75-111.
[2] 张荣. 产酱香功能细菌的筛选及其特征风味化合物的研究[D]. 无锡:江南大学, 2009: 28-32.
[3] 杨帆, 林琳, 季克良, 等. 茅台大曲中3 株芽孢杆菌代谢产物的比对分析[J]. 酿酒科技, 2011(8): 42-43; 46.
[4] 张小龙, 陆安谋, 王晓丹, 等. 酱香大曲中产酱香细菌的分离与鉴定[J].酿酒科技, 2013(11): 4-8.
[5] 聂慧芳, 蒋英丽, 沈毅, 等. 酱香型大曲中高产蛋白酶细菌的分离鉴定[J]. 酿酒科技, 2015(12): 41-44. DOI:10.13746/j.njkj.2015157.
[6] 王婧, 王晓丹, 罗晓叶, 等. 酱香大曲中高产蛋白酶功能细菌的筛选及鉴定[J]. 中国酿造, 2015, 34(10): 43-46. DOI:10.11882/j.issn.0254-5071.2015.10.010.
[7] MATSUO Y, KATSUTA A, MATSUDA S, et al. Mechercharimyces mesophilus gen. nov., sp. nov. and Mechercharimyces asporophorigenens sp. nov., antitumour substance-producing marine bacteria, anddescription of Thermoactinomyce taceae fam. nov.[J].International Journal of Systematic and Evolutionary Microbiology,2006, 56(12): 2837-2842. DOI:10.1099/ijs.0.64223-0.
[8] YOON J, PARK Y. Phylogenetic analysis of the genus Thermoactinomyces based on 16S rDNA sequences[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(3):1081-1086. DOI:10.1099/00207713-50-3-1081.
[9] YU T, ZHANG B, YAO J, et al. Lihuaxuella thermophila gen. nov.,sp. nov., isolated from a geothermal soil sample in Tengchong,Yunnan, south-west China[J]. Antonie Van Leeuwenhoek, 2012,102(4): 711-718. DOI:10.1007/s10482-012-9771-6.
[10] KOUTA H, HIROFUMI S, YASUIHI U, et al. Planifilum fimeticola gen. nov., sp. nov. and Planifilum fulgidum sp. nov. , novel members of the family ‘Thermoactinomyce taceae’ isolated from compost[J].International Journal of Systematic and Evolutionary Microbiology,2005, 55(5): 2101-2104. DOI:10.1099/ijs.0.63367-0.
[11] 李文均, 徐平, 徐丽华, 等. 极端环境中的放线菌资源[J]. 微生物学通报, 2003, 30(4): 125-127. DOI:10.3969/j.issn.0253-2654.2003.04.032.
[12] 王晓丹, 班世栋, 邱树毅, 等. 贵州省遵义地区3 个酱香型大曲细菌群落的比较分析[J]. 食品科学, 2016, 37(7): 110-116. DOI:10.7506/spkx1002-6630-201607021.
[13] 姜怡, 段淑蓉, 唐蜀昆, 等. 稀有放线菌分离方法[J]. 微生物学通报,2006, 33(1): 181-183. DOI:10.3969/j.issn.0253-2654.2006.01.038.
[14] 刘洋, 赵婷, 姚粟, 等. 一株芝麻香型白酒高温大曲嗜热放线菌的分离与鉴定[J]. 生物技术通报, 2012(10): 210-216. DOI:10.13560/j.cnki.biotech.bull.1985.2012.10.025.
[15] 司美茹, 薛泉宏, 来航线. 放线菌分离培养基筛选及杂菌抑制方法研究[J]. 微生物学通报, 2004, 31(2): 61-65. DOI:10.3969/j.issn.0253-2654.2004.02.014.
[16] 张敬, 何伟宏, 唐蜀昆, 等. 云南干热环境可培养高温放线菌多样性及产纤维素酶活性评价[J]. 微生物学通报, 2013, 40(6): 1109-1120.
[17] 布坎南 R E. 伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984:1183-1207.
[18] 谭力, 袁博, 秦盛, 等. 邳州银杏内生放线菌分离、筛选及活性菌株鉴定[J]. 微生物学通报, 2015, 42(6): 1043-1051. DOI:10.13344/j.microbiol.china.150056.
[19] 吴翔, 陈强. 一株耐高温放线菌的分类研究[J]. 西南农业学报, 2009,22(2): 525-527. DOI:10.3969/j.issn.1001-4829.2009.02.066.
[20] 申孟林, 张超, 王玉霞. 白酒大曲微生物研究进展[J]. 中国酿造,2016, 35(5): 1-5. DOI:10.11882/j.issn.0254-5071.2016.05.001.
[21] 杨国华, 邱树毅, 黄永光. 酱香白酒生产中产香微生物研究[J]. 中国酿造, 2011, 30(4): 24-27. DOI:10.3969/j.issn.0254-5071.2011.04.006.
[22] ZHU B F, XU Y, FAN W L. Study of tetramethylpyrazine formation in fermentation system from glucose by Bacillus subtilis,XZ1124[J]. New Biotechnology, 2009, 25(6): S237. DOI:10.1016/j.nbt.2009.06.224.
[23] ZHU B F, XU Y, FAN W L. High-yield fermentative preparation of tetramethylpyrazine by Bacillus sp. using an endogenous precursor approach[J]. Journal of Industrial Microbiology & Biotechnology,2010, 37(2): 179-186. DOI:10.1007/s10295-009-0661-5.
[24] 张荣, 徐岩, 范文来, 等. 酱香大曲中地衣芽孢杆菌及其特征风味代谢产物的分析研究[J]. 工业微生物, 2010, 40(3): 7-12. DOI:10.3969/j.issn.1001-6678.2010.03.002.
[25] WU J, XU Y. Comparison of pyrazine compounds in seven Chinese liquors using headspace solid-phase micro-extraction and GC-nitrogen phosphourus detection[J]. Food Science and Biotechnology, 2013,22(5): 1-6. DOI:10.1007/s10068-013-0209-3.
[26] JELEŃ H, MAJCHER M, GINJA A, et al. Determination of compounds responsible for tempeh aroma[J]. Food Chemistry, 2013,141(1): 459-465. DOI:10.1016/j.foodchem.2013.03.047.
[27] JELEŃ H H, SZCZUREK A. Solid phase microextraction for profiling volatile compounds in liquered white wines[J]. Acta Scientiarum Polonorum Technologia Alimentaria, 2010, 9(1): 23-32.
[28] KOGEL S, GROSS J, HOFFMANN C, et al. Diversity and frequencies of methoxypyrazines in hemolymph of Harmonia axyridis and Coccinella septempunctata and their influence on the taste of wine[J].European Food Research and Technology, 2012, 234(3): 399-404.DOI:10.1007/s00217-011-1646-y.
[29] DUNLEVY J, SOOLE K, PERKINS M, et al. Two O-methyltransferases involved in the biosynthesis of methoxypyrazines: grape-derived aroma compounds important to wine flavour[J]. Plant Molecular Biology, 2010,74(1): 77-89. DOI:10.1007/s11103 -013-0012-9.
[30] ZHU S, LU X, JI K, et al. Characterization of flavor compounds in Chinese liquor Moutai by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J]. Analytica Chimica Acta, 2007, 597(2): 340-348. DOI:10.1016/j.aca.2007.07.007.
[31] 黄蕴利, 黄永光, 郭旭. 白酒中的主要生物活性功能成分研究进展[J]. 食品工业科技, 2016, 37(15): 375-379. DOI:10.13386/j.issn1002-0306.2016.15.065.
[32] 崔云前, 曹小红, 王春玲, 等. 发酵行业4-乙烯基愈创木酚和4-乙基愈创木酚研究进展[J]. 中国酿造, 2009, 28(4): 14-17. DOI:10.3969/j.issn.0254-5071.2009.04.004.
[33] 陈双, 陈华蓉, 吴群, 等. 应用顶空固相微萃取-气相色谱质谱技术解析酿造用高粱蒸挥发性香气成分[J]. 食品与发酵工业, 2017, 43(4):201-207. DOI:10.13995/j.cnki.11-1802/ts.201704032.