花青素是一类具有多个酚羟基的天然黄酮类化合物,是广泛存在于植物界中的一类水溶性色素,在植物的花、果、叶、块根等部位均有分布[1]。花青苷是与类胡萝卜素结合在一起来影响果实的颜色,水果和蔬菜中花青苷色素的积累是成熟和品质的重要决定因素。在植物中最普遍存的为天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素[2-4]。花青素在植物的花朵和果实中积累,可使它们表现出丰富的色彩,吸引传粉动物和利于果实传播者[5]。花青素在营养器官中积累,可以保护植物抵抗紫外线、病虫害以及食草动物进食等非生物和生物胁迫[6];花青素在种子中积累,可以作为内源抗氧化剂保护种子内部的化学成分,并有助于种子的休眠[7]。对人类而言,现代医学研究表明花青素的抗氧化性使其成为一种天然强效的自由基清除剂,具有抗氧化、抗突变、抗炎、促进视力等多种药理作用[2,8-9],具有降血糖、降血脂、预防心脑血管疾病、保护肝脏和抑制肿瘤细胞发生等多种保健功能[5-7,10],因此也越来越受到人们的关注。
近年来,人们对于花青苷合成机理研究关注度高,这方面研究对于加深人们对花青苷合成机理的认识以及加快培育富含花青苷的优良果树新品种具有重要的意义。在果树方面,花青苷的很多结构基因及各种调节基因已经被克隆并进行了详细的分析验证,其中,对苹果和葡萄的相关研究较为深入。研究表明,在生长和对环境的反应中,花青苷色素的含量和分布差异显著。虽然目前对花青素作用机制、代谢途径及调控机理的研究较为深入[11-12],已分离并分析了大量与花青素途径相关的结构基因和调控基因,花青素合成途径的前期、中期过程已基本清楚,末期过程和进化模式的研究也不断深入。但是对其发挥生理功能活性所涉及的分子结构、信号通道以及酶的认识较少,花青素的修饰、转运及汇集过程,花青素途径在其他水平上的调控机制,植物体内花青素的降解途径和其他途径的联系等还需要进一步的研究。
核桃(Juglans regia L.)是世界分布最广、经济价值最大的干果之一。作为重要经济林树种的核桃坚果由硬壳和种仁组成,种仁营养丰富,具有健脑益智、补气养血、温肺润肠、润燥化痰等功效,被国外誉为“大力士超级食品”深受人们喜爱,国内则是我国重要的木本粮油战略树种[13]。研究表明核桃含有丰富的不饱和脂肪酸、蛋白质、糖类以及纤维素、维生素、钙、磷、铁等矿物元素,以及多种具有抗氧化活性的多酚类物质,其果仁对人体具有降血压、降血脂、抗心血管疾病的作用[14-16]。世界范围内广泛栽培的品种核桃果皮和叶片颜色为绿色,核桃仁为黄白色至黄褐色,而我国丰富的核桃种质资源中蕴藏有其他颜色诸如鲜红、紫红、深褐等不同类型,反映了其树体在色素合成和代谢过程中的差异[14-15]。《中国核桃志》中关于红瓤核桃的记载,其典型的生物学性状是当年新梢的表皮、韧皮部、嫩芽、复叶、果皮和核桃仁种皮均为红褐色,主要分布于河南修武县、卫辉市、北京门头沟区、四川广源县、陕西城固县等地[16]。Mc Granahan等[14]通过杂交方法选育出‘Robert Livermore’核桃新品种,其除核桃仁种皮为红色外,枝条、叶芽的颜色与普通核桃相同均呈现为绿色。研究表明红瓤核桃中呈现红色的物质可能是花青素,但是未对其进行分析。王克建等[17]证实在红瓤核桃中的红色物质是花青苷,但未分析清楚具体是哪种物质。董兆斌等[15]仅对国内引进该品种的表现进行了观察研究。关于花青苷的检测方法,目前常用的有紫外-可见分光光度法[18-19]、高效液相色谱法[19-20]和超高效液相色谱-电喷雾串联质谱法[21-22]。其中超高效液相色谱-电喷雾串联质谱法比其他方法在快速分离、准确定性和灵敏度等方面更具有优势。为了解红瓤核桃色素代谢的基本成分,本实验运用超高效液相色谱-二极管阵列检测器串联质谱(ultra performance liquid chromatography-coupled with photo-diode arraytandem mass spectrometry,UPLC-PDA-MS/MS)法对不同发育时期红瓤核桃叶片和果皮提取物进行定性、定量分析,以期为果树色素代谢研究提供参考。
1 材料与方法
1.1 材料与试剂
供试材料采自河南农业大学园艺学院果树试验站。红瓤核桃叶片为测试样,普通核桃叶片为对照。从发芽初期开始采集红瓤核桃和普通核桃的叶片,之后每隔1个月采集一次,涵盖核桃生长的发芽初期、营养生长期和结果期。于果实膨大期和成熟期采集普通核桃和红瓤核桃的果皮,每次采集样品于50 mL的大离心管中,分别存放。叶片和果皮取回实验室后液氮冷冻,置于-80 ℃超低温冰箱冷冻保存,以备提取花青苷使用。
甲醇、乙腈(均为HPLC级) 美国Fisher公司;甲酸(LC-MS级) 美国Anaqura Chemicals Supply公司;矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside)、矢车菊素-3-O-阿拉伯糖苷(cyanidin-3-O-arabinoside) 美国Sigma公司;矢车菊素-3-O-木糖苷(cyanidin-3-O-xyloside)、飞燕草素-3-O-阿拉伯糖苷(delphinidin-3-O-arabinoside) 美国Chromadex公司;矢车菊素-3-O-半乳糖苷(cyanidin-3-O-galactoside)、飞燕草素-3-O-半乳糖苷(delphinidin-3-O-galactoside)、飞燕草素素-3-O-葡萄糖苷(delphinidin-3-O-glucoside)、飞燕草素-3-O-木糖苷(delphinidin-3-O-xyloside) 德国Phytolab公司。
1.2 仪器与设备
UPLC Xevo/TQ超高效液相色谱串联四极杆、ACQUITY UPLC®HSS T3色谱柱(2.1 mm×150 mm,1.8 μm)、Oasis®HLB固相萃取小柱(200 mg/6 mL)美国Waters公司;6870型冷冻研磨机 美国SPEX公司;DW-HL388 -80 ℃超低温冰箱 中科美菱公司;CF16RXII高速冷冻离心机 日本日立公司;Preplinc platfurm固相萃取仪 美国J2 Scientific公司;R-210旋转蒸发仪 瑞士Büchi公司;0.22 μm有机系针头过滤器天津津腾实验设备有限公司;Milli-Q Direct 8超纯水机美国MilliPore公司。
1.3 方法
1.3.1 标准品的制备
分别称取花色苷标准品矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷、飞燕草素-3-O-阿拉伯糖苷、矢车菊素-3-O-半乳糖苷、飞燕草素-3-O-半乳糖苷、飞燕草素素-3-O-葡萄糖苷、飞燕草素-3-O-木糖苷10.0 mg,用1 mol/L甲醇溶液溶解,定容10 mL的棕色容量瓶中,配制成1 000 mg/L标准品作为储备液,临用前根据需要用1 mol/L盐酸-甲醇溶液稀释成5、10、30、50、70、100、120 μg/mL的标准溶液。
1.3.2 花青苷的提取净化与检测
1.3.2.1 提取
称取0.5 g左右的红、绿核桃叶片,2.5 g红、绿核桃果皮,冷冻研磨机研磨,加入甲醇30mL,摇匀超声20 min后,10 000 r/min离心5 min,上清液倒入50.0 mL棕色容量瓶中,使用相同的提取液10 mL重复提取1 次,合并2 次提取上清液,定容50.0 mL。
1.3.2.2 净化与检测
吸取提取液10 mL在40 ℃旋转蒸发去除有机相,加入10 mL 0.05%盐酸溶液,加入15 mL乙酸乙酯混匀后,放入分液漏斗,乙酸乙酯相去除,反复3 次,去除乙酸乙酯相,水相旋蒸,剩余水相少于5 mL,水相倒入活化好的固相萃取小柱,用5 mL水分2 次淋洗固相萃取小柱,去除,再用5 mL甲醇分2 次淋洗固相萃取小柱,定溶5 mL,过0.22 μm有机相滤膜,UPLC-PDA-MS/MS上样进行仪器分析。该分析方法利用MS/MS进行定性分析,用UPLC-PDA进行定量分析[23-24]。普通绿皮核桃叶片、果皮提取的花青苷为对照(空白基质)。
1.3.3 UPLC-PDA-MS/MS条件
1.3.3.1 UPLC-PDA条件
Waters Acquity UPLC®HSS T3色谱柱(2.1 mm×150 mm,1.8 μm),配有10AVp PDA,联有Waters Acquity UPLC®HSS T3保护柱;柱温40 ℃,流速0.3 mL/min,进样量2.0 μL,PDA波长扫描范围200~650 nm;定量检测波长520 nm;流动相:A为5%甲酸,B为甲醇-乙腈溶液(7∶3,V/V);梯度洗脱:0~30 min,10%~15% B;30~60 min,15%~23% B;60~62 min,23%~75% B;63 min回到初始状态,平衡20 min。
1.3.3.2 MS/MS条件
电喷雾离子源;正离子检测模式;多反应监测(multiple reaction monitoring,MRM)模式;分段采集;离子源温度150 ℃;脱溶剂气温度500 ℃;脱溶剂气流量800 L/h;锥孔气流速50 L/h;碰撞气(高纯氩气)流速0.13 mL/min。
1.3.4 加标回收率测定
采用核桃叶片、果皮的提取液为检测试样,分别向其中加入高、中、低3 种不同质量浓度的8 种花青苷标准溶液进行加标回收,每种质量浓度平行测定3 次,并将测得值与标样值进行比较求回收率。
2 结果与分析
2.1 UPLC-PDA条件的优化
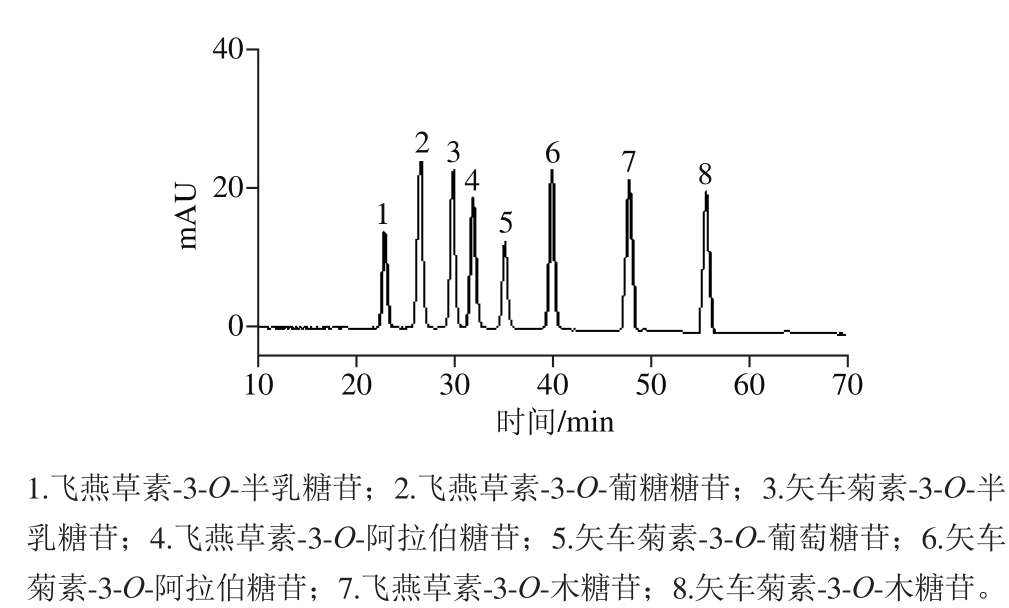
图1 花青苷标准品UPLC图
Fig. 1 UPLC chromatogram of standard anthocyanins
花青素是一类广泛存在于植物中的水溶性色素,属于黄酮类化合物,水果、蔬菜、花卉的颜色大都与之有关,在自然状态下花青素与各种单糖形成糖苷,称为花青苷[25]。花青苷极性较强,因其具有较强的抗氧化活性,已越来越受到人们的重视,当提取溶剂的极性和花青苷极性相近时,花青苷在提取溶剂中的溶解性最好,溶出率最大[26]。由于花青苷类物质的极性较大,在文献[27-28]中目标化合物在C18柱上能够很好地分离。本实验色谱柱为Waters Acquity UPLC®HSS T3色谱柱(2.1 mm×150 mm,1.8 μm),配有10AVpPDA,联有Waters Acquity UPLC®HSS T3保护柱,选择甲醇、乙腈和2.5%甲酸溶液作为流动相。结果表明,甲醇和乙腈溶液的体积比为7∶3,峰形得到明显的改善,灵敏度提高。因此,流动相A为5%甲酸溶液,流动相B为甲醇-乙腈(7∶3,V/V)溶液,梯度洗脱。在此条件下,8 种有机化合物可实现较好的分离,花青苷标准品色谱图见图1。
2.2 MS/MS条件的优化
花青苷类物质是由花青苷苷元与一个或多个糖分子通过糖苷键结合的化合物,种类繁多且存在多个同分异构体,极性相近,因此纯化和检测难度较大[1]。国内外采用液相色谱-质谱联用法对花青苷进行定性分析时,多采用在电喷雾正离子模式下检测化合物的特征离子对[29-30]。本实验根据花青苷类物质的分子结构特征,在电喷雾正离子模式下,对毛细管电压、锥孔电压、脱溶剂温度、脱溶剂气压力和锥孔气压力等质谱参数进行了优化。8 种化合物的母离子均以[M+H]+形式存在,其m/z分别为465.2、465.2、449.2、435.2、449.2、419.2、435.2和419.2,如表1所示。在确定母离子后,再对母离子进行二级质谱扫描,从而得到子离子信息。由表1可知,飞燕草素-3-O-半乳糖苷与飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-半乳糖苷与矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷与矢车菊素-3-O-木糖苷母离子与子离子的核质比相同,则可以根据化合物的保留时间将不同的花青苷分开。采用MRM检测模式对待测物进行定性检测,8 种花青苷的质谱图见图2。
表1 MRM检测模式下8 种花青苷类物质的UPLC-MS/MS优化条件
Table 1 Optimized UPLC-MS/MS parameters for analysis of eight anthocyanins in MRM mode

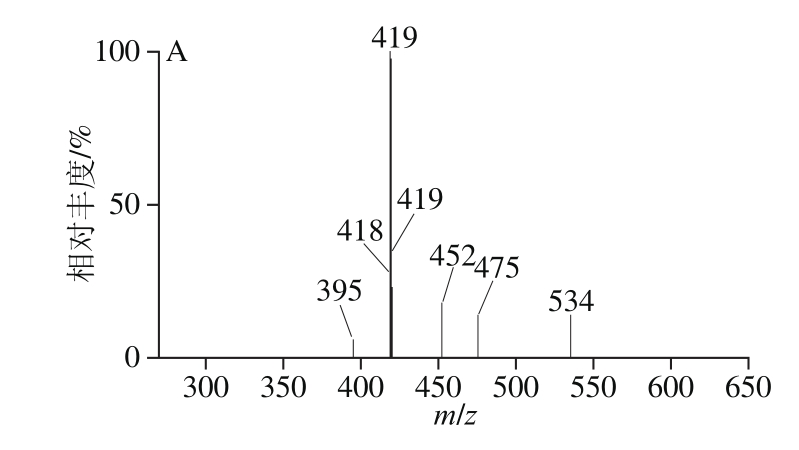
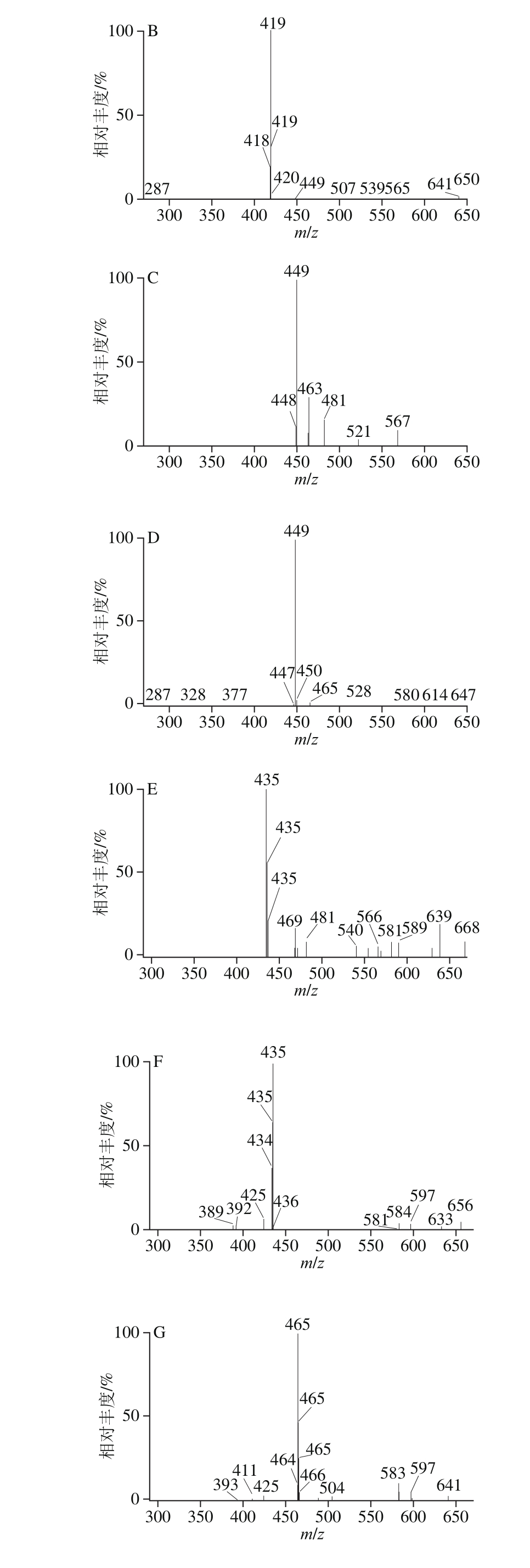

图2 8 种花青苷类物质质谱图
Fig. 2 Mass spectra of eight anthocyanins
2.3 标准曲线的建立
根据在优化的UPLC-PDA条件下进行测定。以定量离子峰面积(y)对质量浓度(x,μg/L)做标准曲线,如表2所示,8 种化合物的线性相关系数(R2)为0.999 0~0.999 6,表明各化合物在0~300 μg/L范围内线性关系良好,能满足检测需求。采用在空白基质中添加目标化合物的方法,依据色谱峰3 倍信噪比确定检出限,8 种花青苷检出限范围为0.20~0.30 μg/mL,以10 倍信噪比确定本方法的定量限,8种花青苷定量限范围为0.60~0.90 μg/mL。
表2 2 种核桃叶片和果皮内8 种化合物的线性方程、相关系数、检出限和定量限
Table 2 Linear equations, correlation coefficients (R2), limits of
detection (LOD) and limits of quantification (LOQ) of eight anthocyanins

2.4 加标回收率测定结果
采用核桃叶片、果皮的提取液为检测试样,分别向其中加入3 种不同质量浓度的矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷和飞燕草素-3-O-阿拉伯糖苷、矢车菊素-3-O-半乳糖苷、飞燕草素-3-O-半乳糖苷和飞燕草素素-3-O-葡萄糖苷和飞燕草素-3-O-木糖苷进行加标回收。每种加标质量浓度平行3 份,如表3所示。8 种花青苷类物质的加标回收率为93.63%~106.67%,相对标准偏差为0.92%~5.67%,说明该方法准确率较高,重复性较好,满足实验要求。
表3 红瓤核桃叶片和果皮8 种花青苷类物质的回收率和相对标准偏差
Table 3 Recoveries and relative standard deviations (RSDs) for eight anthocyanins in spiked walnut leaves and peels

2.5 实际样品的测定结果
2.5.1 不同时期核桃样品的花青苷类种类

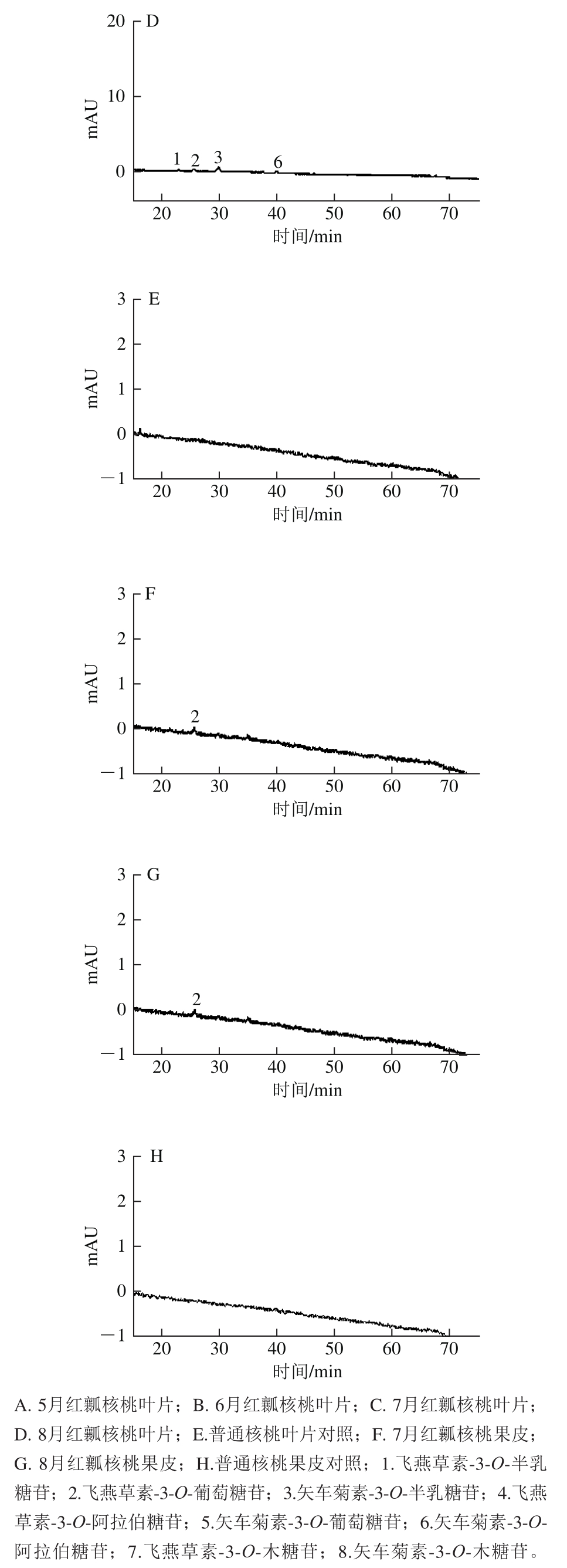
图3 不同时期核桃叶片和果皮在波长520 nm处色谱图
Fig. 3 Chromatograms at 520 nm for walnut leaves and peels at different growing stages
采用本实验建立的方法对不同核桃中花青苷成分进行了定性和定量检测,通过MS/MS定性UPLC-PDA定量检测红瓤核桃和绿核桃中各个时期、部位花青苷含量,可以从红瓤核桃叶片实验组5、6、7、8月叶片和红瓤核桃果皮实验组7、8月中均检测到与花青苷合成的不同物质,而在绿核桃叶片对照组和核桃果皮对照组中均未检测到与花青苷合成的相关物质。各个部位与不同时期花色苷成分见色谱图3所示。
表4 不同时期核桃叶片和果皮花青苷类物质的含量
Table 4 Contents of individual anthocyanins at different growing periods of walnut leaves and fruit peels

注:ND.未检出。
在对不同核桃材料的各个时期的叶片和果皮进行测定后,其中的花青苷成分和含量结果表现不一。由表4可知,在红瓤核桃叶片中检测到飞燕草素-3-O-半乳糖苷、飞燕草素素-3-O-葡萄糖苷、矢车菊素-3-O-半乳糖苷、飞燕草素-3-O-阿拉伯糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、飞燕草素-3-O-木糖苷和矢车菊素-3-O-木糖苷共8 种花青苷类物质。果皮中只检测到飞燕草素-3-O-葡萄糖苷。飞燕草素-3-O-半乳糖苷和矢车菊素-3-O-半乳糖苷是红瓤核桃叶片中的2 种主要花青苷。在叶片的生长初期其含量最高,飞燕草素-3-O-半乳糖苷含量达到148.730 mg/kg,为红瓤核桃叶片含量最高的一种花青苷,矢车菊素-3-O-半乳糖苷含量达到142.588 mg/kg。飞燕草素-3-O-阿拉伯糖苷、飞燕草素-3-O-木糖苷和矢车菊素-3-O-木糖苷花青苷在生长发育后期,可能由于含量太低,均未检测到。在7、8月红瓤核桃果皮的提取物中均只能检测到飞燕草素-3-O-葡萄糖苷。
2.5.2 核桃样品中花青苷含量变化


图4 红瓤核桃叶片、果皮不同时期花青苷总量
Fig. 4 Total anthocyanins contents at different growing periods of walnut leaves and fruit peels
由图4可知,在叶片的生长发育时期,红瓤核桃叶片花青苷类物质的含量随着核桃树的生长进程呈逐渐降低的趋势,但在果皮中则呈上升的趋势。推测可能在红瓤核桃的叶片和果皮中分别由某个基因来调控花青苷的合成与分解,这方面的代谢机理尚不得而知。不同生长阶段叶片花青苷总含量间的差异与果皮中花青苷间总含量差异分别达显著性水平,7、8月红瓤核桃叶片花青苷总含量差异不显著。这就是说,不同生长阶段叶片花青苷总含量的差异具有生物统计学的意义,不同生长阶段果皮花青苷总含量的差异也具有生物统计学的意义。
3 讨论与结论
本研究建立MS/MS定性,UPLC-PDA定量对红瓤核桃不同发育时期的叶片和果皮的花青苷类物质进行定性和定量分析的方法,该方法具有易操作、灵敏度高、重复性好,花青苷类物质的分析覆盖面广的特点,可准确测出红瓤核桃不同时期的叶片和果皮内花青苷的成分与含量。根据前人研究,植物中的花青苷类色素主要包含6 种[3-4]。李玲[31]研究发现,矢车菊素及其衍生物是5 种红色叶植物叶片呈色的共同决定色素,叶绿素、类胡萝卜素及其他类黄酮作为辅色素对红色叶片的形成起着辅助的作用。黑萝卜、花楸及桃果实中的花青苷类主要以矢车菊素的葡萄糖苷形式存在[32-34]。一般而言,不同植物色素的构成有差别。本实验中红瓤核桃叶片中含有的花青苷主要是飞燕草和矢车菊素两类,即飞燕草-3-O-半乳糖苷、飞燕草-3-O-葡萄糖苷、飞燕草-3-O-阿拉伯糖苷、飞燕草-3-O-木糖苷、矢车菊素-3-O-半乳糖苷、飞燕草-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷,且不同时期的叶片中花青苷类物质组分和含量差异很大。
实验检测结果可以看出,飞燕草-3-O-半乳糖苷和矢车菊素-3-O-半乳糖苷是核桃叶片生长初期最重要的2 种花青苷,在生长过程中被检测到的8 种花青苷的含量一直处于下降的趋势,这与实际的生长过程中红瓤核桃叶片由最初的浓红褐色到浅红褐色的变化现象相吻合,故推测其可能的原因有二:一是基因作用的方式发生了改变。据本研究结果可推测红瓤核桃的叶片和果皮的色素代谢是由某个基因来调控花青苷的合成与分解的,这个判断与‘Rober Livemore’品种中的观察结果一致,即该品种中存在控制色素代谢的主效基因R,但其作用方式等鲜见详细报道[13]。二是基因作用的方式未变,花青苷在生长过程中逐渐降解或随着新梢旺长、被大量形成的叶绿素等稀释,但具体的原因仍然有待于后期的进一步研究。在7、8月红瓤核桃果皮中仅发现了飞燕草素-3-O-葡萄糖苷,在果皮的生长阶段,可发现该物质的含量处于上升的趋势,这与红瓤核桃的果皮一直是红褐色的状态相一致。检测结果表明虽然飞燕草素-3-O-葡萄糖苷的含量在检测中的含量比较低,但可能正因为有该物质的存在,才能一直调控红瓤核桃果皮的颜色,这也是红瓤核桃的果皮中花青苷物质的含量与普通核桃果皮一个明显的差异。
本实验结果表明红瓤核桃不同发育时期的叶片和果皮的花青苷类物质含量有生物统计学上的意义。通过空白基质的对比,发现红瓤核桃和普通核桃2 个类型间的花青苷类物质的含量存在差,即该类物质的代谢过程存在差别,也可能是在基因水平上有差别,也可能是代谢调控方面有差别,这将是下一步需研究的重点。随着分子生物学技术在果树育种领域中的成熟应用,本研究也为从分子生物学角度探索红瓤核桃花青苷合成的机理提供了初步的资料,使人们能够更充分的挖掘红瓤核桃中的其他相关成分,也可为红瓤核桃花色苷结构基因、调控基因等的深入研究提供生理学方面的基础。
通过本研究方法对红瓤核桃不同发育期的叶片和果皮的花青苷类物质进行定性和定量分析,结果发现在这2 类材料中存在8 种花青苷,分别是飞燕草素-3-O-半乳糖苷、飞燕草素-3-O-葡萄糖苷、飞燕草素-3-O-阿拉伯糖苷、飞燕草素-3-O-木糖苷、矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-阿拉伯糖苷、矢车菊素-3-O-木糖苷;在不同时期、不同组织上的花青苷的成分与含量不同且具有生物统计学上意义,其中在叶片的生长阶段存在8 种花青苷,而果皮的生长阶段中仅发现有飞燕草素-3-O-葡萄糖苷。此外叶片中花青苷含量呈下降趋势,果皮组织中花青苷含量呈上升趋势。
参考文献:
[1] CASTANEDA-OVANDO A, PACHECO-HERNÁNDEZ M L,PÁEZ-HERNÁNDEZ M E. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4): 859-871. DOI:10.1016/j.foodchem.2008.09.001.
[2] KONG J M, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003, 64(5): 923-933.DOI:10.1016/S0031-9422(03)00438-2.
[3] 王华, 李茂福, 杨媛, 等. 果实花青素生物合成分子机制研究进展[J]. 植物生理学报, 2015, 51(1): 29-43. DOI:10.13592/j.cnki.ppj.2014.0321.
[4] 葛翠莲, 黄春辉, 徐小彪. 果实花青素生物合成研究进展[J]. 园艺学报, 2012, 39(9): 1655-1664.
[5] MILLER R, OWENS S J, RORSLETT B. Plants and colour-flowers and pollination[J]. Optics and Laser Technology, 2011, 43(2): 282-294. DOI:10.1016/j.optlastec.2008.12.018.
[6] DIXON R A, ACHNINE L, KOTA P, et al. The phenylpropanoid pathway and plant defence: a genomics perspective[J]. Molecular Plant Pathology, 2002, 3(5): 371-390. DOI:10.1046/j.1364-3703.2002.00131.x.
[7] LEPINIEC L, DEBEAUJON I, ROUTABOUL J M, et al. Genetics and biochemistry of seed flavonoids[J]. Annual Review of Plant Biology,2006, 57: 405-430. DOI:10.1146/annurev.arplant.57.032905.105252.
[8] 胡雅馨, 李京, 惠伯棣. 蓝莓果实中主要营养及花青素成分的研究[J]. 食品科学, 2006, 27(10): 600-605. DOI:10.3321/j.issn:1002-6630.2006.10.154.
[9] COULTRAP S J, BICKFORD P C, BROWNING M D. Blueberry-enriched diet ameliorates age-related declines in NMDA receptor-dependent LTP[J].AGE, 2008, 30(4): 263-272. DOI:10.1007/s11357-008-9067-y.
[10] TAPAS A R, SAKARKAR D M, KAKDE R B. Flavonoids as nutraceuticals: a review[J]. Tropical Journal of Pharmaceutical Research, 2008, 7(3): 1089-1099. DOI:10.4314/tjpr.v7i3.14693.
[11] 庞红霞, 祝长青, 覃建兵. 植物花青素生物合成相关基因研究进展[J].种子, 2010, 29(3): 60-64.
[12] LENG P, QI J X. Effect of anthocyanin on David peach(Prunus davidiana Franch) under low temperature stress[J].Scientia Corticulturae, 2003, 97(1): 27-39. DOI:10.1016/S0304-4238(01)00374-0.
[13] 童安毕, 严绪成, 班小重. 乌仁核桃种质资源考察及选种初报[J]. 种子, 2002, 21(3): 67-68. DOI:10.3969/j.issn.1001-4705.2002.03.031.
[14] Mc GRANAHAN G, LESLIE C. ‘Robert Livermore’, a persian walnut cultivar with a red seedcoat[J]. Hortscience, 2004, 39(7): 1772.
[15] 董兆斌, 王根宪, 王英宏. 洛南县美国红仁核桃引种初报[J]. 陕西林业科技, 2017(1): 25-28. DOI:10.3969/j.issn.1001-2117.2017.01.005.
[16] 郗荣庭, 张毅萍. 中国果树志: 核桃卷[M]. 北京: 中国林业出版社,1996: 1-19.
[17] 王克建, 郝艳宾, 齐建勋, 等. 红色核桃仁种皮提取物紫外-可见光谱和质谱分析[J]. 光谱学与光谱分析, 2009, 29(6): 1668-1671.DOI:10.3964/j.issn.1000-0593(2009)06-1668-04.
[18] OHMIYA A. Effects of auxin on growth and ripening of mesocarp discs of peach fruit[J]. Scientia Corticulturae, 2000, 84(3): 309-319.DOI:10.1016/S0304-4238(99)00137-5.
[19] 刘仁道, 张猛, 李新贤. 草莓和蓝莓果实花青素提取及定量方法的比较[J]. 园艺学报, 2008, 35(5): 655-660. DOI:10.3321/j.issn:0513-353X.2008.05.006.
[20] 郑杰, 丁晨旭, 赵先恩, 等. 花色苷化学研究进展[J]. 天然产物研究与开发, 2011, 23(5): 970-978. DOI:10.3969/j.issn.1001-6880.2011.05.040.
[21] 杨智勇, 李新生, 马娇燕, 等. 紫色马铃薯“黑金刚”中花青苷组分和含量分析[J]. 食品科学, 2013, 34(14): 271-275. DOI:10.7506/spkx1002-6630-201314056.
[22] 沈丹红, 路鑫, 常玉玮, 等. 高效液相色谱-紫外/质谱检测法联合测定新鲜烟叶中的25 种酚类物质[J]. 色谱, 2014, 32(1): 40-47.
[23] KAISU R, MAA T, AFAF KAMAL-ELDIN, et al. High-performance liquid chromatography (HPLC) analysis of phenolic compounds in berries with diode array and electrospray ionization mass spectrometric(MS) detection: ribes species[J]. Journal of Agricultural and Food Chemistry, 2003, 51(23): 6736-6744. DOI:10.1021/jf0347517.
[24] LIN L Z, JAMES H, ZHANG R W, et al. Quantitation of the hydroxycinnamic acid derivatives and the glycosides of flavonols and flavones by UV absorbance after identification by LC-MS[J].Agricultural and Food Chemistry, 2012, 60(2): 544-553. DOI:10.1021/jf204612t.
[25] 魏蕾, 吕佳飞, 李志洲. 花青素的提取纯化、抗氧化能力及功用方面的研究进展[J]. 氨基酸和生物资源, 2009, 31(4): 83-86.DOI:10.3969/j.issn.1006-8376.2009.04.020.
[26] 潘利华, 王建飞, 叶兴乾, 等. 蓝莓花青素的提取工艺及其免疫调节活性[J]. 食品科学, 2014, 35(2): 81-86. DOI:10.7506/spkx1002-6630-201402015.
[27] SERRADILLA M J, LOZANO M, BERNALTE M J, et al.Physicochemical and bioactive properties evolution during ripening of ‘Ambrunés’ sweet cherry cultivar[J]. LWT-Food Science and Technology, 2011, 44(1): 199-205. DOI:10.1016/j.lwt.2010.05.036.
[28] 褚云霞, 饶钦雄, 陈海荣, 等. 超高效液相色谱法测定矮牵牛中花青苷含量[J]. 上海交通大学学报(农业科学版), 2014, 32(2): 55-61.DOI:10.3969/J.ISSN.1671-9964.2014.02.011.
[29] ABDEL A E S M, YOUNG J C, RABALSKI I. Anthocyanins composition in black, blue, pink, purple, and red cereal grains[J].Journal of Agricultural and Food Chemistry, 2006, 54(13): 4696-4704.DOI:10.1021/jf0606609.
[30] 敬璞, 张晓光, 董英. 紫玉米花青苷的研究进展[J]. 林产与化学工业,2010, 30(1): 103-110.
[31] 李玲. 五种红色叶植物叶片色素分析[D]. 杨凌: 西北农林科技大学,2013.
[32] BLARICOM L, SENN T L. A anthocyanin pigment in free stone peaches grown in the Southeast[J]. Journal of the American Society for Horticultural Science, 1967, 90(8): 541-545.
[33] JAN O, JEAN C S. A research note: anthoeyanins in fruits of Aronia melanocarpa (Chokberry)[J]. Journal of Food Science, 1990, 53(4):1241-1242.
[34] 杨艳. 黑萝卜花青素的提取纯化及特性研究[D]. 太原: 中北大学,2015.