功能性油脂是一类具有降血脂、降血压、抗血栓、提高认知能力等特殊生理功能的油脂[1-2],主要以富含ω-3和ω-6系列脂肪酸的油脂为主。目前人类日常饮食中ω-3和ω-6系列脂肪酸的比例摄入过高,导致了冠心病、糖尿病等疾病的高发,当油脂中ω-3和ω-6的相对含量比为1∶4~1∶6时,该油脂可对高血脂及其并发症具有显著的预防及治疗效果,同时可以起到促进细胞生长、增强免疫力的效果[3-4]。功能性油脂不溶于水,不易均匀一致地添加到各类食品中,使其应用范围受到了限制[5]。此外,功能性油脂中的多不饱和脂肪酸含量较高,氧化稳定性差,易形成过氧化物,产生对人体健康有害的醛类、酮类及有机酸等小分子化合物[6]。
微胶囊化技术是指将固体、液体或气体包埋、封存在一种微型胶囊内成为一种固体微粒产品的技术[7]。利用微胶囊化技术对功能性油脂进行包埋,可保护芯材活性物质免受环境影响,提高氧化稳定性,拓宽其应用范围[8-9]。目前市场上的微胶囊产品主要是通过喷雾干燥法制得,而利用造粒仪进行微胶囊化的应用鲜有报道。相比喷雾干燥法的高温条件,微胶囊造粒仪可在室温条件下通过高频振动的方式,使振动喷嘴通过叠加振动将层流型流体喷射流分成尺寸相等的液滴,制备出0.15~2 mm的圆形微胶囊[10],避免了微胶囊表面脂质氧化的问题,保留了芯材的活性成分[11-12],其高效稳定的包埋效果得到了食品工业的广泛认可[13]。本实验以海藻酸钠(sodium alginate,SA)溶液为壁材,CaCl2溶液为固化剂,采用微胶囊造粒仪对功能性油脂进行微胶囊化处理,通过正交试验优化筛选出油脂微胶囊化的最佳工艺参数,并对功能性油脂微胶囊的表征、化学结构、热稳定性和抗氧化性进行分析研究,为功能性油脂微胶囊的研究和开发提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
玉米油、紫苏油、菜籽油、大豆油均购于长春沃尔玛超市;低黏度SA(食品级) 瑞士Büchi有限公司;无水CaCl2(食品级) 浙江大成钙业有限公司;石油醚、溴化钾、磷酸氢二钠、磷酸二氢钠、碘化钾、硫代硫酸钠均为国产分析纯。
1.2 仪器与设备
395pro微胶囊造粒仪 瑞士Büchi有限公司;IR Prestige傅里叶变换红外光谱仪 日本岛津公司;DS-8510超声波清洗仪 上海生析超声仪器有限公司;Alpha1-4LDplus真空冷冻干燥机 德国Marin Christ公司;SU8010扫描电子显微镜 日立高新技术公司;GBB02电子精密天平 梅特勒-托利多仪器(上海)有限公司;HCT-2热重分析仪 北京恒久科学仪器厂;MOYIC SMZ-168体式显微镜 武汉科赛思机电有限公司;PH-240A干燥培养两用箱 上海仪分科学仪器有限公司。
1.3 方法
1.3.1 功能性油脂的制备
采用玉米油、紫苏油、菜籽油及大豆油为原料,通过MATLAB数学软件计算,调配出ω-6和ω-3相对含量比为4∶1~6∶1的油脂[14-15]。
1.3.2 油脂微胶囊的制备
溶液的配制:称取一定量SA,少量多次逐渐溶解于去离子水中。排气:将溶液转移到耐压玻璃瓶中,采用超声波将溶液中的空气排除,连接到仪器。取样:用螺纹注射器吸取60 mL油脂,连接到仪器。调节压力:打开空气泵,调节进口压力直至SA溶液能连续流出,同时进样。造粒:加载电压2 000 V,调节频率,使壁材及芯材通过高频振荡的同心喷嘴(300 μm)形成微胶囊,微胶囊散射于一定浓度的CaCl2溶液中进行固化,固化的搅拌速率为50%,固化时间30 min。成品:过滤得到样品,用去离子水多次漂洗样品表面的残液。经真空冷冻干燥8 h后制得油脂微胶囊冻干品。
1.3.3 微胶囊包埋率的测定
参照邹强[16]方法略有改动。准确称取微胶囊样品10 g(精确至0.001 g)于锥形瓶中,加入40 mL(0.025 mol/L pH 7.4)预热的磷酸缓冲溶液,使微胶囊溶胀,采用超声波进一步破碎[17]。悬浮液用滤纸过滤。将过滤后得到的样品于55 ℃烘干至恒质量后,采用索氏提取法脱油8 h,溶剂为石油醚。脱油后用氮气将溶剂吹干,测定壁材质量。包埋率按下式计算:
式中:m1为样品的总质量/g;m2为壁材的总质量/g;m为理论芯材质量/g。
1.3.4 微胶囊工艺的单因素试验设计
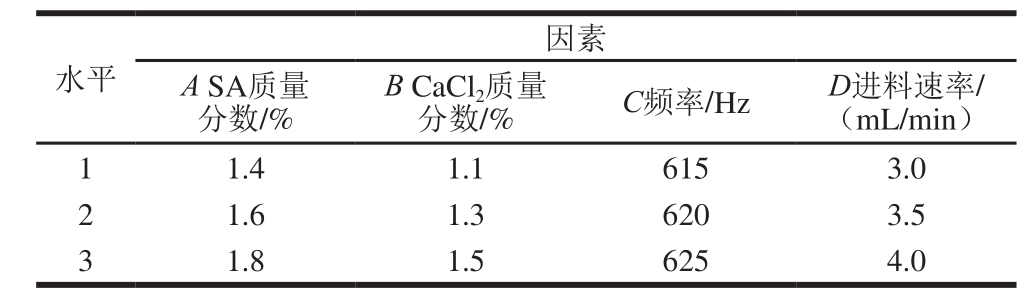
当电压为2 000 V,固化时间为30 min,搅拌速率为50%时,考察SA质量分数、CaCl2质量分数、频率、进料速率对微胶囊包埋率的影响。SA质量分数设定为1.2%、1.4%、1.6%、1.8%、2.0%;CaCl2质量分数设定为0.9%、1.1%、1.3%、1.5%、1.7%;频率设定为610、615、620、625、630 Hz;进料速率设定为3.0、3.5、4.0、4.5、5.0 mL/min,以微胶囊包埋率为考察指标进行试验。
每组单因素试验做3 组平行。单因素试验中固定因素分别设定为SA质量分数1.6%、CaCl2质量分数1.1%,频率620 Hz、进料速率3.5 mL/min。
1.3.5 微胶囊工艺的正交试验设计
根据单因素试验结果,以微胶囊包埋率为考察指标,对SA质量分数、CaCl2质量分数、频率、进料速率进行L9(34)正交试验设计,确定功能性油脂微胶囊化的最佳工艺参数。试验设计因素与水平见表1。
表1 正交试验因素与水平
Table 1 Coded levels of independent variables used for orthogonal array design
1.3.6 微胶囊表征的观察
1.3.6.1 扫描电子显微镜观察
参照Maresca等[18]方法略作改动。将常温干燥24 h后的微胶囊均匀平铺在黏有导电胶的样品台上,在样品表面镀金后,将样品台放入扫描电子显微镜中,于加速电压10 kV条件下进行扫描观察。
1.3.6.2 体式显微镜观察
参照陆雪雷[19]方法。将湿胶囊均匀平铺在载玻片上,放入体式显微镜中,调节物镜,对样品进行观察。
1.3.7 傅里叶变换红外光谱分析
参照郭夏丽等[20]方法。利用傅里叶变换红外光谱仪对壁材、芯材及微胶囊的分子结构进行对比分析。称取样品2 mg左右,加入200 mg烘干的溴化钾于研钵中研磨均匀,压片,于2 cm-1分辨率,4 000~400 cm-1范围进行红外扫描。
1.3.8 热稳定性分析
参照白春清[21]方法略作改动。称取一定量的微胶囊样品放入干锅中,压片封口,放入热重分析仪中分析,升温速率为10 ℃/min,氮气流速为20 mL/min,升温范围为25~500 ℃。
1.3.9 氧化稳定性的测定
参照魏东[22]方法略有改动。将功能性油脂和微胶囊产品分别加入螺口试瓶中(1/2瓶容量),并置于(63±1)℃的烘箱中存放7 d,每隔24 h搅拌一次,兑换位置,取样,并按照GB/T 5538—2005《动植物油脂过氧化值测定》的方法测定样品的过氧化值(peroxide value,POV)。
1.4 数据统计分析
所有实验重复3 次,测定结果以 ±s表示,使用SPSS 17.0软件对实验数据进行差异显著性分析和方差分析。
2 结果与分析
2.1 SA质量分数对功能性油脂微胶囊包埋率的影响

图1 SA质量分数对功能性油脂微胶囊包埋率的影响
Fig. 1 Effect of sodium alginate concentration on microencapsulation efficiency
由图1可知,SA质量分数对微胶囊包埋率的影响较大,当SA质量分数较低时,形成的电解质膜过薄,不能有效形成微胶囊,而SA质量分数过高时,会出现体系黏度大,SA溶液流出困难的现象,导致微胶囊的包埋效果差。另外,不同质量分数的SA溶液与Ca2+络合程度不一样[23],形成微胶囊的囊壁紧密程度和透氧程度也不同[24-25],从而使油脂微胶囊的包埋率有较大差别,当SA质量分数为1.6%时,微胶囊的包埋率可达到89.34%。
2.2 CaCl2质量分数对功能性油脂微胶囊包埋率的影响

图2 CaCl2质量分数对功能性油脂微胶囊包埋率的影响
Fig. 2 Effect of calcium chloride concentration on microencapsulation efficiency
由图2可知,CaCl2质量分数对油脂微胶囊的包埋率也有一定影响。由于SA结构中G段上的Na+和Ca2+发生了离子交换,Ca2+位于带负电荷的腔内,在G段外面形成了一层类似于膜的“egg-box”三维网状结构[26],因此当CaCl2质量分数较低时,膜的形成速率较低,微胶囊的包埋率也随之降低,而CaCl2质量分数过高时又会导致微胶囊内部的网状结构分布不均,包埋效果不好。当CaCl2质量分数为1.3%时,微胶囊的包埋效果最好,为87.32%。
2.3 频率对功能性油脂微胶囊包埋率的影响

图3 频率对功能性油脂微胶囊包埋率的影响
Fig. 3 Effect of frequency on microencapsulation efficiency
由图3可知,微胶囊包埋率随着频率的不断增大而提高,当频率为620 Hz时,微胶囊的包埋率较高,粒径也较为均一,之后随着频率的继续增加,微胶囊包埋率呈降低趋势,这是因为当喷嘴振动频率较低时,会出现部分芯材经过振动喷嘴后无法被壁材充分包埋的情况,降低了微胶囊的包埋率,而当频率高于620 Hz时,微胶囊造粒仪喷嘴的振动速度较快,形成的微胶囊粒径较小,会增加液滴聚结的发生,造成壁材无法将芯材完整包埋,进而使包埋率降低。
2.4 进料速率对功能性油脂微胶囊包埋率的影响
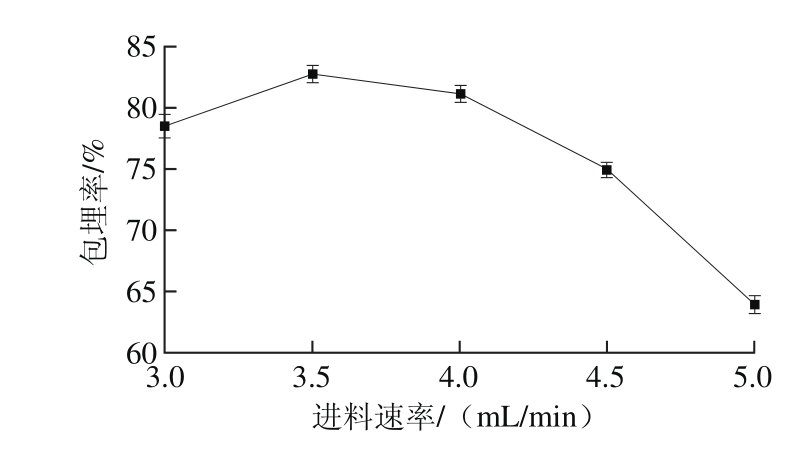
图4 进料速率对功能性油脂微胶囊包埋率的影响
Fig. 4 Effect of feeding rate on microencapsulation efficiency
由图4可知,当进料速率为3.5 mL/min时微胶囊包埋效果最佳,为82.7%,当进料速率小于3.5 mL/min时微胶囊所含芯材的量较少,当进料速率大于3.5 mL/min时,微胶囊的包埋率是逐渐降低的,导致这种现象的原因是当进料速率较快时,芯材经同心喷嘴振动形成的粒径较大,壁材无法将芯材彻底包埋,芯材会有所流失,从而使包埋率有所降低。此外,当频率一定而进料速率过快或过慢时,会出现包埋效果不稳定的现象,甚至可能导致芯材和壁材经喷嘴后无法形成微胶囊。
2.5 油脂微胶囊工艺的正交试验优化
以微胶囊包埋率为考察指标,选取SA质量分数、CaCl2质量分数、频率、进料速率为考察因素,试验结果见表2。
表2 正交试验设计及结果
Table 2 Orthogonal array design with response variable
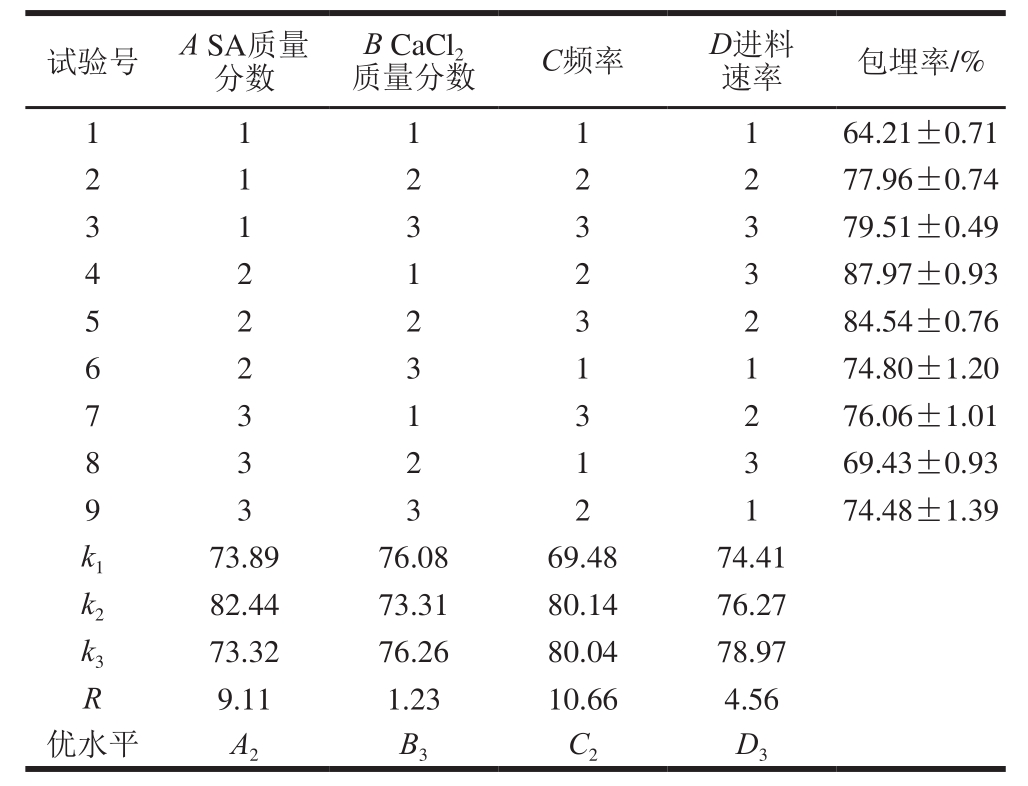
从表2极差分析可知,各因素对微胶囊包埋率影响的主次顺序是频率(C)>SA质量分数(A)>进料速率(D)>CaCl2质量分数(B),油脂微胶囊制备的最优组为A2B3C2D3,该结果不在正交表中,故对其进行验证,即在SA质量分数1.6%、CaCl2质量分数1.5%、频率620 Hz、进料速率4.0 mL/min条件下得到的微胶囊包埋率为(88.32±0.28)%。
表3 方差分析与显著性分析结果
Table 3 Analysis of variance of regression equation and significance test
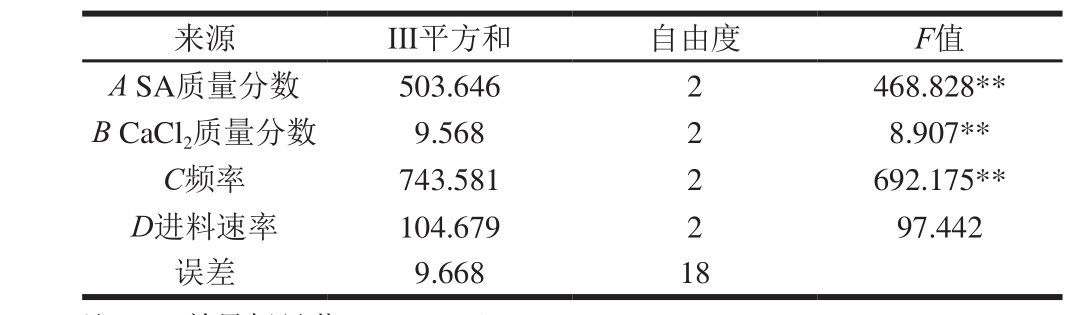
注:**.差异极显著(P<0.01)。
由表3可知,P值小于0.01,说明SA质量分数、CaCl2质量分数、频率、进料速率对油脂微胶囊包埋率的影响极显著。
2.6 微胶囊表征的观察结果
2.6.1 扫描电子显微镜的观察结果
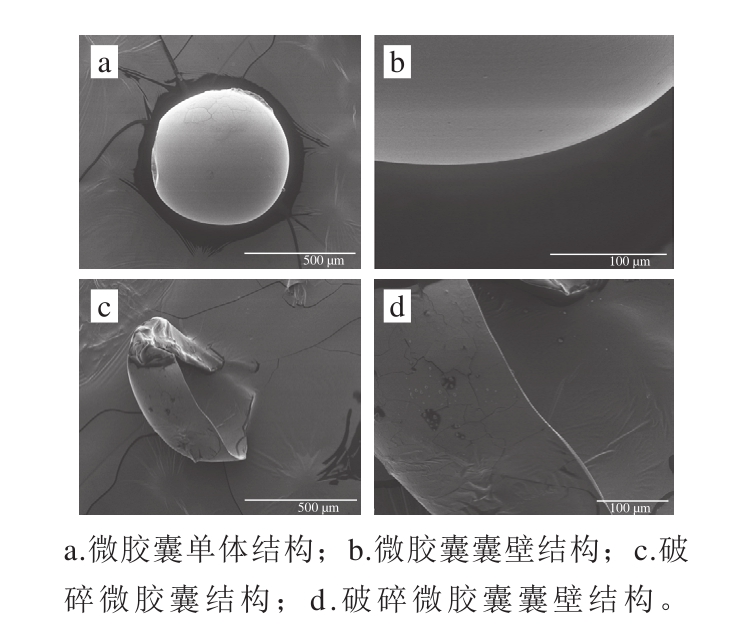
图5 功能性油脂微胶囊结构扫描电子显微镜图
Fig. 5 Structure of microcapsules under SEM
如图5a所示,微胶囊结构基本呈完整的球型。图5b为1 000倍数条件下油脂微胶囊的囊壁结构,可以看出微胶囊的囊壁表面光滑,结构致密,是比较理想的个体颗粒形态,基本达到包埋的预期目的。如图5c所示,微胶囊内部形成了一个大的腔体,这个空腔便是容纳油脂的空间[27]。图5d为1 000 倍数条件下破损微胶囊的囊壁结构,可观察到微胶囊虽已破碎但其囊壁的结构依旧致密,厚度较为均匀,具有良好的包埋结构。
2.6.2 体式显微镜的观察结果

图6 功能性油脂微胶囊结构体视显微镜图
Fig. 6 Observation of microcapsules under stereomicroscope
如图6a所示,微胶囊呈单核结构,内部含有球体状的包埋物。将微胶囊置于强光条件下如图6b所示,能明显看出胶囊内部呈现出油脂的金黄色,表明SA和CaCl2所形成的壁材能将芯材完全包埋,在外部形成一层保护壳,起到封装定型作用。
2.7 傅里叶变换红外光谱分析结果
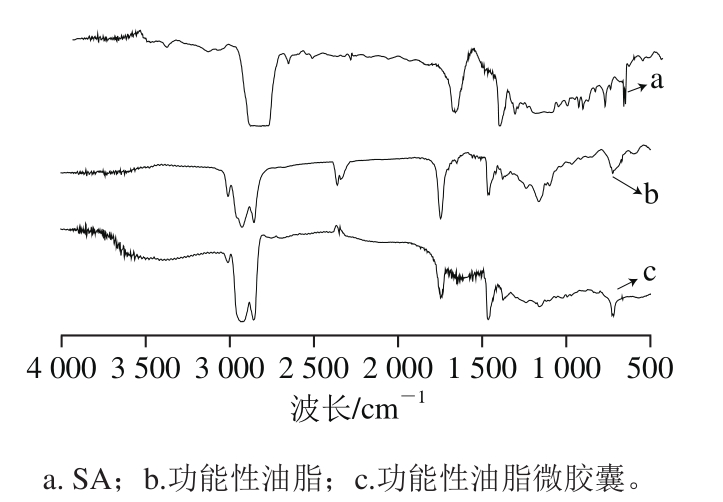
图7 功能性油脂微胶囊结构红外光谱图
Fig. 7 Infrared spectra of microcapsules
如图7a所示,其特征峰主要有1 612 cm-1附近由不对称伸缩振动引起的宽峰,在1 417 cm-1附近有由对称伸缩引起的窄峰,以及由C-OH的伸缩振动引起的,在1 000 cm-1附近有一个吸收峰。如图7b所示,在3 007 cm-1附近,有吸收强度较弱的峰,是由于该油脂中富含不饱和脂肪酸酯,由烯烃不饱和碳原子上的C-H键伸缩振动形成的;邻近的2 924 cm-1和2 854 cm-1有2 个较强的吸收峰,为饱和碳的C-H键的伸缩振动峰;在1 746 cm-1附近的强吸收,为脂肪酸酯的羰基C=O伸缩振动的特征吸收峰;在1 465 cm-1和1 377 cm-1附近,为亚甲基CH2的弯曲振动吸收峰;在1 163 cm-1和1 117 cm-1附近;有一强一弱2 个吸收峰;为脂肪酸酯中C-O-C键的对称和反对称伸缩振动吸收峰[28-29]。对比图7得知,芯材的主要特征峰在微胶囊产品的光谱图上均有所显示,只是吸收峰强度有所改变,一方面是由于芯材与壁材的混合物以及所形成的“egg-box”三维网状结构等混合所致。另一方面可能是在微胶囊的制作过程中少量不饱和脂肪酸与空气接触导致的。由此可初步判定,油脂的微胶囊化处理并未对芯材的化学结构产生影响。
2.8 热稳定性分析结果
由图8可知,微胶囊差热分析和热重分析的变化趋势基本一致,其热解过程大致分为3 个阶段。第1阶段发生在60~250 ℃之间,主要是微胶囊含有的水分蒸发以及少量表面油的分解与挥发阶段;第2阶段为250~380 ℃,是失重的加速阶段,这主要是因为壁材开始热分解,化学键开始断裂,裂解为中间产物CO2、H2O和CH4,此阶段反映了微胶囊发生了剧烈的理化反应,微胶囊被破坏,芯材迅速释放而造成质量损失;第3阶段为当温度高于380 ℃以后,中间产物进一步完全裂解并碳化。在250 ℃以下,油脂微胶囊的质量几乎没有损失,表现出很好的热稳定性,能满足一般食品的加工条件。
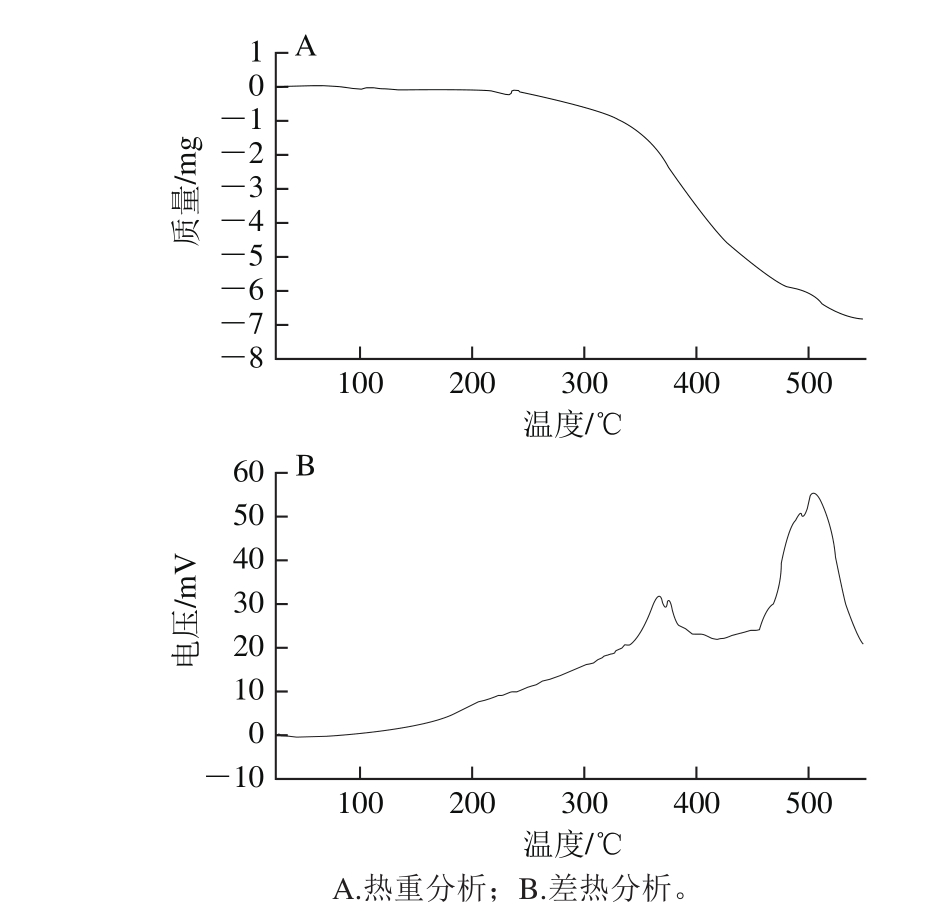
图8 功能性油脂微胶囊热重分析仪分析
Fig. 8 Thermogravimetric and differential thermal analysis of microcapsules
2.9 氧化稳定性测定结果

图9 未包埋油脂和油脂微胶囊的POV变化趋势
Fig. 9 POV of free and microencapsulated under accelerated storage conditions
根据GB 2716—2005《食用植物油卫生标准》及各食用油的标准规定,玉米油、菜籽油、大豆油等的POV允许指标为不大于12 meq/kg(6 mmol/kg)[30-32]。由图9可知,被包埋油脂的稳定性要高于未包埋的油脂。由于未包埋油脂与氧气充分接触的原因,其POV的增加较为明显,当贮藏时间达到3 d后,未包埋油脂的POV已超过国标规定,油脂微胶囊由于有壁材的保护,有效阻隔了油脂与氧气的直接接触,氧化速率相对缓慢,在第6天以后,微胶囊油脂POV为未包埋油脂POV的50%。微胶囊化提高了油脂的氧化稳定性,延长了贮藏时间。
3 结 论
本实验对油脂的微胶囊化工艺进行了筛选,在电压2 000 V、固化时间30 min、搅拌速率50%的条件下,微胶囊化工艺的最佳条件为SA质量分数1.6%、频率620 Hz、CaCl2质量分数1.5%、进料速率4.0 mL/min时能够较好地将油脂进行包埋,微胶囊包埋率达到(88.32±0.28)%。体式显微镜和电子显微镜实验结果显示微胶囊呈均一球体状且为单核结构,表面光滑,结构致密,傅里叶红外光谱分析结果表明微胶囊具有油脂的特征吸收峰,热重分析法结果表明微胶囊在250 ℃以下具有良好的热稳定性,加速氧化实验结果表明该油脂微胶囊具有良好的抗氧化稳定性。
参考文献:
[1] 金玮玲. 功能性油脂的制备及其调节血脂功效评价[D]. 武汉: 武汉轻工大学, 2014.
[2] 王莉梅. 不同比例n-6/n-3多不饱和脂肪酸体外营养评价[D]. 无锡:江南大学, 2015.
[3] SIMOPOULOS A P. The importance of the ratio of omega-6/omega-3 essential fatty acids[J]. Biomedicine & Pharmacotherapy,2002, 56(8): 365-379. DOI:10.1159/000073788.
[4] SIMOPOULOS A P. The Importance of the omega-6/omega-3 fatty acid ratio in cardiovascular disease and other chronic diseases[J]. Experimental Biology & Medicine, 2008, 233(6):674-688. DOI:10.3181/0711-MR-311.
[5] 黄秋婷, 黄惠华. 微胶囊技术在功能性油脂生产中的应用[J]. 中国油脂, 2005, 30(3): 27-29. DOI:10.3321/j.issn:1003-7969.2005.03.008.
[6] 阎师杰, 吴彩娥, 寇晓虹, 等. 核桃油微胶囊化工艺的研究[J]. 农业工程学报, 2003, 19(1): 168-171. DOI:10.3321/j.issn:1002-6819.2003.01.043.
[7] 苏峻峰, 任丽, 王立新. 微胶囊技术及其最新研究进展[J]. 材料导报, 2003, 17(增刊1): 141-144. DOI:10.3321/j.issn:1005-023X.2003.z1.044.
[8] 许燕侠. 微胶囊的制备技术[J]. 上海化工, 2005, 30(3): 21-24.DOI:10.3969/j.issn.1004-017X.2005.03.008.
[9] 许时婴, 张晓鸣, 夏书芹, 等. 微胶囊技术: 原理与应用[M]. 北京:化学工业出版社, 2006: 1-169.
[10] WHELEHAN M, MARISON I W. Microencapsulation using vibrating technology[J]. Journal of Microencapsulation, 2011,28(8): 669-688. DOI:10.3109/02652048.2011.586068.
[11] VAKARELOVA M, ZANONI F, LARDO P, et al. Production of stable food-grade microencapsulated astaxanthin by vibrating nozzle technology[J]. Food Chemistry, 2017, 221: 289-295.DOI:10.1016/j.foodchem.2016.10.085.
[12] CHEW S C, NYAM K L. Microencapsulation of kenaf seed oil by coextrusion technology[J]. Journal of Food Engineering, 2016, 175: 43-50. DOI:10.1016/j.jfoodeng.2015.12.002.
[13] HOMAR M, SULIGOJ D, GASPERLIN M. Preparation of microcapsules with self-microemulsifying core by a vibrating nozzle method[J]. Journal of Microencapsulation, 2007, 24(1):72-81. DOI:10.1080/02652040601058525.
[14] 王立琦, 张青, 任悦, 等. 计算机辅助营养均衡菜籽调和油的研制[J]. 食品科学, 2016, 37(11): 231-236. DOI:10.7506/spkx1002-6630-201611-041.
[15] 李桂华, 钱向明, 姜延超, 等. 功能性调和油的研制[J]. 中国粮油学报, 2005, 20(3): 61-65. DOI:10.3321/j.issn:1003-0174.2005.03.016.
[16] 邹强. 双歧杆菌微胶囊的研究[D]. 无锡: 江南大学, 2012.
[17] 张丽果. 超声刺激对海藻酸钠微球机械特性和释放特性的影响[J]. 北京工业大学学报, 2015, 41(9): 1302-1307. DOI:10.11936/bjutxb2015020-029.
[18] MARESCA D, PRISCO A D, STORIA A L, et al.Microencapsulation of nisin in alginate beads by vibrating technology: preliminary investigation[J]. LWT-Food Science and Technology, 2016, 66: 436-443. DOI:10.1016/j.lwt.2015.10.062.
[19] 陆雪雷. 凤凰木夜蛾蛹和成虫的雌雄形态鉴定[J]. 中国森林病虫,2017, 36(4): 34-36. DOI:10.3969/j.issn.1671-0886.2017.04.009.
[20] 郭夏丽, 蓝雅惠, 邹艺红, 等. 蜂胶醇提物微胶囊的制备及表征[J]. 现代食品科技, 2016, 32(10): 226-232. DOI:10.13982/j.mfst.1673907-8.20-16.10.034.
[21] 白春清. 功能性油脂微纳米胶囊的制备及其性能评价[D]. 南昌: 南昌大学, 2014.
[22] 魏东. 微胶囊多不饱和脂肪酸粉末的氧化稳定性研究[J]. 食品工业科技, 2007, 28(7): 88-89. DOI:10.3969/j.issn.1002-0306.2007.07.024.
[23] ZARATE J, VIRDIS L, ORIVE G, et al. Design and characterization of calcium alginate microparticles coated with polycations as protein delivery system[J]. Journal of Microencapsulation, 2011, 28(7): 614-620. DOI:10.3109/02652048.2011.599439.
[24] HUI C L, WANG W Y, KAN C W, et al. Preparation and characterization of chitosan/sodium alginate (CSA) microcapsule containing cortexmoutan[J]. Colloids and Surfaces a Physicochemical and Engineering Aspects, 2013, 434(19): 95-101. DOI:10.1016/j.colsurfa.2013.05.043.
[25] DOHNAL J, ŠTĚPÁNEK F. Inkjet fabrication and characterization of calcium alginate microcapsules[J]. Powder Technology, 2010, 200(3):254-259. DOI:10.1016/j.powtec.2010.02.032.
[26] 王二琴. 海藻酸钙纳米胶囊的制备、表征及流变性研究[D]. 上海:上海应用技术学院, 2015.
[27] PRISCO A D, MARESCA D, ONGENG D, et al.Microencapsulation by vibrating technology of the probiotic strain Lactobacillus reuteri, DSM 17938 to enhance its survival in foods and in gastrointestinal environment[J]. LWT-Food Science and Technology, 2015, 61(2): 452-462. DOI:10.1016/j.lwt.2014.12.011.
[28] 邹春海. 食用油的红外吸收光谱分析[J]. 光谱实验室, 2013, 30(3):1099-1102. DOI:10.3969/j.issn.1004-8138.2013.03.019.
[29] 贾素贞. 几种食用油的二维红外相关分析[J]. 济南大学学报(自然科学版), 2007, 21(2): 148-150. DOI:10.3969/j.issn.1671-3559.2007.02.014.
[30] 国家质量监督检验检疫总局. 玉米油: GB/T 19111—2003[S]. 北京:中国标准出版社, 2003.
[31] 国家质量监督检验检疫总局. 油茶籽油: GB/T 11765—2003[S].北京: 中国标准出版社, 2003.
[32] 国家质量监督检验检疫总局. 大豆油: GB/T 1535—2003[S]. 北京:中国标准出版社, 2003.