蛹虫草(Cordyceps militarys)又名北冬虫夏草、北虫草,是由蛹虫草真菌寄生于鳞翅目昆虫的蛹而获得的子座、菌核复合体,在我国主要分布于华北、西南等海拔200~2 000多米的针阔混交林中[1-2]。蛹虫草的活性成分、药理功效可与享有“千年国药”、“药中之王”美誉的冬虫夏草(Cordyceps sinensis)相媲美,蛹虫草保健啤酒、口服液等产品越来越被人们所认可[3-4]。
研究发现,虫草素以腺苷为直接前体进行合成,二者结构极其相似且同属核苷类物质,是蛹虫草中重要的活性成分[5]。腺苷具有改善心脑血液循环、松弛血管平滑肌、防止心率失常等生理活性,是深层大脑刺激效果的关键,可用来治疗帕金森症和严重震颤患者。虫草素是第一个从真菌中分离出来的核苷类抗菌素,在抑菌、抗病毒、抗肿瘤、调节免疫力、降血脂、抗血小板凝集、改善记忆力等方面发挥作用[6-9]。蛹虫草的人工培育已经实现规模化生产,其中以大米等谷物为固态培养基生产蛹虫草子实体的方式最为成熟,而在实际生产中,选育出的蛹虫草菌株使用较短时间就会出现退化减产甚至不产子实体等现象,影响生产企业的经济效益。若利用菌丝体阶段的蛹虫草固态发酵产物为原料开发蛹虫草产品,则能避免子实体减产带来的影响。有研究报道显示[10-12],蛹虫草固态发酵产物中含有丰富的核苷类物质,具有广阔的开发前景。
啤酒糟是啤酒生产的主要副产物,约占总副产物的85%[13],仅2012年我国啤酒糟的产量就超过1 000万 t。啤酒糟中含有丰富的膳食纤维和蛋白质,而我国对啤酒糟的综合利用效率偏低,一般被用作饲料,有些甚至作为废弃物被扔掉,既浪费资源又污染环境[14]。单一使用大米作蛹虫草固态发酵原料,经高压蒸汽灭菌后容易吸水胀裂、黏连结块,导致培养基离散度差,影响透气性和比表面积,不利于菌丝的生长[15]。经前期研究发现,在大米中加入适量啤酒糟能够有效改善发酵原料的物理性状,促进蛹虫草菌丝体生长。
本实验以大米、啤酒糟共培养的蛹虫草固态发酵产物为原料,采用热水浸提法综合提取腺苷、虫草素,通过Box-Behnken Design(BBD)优化提取工艺参数,以期提高蛹虫草固态发酵产物中腺苷、虫草素的得率,为蛹虫草固态发酵产物的高效利用提供一定参考依据。
1 材料与方法
1.1 材料与试剂
蛹虫草为来自锦州的草头6-1,由山东省蚕业研究所提供。
虫草素标准品 麦克林生化科技有限公司;腺苷标准品 索莱宝生物科技有限公司;乙醇(分析纯)康德化工有限公司;甲醇(色谱纯) 美国Honeywell公司。
1.2 仪器与设备
1100液相色谱仪 美国Agilent公司;DK-626恒温水浴锅 上海精宏实验设备有限公司;LFP-800T多功能粉碎机 浙江荣浩工贸有限公司;TGL-16C离心机上海安亭科学仪器厂;XC-110A超声清洗机 济宁鑫欣超声电子设备有限公司。
1.3 方法
1.3.1 发酵产物及样品的制备
蛹虫草固态发酵产物:将8 mL蛹虫草液体菌种接种于经高压蒸汽灭菌(121 ℃,1 h)过的大米、啤酒糟混料培养基(大米20 g、啤酒糟20 g、水40 mL)中,于23 ℃培养至菌丝体布满培养基。
样品溶液:将蛹虫草固态发酵产物于60 ℃烘箱中烘干至质量恒定,粉碎、过80 目筛后取2 g置于100 mL烧杯中,使用恒温水浴锅浸提,取上清液经离心(3 000 r/min、10 min)、0.22 μm微孔滤膜过滤后检测。
标准品溶液:准确称取虫草素标准品25 mg,加入25 mL超纯水振荡溶解,制成虫草素标准储备液,将虫草素储备液稀释至0.005、0.01、0.05、0.1 mg/mL和0.3 mg/mL制成标准溶液。准确称取25 mg腺苷标准品,加入25 mL的50%乙醇溶液振荡溶解,制成腺苷标准储备液,将腺苷储备液稀释至0.005、0.01、0.05、0.1 mg/mL和0.3 mg/mL制成标准溶液。
1.3.2 色谱条件
色谱柱:Xtimate C18色谱柱(4.6 mm×150 mm,3 μm);柱温:30 ℃;检测器:紫外检测器;检测波长:254 nm;流动相:甲醇-水;进样量:5 μL;流速:1 mL/min;流动相梯度洗脱程序见表1。
表1 高效液相色谱梯度洗脱程序
Table 1 Gradient elution program for high performance liquid chromatography

1.3.3 单因素试验
各因素固定值分别为纯水提取、液料比30∶1(mL/g)、提取温度60 ℃、提取时间60 min,保持其他3 个因素不变,每次改变1 个因素,设计提取时间分别为20、40、60、80、100、120、140 min;乙醇溶液体积分数分别为0%、10%、20%、30%、40%、50%;液料比分别为10∶1、20∶1、30∶1、40∶1、50∶1(mL/g);提取温度分别为30、40、50、60、70、80 ℃,外标法测定虫草素与腺苷提取得率,二者之和即为综合得率。
1.3.4 响应面优化试验
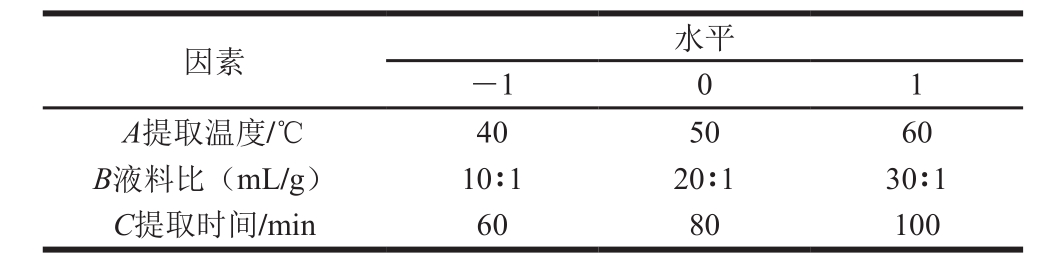
在单因素试验的基础上,采用BBD设计方案,以提取温度(A)、液料比(B)、提取时间(C)为考察变量,以虫草素和腺苷的综合得率为响应值(Y),设计3因素3水平响应面分析试验,确定最佳提取工艺。每一变量的低、中、高水平分别以-1、0、1编码,试验因素与水平见表2。
表2 响应面试验因素与水平
Table 2 Coded levels and corresponding actual levels of independent variables used for response surface analysis
1.4 数据处理
单因素试验测定3 次,取平均值,利用Origin 8.0绘图;响应面试验用Design-Expert 8.0软件进行试验设计并对回归模型进行方差分析。
2 结果与分析
2.1 高效液相色谱测定结果
2.1.1 色谱峰归属

图1 标准品(a)和样品(b)高效液相色谱图
Fig. 1 HPLC chromatograms of standard substance (a) and sample (b)
由图1a可知,腺苷、虫草素标准品保留时间分别为13.917、15.959 min。以虫草素标准品和腺苷标准品的保留时间为依据,确定样品中腺苷和虫草素色谱峰。由图1b可知,样品色谱峰分离良好,表明在所用检测条件下可同时测定腺苷、虫草素含量。
2.1.2 线性关系考察
取虫草素、腺苷标准品按0.005、0.01、0.05、0.1 mg/mL和0.3 mg/mL质量浓度样品依次进样,分别测定峰面积,以峰面积为纵坐标(Y),标准品质量浓度为横坐标(X),进行线性回归,得回归方程为:虫草素:Y=59 682X+421.97,R2=0.998 9;腺苷:Y=59 878X+72.115,R2=0.999 7。表明腺苷、虫草素在0.005~0.3 mg/mL之间呈良好线性关系。
2.1.3 精密度实验结果
取混合标准品溶液重复进样6 次,测定腺苷、虫草素峰面积,结果腺苷、虫草素峰面积相对标准偏差分别为0.49%、0.61%,表明精密度良好。
2.1.4 重复性实验结果
按照1.3.1节方法重复制备6 份样品溶液,测定腺苷、虫草素得率,结果腺苷、虫草素峰面积相对标准偏差分别为1.35%、1.49%,均小于2%表明重复性良好。
2.2 单因素试验结果
2.2.1 提取时间对得率的影响

图2 提取时间对虫草素、腺苷得率的影响
Fig. 2 Effect of extraction time on the yields of cordycepin and adenosine
由图2可知,当提取时间小于80 min时,虫草素得率随提取时间的延长而增大,在80 min时,虫草素得率达到最大为2.055‰;当提取时间小于120 min时,腺苷得率随提取时间的延长而增大,在120 min时,腺苷得率最大为0.324‰,之后随提取时间的延长而降低。提取时间较短时以虫草素、腺苷从原料向溶剂中扩散为主,提取时间过长则会引发虫草素、腺苷的降解、吸附[16]。二者的综合得率在80 min时达到最高为2.368‰,因而选择60~100 min为进一步考察条件。
2.2.2 乙醇溶液体积分数对得率的影响
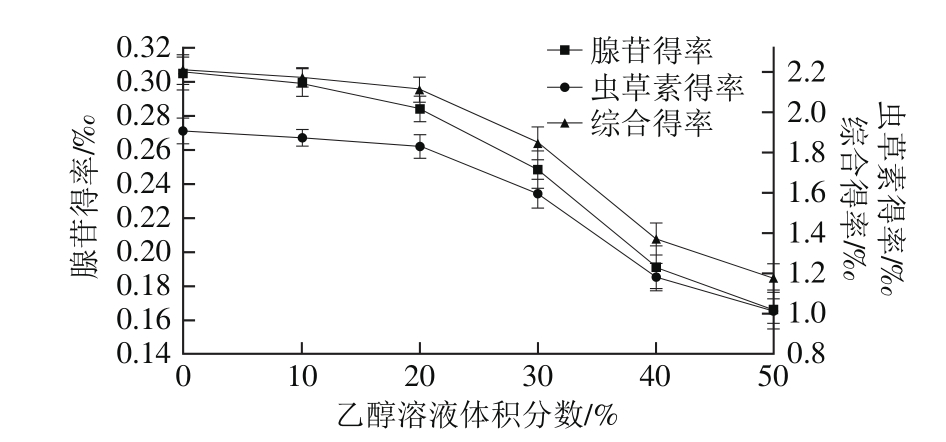
图3 乙醇溶液体积分数对虫草素、腺苷得率的影响
Fig. 3 Effect of ethanol concentration on the yields of cordycepin and adenosine
由图3可知,随着乙醇溶液体积分数的增大,虫草素、腺苷得率逐渐降低。乙醇溶液体积分数为0%时虫草素、腺苷得率最高,分别为1.906‰、0.305‰,综合得率为2.211‰,因此选择纯水作溶剂。究其原因,可能是随着乙醇溶液体积分数的增大,脂溶性杂质的成分溶出量增加,可与乙醇-水分子结合,为虫草素、腺苷的竞争性抑制剂,导致虫草素、腺苷得率降低[17]。
2.2.3 液料比对得率的影响

图4 液料比对虫草素、腺苷得率的影响
Fig. 4 Effect of solvent-to-solid ratio on the yields of cordycepin and adenosine
由图4可知,液料比对得率的影响较大。当液料比在10∶1~20∶1(mL/g)范围内,虫草素得率随液料比的增大而升高,由1.716‰升高到2.011‰,若液料比继续增大,虫草素得率随之下降;液料比在10∶1~30∶1(mL/g)范围内时,腺苷得率随液料比的增大而升高,由0.206‰升高到0.293‰,液料比继续增大,腺苷得率呈下降趋势。液料比过大不但会降低虫草素、腺苷得率,还会给后续浓缩提纯带来不便。在液料比为20∶1(mL/g)时,虫草素与腺苷的综合得率最高达2.279‰,因而选择液料比10∶1~30∶1(mL/g)进一步考察。
2.2.4 提取温度对得率的影响

图5 提取温度对虫草素与腺苷得率的影响
Fig 5 Effect of temperature on the yields of cordycepin and adenosine
由图5可知,温度对得率的影响较明显,在30~50 ℃范围内,虫草素得率随温度升高而增大,50 ℃时虫草素得率达到最高达2.083‰;在30~40 ℃范围内腺苷得率随温度升高而增大,40 ℃时腺苷得率达到最大为0.365‰,之后随温度的升高而降低。这可能是因为低温会降低虫草素、腺苷的溶出速率,而温度过高会使虫草素与腺苷的结构遭到破坏[18]。在50 ℃时综合提取得率最高,为2.443‰,因此进一步考察范围选择40~60 ℃。
2.3 响应面试验结果与分析
2.3.1 响应面试验结果与回归方程拟合
表3 响应面试验设计及结果
Table 3 Experimental design and results with response variables

在单因素试验的基础上,选择提取温度(A)、液料比(B)、提取时间(C)3 个因素为自变量,以腺苷和虫草素2 种核苷类物质综合得率(Y)为响应值继续对提取条件进行优化。采用响应面软件Design-Expert 8.0.6设计BBD试验方案,并对结果进行回归分析,见表3。经拟合回归,得到综合得率Y对自变量A、B、C的回归方程为:Y=2.45-0.068A+0.11B+0.037C-0.014AB-0.12AC-0.052BC-0.12A2-0.20 B2-0.11C2。
2.3.2 模型方差及可信度分析
通过表4可知,此模型达到极显著水平(P<0.000 1),且失拟项不显著(P=0.854 1>0.05)。在一次项中,提取温度(A)、液料比(B)的P值小于0.01,对综合得率的影响极显著;提取时间(C)的P值为0.020 1(0.01<P<0.05)对综合得率的影响显著。交互项中,提取温度与提取时间(AC)对综合得率的影响达到极显著水平(P=0.000 3<0.001);液料比与提取时间(BC)对综合得率的影响达到显著水平(P=0.02<0.05)。二次项均对综合得率有极显著影响。
由模型的可信度分析可知,决定系数R2值为0.983 9,表明试验数据与预测值吻合度较高,98.39%的响应值可由该模型解释;调整后决定系数R2Adj值为0.963 1,表明有96.31%的变化来源于试验所考察变量;信噪比(19.085)高于4表示信号强度足够明显;变异系数为1.56%,表明模型在试验范围内稳定一致。以上数据说明回归模型与实际值拟合良好,未知因素对试验结果干扰很小,可以用来对虫草素、腺苷的综合提取进行预测。
表4 回归模型方差及可信度分析
Table 4 Analysis of variance and reliability of regression model
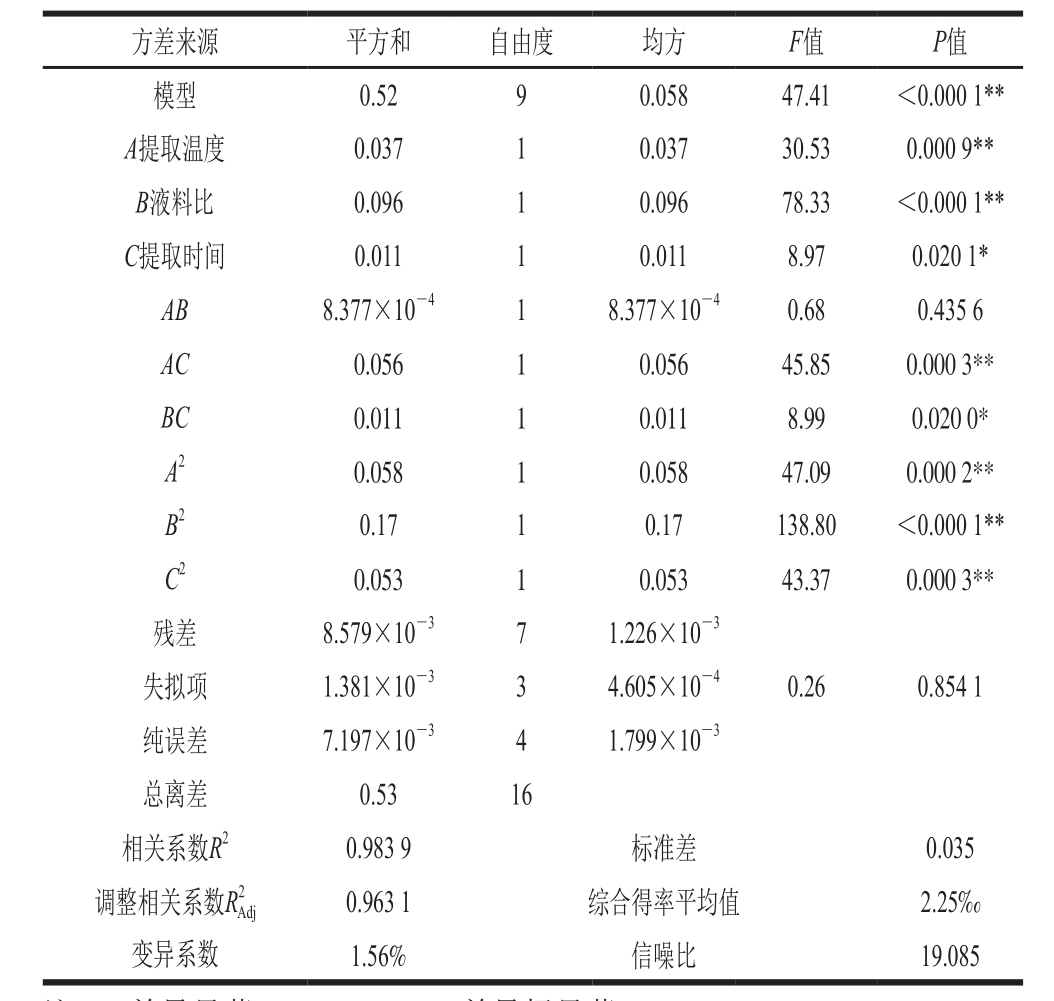
注:*.差异显著,P<0.05;**.差异极显著,P<0.001。
2.3.3 交互作用分析结果


图6 各因素交互作用对综合得率影响的响应面与等高线图
Fig. 6 Response surface and contour plots showing the interactive effects of three process parameters on the total yield of cordycepin and adenosine
由图6可知,综合得率随提取温度、液料比、提取时间的增大呈现先上升后下降的趋势,说明该模型具有极大值。响应面的陡峭程度随液料比、提取温度的变化起伏较大,等高线沿液料比、提取温度轴向变化相对密集,而沿提取时间轴向变化相对稀疏,说明液料比、提取温度对综合得率的影响大于提取时间。提取温度与提取时间的等高线图呈现明显椭圆形,表明提取温度与提取时间的交互作用较强。以上分析与表4中方差分析结论一致。
2.3.4 工艺参数优化验证结果
对回归方程的3 个自变量A、B、C分别求一阶偏导,解三元一次方程组得最大得率时的最优组合为提取温度45.07 ℃、液料比22.42∶1(mL/g)、提取时间87.36 min,该条件下的预测值为2.487‰。在实际操作中将提取条件修正为提取温度45 ℃、液料比22∶1(mL/g)、提取时间87 min,3 次验证实验结果的平均值为2.491‰,与预测值基本一致,表明优化结果合理、可靠,可以用来指导虫草素、腺苷的提取。
3 讨 论
响应面与等高线图可直观体现出试验因素与响应值的关系,响应面坡度越陡峭,表明响应值对于操作条件的改变越敏感,该因素对综合得率的影响越大[19];等高线形状可反映因素间交互作用强弱,椭圆形表示两因素交互作用较强,圆形则与之相反[20]。
提取时间对虫草素与腺苷得率的影响是重点考察因素之一。从单因素结果来看,虫草素的最佳提取时间为80 min,腺苷最佳提取时间为120 min;响应面综合提取优化结果为87 min。部分报道[21-23]表明虫草素提取时间在3~6 h虫草素得率开始出现下降;但也有学者[24-25]的优化结果则显示虫草素得率在60 min时较高。腺苷的提取研究中同样存在最佳提取时间相差较大的问题[26-27]。现阶段研究中,提取虫草素、腺苷等核苷类物质的工艺参数存在较大差异,主要原因是所用原料差别较大,包括子实体和菌丝体的差异、菌种的差异、培养基和前处理的差异。相对而言,从蛹虫草固态发酵产物的菌丝体中提取比从子实体中提取所用时间短;在一定范围内,原料粉碎粒度小更容易提取。
提取温度也会对提取时间产生明显影响,较高的提取温度不仅能加速溶剂对原料的浸润、增加传质速率,而且还可以提高溶质的溶解度[28]。本实验的响应面分析显示提取温度与提取时间的交互作用达到极显著水平,也验证了提取时间与提取温度在浸提时的相互影响。综合得率最高时的提取温度为45 ℃,可见虫草素、腺苷的提取并不需消耗太多能源,过高的温度反而会使提取得率迅速下降,这与大多数研究结论相符[29-30]。
本实验采用浸提法综合提取蛹虫草固态发酵产物中的虫草素、腺苷,该方法技术成熟、所需设备简单、能源消耗少、不需要使用有机溶剂,减少对环境的污染,在生产上具有较高的实用价值,为后续产品的开发提供一定参考基础。
参考文献:
[1] SHRESTHA B, ZHANG W, ZHANG Y, et al. The medicinal fungus Cordyceps militaris: research and development[J]. Mycological Progress, 2012, 11(3): 599-614. DOI:10.1007/s11557-012-0825-y.
[2] CUI J D. Biotechnological production and applications of Cordyceps militaris,a valued traditional Chinese medicine[J]. Critical Reviews in Biotechnology,2015, 35(4): 475-484. DOI:10.3109/07388551.2014.900604.
[3] 柴建萍, 白兴荣, 谢道燕. 蛹虫草主要有效成分及其药理功效[J]. 云南农业科技, 2003(4): 22-23. DOI:10.3969/j.issn.1000-0488.2003.04.010.
[4] 崔亚放. 虫草保健啤酒生产工艺研究[J]. 安徽农业科学, 2010,38(30): 17200-17201. DOI:10.3969/j.issn.0517-6611.2010.30.178.
[5] KE B J, LEE C L. Investigation on the fermentation for high adenosine and N6-(2-hydroxyethyl)-adenosine (HEA) productions of Cordyceps cicadae[J]. New Biotechnology, 2016, 33: 206-207. DOI:10.1016/j.nbt.2016.06.1433.
[6] FAN B, ZHU H. Cordycepin: pharmacological properties and their relevant mechanisms[J]. Tang: Humanitas Medicine, 2012, 2(2): 1-7.
[7] 蔡友华, 刘学铭. 虫草素的研究与开发进展[J]. 中草药, 2007, 38(8):1269-1272. DOI:10.3321/j.issn:0253-2670.2007.08.054.
[8] KODAMA E N, MCCAFFREY R P, YUSA K, et al. Antileukemic activity and mechanism of action of cordycepin against terminal deoxynucleotidyl transferase-positive (TdT+) leukemic cells[J].Biochemical Pharmacology, 2000, 59(3): 273-281. DOI:10.1016/S0006-2952(99)00325-1.
[9] WONG Y Y, MOON A, DUFFIN R, et al. Cordycepin inhibits protein synthesis and cell adhesion through eあects on signal transduction[J].Journal of Biological Chemistry, 2010, 285(4): 2610-2621.DOI:10.1074/jbc.M109.071159.
[10] 王晓龙, 马进川, 周艳, 等. 不出草的蛹虫草固体培养基中虫草素含量分析[J]. 河北农业科学, 2015(3): 77-79. DOI:10.16318/j.cnki.hbnykx.2015.03.017.
[11] 贺晓玉, 罗杰, 李英伦. 响应面法优化蛹虫草菌固体发酵五味子药渣发酵条件[J]. 食品工业科技, 2014, 35(15): 166-169.DOI:10.13386/j.issn1002-0306.2014.15.027.
[12] 韦会平, 叶小莉, 张华英, 等. 用蛹虫草固体发酵法高效生产虫草素的研究[J]. 中国中药杂志, 2008, 33(19): 2159-2162. DOI:10.3321/j.issn:1001-5302.2008.19.001.
[13] MUSSATTO S I. Brewer’s spent grain: a valuable feedstock for industrial applications[J]. Journal of the Science of Food &Agriculture, 2014, 94(7): 1264-1275. DOI:10.1002/jsfa.6486.
[14] 叶春苗. 啤酒糟再利用研究进展[J]. 农业科技与装备, 2016(1): 57-58. DOI:10.16313/j.cnki.nykjyzb.2016.01.023.
[15] 陈乃维. 蛹虫草菌株BYB-08固体发酵工艺及其产品的研究[D]. 武汉:华中农业大学, 2010: 15-35.
[16] 王雅玲, 孙力军, 赵轶男, 等. 蛹虫草大米培养残基中虫草素提取方法的优化研究[J]. 安徽农业科学, 2009, 37(8): 3364-3366.DOI:10.3969/j.issn.0517-6611.2009.08.010.
[17] 郑迎春, 曹玉芬, 李静, 等. 梨叶多酚提取的正交试验优化及其成分测定[J]. 食品科学, 2015, 36(20): 32-36. DOI:10.7506/spkx1002-6630-201520006.
[18] YUE K, YE M, ZHOU Z, et al. The genus Cordyceps: a chemical and pharmacological review[J]. Journal of Pharmacy & Pharmacology,2013, 65(4): 474-493. DOI:10.1111/j.2042-7158.2012.01601.x.
[19] GHOSH A, DAS P, SINHA K. Modeling of biosorption of Cu(II) by alkali-modified spent tea leaves using response surface methodology(RSM) and artificial neural network (ANN)[J]. Applied Water Science,2015, 5(2): 191-199. DOI:10.1007/s13201-014-0180-z.
[20] 宋燕, 罗松明, 向建军, 等. 响应面法优化花椒籽不可溶性膳食纤维提取工艺研究[J]. 中国油脂, 2011, 36(7): 62-67.
[21] 孟胜楠, 杜双田, 简利茹, 等. 蛹虫草子座培养剩余基质中虫草素提取工艺的优化[J]. 西北农林科技大学学报(自然科学版), 2013,41(10): 131-136. DOI:10.13207/j.cnki.jnwafu.2013.10.009.
[22] 李晨曦. 蛹虫草有效成分的提取及保健食品的开发[D]. 南昌: 南昌大学, 2013: 12-33.
[23] 谭琪明, 何珺, 文庭池, 等. 蛹虫草小麦培养基中虫草素提取工艺研究[J]. 山地农业生物学报, 2011, 30(4): 357-361. DOI:10.3969/j.issn.1008-0457.2011.04.017.
[24] 杨青. 蛹虫草培养残基发酵制酒的研究[D]. 天津: 天津科技大学,2014: 23-26.
[25] 梁晨. 蛹虫草培养基中多糖和虫草素的提取及纯化研究[D]. 广州:广东工业大学, 2011: 41-43.
[26] 韩建华, 杨淑芳, 孙继红, 等. 蛹虫草中虫草素、腺苷综合提取工艺研究[J]. 北方蚕业, 2011, 32(4): 24-27. DOI:10.3969/j.issn.1673-9922.2011.04.008.
[27] 牛双, 高翔, 安金双, 等. 蛹虫草菌丝体中腺苷提取工艺的优化[J]. 时珍国医国药, 2009, 20(2): 322-325. DOI:10.3969/j.issn.1008-0805.2009.02.035.
[28] 冯年平. 中药提取分离技术原理与应用[M]. 北京: 中国医药科技出版社, 2005: 130-150.
[29] 邓黎, 周同永, 皮立, 等. 用响应面法优化人工蛹虫草子实体中虫草素的超声提取工艺[J]. 江苏农业科学, 2012, 40(5): 225-228.DOI:10.3969/j.issn.1002-1302.2012.05.087.
[30] 李瑞雪, 汪泰初, 胡飞, 等. 蝉拟青霉中虫草素提取工艺研究[J]. 食品科技, 2013, 38(2): 218-221. DOI:10.13684/j.cnki.spkj.2013.02.016.