随着国内生活水平的提升,牛乳的消费量呈逐年上升的趋势[1],但同时也面临着食品安全方面的威胁。一方面,牛乳从养殖场到工厂的生产过程中被食源性致病菌污染的可能性很高;另一方面,牛乳中丰富的脂肪、蛋白质等营养物质给食源性致病菌提供了良好的增殖条件[2]。根据调查显示,牛乳中食源性致病菌主要有大肠杆菌O157:H7、沙门菌、金黄色葡萄球菌、链球菌、单核细胞性李斯特菌等[3-6]。
大肠杆菌O157:H7是一种重要的食源性致病菌,属于肠杆菌科埃希氏菌属,是肠出血性大肠杆菌中最具代表性的血清型[7]。自1982年首次在美国发现由大肠杆菌O157:H7引起出血性肠炎的爆发以来,在全球范围内已经出现了多起大肠杆菌O157:H7食物中毒事件[8]。据统计,1996—2004年间,大肠杆菌O157:H7平均每年造成约4亿 美元的经济损失,并严重危害人类身体健康[9]。大肠杆菌O157:H7的主要宿主是牛[10],并且世界各地的乳及乳制品中都曾有大肠杆菌O157:H7的检出,特别是在美国、瑞典、意大利的调查研究中发现,大肠杆菌O157:H7在牛乳样品中有着较高的检出率[3,11-12]。因此,牛乳被认为是大肠杆菌O157:H7污染的高风险食品之一,大肠杆菌O157:H7的检测也得到了世界各国的广泛重视。
目前,牛乳中大肠杆菌O157:H7的检测主要依靠常规的细菌学培养方法,然而培养方法耗时费力,无法适应大规模筛查检测的需求[13]。近年来,随着科学技术的进步,越来越多的新方法被应用于牛乳中细菌的检测。杜寒春等[14]运用阻抗法检测牛乳中的细菌总数,但其无法特异地检测牛乳中特定的细菌;王文彬[15]建立的免疫胶体金试纸条的方法检测牛乳中大肠杆菌O157:H7,其肉眼检测限仅能达到3×105CFU/mL;盖冬雪[16]和张微[17]等使用PCR方法可以检测牛乳中的细菌,但该方法在对实际牛乳样品的检测中,由于受到PCR检测模板体系较少等限制,不仅会造成较高的漏检率,且操作相对复杂。流式分析技术在细菌检测领域有着快速、高效的优点[18],因此,将其用于牛乳中细菌检测的研究也愈加受到重视。刘道亮等[19]基于流式分析技术完成了牛乳中细菌总数的检测,所用的检测时间为100 min;Pinder等[20]对牛乳中沙门菌进行了检测,其检测下限达到了104CFU/mL;He Shengbin等[21]对酸乳中乳酸菌进行了检测,但其检测范围为106~109CFU/mL。而基于流式分析技术检测牛乳大肠杆菌O157:H7的研究中,Yamaguchi等[22]已将其检测时间缩短到了90 min。然而目前流式分析方法仍难以满足乳及乳制品生产企业和市场监管日益增长的快速、准确检测的要求。
本研究以大肠杆菌O157:H7为检测对象,结合流式分析技术和免疫荧光标记技术,建立了一种牛乳中大肠杆菌O157:H7的快速定量检测方法。该方法旨在进一步缩短大肠杆菌O157:H7检测时间、提高定量检测的准确性,从而满足牛乳中大肠杆菌O157:H7快速定量检测的需要。
1 材料与方法
1.1 材料与试剂
全脂灭菌乳 内蒙古蒙牛乳业股份有限公司。
大肠杆菌O157:H7(CICC 21530)、大肠杆菌(CMCC 44102)、大肠杆菌K12(ATCC 10798)、金黄色葡萄球菌(ATCC 6538P)、阴沟肠杆菌(ATCC 13047)和弗氏柠檬酸杆菌(ATCC 43864)均购于中国工业微生物菌种保藏管理中心。
营养肉汤培养基、结晶紫中性红胆盐琼脂(VRBA)、结晶紫中性红胆盐-4-甲基伞形酮-β-D-葡萄糖苷琼脂(VRBA-MUG) 北京陆桥技术有限责任公司;标记有异硫氰酸荧光素(fluorescein isothiocyante,FITC)的大肠杆菌O157单克隆抗体 美国Virostat公司;牛奶中微生物快速纯化试剂盒 北京亦泰生物技术有限公司。
1.2 仪器与设备
A50-Micro型流式细胞仪 英国Apogee公司;1-14型离心机 德国Sigma公司;HZQ-X100型恒温振荡培养箱江苏太仓市实验设备厂;DNP-9272型恒温培养箱上海精宏实验设备有限公司。
1.3 方法
1.3.1 细菌悬浊液的制备
将大肠杆菌O157:H7、大肠杆菌(CMCC 44102)、大肠杆菌K12、金黄色葡萄球菌、阴沟肠杆菌、弗氏柠檬酸杆菌分别接种于20 mL营养肉汤培养基中,在恒温振荡培养箱内37 ℃培养12 h。取1 mL菌液,12 000×g离心10 min,弃去上清液,底部沉淀用1 mL磷酸盐缓冲溶液(phosphate buffer saline,PBS)(pH 7.2)重悬。用灭菌的PBS将重悬后的大肠杆菌O157:H7纯菌液进行10 倍系列稀释。
1.3.2 大肠杆菌O157:H7的染色
吸取两份适宜浓度的大肠杆菌O157:H7菌液(最终浓度约为107CFU/mL),其中一份菌液与FITC标记的大肠杆菌O157单克隆抗体(最终质量浓度为1 μg/mL)避光孵育15 min作为实验组,另一份菌液作为对照组,用流式分析仪进行检测。
荧光染料FITC的激发波长为495 nm,发射波长为519 nm,呈现绿色荧光[23]。因此,流式分析仪检测参数设定如下:激发光波长488 nm,分析速率10.5 μL/min,检测时间30 s,通过488-Grn绿色荧光通道进行检测分析。
1.3.3 大肠杆菌O157:H7与抗体反应条件的优化
为了探索大肠杆菌O157:H7与FITC标记的大肠杆菌O157单克隆抗体的最佳反应条件,参照王宁[24]的方法,对反应条件进行优化。大肠杆菌O157:H7(最终浓度约为108CFU/mL)分别与不同质量浓度的抗体(0.01、0.1、1、2 μg/mL)避光孵育15 min,每个质量浓度做3 次重复,随后进行流式分析,计算染色率,确定抗体最适质量浓度。
大肠杆菌O157:H7(最终浓度约为108CFU/mL)与荧光抗体(最终质量浓度为1 μg/mL)进行避光孵育,时间分别为5、10、15、20 min和25 min。每个条件做3 次重复,再用流式分析仪进行检测,计算染色率,确定最佳反应时间。
1.3.4 流式检测方法的线性与灵敏度[25]
将用灭菌PBS 10 倍系列稀释的大肠杆菌O157:H7菌液分别采用流式检测法和国标中大肠埃希氏菌平板计数法[26]进行定量检测,每个浓度分别用流式检测法和平板计数法做3 次重复。分析流式检测法的线性与灵敏度。
1.3.5 流式检测方法的特异性检测[27]
用灭菌的PBS分别将大肠杆菌(CMCC 44102)、大肠杆菌K12、金黄色葡萄球菌、阴沟肠杆菌、弗氏柠檬酸菌等常见致病菌制备成107CFU/mL菌悬液,分别与FITC标记的大肠杆菌O157单克隆抗体(最终质量浓度为1 μg/mL)避光孵育15 min,用流式分析仪进行检测,验证其特异性。
1.3.6 人工污染牛乳样品的检测
将大肠杆菌O157:H7人工接种到牛乳中,制备成人工污染的牛乳样品,浓度为1.51×103~1.51×108CFU/mL。采用牛乳中微生物快速纯化试剂盒去除牛乳样品中的脂肪和蛋白颗粒,对人工污染的牛乳样品进行如下处理:取0.5 mL牛乳置于2 mL离心管中,再取牛乳中微生物快速纯化试剂盒的样品处理液1 mL置于牛乳中,反复颠倒混匀20 次,12 000×g离心5 min。弃去上层脂肪和中层清液,保留底部的沉淀。加入500 μL的PBS重悬沉淀,转移至新的离心管中,再加入1 mL的PBS,混匀后,12 000×g离心5 min。弃去上清液,保留底部沉淀,加入500 μL的PBS重悬沉淀。再经过荧光抗体孵育后,用流式分析仪进行检测。每个浓度的样品做3 次重复。
2 结果与分析
2.1 FITC标记大肠杆菌O157:H7的检测结果
将FITC标记的单克隆抗体与大肠杆菌O157:H7孵育15 min后,用流式分析仪进行检测,结果如图1所示,实验组的大肠杆菌O157:H7可以检测到绿色荧光,而对照组未检测到绿色荧光,证明大肠杆菌O157:H7与FITC标记的单克隆抗体可以发生反应,并通过流式分析技术可以在20 min内快速检测到大肠杆菌O157:H7。

图1 FITC标记大肠杆菌O157:H7
Fig. 1 Detection of E. coli O157:H7 labelled with FITC
2.2 大肠杆菌O157:H7与抗体反应条件的优化
将大肠杆菌O157:H7(最终浓度约为108CFU/mL)分别于不同质量浓度的抗体(0.01、0.1、1、2 μg/mL)避光孵育15 min,随后进行流式分析,通过计算抗体不同质量浓度和反应时间条件下的染色率,如表1所示,大肠杆菌O157:H7的染色率随着所用抗体质量浓度的升高而升高,当抗体质量浓度为1 μg/mL时,染色率趋于稳定,因此抗体的最佳质量浓度为1 μg/mL。此外,大肠杆菌O157:H7的染色率随着反应时间的延长而升高,当反应时间达到15 min时染色率趋于稳定,因此抗体与大肠杆菌O157:H7的反应时间为15 min。
表1 不同抗体反应条件下大肠杆菌O157:H7的染色率
Table 1 Staining rate of E. coli O157:H7 under different reaction conditions with the antibody

2.3 流式检测方法的线性与灵敏度结果
将用灭菌PBS进行10 倍系列稀释的大肠杆菌O157:H7菌液采用流式方法进行检测,同时对每一个稀释度的菌液采用平板计数法进行检测。结果显示(表2),大肠杆菌O157:H7的浓度在103~108CFU/mL时,流式分析技术检测大肠杆菌O157:H7的结果与平板计数法基本一致,且流式检测法与平板计数法之间线性良好(R2=0.997 2)。大肠杆菌O157:H7的浓度大于108CFU/mL时,由于流式分析仪自身的限制,超出其检测上限。当大肠杆菌O157:H7的浓度小于103CFU/mL时,流式分析结果与平板计数法偏差较大。流式检测方法在PBS中的检测范围为2.57×103~1.12×108CFU/mL,灵敏度为2.57×103CFU/mL。
表2 流式检测与平板计数法检测大肠杆菌O157:H7的结果(n= 3)
Table 2 Comparison of the results of FCM method and plate counting method in detection of E. coli O157:H7
(n= 3)

2.4 流式检测方法的特异性实验结果
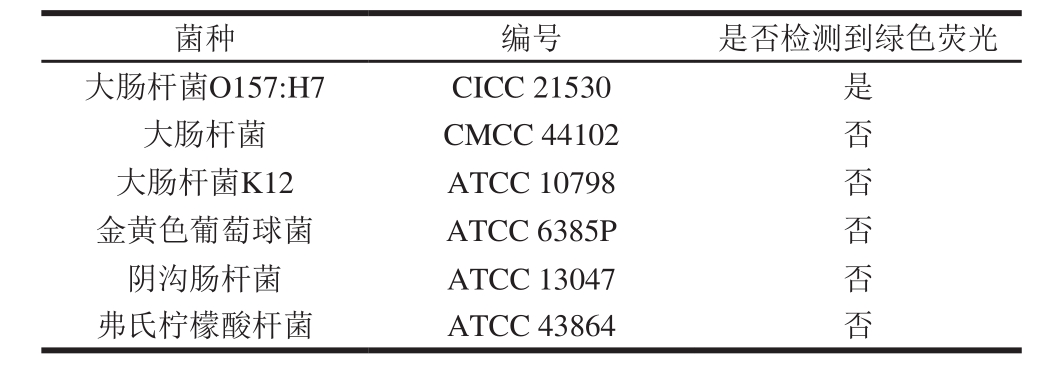
大肠杆菌(CMCC 44102)、大肠杆菌K12、金黄色葡萄球菌、阴沟肠杆菌和弗氏柠檬酸杆菌分别与大肠杆菌O157单克隆抗体在优化条件下进行反应,上述5 种菌株在流式分析仪中均未检测到绿色荧光(表3)。结果表明:大肠杆菌O157单克隆抗体与大肠杆菌(CMCC 44102)、大肠杆菌K12、金黄色葡萄球菌、阴沟肠杆菌、弗氏柠檬酸杆菌不发生反应,表明建立的流式检测方法特异性良好。
表3 流式检测方法的特异性实验结果
Table 3 Specificity of flow counting method for E. coli O157:H7
2.5 人工污染牛乳样品的检测结果
在牛乳中接种不同浓度梯度的大肠杆菌O157:H7。用牛乳中微生物快速纯化试剂盒对人工污染的牛乳样品进行前处理。样品与处理液反复颠倒混匀,高速离心后,样品分离为3 层,分别为上层的脂肪层、中间的透明液体以及底部沉淀,其中底部沉淀是经纯化的大肠杆菌O157:H7;而用同样体积的纯水作为对照代替牛乳中微生物快速纯化试剂盒来处理人工污染的牛乳样品时,当牛乳样品与纯水颠倒混匀并离心后,底部仍残留有较多的白色沉淀,沉淀不仅包含人工污染的大肠杆菌O157:H7,还含有较多的和蛋白颗粒。通过与纯水的对比说明,牛乳中微生物快速纯化试剂盒可以完成对大肠杆菌O157:H7的纯化。
表4 人工污染牛乳样品中流式检测方法与平板计数方法检测结果的比较(n=3)
Table 4 Comparison of quantitative results of E. coli O157:H7 in artificially infected milk samples between FCW and plate counting method (n= 3)

将经过纯化的大肠杆菌O157:H7,用流式分析进行检测,结果如表4所示,大肠杆菌O157:H7的浓度在104~108CFU/mL之间时,流式检测方法与平板计数方法的检测结果非常接近。大肠杆菌O157:H7的浓度小于104CFU/mL时,流式检测方法与平板计数方法的检测结果偏差较大。因此,人工污染牛乳样品中流式检测方法的检测范围为2.31×104~1.48×108CFU/mL,灵敏度为2.31×104CFU/mL。
3 讨 论
大肠杆菌O157:H7的污染是食品安全领域中的重要问题。因此,建立快速高效检测方法是控制其污染的有效手段之一[27]。本研究通过偶联FITC的单克隆抗体特异性标记大肠杆菌O157:H7,结合流式分析技术,建立了一种牛乳中大肠杆菌O157:H7的快速定量检测方法。
荧光抗体在流式分析仪检测单一细菌的方法中应用广泛,且抗体的特异性对方法的特异性起着至关重要的作用[25,27]。本研究将偶联FITC的大肠杆菌O157单克隆抗体与大肠杆菌O157:H7以及其他5 种常见菌株进行反应,所得结果证明了流式分析技术检测大肠杆菌O157:H7的特异性。
流式分析技术检测牛乳中的细菌时,需要对样品进行一定的前处理来排除牛乳中大分子蛋白和脂肪的干扰。通常的前处理方法为:用蛋白酶降解大分子蛋白质,用TritonX-100破碎牛乳中的体细胞,通过离心完成脂肪的分离[20-22,24,28],整个过程用时30 min。本研究所用的牛乳中微生物快速纯化试剂盒,将纯化的时间缩短到了15 min,但缺点是步骤比较繁琐,对操作者有较高的要求。
目前,平板培养法是细菌检测最权威最通用的方法,但是国标中大肠杆菌O157:H7的检测仅为定性检测,难以满足食品安全领域中定量检测的需求[13]。因此,本研究中对大肠杆菌O157:H7的平板计数方法参照国标中大肠埃希氏菌的平板计数方法[26]。本研究对流式检测结果与平板计数结果进行了对比,证明了流式检测方法具有良好的线性,其并且检测结果与平板计数方法基本一致,有望满足食品安全领域中大肠杆菌O157:H7定量检测的需求。该方法在PBS中的检测限为2.57×103~1.12×108CFU/mL,在牛乳样品中的检测限为2.31×104~1.48×108CFU/mL,与前人文献中报道的结果十分接近[22]。相信随着大肠杆菌O157:H7富集技术的逐步改进,该方法的灵敏度可进一步提升[25,29]。
此外,流式分析技术检测牛乳中大肠杆菌O157:H7的过程中,牛乳样品前处理的时间为15 min,大肠杆菌O157:H7与抗体的反应时间为15 min,流式检测与结果分析的时间约为5 min,合计35 min。与平板计数法、阻抗法、胶体金试纸条法以及PCR方法相比较,检测时间明显缩短[14-17,30],有望满足食品安全领域中大肠杆菌O157:H7快速检测的需求。
流式分析技术对样品溶液有比较严格的要求,任何与待测目标颗粒直径相近的杂质颗粒都会影响检测结果。牛乳的成分十分复杂,前处理方法难以完全消除牛乳中的杂质成分。所以使用流式分析仪检测牛乳中大肠杆菌O157:H7,当浓度接近103CFU/mL时,检测结果偏差较大且重复性差(相对标准偏差为46.40%)。实际牛乳加工过程中要求大肠杆菌O157:H7不得检出,而流式检测方法有一定的检测下限,所以目前方法应用于实际牛乳检测尚有一定的困难。本研究在牛乳中大肠杆菌O157:H7的快速定量检测中做了有益尝试,同时,在今后的工作中不断优化细菌的富集方法,进一步提升该方法的灵敏度,推动该方法在实际检测样品中的应用。
综上所述,本研究成功建立起一种新的大肠杆菌O157:H7的检测方法,并且一定浓度范围内可替代平板培养法,有望满足牛乳中大肠杆菌O157:H7快速定量检测的需要。相信随着方法的不断优化和成熟,再配上效果良好的细菌富集技术,其有望实现对食源性致病菌的快速筛查和监控,降低食源性疾病的感染几率。
参考文献:
[1] 程长林, 任爱胜, 陈林. 中国牛奶市场供需关系及预测分析-基于局部均衡模型[J]. 干旱区资源与环境, 2017, 31(4): 9-15.DOI:10.13448/j.cnki.jalre.2017.103.
[2] 张雅君, 安颖, 靳烨, 等. 乳制品中大肠菌群的鉴定与分类[J]. 农产品加工: 学刊, 2010(8): 45-48.
[3] GIACOMETTI F, BONILAURI P, SERRAINO A, et al. Four-year monitoring of foodborne pathogens in raw milk sold by vending machines in Italy[J]. Journal of Food Protection, 2013, 76(11): 1902-1907. DOI:10.4315/0362-028X.JFP-13-213.
[4] 张晓梅. 鲜牛奶中细菌的分离纯化及其药物敏感性分析[J]. 饲料工业, 2012(5): 26-30.
[5] OLIVER S P, JAYARAO B M, ALMEIDA R A. Foodborne pathogens in milk and the dairy farm environment: food safety and public health implications[J]. Foodborne Pathogens and Disease, 2005, 2(2):115-129. DOI:10.1089/fpd.2005.2.115.
[6] 海岩. 内蒙地区奶牛环境性乳房炎主要病原菌的分离鉴定及克雷伯氏菌的基因分型[D]. 呼和浩特: 内蒙古农业大学, 2007: 30-31.
[7] 解泉源, 赖卫华, 刘春梅, 等. 大肠杆菌O157:H7荧光微球免疫层析试纸条的研制[J]. 食品科学, 2013, 34(16): 353-357. DOI:10.7506/spkx1002-6630-201316072.
[8] 李浩林, 刘箐, 刘芳, 等. 基于可视化抗体宏阵列技术的出血性大肠杆菌O157:H7定量检测[J]. 食品科学, 2014, 35(20): 185-191.DOI:10.7506/spkx1002-6630-201420037.
[9] 冯可, 胡文忠, 姜爱丽, 等. 鲜切哈密瓜中三种食源性致病菌多重PCR检测方法的建立[J]. 食品科学, 2017, 38(6): 295-302.DOI:10.7506/spkx1002-6630-201706046.
[10] 程慧芳, 寇亚楠, 陈雅君, 等. 牛源大肠杆菌O157:H7的分离鉴定及其生物学特性研究[J]. 中国人兽共患病学报, 2014(10): 1002-1008.
[11] ISLAM M Z, MUSEKIWA A, ISLAM K, et al. Regional variation in the prevalence of E. coli O157 in cattle: a meta-analysis and metaregression[J]. PLoS ONE, 2014, 9(4): e93299. DOI:10.1371/journal.pone.0093299.
[12] ERIKSSON E, ASPAN A, GUNNARSSON A, et al. Prevalence of verotoxin-producing Escherichia coli (VTEC) O157 in swedish dairy herds[J]. Epidemiology and Infection, 2005, 133(2): 349-358.
[13] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品卫生微生物学检验 大肠埃希氏菌O157:H7/NM检验: GB 4789.36—2016[S]. 北京: 中国标准出版社, 2016.
[14] 杜寒春, 叶开富, 刘绍刚, 等. 电阻抗法快速测定巴氏杀菌牛乳中菌落总数[J]. 中国乳品工业, 2017(4): 56-58; 61.
[15] 王文彬. 乳及乳制品中主要食源性致病菌的免疫快速检测方法研究[D]. 无锡: 江南大学, 2017: 15-35.
[16] 盖冬雪. 巴氏杀菌乳中细菌PMA-PCR活菌检测方法的建立[C]//中国畜牧兽医学会兽医公共卫生学分会第五次学术研讨会论文集.北京: 中国畜牧兽医学会兽医公共卫生学分会, 2016: 2.
[17] 张微, 姚笛, 侯婷婷, 等. 乳中大肠杆菌O157:H7的荧光定量PCR检测方法的建立[J]. 中国乳品工业, 2015(7): 52-54.
[18] RIU J C, RIU N. Flow cytometry applications in the food industry[J].Journal of Industrial Microbiology & Biotechnology, 2009, 36: 999-1011. DOI:10.1007/s10295-009-0608-x.
[19] 刘道亮, 赵占民, 胡连霞, 等. 应用流式细胞技术快速检测液态商品中的细菌总数[J]. 食品科学, 2011, 32(2): 157-163.
[20] PINDER A C, MCCLELLAND R G. Rapid assay for pathogenic Salmonella organisms by immunofluorescence flow cytometry[J].Journal of Microscopy, 1994, 176(1): 17-22.
[21] HE S B, HONG X Y, HUANG T X, et al. Rapid quantification of live/dead lactic acid bacteria in probiotic products using high-sensitivity flow cytometry[J]. Methods and Applications in Fluorescence, 2017,5(2): 024002. DOI:10.1088/2050-6120/aa64e4.
[22] YAMAGUCHI N, SASADA M, YAMANAKA M, et al. Rapid detection of respiring Escherichia coli O157:H7 in apple juice, milk,and ground beef by flow cytometry[J]. Cytometry Part A, 2003, 54(1):27-35.
[23] 张雅娟, 俞洁, 张冬未, 等. 异硫氰酸荧光素标记尿激酶的制备与性能研究[J]. 宁波大学学报(理工版), 2016(3): 78-82.
[24] 王宁. 流式细胞术检测牛乳中大肠杆菌数及细菌总数的研究[D].哈尔滨: 东北农业大学, 2007.
[25] OZAWA S, OKABE S, ISHII S. Specific single-cell isolation of Escherichia coli O157 from environmental water samples by using flow cytometry and fluorescence-activated cell sorting[J]. Foodborne Pathogens and Disease, 2016, 13(8): 456-461. DOI:10.1089/fpd.2016.2125.
[26] 卫生部. 食品微生物学检验 大肠埃希氏菌计数: GB 4789.38—2012[S]. 北京: 中国标准出版社, 2012: 5-6.
[27] TANAKA Y, YAMAGUCHI N, NASU M. Viability of Escherichia coli O157:H7 in natural river water determined by the use of flow cytometry[J]. Journal of Applied Microbiology, 2000, 88(2): 228-236.
[28] 杨莉婷, 何丽, 何海宁, 等. 流式细胞术对生乳中微生物检测的应用研究[J]. 广西师范大学学报(自然科学版), 2017(2): 112-116.DOI:10.16088/j.issn.1001-6600.2017.02.017.
[29] WILLIAMS A J, COOPER W M, RAMSAROOP S, et al. Rapid flow cytometry detection of a single viable Escherichia coli O157:H7 cell in raw spinach using a simplified sample preparation technique[J].Frontiers in Microbiology, 2017, 8: 1493.
[30] 胡慧, 陈雅君, 段志刚, 等. 大肠杆菌O157:H7特异基因的实时荧光定量PCR检测[J]. 食品科学, 2011, 32(12): 278-282.

 大肠杆菌O157:H7 CICC 21530 是大肠杆菌 CMCC 44102 否大肠杆菌K12 ATCC 10798 否金黄色葡萄球菌 ATCC 6385P 否阴沟肠杆菌 ATCC 13047 否弗氏柠檬酸杆菌 ATCC 43864 否
大肠杆菌O157:H7 CICC 21530 是大肠杆菌 CMCC 44102 否大肠杆菌K12 ATCC 10798 否金黄色葡萄球菌 ATCC 6385P 否阴沟肠杆菌 ATCC 13047 否弗氏柠檬酸杆菌 ATCC 43864 否 1.51×10
1.51×10