多氯联苯(polychlorinated biphenyls,PCBs)又称氯化联苯,是联苯在不同程度上氯原子取代的合成品,是一种广泛存在的环境污染物,在环境中的分解速率缓慢且可以通过食物链富集,是一类典型的持久性有机污染物[1-2]。PCBs由于其化学性质稳定、电导率低、导热性好、不易燃等性质,曾被广泛应用于电力、油漆、塑料、化工等行业,直到1968年日本的“米糠油”事件引起人们对PCBs环境污染问题的关注,PCBs因其高毒性、环境持久性、生物蓄积性及挥发迁移性等特点[3],给人体健康和生态系统造成潜在的威胁,才逐渐禁止生产及应用。PCBs具有致癌、致畸、致突变的“三致”作用[4],由于其难溶于水、易溶于脂肪和有机溶剂,且性质稳定,难分解,会在生物体内富集,可通过食物链放大逐级传递,危害人类及动物的健康。目前在水质、土壤、大气、动植物等介质中均发现PCBs污染[5]。膳食暴露是PCBs进入人体的主要渠道,Xing Guanhua等[6-8]研究表明,由于PCBs的亲脂性,蔬菜中PCBs残留量远低于肉类,但叶类蔬菜的生物可利用度为却远高于肉类(蔬菜可利用度为25%,肉类仅为3%)。目前仅GB 2762—2017《食品中污染物限量》中明确了水产动物及其制品中PCBs限量要求,最大限量为0.5 mg/kg,但没有蔬菜中PCBs的相关限量,且现行的国家标准、地方标准以及行业标准中涉及的多为动物源性食品及环境介质,没有关于蔬菜中PCBs残留量测定的标准。因此,蔬菜类等非动物源性食品的PCBs残留检测也应引起足够的重视。
目前关于PCBs的研究主要集中在环境中的土壤、水体、大气以及食品中的水产品等基质,测定方法主要有气相色谱法[9-14]、气相色谱-质谱法[15-19]、气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)法[20-24]和高效液相色谱法[25]等。而PCBs由于氯原子在联苯上的取代位置不同,同一分子式下具有多种同分异构体,而大多数的同分异构体均具有相似的化学性质,单纯地利用GC法或高效液相色谱法进行分离测定很容易出现假阳性的结果。MS/MS是指质量分离的质谱检测技术,具有组分分离、结构解析同步完成的特点,可以直接分析混合组分,有高度的选择性和可靠性[26]。多级质谱比单级质谱具有更高的灵敏度,MS/MS常用于复杂样品的痕量分析。艾连锋等[27]用快速溶剂萃取-固相萃取柱净化结合GC-MS/MS测定牛奶中的PCBs及多环芳烃,方法定量下限为1.0 ng/g。郑群雄等[28]使用索氏提取,浓硫酸结合Florisil固相萃取柱净化,GC-MS/MS方法测定蔬菜中19 种PCBs,方法检出限为0.04~0.43 μg/kg。崔立迁等[29]使用正己烷-丙酮提取,浓硫酸结合硅胶柱净化后,经GC-MS/MS测定艾叶中19 种有机溶剂和PCBs残留。这些前处理方法繁琐、溶剂使用量大、处理时间长,特别是使用硅胶柱净化,不利于大批量的样品检测。QuEChERS[30](quick, easy,cheap, effective, rugged and safe)具有快速、简单、廉价、有效、可靠及安全等特点,广泛应用于蔬菜、谷物等基质中多种农药残留的样品前处理。目前王彬[31]使用QuEChERS结合GC法测定鱼肉中的PCBs;蔡小虎等[32]使用QuEChERS-GC/电子捕获检测器法分析土壤和沉积物中残留有机氯农药和PCBs,鲜见使用QuEChERS结合GC-MS/MS法进行测定蔬菜中PCBs残留量研究的相关文献报道。因此,采用QuEChERS对样品进行前处理,利用GC-MS/MS法分别得到PCBs的一、二级质谱图以及相对应的母离子、子离子,建立测定蔬菜中PCBs残留量的方法。
1 材料与方法
1.1 材料与试剂
菜心、上海青、生姜、西红柿、生菜等蔬菜样品来自国内市场。
乙腈、乙酸乙酯、正己烷(均为色谱纯)、无水硫酸镁、无水硫酸钠(分析纯,使用前在650 ℃马弗炉内灼烧4 h) 飞世尔实验器材(上海)公司;丙酮(色谱纯) 美国霍尼韦尔公司;二氯甲烷、乙酸(分析纯)广州化学试剂公司;异辛烷(分析纯) 上海凌峰化学试剂有限公司;乙二胺-N-丙基硅烷(primary secondary amine,PSA)、十八烷基硅烷键合硅胶(ostadecylsilane,C18)、石墨化炭黑(graphitized carbon black,GCB)、中性氧化铝、QuEChERS提取包(含4 g硫酸镁,1 g氯化钠,0.5 g柠檬酸氢二钠,1 g柠檬酸钠)德国CNW公司;35 种PCBs和PCB101-D3标准品(纯度>95.0%) 德国Dr. Ehrenstorfer公司。
1.2 仪器与设备
TSQ 8000 Evo GC-MS/MS(配Xcalibur数据处理系统)、ST 40R离心机 美国Thermo公司;MS3 basic旋涡混合器 德国IKA公司;Turbo Vap LV型氮吹仪美国Zymark公司;MMV-1000W分液漏斗振动器 上海爱朗公司;Milli-Q超纯水器 美国Millipore公司;GM200捣磨仪 德国Retsch公司。
1.3 方法
1.3.1 标准溶液的配制
PCBs标准储备液:准确称取各PCBs标准品适量,用正己烷配制成200 μg/mL的标准储备液,-18 ℃冰箱保存6 个月。
PCBs标准工作液:准确量取各PCBs标准储备液1 mL,用正己烷配制成2 μg/mL的混合标准工作液,-18 ℃冰箱保存3 个月。
PCB101-D3标准工作液(内标):准确称取各PCB101-D3标准品适量,用正己烷配制成200 μg/mL的标准储备液,-18 ℃冰箱保存6 个月。量取1 mL标准储备液,用正己烷配制成10 μg/mL的标准工作液,作为内标使用,-18 ℃冰箱保存3 个月。
混合标准工作系列溶液:准确量取PCBs混合标准工作液0.005、0.01、0.025、0.05、0.1、0.25、0.5 mL,用正己烷稀释,加入0.01 mL内标,配制成混合标准系列工作溶液。
1.3.2 GC-MS/MS测定
1.3.2.1 GC条件
色谱柱:TR-Pesticide(30 m×0.25 mm,0.25 μm);进样方式:不分流进样,流量:60 mL/min,不分流时间:1 min;流速:1.3 mL/min,进样体积:1 μL;进样口温度:280 ℃;升温程序:初始温度100 ℃,保持2 min,以30 ℃/min升到200 ℃,以3 ℃/min升到265 ℃,以20 ℃/min升到310 ℃。
1.3.2.2 MS条件
表1 35 种PCBs的选择反应监测模式分析参数
Table 1 Parameters in selected reaction monitoring mode for 35 PCBs
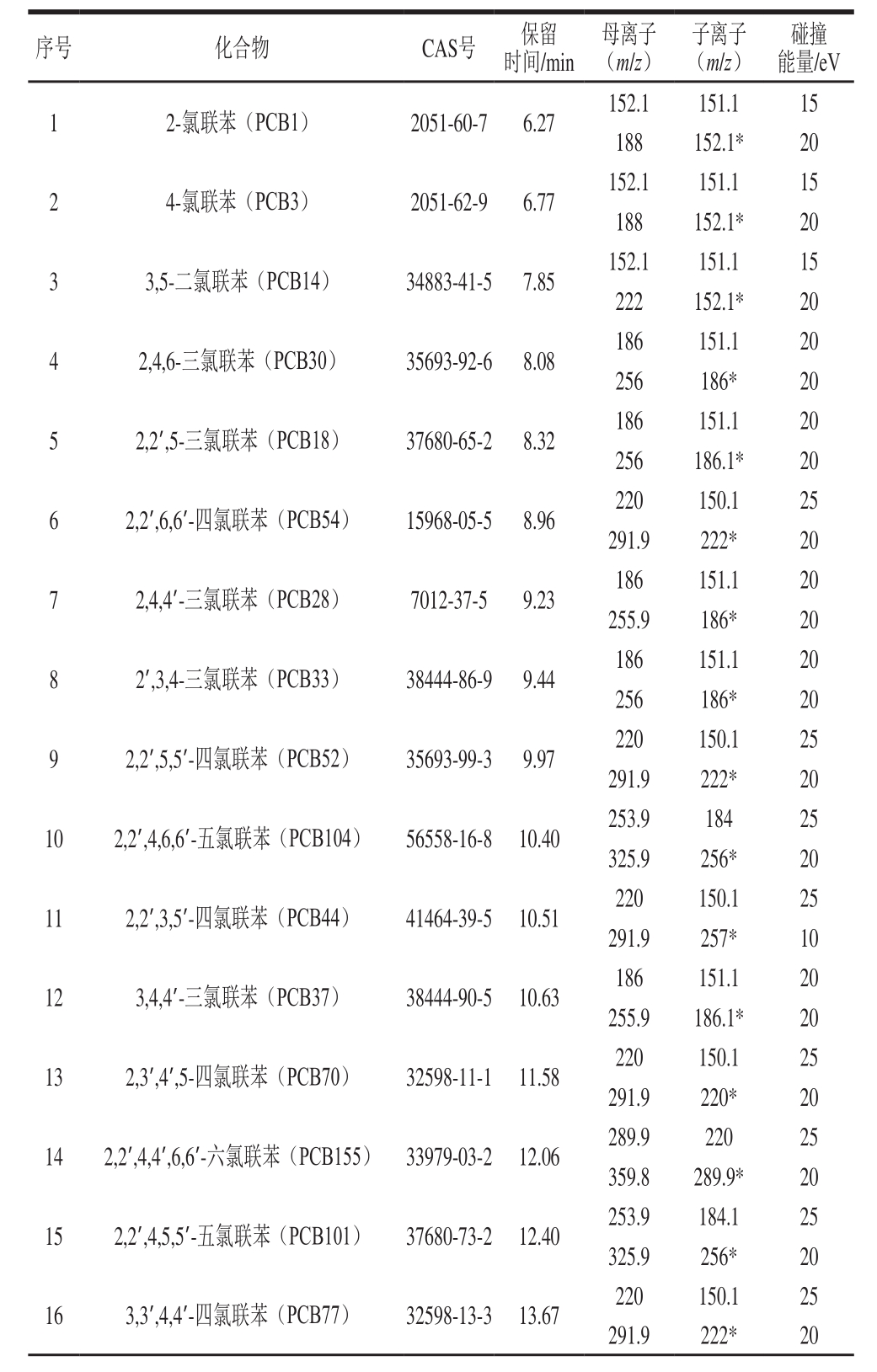
续表1

注:*.定量离子;※.内标物。

图1 35 种PCBs在选择反应监测模式下的总离子流图
Fig. 1 Total ion chromatogram for 35 PCBs in selected reaction monitoring mode
方法类型:Acquistion-Timed;电离源:电子电离源;电离电压:70 eV;离子源温度:300 ℃,传输线温度:300 ℃;溶剂延迟时间:5 min;扫描模式:选择反应监测模式,其具体参数见表1,总离子流图见图1。定量方法:峰面积内标法定量。
1.3.3 样品预处理
1.3.3.1 QuEChERS提取
取适量样品于捣磨仪中粉碎,准确称取10 g样品于50 mL离心管中,加入40 μL内标标准工作液,涡旋,静置;加入20 mL乙酸乙酯,涡旋30 s,再加入QuEChERS提取包,涡旋1 min,振荡提取10 min,然后以4 500 r/min离心5 min,吸取10 mL上清液于45 ℃氮吹浓缩定容至2 mL,加入500 mg无水硫酸镁、100 mg PSA、50 mg GCB,涡旋1 min,4 500 r/min离心5 min,吸取全部上清液,12 000 r/min离心5 min,取上清液供GC-MS/MS分析。
1.3.3.2 固相萃取
取适量样品于捣磨仪中粉碎,准确称取10 g样品,加入40 μL内标标准工作液,涡旋,静置;加入20 mL乙酸乙酯,涡旋30 s,再加入10 g无水硫酸钠,涡旋1 min,振荡提取10 min,然后以4 500 r/min离心5 min,吸取10 mL上清液于已用乙酸乙酯活化好的萃取小柱中净化,净化液于45 ℃氮吹浓缩定容至2 mL,12 000 r/min离心5 min,取上清液供GC-MS/MS分析。
1.3.4 提取方法
1.3.4.1 不同基质对各组分响应值的影响
选择空白样品菜心和生姜,按1.3.3.1节QuEChERS方法进行提取,将所得的定容溶液与乙酸乙酯分别用于稀释1.3.1节标准工作液,并配制成各组分质量浓度为100 ng/mL基质标准溶液和溶剂标准溶液,考察不同基质对各组分响应值的影响。响应值以基质效应表示,考察基质效应与1的关系,基质效应越接近1,则基质对PCBs响应值的影响越小;当基质效应小于1时,基质对PCBs的响应起抑制作用,且基质效应数值越小,抑制作用越大,反之,则起增强作用。基质效应按下式进行计算:
式中:A为基质标准工作液中PCBs峰面积的响应值;B为溶剂标准工作液中PCBs峰面积的响应值。
1.3.4.2 不同溶剂对各组分响应值的影响
由于不同溶剂可提取的目标物及提取效果不同,按1.3.3.1节进行QuEChERS提取,考察正己烷、正己烷-丙酮(1∶1,V/V)、丙酮、二氯甲烷、1%乙酸化乙腈、乙酸乙酯、异辛烷7 种不同提取溶剂对蔬菜中35 种待测物的提取效率。
1.3.4.3 不同净化剂对各组分响应值的影响
蔬菜中的色素、有机酸、碳水化合物等的净化程度会影响样品的回收率。目前QuEChERS方法的净化剂有GCB、C18吸附剂、PSA、中性氧化铝等,GCB主要除去蔬菜中的色素,PSA为正相硅胶键合吸附剂,可以吸附蔬菜中的碳水化合物、有机酸及少量色素,C18是反向硅胶键合吸附剂,可以吸附溶液中弱极性的干扰物如脂肪、多环芳烃等,中性氧化铝表面呈中性,容易保留杂环类(含氮、磷、硫基)、芳香烃和有机胺等富电化合物。选取GCB、C18、PSA、中性氧化铝作为净化剂,按1.3.3.1节进行QuEChERS提取,考察不同吸附剂组合A(100 mg PSA-50 mg GCB)、B(100 mg C18-50 mg GCB)、C(100 mg中性氧化铝-50 mg GCB)、D(100 mg PSA-50 mg中性氧化铝)和E(100 mg PSA-50 mg C18)对蔬菜的净化效果。
1.3.4.4 净化剂不同配比对各组分响应值的影响
同一净化剂组合,不同配比对净化的效果及目标物的回收率有不同影响。在1.3.4.3节的基础上,通过改变单一变量,即固定GCB用量为50 mg,改变PSA用量分别为0、50、100、150、200 mg;固定PSA用量为100 mg,改变GCB用量分别为0、25、50、75、100 mg进行考察,优化净化剂配比。
1.3.4.5 空白样品基质标准曲线的配制
取空白蔬菜样品,按1.3.3.1节进行提取,将所取得的基质溶液配制成内标质量浓度为100 μg/L,各组分质量浓度分别为10、20、50、100、200、500、1 000 μg/L的标准工作曲线,供GC-MS/MS检测。与此同时,取空白生菜、西红柿、生姜3 种空白样品,同时添加35 种PCBs混合标准溶液及内标物PCB101-D3,设定0.01、0.02、0.1 mg/kg三个添加水平,每个水平设置6 个平行样,按1.3.3.1节方法进行实验。
2 结果与分析
2.1 基质效应的影响结果
表2 2 种不同基质对PCBs的基质效应
Table 2 Matrix effect in determination of PCBs in two vegetable matrices

续表2
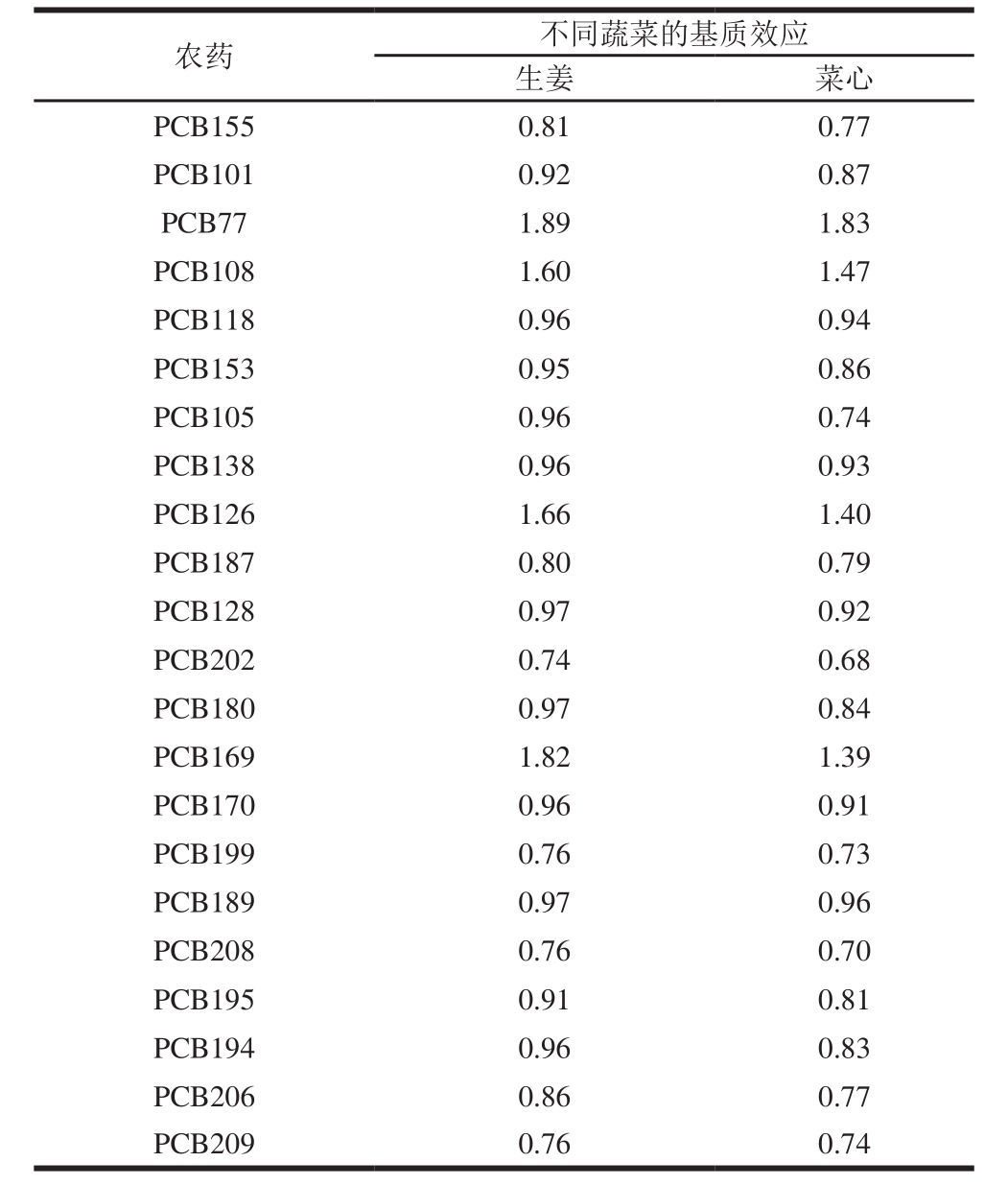
由表2可知,基质对35 种PCBs的大多数化合物起抑制作用,小部分起增强作用,不同基质之间的基质效应虽然有差别,但差别不大,且同种化合物间基质效应为同向。因此,为保证实验数据的真实、准确,采用空白基质配制标准工作液进行测定。
2.2 提取结果

图2 2 种提取方法对回收率的影响
Fig. 2 Influence of extraction methods on recovery
由图2可见,QuEChERS方法中各化合物回收率为83.1%~142.7%,而采用固相萃取作为提取方法时,PCB3、PCB14、PCB37、PCB126、PCB169等化合物未检出。因此,选择QuEChERS提取作为本实验的前处理方法。
2.3 提取溶剂的选择结果
实验结果表明,以丙酮、正己烷、异辛烷、1%乙酸化乙腈作为提取溶剂时,除目标物PCB126、PCB169的回收率低于50%外,其余目标物的平均回收率为69%~148%;采用正己烷-丙酮(1∶1,V/V)、二氯甲烷、乙酸乙酯提取时,其平均回收率为85%~130%,提取效果较好。但目前关于PCBs的提取溶剂大多为正己烷-丙酮(1∶1,V/V),鲜见以乙酸乙酯为提取溶剂的文献报道,且考虑到二氯甲烷的毒性较大,因此,本实验选用乙酸乙酯作为提取溶剂。
2.4 净化剂的优化结果
实验结果表明,组合B、C、D、E中各化合物组分的回收率为43%~157%,其中经组合D和E净化后的上机溶液颜色很深,不利于进样针、衬管、色谱柱的使用寿命;组合A各化合物的回收率为66%~122%,相对组合B、C、D、E而言,结果较为理想,因此,选用组合A(100 mg PSA-50 mg GCB)作为实验的净化剂组合。
2.5 样品净化的优化结果

图3 单一变量PSA对回收率的影响
Fig. 3 Influence of single variable PSA on recovery

图4 单一变量GCB对回收率的影响
Fig. 4 Influence of single variable GCB on recovery
去除有机酸、色素、碳水化合物等的干扰是蔬菜样品检测中的主要环节。按1.3.4.4节方法优化,结果见图3、4(选取部分有代表性化合物进行制图)。结果表明,单独改变PSA的量,大部分化合物回收率随PSA用量的增加而增加,PCB77、PCB126、PCB169随着PSA用量的增加,其回收率先增加后减小,当PSA用量为100 mg时,各组分都能得到较理想的回收;单独改变GCB用量对大部分化合物回收率的影响不大,PCB77、PCB126、PCB169的回收率随着GCB用量的增加而减少,但当GCB用量小于50 mg时,净化后的样品效果差,存在大量的色素杂质,衬管的耗损大,影响色谱柱的使用寿命,GCB用量为50 mg时,各化合物的回收率可达70%以上。通过对PSA、GCB使用量的优化,选择100 mg PSA、50 mg GCB作为蔬菜检测的净化剂。
2.6 方法线性范围及方法检出限
以化合物定量离子峰面积与内标峰面积之比Y为纵坐标,质量浓度X(μg/L)为横坐标绘制标准曲线,以3 倍信噪比确定各目标物的方法检出限,其线性范围、线性方程、相关系数及方法检出限见表3。
表3 35 种PCBs的线性范围、线性方程、相关系数、方法检出限
Table 3 Linear ranges, linear equations, correlation coefficients, and LODs for 35 PCBs

2.7 回收率与精密度实验结果
由表4可知,35 种PCBs的平均回收率为72.3%~119.0%,相对标准偏差为0.4%~9.8%。
表4 回收率及精密度实验结果(n=6)
Table 4 Recovery and precision of the method (n= 6)

续表4

2.8 实际样品分析结果
为考察本方法的实用性,选取菜心、西红柿、生菜、麦菜、芥蓝和生姜6 类蔬菜各10 批,共60 批样品,采用本方法进行分析。由表5可知,在该60 批样品中,采集于电镀厂附近的菜心、生菜、麦菜和芥蓝的蔬菜样品中均检出PCBs,其余样品均未检出。结果表明,电镀厂附近的土壤已被污染;同时样品中低氯代的PCBs相对含量较大,其原因主要为低氯代的PCBs挥发迁移性和生物积累性。其中,菜心检出样品的总离子流图见图5。
表5 实际样品中PCBs的残留检测结果
Table 5 Residues of PCBs in real samples

注:ND.未检出。
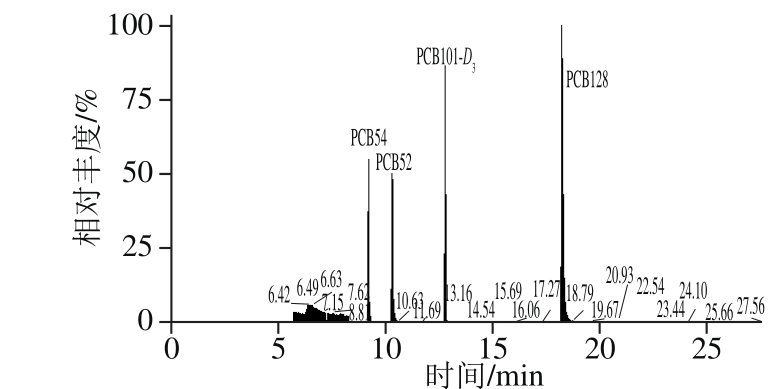
图5 菜心样品检出农药总离子流图
Fig. 5 Total ion current chromatogram for PCB residues in flowering cabbage
3 结 论
建立QuEChERS-GC-MS/MS法测定蔬菜中35 种PCBs残留量的分析方法。采用乙酸乙酯为提取溶剂,QuEChERS净化处理,空白基质匹配标准溶液内标法定量,方法简单、快速、灵敏度高,适用于不同种类蔬菜中PCBs确证和定量分析。
参考文献:
[1] 胡华, 王政华. 多氯联苯类污染物对人类健康的影响[J]. 长沙民政职业技术学院学报, 2007, 14(1): 121-126. DOI:10.3969/j.issn.1671-5136.2007.01.041.
[2] YANG Z P, LU W X, LONG Y Q, et al. Assessment of heavy metals contamination in urban topsoil from Changchun city, China[J]. Journal of Geochemical Exploration, 2011, 108(1): 27-38. DOI:10.1016/j.gexplo.2010.09.006.
[3] JIANG Y F, WANG X T, ZHU K, et al. Polychlorinated biphenyls contamination in urban soil of Shanghai: level, compositional profiles and source identification[J]. Chemosphere, 2011, 83(6): 767-773.DOI:10.1016/j.chemosphere.2011.02.077.
[4] 王飞. 持久性有机污染物多氯联苯(PCBs)的研究进展[J]. 科技资讯,2015, 11(20): 139-141; 143. DOI:10.3969/j.issn.1672-3791.2015.20.072.
[5] 郭莉, 汪亚林, 李成, 等. 电子电器废弃物拆解区蔬菜多氯联苯污染及其健康风险[J]. 科学通报, 2017, 62(7): 674-684.
[6] XING G H, YANG Y, CHAN J K Y, et al. Bioaccessibility of PCBs in different foods using an in vitro digestion method[J].Environmental Pollution, 2008, 156(3): 1218-1226. DOI:10.1016/j.envpol.2008.03.020.
[7] JOHN R D, RENLI M. Approaches to assess the oral bioaccessibility of persistent organic pollutants: a article review[J]. Chemosphere,2007, 68(8): 1399-1407. DOI:10.1016/j.chemosphere.2007.03.054.
[8] WANG H S, ZHAO Y G, MAN Y B, et al. Oral bioaccessibility and human risk assessment of organocglorime pesticides (OCPs) via fish consumption, using an in vitro gastrointestinal mode[J]. Food Chemistry,2011, 127(4): 1673-1679. DOI:10.1016/j.foodchem.2011.02.035.
[9] 胡恩宇, 杨丽莉, 王美飞, 等. 气相色谱法同时测定水产品中28种多氯联苯单体[J]. 环境检测管理与技术, 2010, 22(1): 44-48.DOI:10.3969/jissn.1006.2009.2010.01.012.
[10] HERRERA A, PÉREZ-ARQUILLUÉ C, CONCHELLO P, et al.Determination of pesticides and PCBs in honey by solid-phase extraction cleanup followde by gas chromatography with electroncapture and nitrogen-phosphorus detection[J]. Analytical and Bioanalytical Chemistry, 2005, 381(3): 695-701. DOI:10.1007/s00216-004-2924-3.
[11] 胡红美, 郭远明, 郝青, 等. 超声波萃取-PSA净化-GC-ECD法测定鲍鱼不同组织中的多氯联苯[J]. 分析化学, 2016, 44(1): 88-94.DOI:10.11895/j.issn.0253-3820.150544.
[12] 胡红美, 郭远明, 孙秀梅, 等. 超声波萃取-分散固相萃取净化-气相色谱电子捕获法测定土壤或底泥中的多氯联苯[J]. 中国食品学报,2014, 14(4): 198-203. DOI:10.11895/j.issn.0253-3820.150544.
[13] 柯常亮, 刘奇, 王许诺, 等. 气相色谱法同时测定水产品中28 种多氯联苯同系物[J]. 食品发酵与工业, 2015, 41(7): 155-159.DOI:10.13995/j.cnki.11-1802/ts.201507028.
[14] STOKER C, ZAYAS M A, FERREIRA M A, et al. The eggshell features and clutch viability of the broad-snouted caiman (Caiman latirostris) are accociated with the egg burden of organochlorine compounds[J]. Ecotoxicology and Environmental Safety, 2013, 98(3):191-195. DOI:10.1016/j.ecoenv.2013.08.22.
[15] 吉仙枝. 气相色谱-质谱联用法测定食品中的多氯联苯技术研究[D].杨凌: 西北农林科技大学, 2013: 5-11.
[16] 张潜, 余辉菊, 王炼, 等. 饮水中16 种多环芳烃和6 种多氯联苯的固相微萃取-气相色谱-三重四极杆质谱同时测定法[J]. 环境与健康杂志, 2014, 31(2): 173-176.
[17] 姚銘栋, 王余萍, 王冬梅. 饮用水中多氯联苯的全自动固相萃取-气相色谱-三重四极杆质谱测定法[J]. 职业与健康, 2015, 31(19): 2634-2636.
[18] 邓敏军, 罗艳, 邓超冰. 固相萃取-气相色谱-质谱法测定水中的19种多氯联苯[J]. 光谱实验室, 2012, 29(2): 947-950. DOI:10.3969/j.issn.1004-9138.2012.02.070.
[19] 傅胜武, 林麒, 吕华东, 等. 加速溶剂萃取-气相色谱质谱联用法测定食品中指示性多氯联苯的研究[J]. 中国卫生检验杂志, 2006, 16(9):1025-1028. DOI:10.3969/j.issn.1004.8685.2006.09.001.
[20] 佟玲, 杨佳佳, 吴淑琪. 气相色谱-串联质谱法测定植物样品中17 种有机氯农药和8 种多氯联苯[J]. 农药学学报, 2012, 14(2): 185-190.DOI:10.3969/j.issn.1008-7303.2012.02.11.
[21] 田福林, 刘成雁, 王志嘉, 等. 气相色谱-串联质谱法测定土壤中多环芳烃和多氯联苯[J]. 分析科学学报, 2017, 33(2): 212-216.DOI:10.13526/j.issn.1006-6144.2017.02.012.
[22] 周蓓蕾, 赵玲, 沈燕, 等. 气相色谱-串联质谱法测定虾体中18 种多氯联苯[J]. 农药学学报, 2017, 19(2): 223-230. DOI:10.16801/j.issn1008-7303.2017.0030.
[23] 吴岩, 张辛博, 刘永, 等. 凝胶渗透色谱-气相色谱-串联质谱法测定血清中7 种多氯联苯残留量[J]. 中国卫生检验杂志, 2012, 22(3): 478-481.
[24] MOHEBBI-NOZAR S L, ISMAIL W R, ZAKARIA M P. Distribution,sources identification, and ecological risk of PAHs and PCBs in coastal surface sediments from the northern Persian gulf[J]. Human and Ecological Risk Assessment, 2014, 20(6): 1507-1520. DOI:10.1080/10 807039.2014.884410.
[25] 李志英, 杜新贞, 饶红红, 等. 介孔材料固相微萃取-高效液相色谱联用测定黄河底泥中的多氯联苯[C]. 兰州: 西北地区第六届色谱学术报告会甘肃省第十一届色谱年会, 2010.
[26] 史永富, 蔡友琼, 于慧娟, 等. 气相色谱串联质谱法用于水产品中多氯联苯二代污染物鉴别[J]. 分析化学研究报告, 2014, 42(11): 1640-1645. DOI:10.11895/j.issn.0253-3820.140346.
[27] 艾连锋, 李玮, 王敬, 等. 气相色谱-串联质谱法测定牛奶中多氯联苯及多环芳烃[J]. 分析测试学报, 2015, 34(5): 570-575. DOI:10.3969/j.issn.1004-4957.2015.05.012.
[28] 郑群雄, 徐小强, 刘清辉, 等. 气相色谱-质谱法检测蔬菜中19 种多氯联苯[J]. 中国食品学报, 2012, 12(2): 151-158. DOI:10.3969/j.issn.1009-7848.2012.02.023.
[29] 崔立迁, 王欣, 崔进, 等. 气相色谱-质谱联用测定艾叶中持久性有机污染物[J]. 分析科学学报, 2016, 32(1): 111-115. DOI:10.13426/j.issn.1006-6144.2016.01.023.
[30] STEVEN J. Quick, easy, cheap, eあective, rugged, and safe approach for determining pesticide residues[M]//Pestcide Protacols, OAI, 2005:239-261. DOI:10.1385/1-59259-929-X:239.
[31] 王彬. QuEChERS-气相色谱法鱼肉中多氯联苯残留分析方法的研究[J]. 工程与技术, 2016, 40(14): 107-111. DOI:10.16736/j.cnki.cn41-1434/ts.2016.14.040.
[32] 蔡小虎, 蔡述伟, 时磊, 等. QuEChERS-GC/ECD法分析土壤和沉积物中残留有机氯农药和多氯联苯[J]. 环境监控与预警, 2016, 8(3):14-17. DOI:10.3969/j.issn.1674-6732.2016.03.004.
 PCB1 0.63 0.62 PCB3 1.65 1.45 PCB14 1.74 1.62 PCB30 1.26 1.16 PCB18 0.98 0.99 PCB54 0.85 0.80 PCB28 1.93 1.86 PCB33 1.50 1.34 PCB52 0.88 0.81 PCB104 0.81 0.80 PCB44 0.94 0.95 PCB37 1.58 1.24 PCB70 0.84 0.89
PCB1 0.63 0.62 PCB3 1.65 1.45 PCB14 1.74 1.62 PCB30 1.26 1.16 PCB18 0.98 0.99 PCB54 0.85 0.80 PCB28 1.93 1.86 PCB33 1.50 1.34 PCB52 0.88 0.81 PCB104 0.81 0.80 PCB44 0.94 0.95 PCB37 1.58 1.24 PCB70 0.84 0.89