蛋白质糖基化即还原糖和蛋白质中氨基酸残基的游离氨基发生的非酶促褐变反应,该反应过程中生成一系列的晚期糖基化终产物(advanced glycation end products,AGEs)[1]。AGEs的形成涉及到复杂的连续和平行反应,它形成的具体机制存在多条路径,产物复杂,存在争议,一直是研究的热点[2-3]。食源性的AGEs明显地增加了生物体内总AGEs的含量[4-5]。研究发现通过饮食摄入含量超过10%的AGEs后,有2/3进入生物体组织,其余1/3通过肾脏排出[6]。AGEs在体内蓄积[7-8]会导致多种疾病的发生,如糖尿病、动脉粥样硬化、阿尔兹海默症和慢性心脏衰竭等[9-11]。近年来,很多学者对如何检测和有效抑制食源性和体内产生的AGEs进行了大量研究,由于AGEs结构复杂,种类很多,逐一检测有一定难度,但大多数大分子AGEs具有荧光吸收的特点,目前荧光光谱法因适合对体系荧光性AGEs总量进行检测而被广泛应用[12]。
大豆含有丰富的蛋白质,蛋白质组成主要为7S球蛋白和11S球蛋白,约占蛋白质总含量70%左右。11S球蛋白占大豆总蛋白含量的25%~35%,含有较多的谷氨酸、天冬氨酸残基,少量的组氨酸、色氨酸和胱氨酸[13],并且含有丰富的赖氨酸,赖氨酸含量占总蛋白的10.75%[14]。1999年美国食品药品监督管理局同意在产品标签中标注大豆具有降低胆固醇作用,使得大豆市场得到了更高地增长[15]。由于11S大豆球蛋白溶解性和乳化性能较低,限制其在工业上的应用。目前通过对大豆蛋白进行糖基化改性从而有效改善大豆11S球蛋白的乳化性[16]、溶解性[17]、稳定性[18]、凝胶性[19]等蛋白功能性质,并广泛应用于工业化生产。而在大豆蛋白改性或者含糖大豆食品加工过程中,美拉德反应是否会产生大量的有害大分子交联AGEs,是要关注的重点。齐军茹等[20]通过干热反应采用多糖对大豆蛋白进行改性,且十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)实验证明复合产物中存在美拉德反应产物。但是,目前对其中有害产物AGEs的监测、抑制及有效调控的研究鲜有报道。因此,本研究通过荧光分光光度法、SDS-PAGE、液相色谱-串联质谱(liquid chromatograph-tandem mass spectrometry,LC-MS/MS)等技术,探讨了大豆在高温加工或蛋白改性过程中有害糖产物AGEs的形成及添加黄酮对其抑制机理,提高了大豆食品安全性,具有一定的现实意义。
1 材料与方法
1.1 材料与试剂
大豆11S球蛋白依据文献[21]的方法由低温脱脂大豆粕分离提纯而得;染料木素、木犀草素、芦丁(均为色谱级) 南京广润生物试剂有限公司;槲皮素(色谱级) 美国Sigma Aldrich公司;考马斯亮蓝、丙烯酰胺、N,N,N’,N’-四甲基乙二胺、N,N-甲叉双丙烯酰胺、三羟基氨基甲烷、过硫酸铵、溴酚蓝、SDS、甘氨酸生工生物工程(上海)股份有限公司;β-巯基乙醇、冰醋酸 南京赛吉科技有限公司;大豆油 新加坡益海嘉里集团;葡萄糖、果糖、蔗糖、乳糖、乙酸乙酯、甲醇、乙腈、甲酸(均为分析纯) 上海国药集团化学试剂有限公司。
1.2 仪器与设备
Infinite 200Pro多孔酶标仪 瑞士帝肯贸易有限公司;EPS 300电泳仪 上海天能科技有限公司;凝胶成像仪 美国Bio-Rad公司;LC-MS/MS联用仪 美国安捷伦公司;UV1600紫外-可见分光光度计 北京瑞利分析仪器公司;T18高速匀浆机 德国IKA公司;冷冻干燥机 德国CHRIST公司。
1.3 方法
1.3.1 11S球蛋白糖基化过程中AGEs形成的影响因素
1.3.1.1 糖种类对11S球蛋白糖基化过程中AGEs形成的影响
11S球蛋白和糖均用0.2 mol/L pH 7.2的磷酸盐缓冲液(phosphate buffered saline,PBS)溶解。在样品管中加入11S球蛋白、葡萄糖(或乳糖、果糖、蔗糖)和PBS各2 mL,使11S球蛋白和糖的终质量浓度分别为2 mg/mL和4 mg/mL。混匀后于100 ℃沸水浴中反应0、5、15、30、60、90、120 min,以8 000×g冷冻离心30 min,取上清液测定λex/λem=340 nm/465 nm波长处荧光值。空白组以PBS代替还原糖,所有实验均做3 组平行。
1.3.1.2 糖质量浓度对11S球蛋白糖基化过程中AGEs形成的影响
在样品管中加入11S球蛋白、不同质量浓度的葡萄糖和PBS各2 mL,使体系中11S球蛋白的终质量浓度为2 mg/mL,葡萄糖的终质量浓度分别为2、4、6、8 mg/mL,后续操作同1.3.1.1节。
1.3.1.3 反应温度对11S球蛋白糖基化过程中AGEs形成的影响
在样品管中加入11S球蛋白、葡萄糖和PBS各2 mL,使11S球蛋白和葡萄糖的终质量浓度分别为2 mg/mL和4 mg/mL,分别于60 ℃水浴锅、100 ℃沸水浴、121 ℃油浴锅中反应,后续操作同1.3.1.1节。
1.3.1.4 pH值对11S球蛋白糖基化过程中AGEs形成的影响
分别用pH 6.5、7.2、9.2,浓度为0.2 mol/L的PBS溶解11S球蛋白和葡萄糖。反应体系及其他操作同1.3.1.3节。
1.3.1.5 黄酮类化合物对11S球蛋白糖基化过程中AGEs形成的影响
在1.3.1.3节体系中,分别加入槲皮素、木犀草素、染料木素、芦丁,使其终浓度分别为0.05、0.10、0.50、1.00、5.00 mmol/L,将反应物于100 ℃沸水浴中反应120 min,其他操作同上。糖基化组以PBS代替黄酮,计算抑制率,公式如式(1)所示。
式中:F0为糖基化组荧光值;F为抑制组荧光值。
1.3.2 槲皮素抑制大豆11S球蛋白糖基化过程中AGEs形成机理
1.3.2.1 LC-MS/MS分析槲皮素抑制AGEs生成机理
样品制备同1.3.1.5节操作配制11S球蛋白-葡萄糖-槲皮素体系,使槲皮素终浓度为1 mmol/L,100 ℃沸水浴中反应120 min后,冰水冷却,精确量取2 mL样品,加入4 mL乙酸乙酯,涡漩混匀,超声10 min萃取,取上清液并氮吹除去溶剂,放入-80 ℃冰箱备用。测定前用体积分数70%甲醇水溶液复溶,过滤膜收集滤液,用LC-MS/MS分析。
液相色谱条件:ZORBAX Eclipse XDB-C18柱(250 mm×4.6 mm,5 μm),以乙腈(含有体积分数1‰的甲酸)为流动相(A)进行梯度洗脱检测,然后以水(含有体积分数1‰的甲酸)为流动相(B)。梯度洗脱:0~5 min(10% A),5~40 min(70% A),40~50 min(90% A)。柱温20 ℃;进样量10 μL;检测波长扫描200~400 nm。
质谱条件:电喷雾负离子化(ESI-)检测,扫描范围为m/z 50~1 000;喷雾电压4 000 V,雾化气压45 psi,辅助气压力5 psi,毛细管温度280 ℃,裂解电压135 V,紫外检测:波长为370 nm。
1.3.2.2 大豆11S球蛋白糖基化过程及槲皮素的抑制作用
依据文献[22]方法,如1.3.1.3节方法制备大豆11S球蛋白-葡萄糖体系,于100 ℃沸水浴中反应0、5、10、20、30、60 min,分别取样1 mL于样品管,14 000 r/min离心10 min,取沉淀,加入100 µL样品缓冲液,高速振荡混匀,100 ℃沸水浴中反应5 min,进行SDS-PAGE检测。采用考马斯亮蓝染色,脱色后用凝胶成像仪拍摄凝胶,进而对图像进行分析。
于上述体系中添加槲皮素,使其最终浓度分别为0.1、0.5、1.0 mmol/L,在100 ℃沸水浴中反应60 min,如上同样方法处理样品,SDS-PAGE检测槲皮素在100 ℃条件下反应60 min后的作用效果。
1.3.3 大豆11S改性蛋白乳化性质
1.3.3.1 样品制备
同1.3.1.1节实验方法于100 ℃沸水浴中反应60、120 min,制备添加和不添加槲皮素的11S球蛋白糖基化产物,冷冻干燥。
1.3.3.2 乳化活性测定
分别取未改性的11S球蛋白粉、糖基化蛋白、添加槲皮素的糖基化产物溶于0.2 mol/L、pH 7.2的PBS中,使得蛋白质量浓度为5 mg/mL,将6 mL样品溶液和2 mL大豆油放入离心管中,高速匀浆1 min,立即从匀浆液底部吸取50 μL加入到5 mL质量分数0.1%的SDS溶液中,混匀后在500 nm波长处测定吸光度A0,带入公式(2)计算乳化活性指数(emulsifying activity index,EAI),以质量分数0.1% SDS溶液作为空白对照,每个样品进行3 次平行实验,取平均值。
式中:ρ是蛋白质量浓度/(g/mL);d为光径(1 cm);φ为大豆油所占体积分数(25%);稀释倍数为100;A0为乳状液在0 min时的吸光度。
1.4 数据统计分析
采用Excel 2013和SPSS软件统计分析数据,采用Duncan法进行显著性分析。
2 结果与分析
2.1 荧光法分析11S球蛋白糖基化过程中AGEs的形成
2.1.1 糖种类对11S球蛋白糖基化过程中AGEs形成的影响
由图1可见,不同的糖对体系中荧光性AGEs的量存在显著性差异,随着反应时间的延长,荧光性AGEs的量增大,且各种糖之间的差异性呈现递增的趋势。其中,大豆11S球蛋白-果糖体系,荧光性AGEs的相对荧光强度最高,其次为葡萄糖、乳糖,蔗糖相对荧光强度最低,这与Bierhaus等[23]研究果糖产生AGEs量高于葡萄糖相一致;Srey等[24]也证明在美拉德反应中五碳糖反应活性高于六碳糖,且单糖比双糖更易发生糖基化反应[25]。另外,葡萄糖、果糖和乳糖较蔗糖形成AGEs多,说明还原性糖比非还原性糖反应活性更高。因此,建议在大豆11S球蛋白改性过程中尽量选用低反应活性的糖。
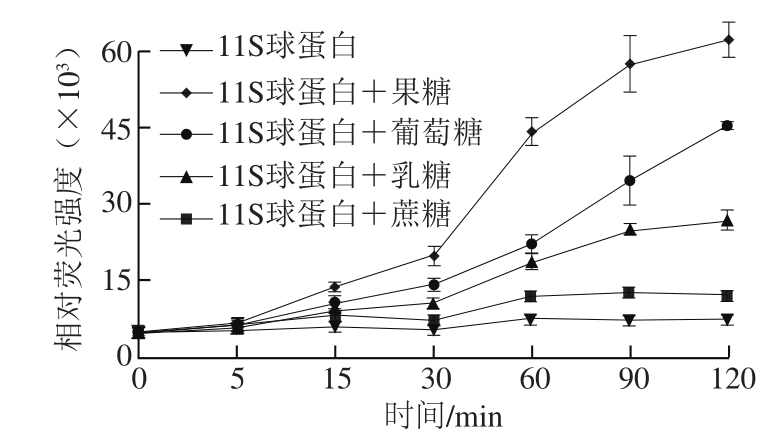
图1 糖种类对11S球蛋白糖基化过程中AGEs形成的影响
Fig. 1 Effect of sugar type on the formation of AGEs
2.1.2 糖质量浓度对11S球蛋白糖基化过程中AGEs形成的影响
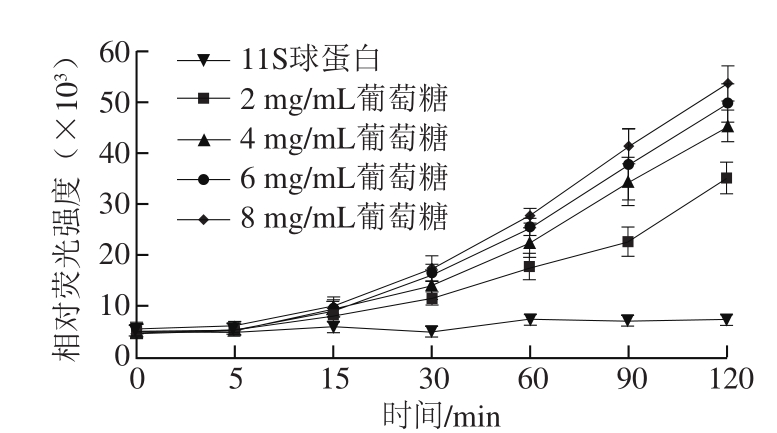
图2 还原糖质量浓度对11S球蛋白糖基化过程中AGEs形成的影响
Fig. 2 Effect of reducing sugar concentration on the formation of AGEs
由图2可知,大豆11S球蛋白-葡萄糖模型中,葡萄糖的质量浓度与荧光性AGEs形成量呈现明显的量效关系。当葡萄糖质量浓度为8 mg/mL,反应时间为120 min时,AGEs的生成量约为2 mg/mL葡萄糖的1.5 倍。随着糖质量浓度在反应体系中的增加,糖分子与大豆11S球蛋白游离氨基充分接触,从而有助于反应的进行[26]。在不影响改性效果的基础上,选择大豆11S球蛋白、葡萄糖低配比(质量浓度分别为2、2 mg/mL和2、4 mg/mL)进行改性。
2.1.3 温度对11S球蛋白糖基化过程中AGEs形成的影响

图3 温度对11S球蛋白糖基化过程中AGEs形成的影响
Fig. 3 Effect of temperature on the formation of AGEs
不同温度(60~121 ℃)对11S球蛋白与葡萄糖模拟体系中荧光性AGEs的产生存在显著性差异(P<0.05),特别是在100 ℃以上,随着温度的升高和时间的延长,体系中荧光性AGEs的量大幅增加[27],而在中低温条件下(60 ℃)荧光性AGEs的生成量变化不大(图3)。这与Ho等[28]研究的当温度低于60 ℃时,加工温度对AGEs的生成量没有显著性影响,但当加工温度升高至150~200 ℃之间时,随着温度的升高,食品中的AGEs生成量呈显著性升高趋势相一致。一般反应温度在小于等于90 ℃时反应速率较慢,大于等于90 ℃时反应速率较快[29-31]。Ledl等[32]研究证明温度每升高10 ℃,糖基化反应速率至少增加一倍。
2.1.4 pH值对11S球蛋白糖基化过程中AGEs形成的影响
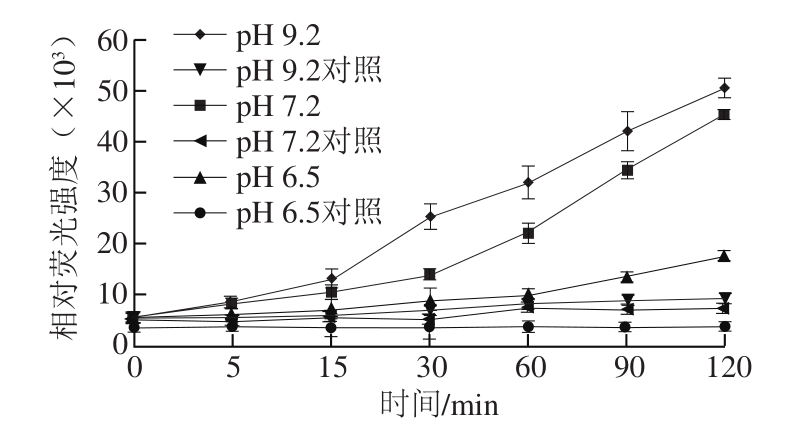
图4 pH值对11S球蛋白糖基化过程中AGEs形成的影响
Fig. 4 Effect of pH on the formation of AGEs
如图4所示,pH值越大,体系中荧光性吸收越高,pH 9.2条件下荧光性AGEs的生成量最多。有文献报道,在中等水分条件下,糖基化反应的最适pH值为7.8~9.2[33]。在偏酸环境中,溶液中的氨基处于质子化状态,使得N-葡基胺难以形成,糖基化反应难以进行;而在中性偏碱的反应环境则最有利于糖基化反应的进行[34]。大豆11S球蛋白在pH 7.2时溶解度最大,且从食品安全角度考虑,选择pH 7.2为糖基化最适pH值。
2.1.5 黄酮对11S球蛋白糖基化过程中AGEs的抑制作用
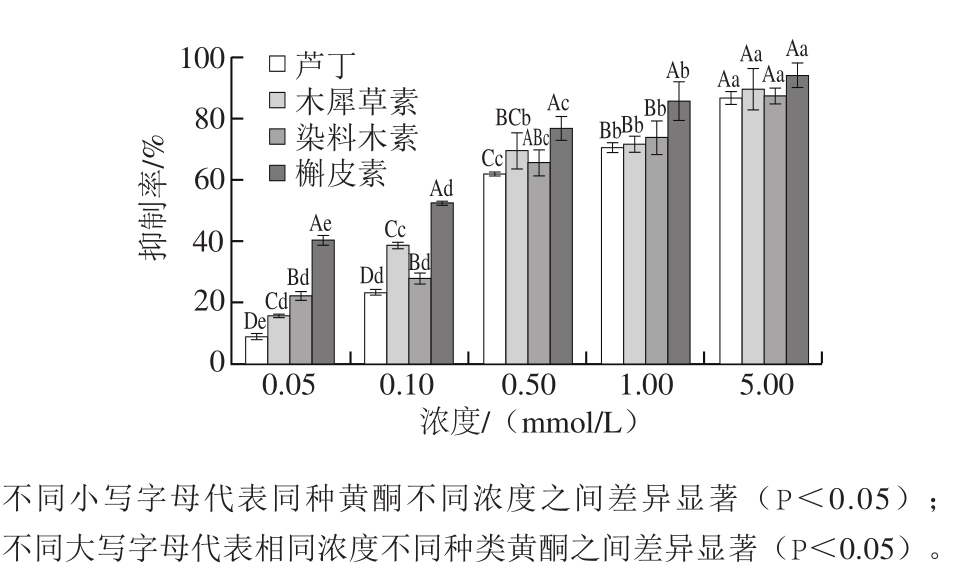
图5 黄酮对11S球蛋白糖基化过程中AGEs形成的影响
Fig. 5 Effect of flavonoids on the formation of AGEs
添加黄酮后对AGEs的抑制效果如图5所示,同种黄酮随着浓度的增加,体系中的AGEs生成量均减少,即抑制率与添加量呈现量效关系。在各浓度下,槲皮素抑制效果最好,染料木素与木犀草素抑制效果较为接近,芦丁抑制率在四者中最低。当浓度为1.00 mmol/L时,对AGEs的抑制率均达到60%以上。槲皮素浓度为0.10 mmol/L时,即可达到半抑制率,浓度升高至0.50、1.00、5.00 mmol/L时,抑制率可分别达到77%、86%和94%。这与Kong Yanghui等[35]用染料木素抑制β-乳球蛋白糖基化过程中生成的AGEs,其抑制效果在一定范围内与抑制剂的浓度呈正相关的实验结果一致。
2.2 槲皮素抑制大豆11S球蛋白糖基化过程中AGEs形成机理
2.2.1 LC-MS/MS分析槲皮素抑制AGEs生成机理

图6 槲皮素在11S球蛋白糖基化过程中结构变化液相色谱图
Fig. 6 Liquid chromatogram of quercetin derivatives during glycosylation of 11S globulin
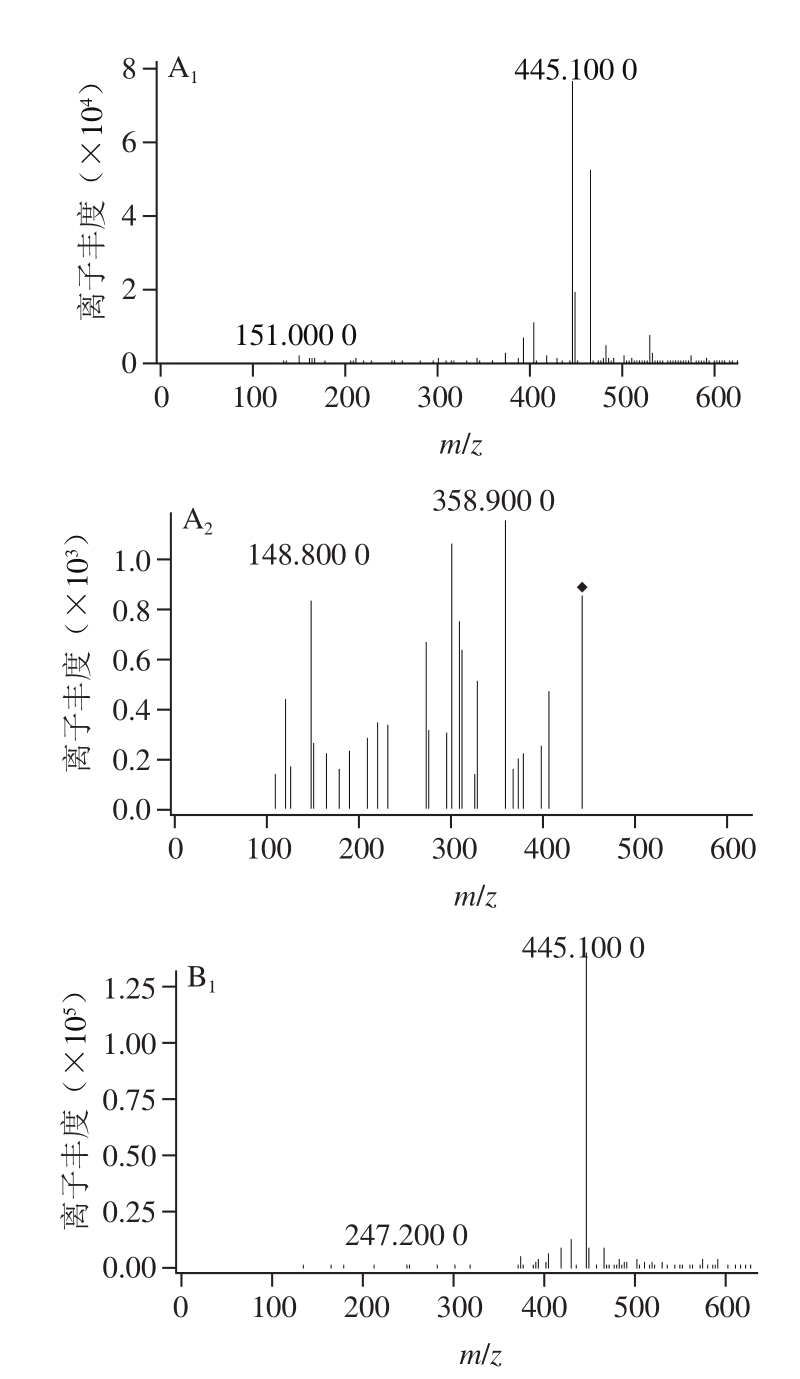
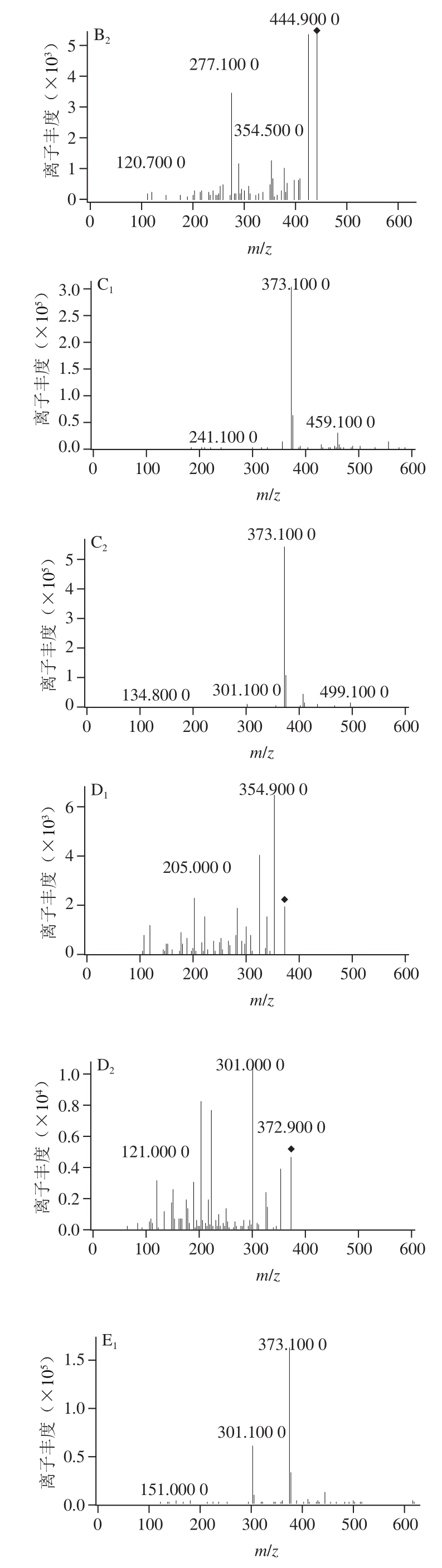
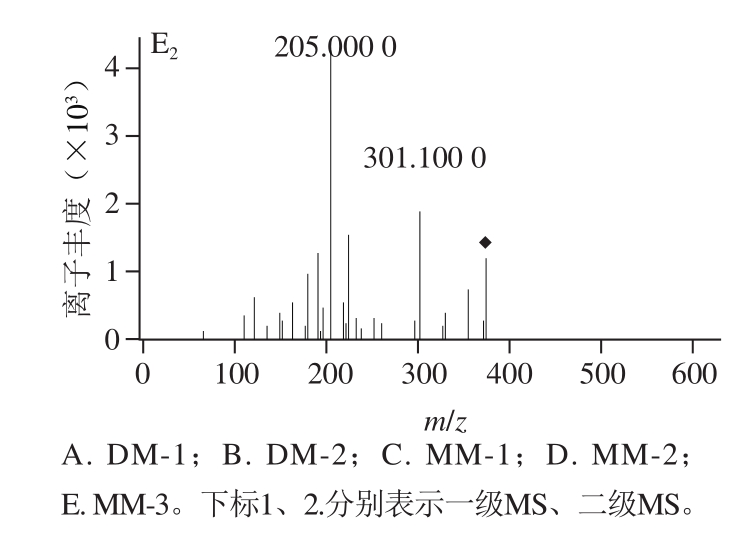
图7 槲皮素在11S球蛋白糖基化过程中产物变化质谱图
Fig. 7 Mass spectra of quercetin derivatives during glycosylation of 11S globulin
为了研究槲皮素抑制AGEs生成的机理,将槲皮素添加到11S球蛋白-葡萄糖体系中,在100 ℃下反应120 min后用LC-MS/MS进行分析。如图6所示,除槲皮素主峰(tR27.60 min),体系中出现tR21.04、21.34 min的两个色谱峰,在MS1(图7A、B)中,ESI-MS(m/z)准分子离子峰是445[M—H]-,相对分子质量比槲皮素高144(2 个MWMGO),MS2中出现m/z 301(槲皮素)碎片离子峰,推测其为槲皮素与两个MGO的加合物。在tR23.81、24.06、28.69 min的3 个色谱峰,MS1(图7C、D、E)中,ESI-MS(m/z)准分子离子峰是373[M-H]-,相对分子质量比槲皮素高72(MWMGO),MS2中均出现m/z 301(槲皮素)碎片离子峰,推测其为槲皮素与一个MGO的加合物。MGO是糖基化反应过程中产生的活性中间产物,是AGEs的前体物质[36]。槲皮素通过捕获糖基化过程中产生的高活性反应因子MGO,进而抑制AGEs的形成,实验结果与前期的报道槲皮素抑制体系中MGO(抑制率80.1%)[37]相一致。
2.2.2 SDS-PAGE定性分析大豆11S球蛋白糖基化的变化及槲皮素的抑制效果

图8 糖基化对大豆11S球蛋白蛋白结构的影响及槲皮素抑制作用
Fig. 8 Effect of glycosylation on protein structure of soybean 11S globulin and inhibitory effect of quercetin
如图8所示,SDS-PAGE图在20 min后大豆11S球蛋白的亚基条带开始逐渐变弱,而形成的交联蛋白由于分子质量过大而无法进入凝胶,此时在浓缩胶顶部开始出现条带,特别是在60 min时更加明显。由此推测糖基化引起大豆11S球蛋白的交联,分子质量增大,且交联程度不同导致交联蛋白分子质量不同[38]。Akhtar等[39]报道蛋白和糖发生糖基化反应产物的电泳图,出现新的电泳条带,部分条带消失,与本实验所得结果相近。
在添加槲皮素(0.1、0.5、1.0 mmol/L)后,大豆11S球蛋白亚基条带保留清晰可见,高分子蛋白较糖基化组减少,添加浓度为1.0 mmol/L时,11S球蛋白各亚基条带与未添加槲皮素相比颜色加深,而高分子蛋白质几乎没有产生。表明槲皮素对蛋白质大分子交联有一定抑制作用,即抑制了高活性反应因子MGO引发的蛋白质大分子交联。
2.3 大豆11S改性蛋白乳化性质
表1 糖基化产物与槲皮素抑制产物的乳化性质
Table 1 Emulsifying properties of glycosylation products formed in the presence and absence of quercetin

注:同行肩标小写字母表示不同样品之间差异显著(P<0.05)。
从表1可知,糖基化反应60 min后,乳化活性提高了0.7 倍,120 min后,提高1.6 倍,表明糖基化改性有效改善蛋白的乳化活性。Diftis等[40]研究证明糖基化后蛋白质乳化活性提高主要是由于其溶解性增加。同时,11S球蛋白与葡萄糖共价交联产物表面疏水性降低,空间结构变得松散,使蛋白质分子更为亲水,分子流动性增加,从而可以较快吸附于油-水界面,表现出更高的乳化活性。添加槲皮素后,反应60 min,改性蛋白乳化活性与未添加相差不大,但荧光强度显著降低,抑制率达到77%;反应120 min后,其乳化活性虽然低于未添加的糖基化组,但仍明显高于未改性的蛋白质,荧光性AGEs抑制率高达到86%,推测可能是随着时间延长槲皮素捕获MGO的量增大,从而抑制了由MGO诱发的荧光性AGEs的形成,但不影响糖对蛋白的修饰改性,故而乳化活性仍维持在一定水平。
3 结 论
大豆11S球蛋白糖基化改性过程中会产生有害产物荧光性AGEs。当反应时间一定时,反应温度和还原糖浓度越高,产生荧光性AGEs的强度就越高,pH值偏大的条件下AGEs的量增大;因此,在大豆蛋白的糖基化改性和加工过程中,尽量选择低温、低糖、低pH值,以便降低有害产物AGEs的形成。此外,添加食源性黄酮如槲皮素等,对荧光性AGEs的形成具有良好的抑制效果,且呈现明显的量效关系。通过SDS-PAGE和LC-MS/MS方法,表明槲皮素通过捕获糖基化中间产物MGO形成加合物,进而抑制可能由于MGO引起的大分子交联AGEs的生成,并保留了糖对蛋白的修饰改性,提高了乳化性能。本研究为提高大豆食品安全性,降低加工和改性过程中有害AGEs的形成提供了理论依据和新的思路。
参考文献:
[1] ZHANG Q, AMES J M, SMITH R D, et al. A perspective on the Maillard reaction and the analysis of protein glycation by mass spectrometry: probing the pathogenesis of chronic disease[J]. Journal of Proteome Research, 2009, 8(2): 754-769. DOI:10.1021/pr800858h.
[2] RABBANI N, THORNALLEY P J. Glycation research in amino acids: a place to call home[J]. Amino Acids, 2012, 42(4): 1087-1096.DOI:10.1007/s00726-010-0782-1.
[3] CHO S J, ROMAN G F, YEBOAH F, et al. The road to advanced glycation end products: a mechanistic perspective[J].Current Medicinal Chemistry, 2007, 14(15): 1653-1671.DOI:10.2174/092986707780830989.
[4] LUEVANO-CONTRERAS C, CHAPMAN-NOVAKOFSKI K.Dietary advanced glycation end products and aging[J]. Nutrients,2010, 2(12): 1247-1265. DOI:10.3390/nu2121247.
[5] VAN LANCKER F, ADAMS A, DE KIMPE N. Chemical modifications of peptides and their impact on food properties[J].Chemical Reviews, 2011, 111(12): 7876-7903. DOI:10.1021/cr200032j.
[6] BOOTH A A, KHALIFAH R G, HUDSON B G. Thiamine pyrophosphate and pyridoxamine inhibit the formation of antigenic advanced glycation end-products: comparison with aminoguanidine[J].Biochemical and Biophysical Research Communications, 1996,220(1): 113-119. DOI:10.1006/bbrc.1996.0366.
[7] URIBARRI J, WOODRUFF S, GOODMAN S, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet[J]. Journal of the American Dietetic Association, 2010,110(6): 911-916. DOI:e12.10.1016/j.jada.2010.03.018.
[8] KRAJČOVIČOVÁ-KUDLÁČKOVÁ M, ŠEBEKOVÁ K, SCHINZEL R,et al. Advanced glycation end products and nutrition[J]. Physiological Research, 2002, 51(3): 313-316.
[9] KANDARAKIS S A, PIPERI C, TOPOUZIS F, et al. Emerging role of advanced glycation-end products (AGEs) in the pathobiology of eye diseases[J]. Progress in Retinal & Eye Research, 2014, 42(9): 85-102.DOI:0.1016/j.preteyeres.2014.05.002.
[10] VLASSARA H, URIBARRI J. Advanced glycation end products(AGE) and diabetes: cause, effect, or both?[J]. Current Diabetes Reports, 2014, 14(1): 1-10. DOI:10.1007/s11892-013-0453-1.
[11] MONNIER V M, SUN W, GAO X, et al. Skin collagen advanced glycation end products (AGEs) and the long-term progression of subclinical cardiovascular disease in type 1 diabetes[J]. Cardiovascular Diabetology, 2015, 14(1): 1-9. DOI:10.1186/s12933-015-0266-4.
[12] MIROLIAEI M, KHAZAEI S, MOSHKELGOSHA S, et al. Inhibitory effects of lemon balm (Melissa officinalis, L.) extract on the formation of advanced glycation end products[J]. Food Chemistry, 2011, 129(2):267-271. DOI:10.1016/j.foodchem.2011.04.039.
[13] UTSUMI S, MATSUMURA Y, MORI T. Structure-function relationships of soy proteins[J]. Food Proteins and Their Applications,1997: 257-292.
[14] 田琨, 管娟, 邵正中, 等. 大豆分离蛋白结构与性能[J]. 化学进展,2008, 20(4): 565-573.
[15] RIBLETT A L, HERALD T J, SCHMIDT K A, et al. Characterization of β-conglycinin and glycinin soy protein fractions from four selected soybean genotypes[J]. Journal of Agricultural and Food Chemistry,2001, 49(10): 4983-4989. DOI:10.1021/jf0105081.
[16] 徐轲轲. 大豆蛋白与多糖复合物乳化性质的研究[D]. 上海: 复旦大学, 2009: 12-14.
[17] 布冠好, 朱婷伟, 陈复生, 等. 大豆蛋白-乳糖复合物的结构及功能特性研究[J]. 中国粮油学报, 2014, 29(7): 40-44.
[18] 齐军茹, 杨晓泉, 廖劲松, 等. 大豆球蛋白与葡聚糖的干热反应特性[J].中国粮油学报, 2005, 20(6): 79-83.
[19] 李冰, 迟玉杰, 鲍志杰, 等. 大豆11S球蛋白-麦芽糖共价改性及其凝胶流变特性[J]. 食品与发酵工业, 2013, 39(7): 39-43.
[20] 齐军茹, 杨晓泉, 廖劲松, 等. 大豆蛋白-多糖干热制备复合物及其反应机理研究(Ⅰ)共价复合物的制备及生成机理探讨[J]. 食品科学,2006, 27(1): 65-68.
[21] NAGANO T, HIROTSUKA M, MORI H, et al. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 941-944. DOI:10.1021/jf00018a004.
[22] 许彩虹, 于淑娟, 杨晓泉. 大豆球蛋白糖基化接枝改性及其热聚集行为研究[D]. 广州: 华南理工大学, 2010: 33-36.
[23] BIERHAUS A, HOFMANN M A, ZIEGLER R, et al. AGEs and their interaction with AGE-receptors in vascular disease and diabetes mellitus. I. the AGE concept[J]. Cardiovascular Research, 1998, 37(3):586-600. DOI:10.1016/S0008-6363(97)00233-2.
[24] SREY C, HULL G L J, CONNOLLY L, et al. Effect of inhibitor compounds on Nε-(carboxymethyl)lysine (CML) and Nε-(carboxyethyl)lysine (CEL) formation in model foods[J]. Journal of Agricultural and Food Chemistry, 2010, 58(22):12036-12041.DOI:10.1021/jf103353e.
[25] HOLLNAGEL A, KROH L W. Formation of α-dicarbonyl fragments from mono- and disaccharides under caramelization and Maillard reaction conditions[J]. Zeitschrift für Lebensmitteluntersuchung und-Forschung A, 1998, 207(1): 50-54. DOI:10.1007/s002170050294.
[26] 包怡红, 邓启, 伊文慧. 黑木耳多糖: 大豆蛋白复合物的制备及其功能物性研究[J]. 食品与机械, 2014, 30(6): 47-53.
[27] HOMOKI-FARKAS P, ÖRSI F, KROH L W. Methylglyoxal determination from different carbohydrates during heat processing[J].Food Chemistry, 1997, 59(1): 157-163. DOI:10.1016/S0308-8146(96)00273-7.
[28] HO Y T, ISHIZAKI S, TANAKA M. Improving emulsifying activity of ε-polylysine by conjugation with dextran through the Maillard reaction[J]. Food Chemistry, 2000, 68(4): 449-455. DOI:10.1016/S0308-8146(99)00220-4.
[29] LIU S C, YANG D J, JIN S Y, et al. Kinetics of color development,pH decreasing, and anti-oxidative activity reduction of Maillard reaction in galactose/glycine model systems[J]. Food Chemistry, 2008,108(2): 533-541. DOI:10.1016/j.foodchem.2007.11.006.
[30] BENJAKUL S, LERTITTIKUL W, BAUER F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J]. Food Chemistry, 93(2): 189-196. DOI:10.1016/j.foodchem.2004.10.019.
[31] MARTINS S, JONGEN W M F, VAN BOEKEL M A J S. A review of Maillard reaction in food and implications to kinetic modelling[J].Trends in Food Science and Technology, 2001, 11(9/10): 364-373.DOI:10.1016/S0924-2244(01)00022-X.
[32] LEDL F, SCHLEICHER E. New aspects of the Maillard reaction in foods and in the human body[J]. Angewandte Chemie International Edition, 1990, 29(6): 565-594. DOI:10.1002/anie.199005653.
[33] 房红娟, 李红姣, 张双凤, 等. 加工条件对BSA-Glucose模拟体系中晚期糖基化末端产物形成的影响[J]. 食品科学, 2012, 33(21): 6-10.
[34] 肖怀秋, 李玉珍, 林亲录. 美拉德反应及其在食品风味中的应用研究[J]. 中国食品添加剂, 2005(2): 27-30.
[35] KONG Yanghui, LI Xiaoming, ZHENG Tiesong, et al. Glycation of β-lactoglobulin and antiglycation by genistein in different reactive carbonyl model systems[J]. Food Chemistry, 2015, 183: 36-42.DOI:10.1016/j.foodchem.2015.02.122.
[36] 邓荣华, 陆敏, 夏秋琴, 等. 芦蒿秸秆黄酮类化合物对晚期蛋白质糖基化终末产物形成的抑制作用[J]. 食品科学, 2014, 35(9): 123-127.
[37] LI X M, ZHENG T S, SANG S M, et al. Quercetin inhibits advanced glycation end product formation by trapping methylglyoxal and glyoxal[J]. Journal of Agricultural and Food Chemistry, 2014, 62(50):12152-12158. DOI:10.1021/jf504132x.
[38] CHEN Y J, LIANG L, LIU X M, et al. Effect of fructose and glucose on glycation of β-lactoglobulin in an intermediate-moisture food model system: analysis by liquid chromatography-mass spectrometry(LC-MS) and data-independent acquisition LC-MS (LC-MS(E))[J].Journal of Agricultural and Food Chemistry, 2012, 60(42): 10674-10682. DOI:10.1021/jf3027765.
[39] AKHTAR M, DICKINSON E. Whey protein-maltodextrin conjugates as emulsifying agents: an alternative to gum arabic[J].Food Hydrocolloids, 2006, 21(4): 607-616. DOI:10.1016/j.foodhyd.2005.07.013.
[40] DIFTIS N, KIOSSEOGLOU V. Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J].Food Chemistry, 2003, 81(1): 1-6. DOI:10.1016/S0308-8146(02)00236-4.