蔬菜极易累积硝酸盐,在人体所摄入的硝酸盐中,其贡献高达72%~94%[1-2]。虽然过量的硝酸盐对植物无害,但大量的NO3-通过食物链进入人体肠胃后,可经细菌的作用还原为亚硝酸或与胺反应生成亚硝胺,从而可能使血液载氧能力降低、诱发人体消化系统癌变等[3-6]。目前我国不少大城市叶类蔬菜的硝酸盐含量偏高,部分地区高达3 000 mg/kg[7]。氮肥的不合理施用被认为是作物硝酸盐积累的原因,蔬菜中的硝酸盐含量会随氮肥施用量的增加迅速升高[8]。而且,不同形态的氮肥(如铵态氮和硝态氮)及其比例是影响蔬菜硝酸盐含量的重要因素[9-10]。有研究表明,增加铵态氮含量可以显著降低叶类蔬菜茎叶中硝酸盐的含量[11-13]。
不同种蔬菜及同种蔬菜的不同品种间硝酸盐含量有差异[13],且硝酸盐积累量的差异变幅可高达1 600 mg/kg[14]。硝酸还原酶(nitrate reductase,NR)活性、硝酸盐转运蛋白(nitrate transporter,NRT)等遗传因子差异是造成积累差异的主要原因;其中,NRT基因对于氮素吸收、运输和同化有着重要作用,是提高作物氮素利用效率,解决硝酸盐积累的重要研究对象[11]。NO3-—N主要是通过低亲和的NRT1和高亲和的NRT2而被高等植物吸收,且这两类转运体基因已在拟南芥、水稻和番茄中得到克隆[15]。而目前有关蔬菜NRT基因的表达和亚细胞定位,以及硝铵比、氮代谢酶与蔬菜的硝酸盐含量相关性的研究报道较少,且结果不一致[16-18]。
小白菜(Brassica chinensis L.)是我国最重要的叶类蔬菜之一。都韶婷等[7]检测了我国多个城市的主要蔬菜硝酸盐含量,发现小白菜是硝酸盐含量最高的蔬菜之一,其中北京和长沙地区的硝酸盐含量分别高达3 615 mg/kg和3 514 mg/kg,超出了叶类蔬菜的硝酸盐限量标准;因此,本研究采用液体培养实验,以低硝酸盐富集品种‘香港特选奶白菜’和高硝酸盐富集品种‘揭农四号春白菜’为供试材料,系统探讨了硝铵比对2 种小白菜硝酸盐含量、氮代谢关键酶活性的影响及NRT基因的表达和亚细胞定位在小白菜不同品种间的差异,初步明确硝酸盐积累的生理及分子机理;同时也为蔬菜生产中的氮肥运筹及栽培品种合理选择提供理论依据。
1 材料与方法
1.1 材料与试剂
供试作物为小白菜,品种为前期实验中筛选出的低硝酸盐富集品种‘香港特选奶白菜’和高硝酸盐富集品种‘揭农四号春白菜’[19]。
小量RNA抽提试剂盒 华舜生物公司;Taq DNA聚合酶 上海鼎国公司;RNase Free-DNaseⅠ、SYBR Premix Ex TaqTMⅡ试剂盒、高保真酶Pfu、dNTP 日本TaKaRa公司;Trizol RNA提取试剂盒 美国Invitrogen公司;逆转录酶(M-MLV) 美国Fermentas公司;PCR合成试剂 上海生工生物工程公司;胶回收试剂盒美国Axygen公司;酶解液、PEG4000溶液、W5溶液、MMG溶液 武汉伯远生物技术公司。
1.2 仪器与设备
ABI-9700聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;Nanodrop2000紫外-可见分光光度计 美国Thermo Scientific公司;HE99电泳仪 美国GE公司;WD-9403C紫外透射仪 北京市六一仪器厂;LSM700激光共聚焦显微镜 德国Zeiss公司。
1.3 方法
实验共设3 个硝铵比处理组(c(NO3-)∶c(NH4+)分别为50∶50、75∶25和100∶0),营养液按霍格兰营养液配方配制,氮浓度为16 mmol/L,调节pH值至5.8~6.0,具体操作参见文献[19]。
1.3.1 植株硝酸盐含量及氮代谢关键酶活力测定
硝酸盐含量的测定采用GB 5009.33—2010《食品中亚硝酸盐与硝酸盐的测定》方法;NR活力测定采用活体法[20-21];亚硝酸还原酶(nitrite reductase,NiR)活力测定参照Ozawa等[22]的方法;谷氨酰胺合成酶(glutamine synthetase,GS)活力参照植物生理学实验指导[23]测定;谷氨酸合成酶(glutamate synthase,GOGAT)和谷氨酸脱氢酶(glutamate dehydrogenase,GDH)活力参照叶利庭等[24]的方法测定。
1.3.2 荧光定量PCR
1.3.2.1 总RNA提取与检测
采用华舜生物公司的小量RNA抽提试剂盒提取,并通过电泳结果以及RNA浓度综合评价RNA的质量。
1.3.2.2 RNA的纯化与反转录
使用PrimeScript™ RT reagent Kit with gDNA Eraser进行RNA的反转录,并采用RNase Free-DNaseⅠ除去RNA中微量的DNA。将所得的cDNA置于-20 ℃冰箱保存备用。
1.3.2.3 引物设计与合成
本实验研究硝酸盐低亲和转运蛋白基因NRT1。由武汉伯远生物技术公司设计并合成NRT1基因的反转录(reverse transcription,RT)-PCR特异引物,内参引物为actin-F/R(表1)。
表1 NRT1基因的RT-PCR引物
Table 1 Primers used for RT-PCR of NRT1
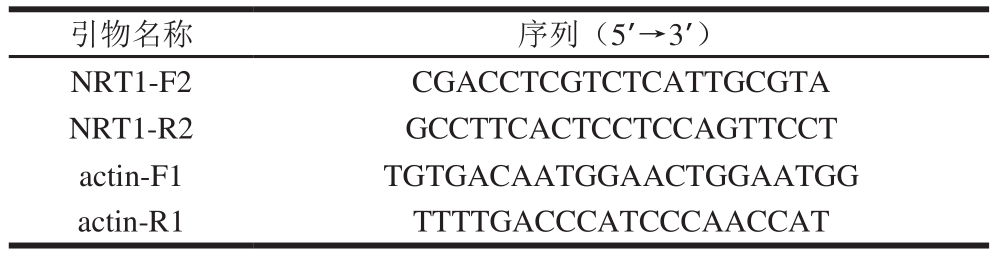
引物名称 序列(5’→3’)NRT1-F2 CGACCTCGTCTCATTGCGTA NRT1-R2 GCCTTCACTCCTCCAGTTCCT actin-F1 TGTGACAATGGAACTGGAATGG actin-R1 TTTTGACCCATCCCAACCAT
1.3.2.4 cDNA的PCR扩增
取获得的cDNA,用ABI-9700 PRC仪进行特异扩增。反应体系的总体积为25 μL,包括2.5 μL 10×Buffer(含Mg2+)、0.5 μL dNTP(10 mmol/L)、正反向引物(10 μmol/L)各0.5 μL、Taq DNA聚合酶(5 U/μL)0.3 μL、cDNA模板0.25 μL,剩余部分用ddH2O补足。PCR程序为:94 ℃预变性2 min,94 ℃变性40 s,退火(温度为55 ℃)1 min,72 ℃ 45 s,30 个循环,72 ℃ 10 min。PCR产物在1.5%的琼脂糖凝胶中电泳检测,并用紫外透射仪拍照。
1.3.2.5 实时荧光定量PCR
将反转录得到的cDNA用ddH2O稀释25 倍,采用SYBR Premix Ex TaqTMⅡ试剂盒,进行qRT-PCR,检测其特异性。操作方法参照使用说明书进行,每个试样重复3 次。
1.3.3 NRT1亚细胞定位
菌种:大肠杆菌用作质粒的转化宿主;质粒:pBWA(V)H-YFPNR1;融合表达载体的构建:参照杨学东等[25]的NRT1序列设计引物,以NRT1克隆为模板用高保真酶Pfu进行PCR扩增,PCR产物经电泳回收后连接到pBWA(V)H-YFPNR1载体上,获得最终表达载体(图1)。

图1 原生质体亚细胞定位载体图谱
Fig. 1 Map of the protoplast subcellular localization vector
质粒定位原生质体:取小白菜叶用水冲洗表面污垢,在干净塑料/玻璃板上用锋利的刀片切成碎段(长度小于0.5 mm),总质量5~10 g左右。加入5~10 mL酶解液全部浸泡组织,28 ℃缓慢振荡(100 r/min)酶解5~6 h。将原生质体用40 μm滤网进行过滤,然后50×g离心10 min,可见浑浊沉淀。直接倒去上清液,用预冷W5溶液10 mL洗涤2 次,每次50×g离心5 min,可见管底浑浊沉淀。根据需要加入500 μL MMG溶液稀释原生质体得到原生质体原液。使其在40 倍下显微镜检测每个视野20~40 个左右。取200 μL原生质体悬液原液,等体积的PEG溶液及500 ng以上的纯化质粒进行轻柔均匀混合,室温静置30 min,用1 mL W5稀释,混合均匀终止反应,100×g离心5 min收集原生质体,加入1 mL W5洗1~2 次,最后加入1 mL W5溶液重悬,转移到2 mL EP管中,28 ℃暗培养24~48 h,激光共聚焦显微镜观察。
1.4 数据处理
采用Excel 2010和SPSS 23.0软件进行统计处理,利用Duncan’s新复极差法做显著性分析。
2 结果与分析
2.1 硝铵比对不同品种小白菜各部位硝酸盐含量的影响
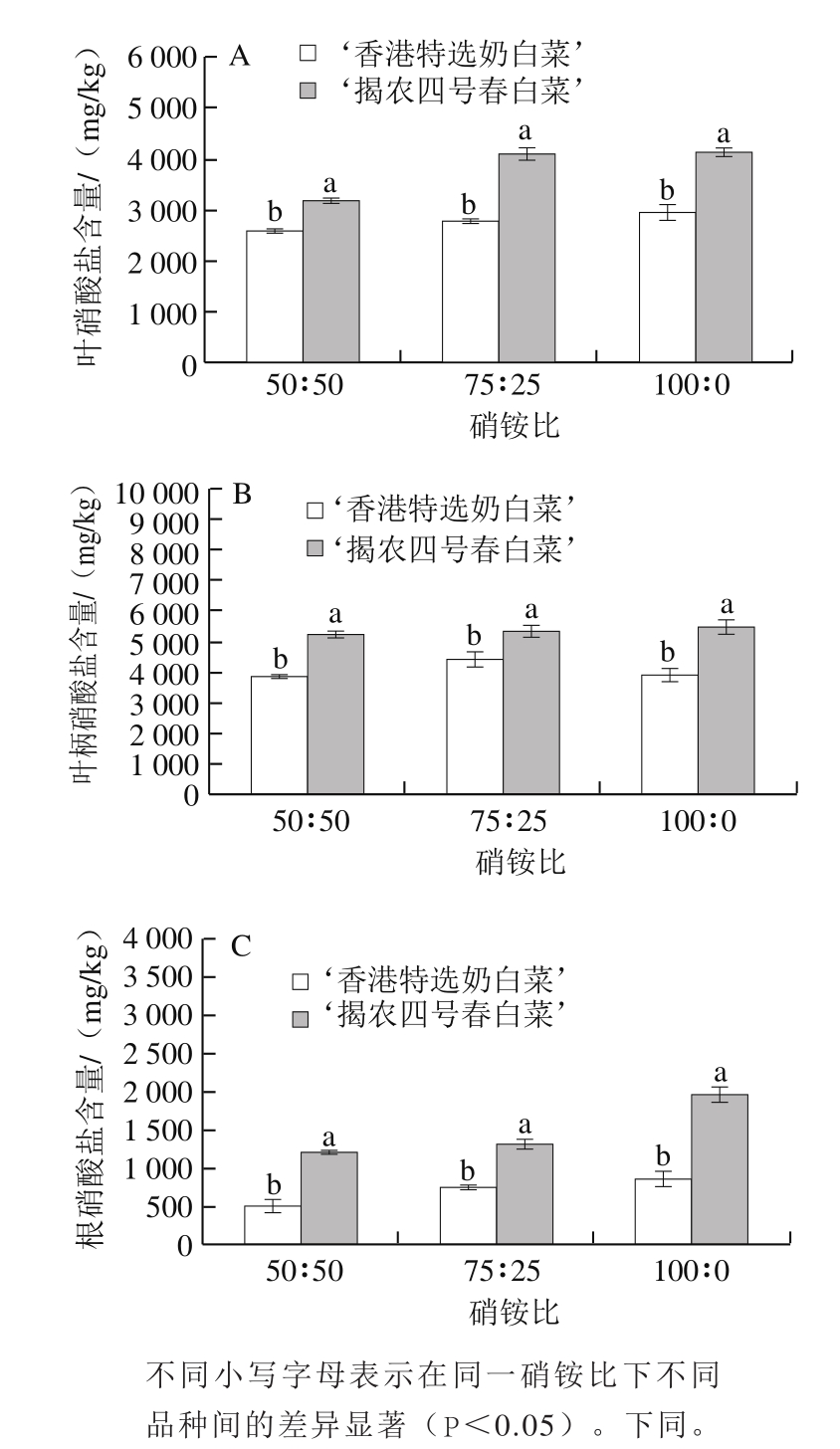
图2 硝铵比对不同品种小白菜叶(A)、叶柄(B)、根(C)硝酸盐含量的影响
Fig. 2 Effect of NO3-/NH4+ratio on nitrate contents in leaves (A),petioles (B) and roots (C) of two varieties of pakchoi
从图2可以看出,在不同硝铵比处理下,小白菜硝酸盐含量为叶柄>叶>根。随NO3-比例的增加,小白菜叶柄、叶和根硝酸盐含量总体呈增加趋势。在硝铵比75∶25和100∶0处理中,‘香港特选奶白菜’和‘揭农四号春白菜’叶片硝酸盐含量分别较硝铵比50∶50处理增加了7.9%~13.2%和29.1%~30.4%,叶柄硝酸盐含量分别较硝铵比50∶50处理增加了0.3%~14.3%和3.3%~4.9%,根硝酸盐含量分别较硝铵比50∶50处理增加了45.4%~73.8%和9.8%~63.3%。相同硝铵比处理下,‘香港特选奶白菜’叶、叶柄和根中的硝酸盐含量均明显低于‘揭农四号春白菜’。
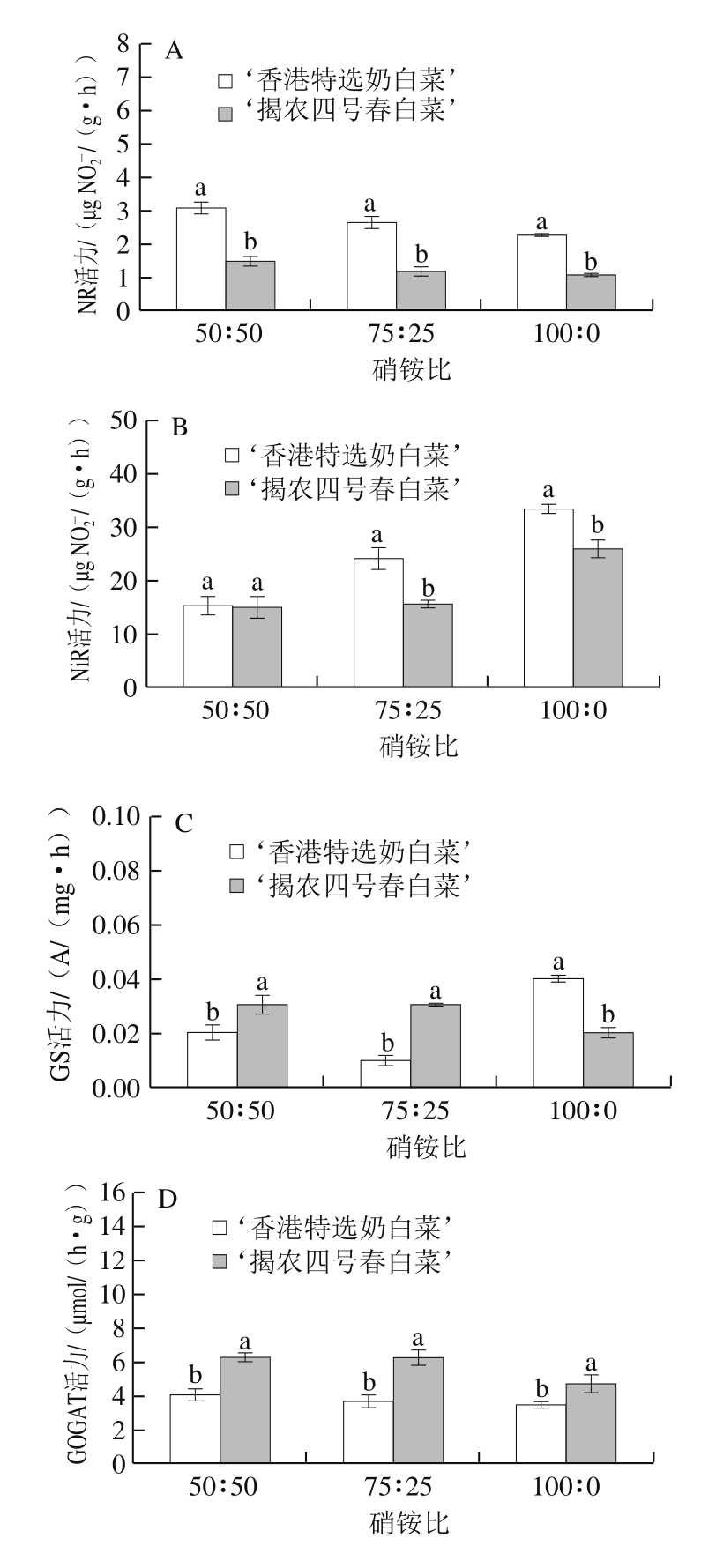
2.2 硝铵比对不同品种小白菜氮代谢相关酶活性的影响
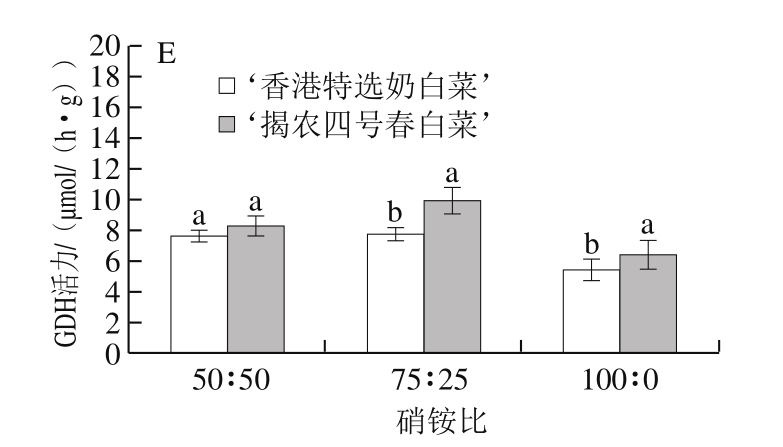
图3 不同硝铵比对2 个品种小白菜叶片NR(A)、NiR(B)、GS(C)、GOGAT(D)、GDH(E)活力的影响
Fig. 3 Effect of NO3-/NH4+ratio on the activities of NR (A), NiR (B),GS (C), GOGAT (D) and GDH (E) in leaves of two varieties of pakchoi
由图3可知,随着硝铵比的增加小白菜叶片NR活力呈现降低趋势,在硝铵比75∶25和100∶0处理中,‘香港特选奶白菜’和‘揭农四号春白菜’叶片NR活性分别较硝铵比50∶50处理降低了15.5%~26.6%和21.9%~26.5%。‘香港特选奶白菜’和‘揭农四号春白菜’叶片NiR活力随着硝铵比的增加有所增加,硝铵比75∶25和100∶0处理分别较硝铵比50∶50处理增加了38.9%~57.3%和5.1%~74.9%。小白菜叶片GOGAT活力随着硝铵比的增加呈现降低趋势,硝铵比75∶25和100∶0处理‘香港特选奶白菜’和‘揭农四号春白菜’叶片GOGAT活力分别较硝铵比50∶50处理降低了10.5%~15.5%和0.2%~24.6%。随着硝铵比的增加小白菜叶片GDH活力呈先增加后降低趋势,‘香港特选奶白菜’和‘揭农四号春白菜’叶片GDH活力在75∶25时达到最大值,分别较硝铵比50∶50处理增加了2.1%和20.0%。而不同硝铵比对2 个品种小白菜的GS活力没有显著影响。不同硝铵比处理中,除硝铵比50∶50处理下的NiR、GDH活力外,其他氮代谢相关酶活力在两个小白菜品种之间达到显著性差异。
2.3 小白菜NRT1基因表达分析
高等植物有两种细胞质膜NRT,即NRTl和NRT2。NRT2是高亲和硝酸盐转运系统(high-affinity transport system,HATs),而大部分NRTl是低亲和硝酸盐转运系统(low-affinity transport system,LATs)。根据以上实验结果分别选择高硝酸盐富集品种‘揭农四号春白菜’和低硝酸盐富集品种‘香港特选奶白菜’为材料,对其叶片部位的RNA进行实时荧光定量PCR。如图4所示,NRT1在‘香港特选奶白菜’和‘揭农四号春白菜’叶片中均有表达;以‘香港特选奶白菜’NRT1的平均相对表达量为1.00,‘揭农四号春白菜’的NRT1的平均相对表达量为2.47,‘揭农四号春白菜’的NRT1相对表达量显著高于‘香港特选奶白菜’,且2 个白菜品种叶片中NRT1表达量组内差异均较大。但未检测出NRT2表达量。

图4 小白菜叶片中NRT1实时定量荧光PCR分析
Fig. 4 Real-time PCR analysis of NRT1-associated genes in leaves of pakchoi
2.4 小白菜NRT1亚细胞定位
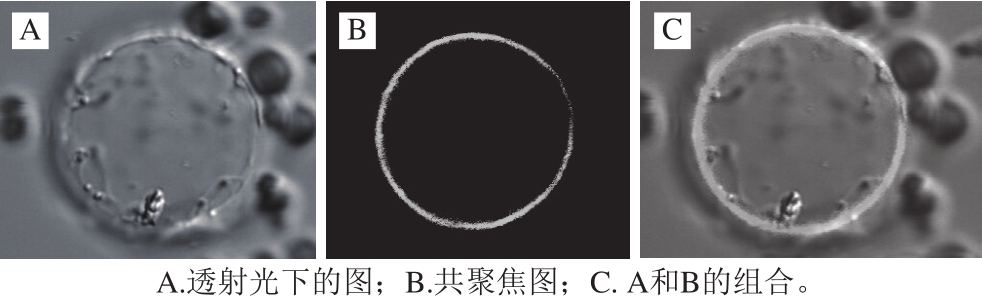
图5 NRT1在小白菜叶片原生质体中的亚细胞定位
Fig. 5 Subcellular localization of NRT1 in pakchoi protoplasts
通过生物信息学方法分析蛋白可能的信号肽或功能域来确定蛋白在细胞内的定位,有利于高效地探索蛋白的功能。近年来绿色荧光蛋白被广泛应用于基因表达、蛋白质定位等领域。当其在细胞中表达时,若遇到蓝光或紫外光,便会产生明亮的绿色荧光。为了研究NRT1在植物细胞中的作用部位,以高硝酸盐富集品种‘揭农四号春白菜’和低硝酸盐富集品种‘香港特选奶白菜’为材料,构建了原生质体表达载体。如图5所示,NRT1在小白菜叶片原生质体中的亚细胞定位结果表明,NRT1在原生质膜上大量表达,而在原生质体内并无表达,说明NRT1是定位于原生质体细胞膜上的非跨膜蛋白。
3 讨 论
艾绍英等[26]研究发现适当增加营养液中铵态氮的比例可有效降低菜心中的硝酸盐含量。在本实验中,2 个品种小白菜叶片、叶柄和根的硝酸盐含量随着铵态氮比例的增加而降低,随硝态氮比例的增加而增加。Ullrich[27]认为其可能的原因是铵能够高速进入细胞,而导致细胞膜去极化,阻止了H+与阴离子的协同运输,因此抑制了硝酸盐的吸收;也可能是因为受到了温度、光照等外部因素的影响[28-31]。供试2 个品种小白菜体内硝酸盐含量表现为叶柄>叶片>根,这与Chen Wei等[32]报道一致。Gransteck等[33]认为这是由于根和叶主要承担物质的吸收和同化的作用,进入根部后的NO3-部分被同化为营养物质,而大部分NO3-则在蒸腾拉力的作用下经由木质部输送到叶片、果实等地上部位,参与各种生理代谢。供试低硝酸盐富集品种‘香港特选奶白菜’,高富集品种‘揭农四号春白菜’,2 个小白菜品种之间叶片硝酸盐含量相差1.22~1.46 mg/kg,叶柄硝酸盐含量相差1.21~1.40 mg/kg,根硝酸盐含量相差1.80~2.38 mg/kg,这种蔬菜种间、品种间硝酸盐积累差异原因主要由遗传因子控制所致。有研究表明,蔬菜硝酸盐积累较高和较低的两极类群品种表现稳定,基因型差异可稳定遗传[11]。
硝酸盐被特异性的NRT高效运输到植物根细胞中,储存在液泡里,在细胞质中被NR降解成亚硝酸盐。亚硝酸盐进入根的叶绿体或非绿色组织的质体中,在6-铁氧还蛋白的帮助下NiR将其进一步还原成铵。随后在ATP供能下,GS将谷氨酸和NH4+转换成谷氨酰胺,该过程是在叶绿体、细胞质或根细胞质体中进行的,最终铵参与到氨基酸的合成。当植物细胞中NH4+浓度较高时,NADH提供电子,NH4+还可以由存在于叶绿体和线粒体中的GDH还原为谷氨酸。植物体内,NR和NiR对初级氮的同化起着非常重要的作用,NR调控硝酸盐降解为亚硝酸盐,NiR再进一步将亚硝酸盐降解为铵,最终铵参与到蛋白质的合成中[34]。本实验中,对小白菜硝酸盐含量影响较大的是NR活性。有研究报道随着营养液硝态氮的增加,蔬菜硝酸盐含量与NR活力随之升高[35]。而本实验中,随着硝铵比的增加,小白菜叶片NR活力呈下降趋势。该结果与胡承孝等[36]报道小白菜、番茄的硝酸盐含量与NR活力间呈负相关相似。NR作为是植物氮代谢中一个重要的限速酶和调节酶,在高硝态氮下其活性降低,可能是造成小白菜体内硝酸盐积累的重要原因。
NRT在植物体内介导根系对NO3-的吸收以及在不同组织、器官间的转运。高等植物共有2 个家族的转运蛋白:NRT1和NRT2,分别与LATS和HATS有关[37]。从实时荧光定量PCR的结果来看,NRT1在‘香港特选奶白菜’和‘揭农四号春白菜’中均显著表达,而未检测出NRT2表达量。这与孔敏等[38]的结果不一致。这可能是由于NRT基因在植物组织中各器官中表达有很大的差异,且NRT2在根部表达量要比叶、花等器官中的表达量要高[39]。本实验中,‘揭农四号春白菜’中的NRT1相对表达量显著高于‘香港特选奶白菜’,这与‘揭农四号春白菜’和‘香港特选奶白菜’叶片硝酸盐积累量差异表现一致。此结果与赵首萍等[15]的结果大致相同。说明NRT1的表达在一定程度上可以解释品种间叶片硝酸盐积累的差异原因。在本实验中,由于在硝铵比为100∶0时两个小白菜叶片中的硝酸盐含量最高,且叶片是主要食用部分,因此仅对硝铵比为100∶0处理时的‘香港特选奶白菜’和‘揭农四号春白菜’叶片进行了实时荧光定量PCR测定,仅检测出NRT1的表达量。因此,要从根本上去探究硝酸盐积累差异的机理,还需要对硝铵比为75∶25、50∶50的小白菜根、叶柄中的NRT1和NRT2的表达进行研究,并且研究NRT1和NRT2家族各成员在白菜各组织器官中发挥的作用对于探究小白菜中硝酸盐积累的机理有重要意义。
NRT1表达部位与其功能密切相关,通常无机营养的吸收同化需要各种膜结合的离子转运蛋白,一部分直接参与土壤中离子的吸收,而另一部分则参与离子的转运和储存[39]。CHL1基因的蛙卵实验表明该基因蛋白位于细胞膜上,属于质子的硝酸盐依赖共转运系统[40]。本研究亚细胞定位结果显示小白菜NRTl定位于细胞膜上,是一个质膜蛋白。说明NRT1发生功能的部位是细胞膜,这与离子转运蛋白大部分是膜蛋白的特征一致。但是庞永奇等[41]认为目前所进行的亚细胞定位分析大多是稳定过量表达或者瞬时表达产生的结果,在一定程度上可以反映蛋白质的定位情况,但由于表达位置的不同、表达量的变化以及可能存在某些调控因子,可能不能够真实呈现基因的定位情况,而采用免疫原位杂交的方法或利用自身启动子驱动基因融合标记的表达可能会得到更准确的结果。因此,对于NRT1在细胞膜上如何发生转运功能,还需要进一步研究。
4 结 论
供试2 个品种小白菜体内硝酸盐含量在不同硝铵比下均表现为叶柄>叶片>根。相同硝铵比处理下,‘香港特选奶白菜’叶、叶柄和根中的硝酸盐含量均明显低于‘揭农四号春白菜’。
不同硝铵比处理中,除硝铵比50∶50处理下的NiR、GDH活力外,其他氮代谢相关酶活力在两个小白菜品种之间均达到显著性差异。‘香港特选奶白菜’和‘揭农四号春白菜’叶片GDH活力在75∶25时均达到最大值。随着硝铵比的增加,小白菜叶片NR、GOGAT活力呈降低趋势,NiR活性呈上升趋势,GDH活性呈先增加后降低趋势。
低亲和转运蛋白基因NRT1在筛选出的两个小白菜品种中均显著表达,且硝酸盐高富集品种‘揭农四号春白菜’的表达量显著高于低富集硝酸盐品种‘香港特选奶白菜’。NRT1是定位于细胞膜上的低亲和NRT。
参考文献:
[1] 赵婉伊, 姚云柯, 徐卫红, 等. 外源硒对茎瘤芥硒形态及硒吸收的影响[J]. 食品科学, 2017, 38(1): 105-109. DOI:10.7506/spkx1002-6630-201701017.
[2] 赵静, 王娜, 冯叙桥, 等. 蔬菜中硝酸盐和亚硝酸盐检测方法的研究进展[J]. 食品科学, 2014, 35(8): 42-49. DOI:10.7506/spkx1002-6630-201408008.
[3] 陈云增, 陈志凡, 马建华, 等. 沙颍河流域典型癌病高发区土壤硝态氮对地下水和蔬菜硝酸盐积累的影响[J]. 环境科学学报, 2016,36(3): 990-998. DOI:10.13671/j.hjkxxb.2015.0497.
[4] 孙钟雷, 许艺, 李宇, 等. 离子电极法快速测定榨菜中硝酸盐含量[J].食品科学, 2016, 37(14): 184-188. DOI:10.7506/spkx1002-6630-201614033.
[5] 都韶婷, 章永松, 林咸永, 等. 蔬菜积累的硝酸盐及其对人体健康的影响[J]. 中国农业科学, 2007, 40(9): 2007-2014. DOI:10.3321/j.issn:0578-1752.2007.09.021.
[6] MARCO T A, NEIL P B, GIOVANNA S C, et al. Combining social learning with agro-ecological research practice for more effective management of nitrate pollution[J]. Environmental Science and Policy,2007, 10(6): 551-563. DOI:10.1016/j.envsci.2007.02.006.
[7] 都韶婷, 金崇伟, 章永松. 蔬菜硝酸盐积累现状及其调控措施研究进展[J]. 中国农业科学, 2010, 43(17): 3580-3589. DOI:10.3864/j.issn.0578-1752.2010.17.012.
[8] 刘永刚, 陈利军, 武志杰. 蔬菜中硝酸盐的积累机制及其调控措施[J]. 土壤通报, 2006, 37(3): 612-616. DOI:10.3321/j.issn:0564-3945.2006.03.045.
[9] CHEN Guilin, GAO Xiurui, ZHANG Xianbin. Effect of partial replacement of nitrate by amino acid and urea on nitrate content of non-heading Chinese cabbage and lettuce in hydroponic condition[J].Agricultural Sciences in China, 2002, 1(4): 444-449.
[10] 邢素芝, 汪建飞, 李孝良, 等. 氮肥形态及配比对菠菜生长和安全品质的影响[J]. 植物营养与肥料学报, 2015, 21(2): 527-534.DOI:10.11674/zwyf.2015.0229.
[11] 汪李平, 向长萍, 王运华. 白菜不同基因型硝酸盐含量差异的研究[J]. 园艺学报, 2004, 31(1): 43-46; 16. DOI:10.3321/j.issn:0513-353X.2004.01.010.
[12] 杜红艳, 于平彬, 季延海, 等. 不同氮素浓度对水培韭菜生长发育与品质的影响[J]. 中国蔬菜, 2015, 1(5): 45-48. DOI:10.3969/j.issn.1000-6346.2015.05.013.
[13] 都韶婷, 李玲玲, 章永松, 等. 不同基因型小白菜硝酸盐积累差异及筛选研究[J]. 植物营养与肥料学报, 2008, 14(5): 969-975.DOI:10.3321/j.issn:1008-505X.2008.05.024.
[14] 陈振德, 陈建美, 何金明, 等. 大白菜不同品种硝酸盐含量的分析[J].中国蔬菜, 2002, 1(2): 40. DOI:10.3969/j.issn.1000-6346.2002.02.019.
[15] 赵首萍, 张瑞麟, 徐明飞, 等. 铵硝比例对不同基因型小白菜硝酸盐积累影响机理研究[J]. 土壤, 2011, 43(1): 32-38. DOI:10.13758/j.cnki.tr.2011.01.024.
[16] 田真, 李敬蕊, 王祥, 等. 生菜硝酸还原酶基因的克隆及高氮水平下外源γ-氨基丁酸对其表达和叶片硝酸盐含量的影响[J]. 西北植物学报, 2015, 35(6): 1098-1105. DOI:10.7606/j.issn.1000-4025.2015.06.1098.
[17] 朱美红, 蔡妙珍, 邢承华, 等. 蔬菜硝酸盐累积的生理和分子生物学机理[J]. 土壤通报, 2008, 39(3): 694-697. DOI:10.3321/j.issn:0564-3945.2008.03.045.
[18] 王利群, 王文兵, 吴守一, 等. 蔬菜硝酸盐含量与硝酸还原酶活性的研究[J]. 食品科学, 2003, 24(12): 37-40. DOI:10.3321/j.issn:1002-6630.2003.12.003.
[19] 迟荪琳, 杨芸, 徐卫红, 等. 小白菜硝酸盐含量与NH4+/NO3-及氮代谢关键酶的相关性研究[J]. 食品科学, 2015, 36(23): 70-77.DOI:10.7506/spkx1002-6630-201523014.
[20] 刘娜, 闫志山, 范有君, 等. 不同氮素水平对甜菜氮代谢酶和可溶性蛋白含量的影响[J]. 中国农学通报, 2015(30): 149-154.
[21] 宗学凤, 王三根. 植物生理研究技术[M]. 重庆: 西南师范大学出版社, 2011: 112-116.
[22] OZAWA K, KAWAHIGASHI H. Positional cloning of the nitrite reductase gene associated with good growth and regeneration ability of calli and establishment of a new selection system for Agrobacterium mediated transformation in rice (Oryza sativa L.)[J]. Plant Science,2006, 170(2): 384-393. DOI:10.1016/j.plantsci.2005.09.015.
[23] 邹奇. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2003:125-126.
[24] 叶利庭, 吕华军, 宋文静, 等. 不同氮效率水稻生育后期氮代谢酶活性的变化特征[J]. 土壤学报, 2011, 48(1): 132-140.
[25] 杨学东, 戴薇, 张昌伟, 等. 白菜病毒诱导基因沉默技术体系的建立[J].园艺学报, 2012, 39(11): 2168-2174.
[26] 艾绍英, 姚建武, 黄小红, 等. 蔬菜硝酸盐的还原转化特性研究[J].植物营养与肥料学报, 2002, 8(1): 40-43. DOI:10.3321/j.issn:1008-505X.2002.01.007.
[27] ULLRICH W R. Transport of nitrate and ammonium through plant membranes[M]// MENGEL K, PILBEAM D. Nitrogen metabolism of plants. Oxford: Clarendon Press, 1992: 121-137.
[28] 何欣, 张攀伟, 丁传雨, 等. 弱光下硝铵比对小白菜氮吸收和碳氮分配的影响[J]. 土壤学报, 2009, 46(3): 452-458. DOI:10.3321/j.issn:0564-3929.2009.03.011.
[29] 王朝辉, 田霄鸿, 李生秀. 叶类蔬菜的硝态氮累积及成因研究[J]. 生态学报, 2001, 21(7): 1136-1141. DOI:10.3321/j.issn:1000-0933.2001.07.015.
[30] CORREIA M J, FONSECA F, AZEDO-SILVA J, et al. Effects of water deficit on the activity of nitrate reductase and content of sugars,nitrate and free amino acids in the leaves and roots of sunflower and white lupin plants growing under two nutrient supply regimes[J].Physiologia Plantarum, 2005, 124(1): 61-70. DOI:10.1111/j.1399-3054.2005.00486.x.
[31] LILLO C. Signalling cascades integrating light-enhanced nitrate metabolism[J]. Biochemical Journal, 2008, 415(1): 11-19.DOI:10.1042/BJ20081115.
[32] CHEN Wei, LUO Jinkui, SHEN Qirong. Effect of NH4+-N/NO3--N ratios on growth and some physiological parameters of Chinese cabbage cultivars[J]. Pedosphere, 2005, 15(3): 310-318.
[33] GRANSTECK R C, HUFFAKER R C. Identification of the leaf vacuole as a major nitrate storage pool[J]. Plant Physiology, 1982,70(2): 410-413. DOI:10.1104/pp.70.2.410.
[34] KYAING M S, 顾立江, 程红梅. 植物中硝酸还原酶和亚硝酸还原酶的作用[J]. 生物技术进展, 2011, 1(3): 159-164. DOI:10.3969/j.issn.2095-2341.2011.03.02.
[35] 李亦松. 氮肥对绿叶类蔬菜硝酸盐累积的影响及机理的研究[D]. 乌鲁木齐: 新疆农业大学, 2006: 1-40. DOI:10.7666/d.y873788.
[36] 胡承孝, 邓波儿, 刘同仇. 施用氮肥对小白菜、番茄中硝酸盐积累的影响[J]. 华中农业大学学报, 1992, 11(3): 239-243. DOI:10.13300/j.cnki.hnlkxb.1992.03.007.
[37] 贺瑞, 彭赟, 刘扬, 等. 低氮胁迫下香蕉硝酸盐转运蛋白Manrt2基因的克隆与表达分析[J]. 热带生物学报, 2016, 7(1): 76-81.DOI:10.15886/j.cnki.rdswxb.2016.01.013.
[38] 孔敏, 杨学东, 侯喜林, 等. 白菜NRT2基因的克隆及表达模式分析[J].园艺学报, 2011, 38(2): 2309-2316. DOI:10.16420/j.issn.0513-353x.2011.12.014.
[39] MARTINOIA E, WIEKEN A. Vacuoles as storage compartments for nitrate in barley leaves[J]. Nature, 1981, 289: 292-294. DOI:10.1038/289292a0.
[40] TSAY Y F, SCHROEDER J I, FELDMANN K A, et al. The herbicide sensitivity gene CHL1 of arabidopsis encodes a nitrate-inducible nitrate transporter[J]. Cell, 1993, 72(5): 705-713. DOI:10.1016/0092-8674(93)90399-B.
[41] 庞永奇, 王高奇, 王旭初, 等. 植物水孔蛋白的亚细胞分布与生理功能研究浅析[J]. 生物化学与生物物理进展, 2012, 39(10): 962-971.DOI:10.3724/SP.J.1206.2011.00617.
Nitrate Content, Activities of Key Enzymes for Nitrogen Metabolism, and Expression and Subcellular Localization of NRT1 in Different Nitrate-Enriched Varieties of Pakchoi (Brassica chinensis L.)
LI Yanhua, YANG Yun, XU Weihong*, ZHOU Xinbin, WANG Weizhong, CHI Sunlin, LI Tao, ZHANG Chunlai,ZHAO Wanyi, QIN Yuli, WANG Zhengyin, XIE Deti
(College of Resources and Environment, Southwest University, Chongqing 400715, China)
李彦华, 杨芸, 徐卫红, 等. 不同小白菜品种硝酸盐含量、氮代谢关键酶活性及NRT1表达和亚细胞定位[J]. 食品科学,
2018, 39(7): 78-84.
LI Yanhua, YANG Yun, XU Weihong, et al. Nitrate content, activities of key enzymes for nitrogen metabolism, and expression and subcellular localization of NRT1 in different nitrate-enriched varieties of pakchoi (Brassica chinensis L.)[J]. Food Science,2018, 39(7): 78-84. (in Chinese with English
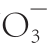 )∶c(N
)∶c(N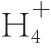 )分别为50∶50、75∶25和100∶0)对低硝酸盐富集品种‘香港特选奶白菜’和高硝酸盐富集品种‘揭农四号春白菜’硝酸盐含量、氮代谢关键酶活性的影响,并探讨了两个品种小白菜硝酸盐转运蛋白基因的表达和亚细胞定位。结果表明:‘香港特选奶白菜’和‘揭农四号春白菜’在硝铵比100∶0处理中,叶硝酸盐含量分别较硝铵比50∶50处理增加了13.2%和30.4%,叶柄硝酸盐含量增加了14.3%和4.9%。随着硝铵比的增加,小白菜叶片硝酸还原酶、谷氨酸合成酶活力呈降低趋势,亚硝酸还原酶活力呈上升趋势,谷氨酸脱氢酶活力呈先增加后降低趋势,且两个小白菜品种之间差异显著。低亲和硝酸盐转运蛋白(nitrate transporter,NRT)1基因NRT1在两个小白菜品种中均显著表达,且高富集硝酸盐品种“揭农四号春白菜”的表达量显著高于低富集硝酸盐品种‘香港特选奶白菜’的表达量。NRT1是一个定位于细胞膜上的低亲和NRT。
)分别为50∶50、75∶25和100∶0)对低硝酸盐富集品种‘香港特选奶白菜’和高硝酸盐富集品种‘揭农四号春白菜’硝酸盐含量、氮代谢关键酶活性的影响,并探讨了两个品种小白菜硝酸盐转运蛋白基因的表达和亚细胞定位。结果表明:‘香港特选奶白菜’和‘揭农四号春白菜’在硝铵比100∶0处理中,叶硝酸盐含量分别较硝铵比50∶50处理增加了13.2%和30.4%,叶柄硝酸盐含量增加了14.3%和4.9%。随着硝铵比的增加,小白菜叶片硝酸还原酶、谷氨酸合成酶活力呈降低趋势,亚硝酸还原酶活力呈上升趋势,谷氨酸脱氢酶活力呈先增加后降低趋势,且两个小白菜品种之间差异显著。低亲和硝酸盐转运蛋白(nitrate transporter,NRT)1基因NRT1在两个小白菜品种中均显著表达,且高富集硝酸盐品种“揭农四号春白菜”的表达量显著高于低富集硝酸盐品种‘香港特选奶白菜’的表达量。NRT1是一个定位于细胞膜上的低亲和NRT。





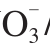 /N
/N ratio of 100:0 increased respectively by 13.2% and 30.4% compared with treatment at N
ratio of 100:0 increased respectively by 13.2% and 30.4% compared with treatment at N /N
/N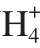 ratio of 150:50;nitrate contents in petioles of ‘HKTX’ and ‘JN4’ were increased respectively by 14.3% and 4.9% compared with treatment at N
ratio of 150:50;nitrate contents in petioles of ‘HKTX’ and ‘JN4’ were increased respectively by 14.3% and 4.9% compared with treatment at N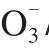 /N
/N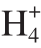 ratio of 50:50. With the increase of N
ratio of 50:50. With the increase of N /N
/N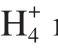 ratio, the activities of nitrate reductase (NR) and glutamate synthase (GOGAT) in pakchoi decreased, the activity of nitrite reductase (NiR) increased, and the activity of glutamate dehydrogenase (GDH) initially increased and then decreased. Significant differences in NR, GOGAT, NiR, and GDH were observed between the two varieties. Significant expression of low affinity transporter gene (NRT1) was detected in both varieties, and a higher expression level was observed in ‘JN4’ than in ‘HKTX’. NRT1 was a low affinity nitrate transporter located in the plant cell membrane.
ratio, the activities of nitrate reductase (NR) and glutamate synthase (GOGAT) in pakchoi decreased, the activity of nitrite reductase (NiR) increased, and the activity of glutamate dehydrogenase (GDH) initially increased and then decreased. Significant differences in NR, GOGAT, NiR, and GDH were observed between the two varieties. Significant expression of low affinity transporter gene (NRT1) was detected in both varieties, and a higher expression level was observed in ‘JN4’ than in ‘HKTX’. NRT1 was a low affinity nitrate transporter located in the plant cell membrane.