大豆分离蛋白(soy protein isolate,SPI)由于其良好的功能性质、营养价值及潜在的健康益处而一直是国内外的研究热点,并被广泛应用于食品的多个领域[1-3]。蛋白质的柔性可以理解为蛋白质所处外部环境变化时,其结构能够发生改变的能力,反映出蛋白质结构对环境变化的敏感性[4-6]。因其在决定蛋白功能性质尤其是界面性质中的关键作用而受到越来越多学者的关注。Tang Chuanhe等[7]研究牛血清白蛋白结构与功能性质发现,柔性越高的蛋白越易在界面形成更好的黏弹性蛋白膜,从而表现出更好的乳化性质。Kato等[8]利用不同蛋白对胰蛋白的敏感性来表征柔性,结果发现起泡性、乳化性与蛋白柔性具有较好的相关性。Tang Chuanhe[6]、Nakai[9]等认为相比于表面疏水性,蛋白柔性在决定SPI乳化性时起着更为决定性的作用。江连洲[10]总结现有食用蛋白质加工技术,首次提出蛋白质柔性化加工技术概念,即通过物理、化学及生物等加工方式改变蛋白质天然的刚性结构,使其柔性化,从而提高蛋白的功能性质。虽然柔性在蛋白质功能性质中的作用得到广泛的关注[11-13],但用胰蛋白酶的敏感性表征蛋白柔性来研究柔性与蛋白结构的关系还鲜有报道。
柔性蛋白比刚性蛋白对胰蛋白酶更加敏感[8],本实验利用SPI对胰蛋白酶的敏感性表征柔性,研究不同热处理条件对SPI柔性与结构的影响,并分析它们之间的关系,以期为进一步研究柔性在SPI结构与功能性质中的作用提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆由东北农业大学大豆研究所提供;三氯乙酸永华精细化学品有限公司;十二烷基硫酸钠、Tris、胰蛋白酶、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)荧光探针 美国Sigma公司;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB) 美国Merck公司;其他试剂均为分析纯。
1.2 仪器与设备
T18 Basic型高速分散机/匀浆机 德国IKA公司;LD4-2A低速离心机 北京医用离心机厂;TU-1800型紫外-可见分光光度计 北京普析通用仪器有限责任公司;ALPHA 1-4 LSC型冷冻干燥机 德国Christ公司;ALC-310.3型分析天平 德国艾科勒公司;紫外分光光度计 美国布鲁克海文仪器公司;F-4500荧光分光光度计 日本日立公司;恒温数显水浴锅 赛普实验仪器厂;灭菌锅 上海申安医疗器械厂。
1.3 方法
1.3.1 SPI制备
参照Sorgentini等[14]方法并略作改动。大豆粉碎后过60 目筛,乙醚低温脱脂,脱脂后豆粕与蒸馏水以1∶10(m/V)的比例混合,调pH值至8.5,室温低速搅拌2 h溶解。4 000×g离心20 min,取上清液,调pH值至4.5,4 ℃静置过夜,去上清液,4 000×g离心5 min,水洗沉淀,离心两次,复溶后调pH值至7.0,冷冻干燥。
1.3.2 SPI成分测定
蛋白质量分数测定:GB 5009.5-2010《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法;水分质量分数测定:GB 5009.3-2010《食品中水分的测定》中直接干燥法;灰分质量分数测定:GB 5009.4-2010《食品中灰分的测定》;粗脂肪的测定:GB/T 14772-2008《食品中粗脂肪的测定》。
1.3.3 样品制备
将SPI溶于缓冲液(0.2 mol/L、pH 7.0磷酸盐缓冲液),质量浓度为20 mg/mL,室温搅拌2 h,再用分散机10 000 r/min处理1 min,水化过夜。
1.3.4 热处理
将制备好的SPI样品在不同温度60、70、80、90、100 ℃(水浴)、121 ℃(灭菌锅)下处理5、10、30 min,迅速用冰水冷却5 min备用。
1.3.5 柔性测定
参照Kato等[15]的方法略作修改。利用SPI对胰蛋白酶的敏感性来表征并量化柔性。取250 μL 1 mg/mL胰蛋白酶(溶于0.05 mol/L、pH 8.0的Tris-HCl缓冲液)溶液加入到4 mL 1 mg/mL热处理后蛋白溶液中(V(蛋白):V(酶)=16∶1),38 ℃保温酶解5 min,酶解反应结束后,加4 mL 体积分数5% 三氯乙酸溶液终止酶解反应,离心后取上清液测定其在280 nm波长处吸光度,用吸光度A0表示柔性。
1.3.6 浊度测定
浊度的测定参照Kurganov等[16]的方法,并略作改动,将热处理后的SPI样品溶液用去离子水稀释至3 mg/mL,混合均匀后于400 nm波长处测定其吸光度,即为浊度值。
1.3.7 游离巯基含量测定
游离巯基的含量测定参照Beveriger等[17]的方法,并略作改动。取1 mL不同热处理后SPI样品(10 mg/mL)加入到5 mL的Tris-Gly缓冲溶液(0.086 mol/L Tris、0.09 mol/L甘氨酸、0.004 mol/L乙二胺四乙酸、8 mol/L尿素,pH 8.0)中,然后加入20 μL DTNB试剂,振荡混匀,在室温下静止反应15 min,412 nm波长处测定吸光度,以不加DTNB的溶液做空白调零。游离巯基含量按下式计算。
式中:A412nm为412 nm波长处的吸光度;ρ为固形物质量浓度/(mg/mL);D为稀释系数。
1.3.8 表面疏水性测定
参照Hayakawa等[18]方法并略作改动。用0.01 mol/L的磷酸盐缓冲液(pH 7.0)将SPI样品溶液稀释到0.100 00、0.050 00、0.002 50 mg/mL和0.001 25 mg/mL,然后加入20 μL的ANS(8 mmol/L,溶于0.01 mol/L的磷酸盐缓冲液,pH 7.0)荧光探针,混匀后在室温下避光15 min后测定样品的荧光强度,设定激发波长为390 nm,发射波长为470 nm,狭缝宽度5 nm,测得的荧光强度对蛋白溶液质量浓度作图,选择线性关系良好的回归曲线斜率作为蛋白质表面的疏水性指数。
1.3.9 紫外光谱扫描
参照Liang Haini等[19]的方法并略作改动。热处理后的SPI样品稀释至0.2 mg/mL后进行紫外光谱扫描,波长范围为250~310 nm,扫描速率为100 nm/min,分辨率为0.2 nm。
1.3.10 内源色氨酸荧光光谱
参照Liu Yan等[20]的方法并略作改动,热处理后的SPI样品用10 mmol/L磷酸盐缓冲液(pH 7.0)稀释到0.2 mg/mL进行测定,设定激发波长为290 nm,发射波长范围为300~460 nm,狭缝宽度均为2.5 nm,电压为700 mV进行荧光光谱扫描,所有测定重复3 次。
1.4 数据统计分析
每次实验做3 次平行,结果用 ±s表示,数据统计分析采用SPSS 17.0软件,组间差异显著性采用t检验分析(P<0.05);实验数据用Origin 9.0软件绘图。
2 结果与分析
2.1 SPI成分及质量分数
实验所制得的SPI蛋白质、水分、灰分和粗脂肪质量分数分别为(87.22±0.44)%、(3.24±0.67)%、(3.39±0.53)%和(0.47±0.56)%,符合实验要求。
2.2 热处理对SPI柔性与结构的影响
2.2.1 热处理温度对SPI柔性的影响
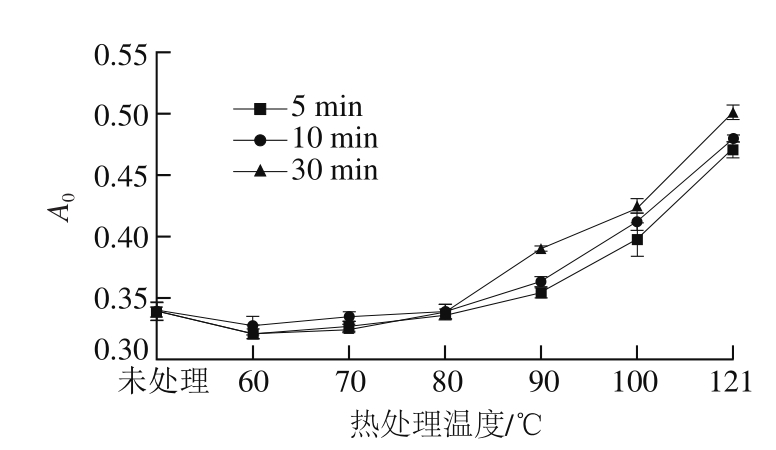
图1 不同热处理条件对SPI柔性的影响
Fig. 1 Flexibility of soy protein isolate under different heating treatment conditions
由图1可知,处理温度低于80 ℃,热处理对SPI柔性影响不显著,当温度高于80 ℃,SPI柔性随着处理温度的增加和时间的延长而增加,在121 ℃、30 min时达到最大。有文献表明SPI中7S变性温度在70 ℃以上,而11S的变性温度大约在95 ℃左右[21]。处理温度低于70 ℃,热处理不足以破坏SPI的刚性结构,所有热处理对柔性影响不显著,而高于80 ℃热处理会破坏维系SPI刚性结构的共价和/或非共价作用[21-22](如范德华力、氢键、静电相互作用、二硫键、疏水作用等)从而造成SPI柔性的增加。
2.2.2 热处理温度对SPI浊度的影响

图2 不同热处理条件对SPI浊度的影响
Fig. 2 Turbidity of soy protein isolate under different heating treatment conditions
由图2可知,随着处理温度的升高和处理时间的延长,SPI浊度逐渐增加,并在100 ℃处理条件下达到最大,热处理温度高于100 ℃,随着SPI柔性持续增加,浊度却发生了显著下降。Cromwell等[23]认为浊度与溶液中聚集体大小和数量有关,处理温度在60~100 ℃,柔性的增强有利于SPI聚集体的形成而导致浊度的上升,处理温度为121 ℃时柔性与浊度表现出相反的变化趋势,可能是由于121 ℃高温会使SPI形成较大的聚集体(实验过程中发现有沉淀产生)从而导致浊度的下降,但会持续破坏维系SPI刚性结构的化学键(如二硫键,图3)从而导致SPI柔性的增加。
2.2.3 热处理温度对SPI游离巯基含量的影响
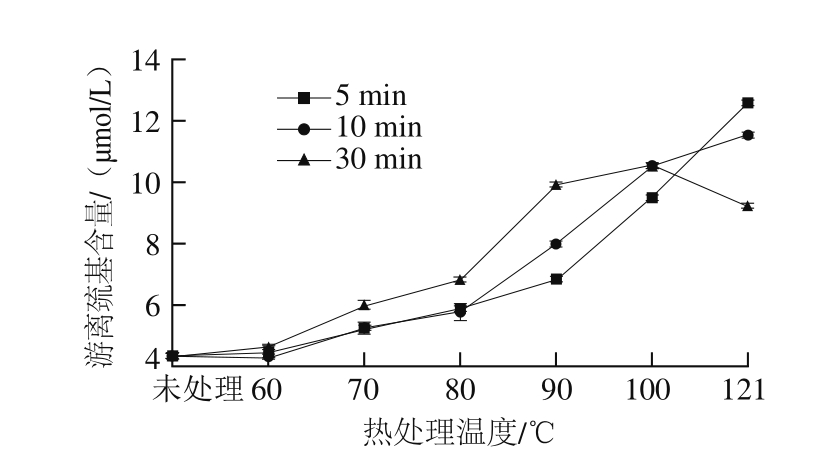
图3 不同热处理条件对SPI游离巯基含量的影响
Fig. 3 Content of free sulfhydryl groups in soy protein isolate under different heating treatment conditions
由图3可知,热处理温度高于60 ℃,SPI游离巯基含量随柔性上升而上升,在121 ℃处理5 min时达到最大,随后游离巯基含量随着时间的延长而下降。原因可能是当SPI柔性上升到某一个值时,柔性的增加反而有利于断裂生成的游离巯基在冷却过程中发生重排,形成新的二硫键,从而导致游离巯基含量的下降。
2.2.4 热处理温度对SPI表面疏水性的影响
由图4可知,SPI表面疏水性与浊度表现出相同的变化趋势,随着处理温度的升高和处理时间的延长,SPI表面疏水性随柔性增加逐渐增大,在处理温度为100 ℃时达到最大,随后又下降。可能的解释为在一定范围内柔性的增加伴随着原来隐藏在SPI内部的疏水基团暴露在外从而导致表面疏水性的上升,而在121 ℃处理条件下形成的柔性更大的松散肽链在冷却过程中易发生疏水相互作用引起蛋白质的疏水聚集,导致SPI表面疏水性的降低。121 ℃处理条件下SPI表面疏水性的降低和游离巯基含量上升的结果与Wang Jinmei等[24]研究结果相似,他们认为在这种情况下聚集体更易由疏水相互作用稳定,部分游离巯基内卷于聚集体内部,抑制了分子间二硫键的形成,以维持蛋白的柔性构象。

图4 不同热处理条件对SPI表面疏水性的影响
Fig. 4 Surface hydrophobicity of soy protein isolate under different heating treatment conditions
2.2.5 热处理SPI的紫外光谱分析
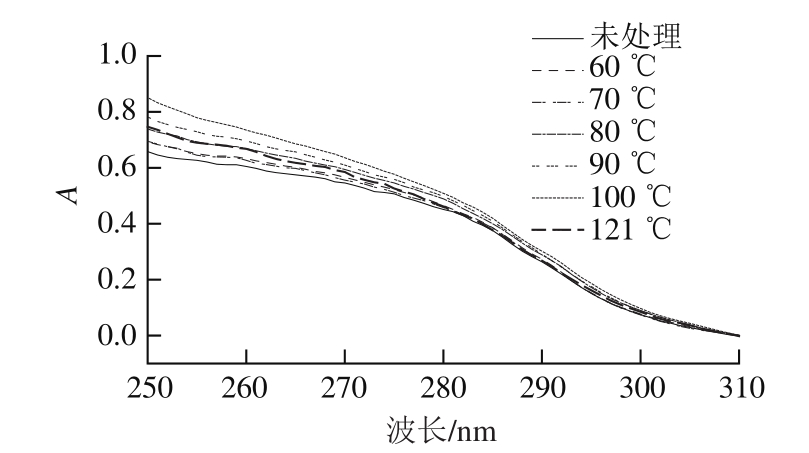
图5 热处理10 min SPI紫外吸收光谱
Fig. 5 UV spectra of SPI with 10 min heating treatment
蛋白质产生紫外吸收光谱主要是由于色氨酸和酪氨酸残基侧链基团对紫外光的吸收作用,据蛋白质对紫外光谱吸收的不同,可以推断蛋白质分子在溶液中构象的变化[25]。由图5可知,热处理温度在80~100 ℃范围,SPI紫外吸收强度随着柔性的增加而增加,表明随柔性增加,SPI分子内部发色基团暴露在外部,SPI结构变得更加舒展。而当处理温度上升到121 ℃过程中,紫外吸收强度随柔性的继续上升而下降(5、30 min处理条件结果相似),可能是因为聚集体的形成(2.2.2节)导致暴露在外部的发色基团重新隐藏在内部从而导致紫外吸收强度的降低[25]。
2.2.6 热处理SPI的内源色氨酸荧光光谱分析
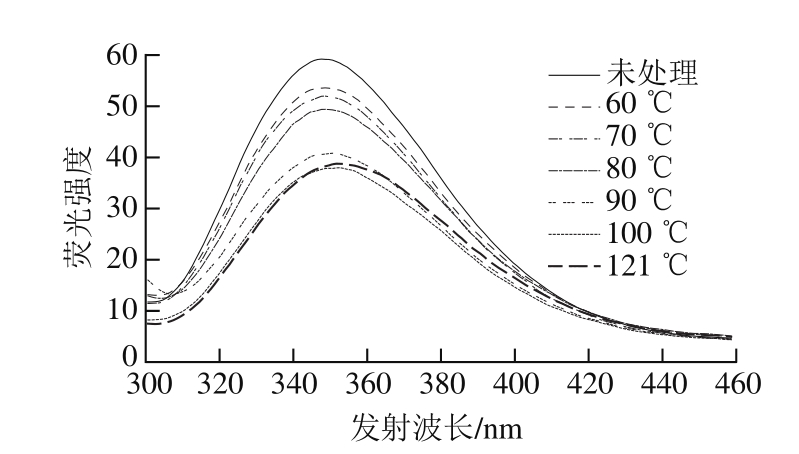
图6 热处理10 min SPI内源色氨酸荧光光谱
Fig. 6 Typical intrinsic emission fluorescence spectra of SPI with 10 min heating treatment
蛋白质内源荧光强度及发射波长主要取决于暴露于溶液环境中的酪氨酸和色氨酸残基的极性,或者两者之间的相互作用。当蛋白质结构展开,发色团暴露于溶剂中会导致溶液荧光强度的降低[26-27]。由图6可知,不同的热处理条件,并没有导致SPI在最大发射波长发生偏移。然而,热处理温度在60~100 ℃范围,所有经过热处理的SPI样品的荧光强度都降低,原因可能是热处理导致SPI的柔性增加,使得更多的发色团暴露于溶剂中发生荧光猝灭从而导致荧光强度降低,这与Liang Haini等[19]的研究结构一致,他们认为一定浓度尿素处理能降低牛血清白蛋白内源性色氨酸荧光强度。而当处理温度继续升到121 ℃时,荧光强度随柔性的继续上升又有了轻微上升(5、30 min处理条件结果相似),这与2.2.5节的结果一致,推测也可能是由于较大聚集体的形成导致。
2.3 SPI柔性与结构关系分析
相关性分析指出,当热处理温度范围在60~100 ℃时,SPI柔性与浊度、游离巯基含量、表面疏水性呈显著正相关关系,相关性系数分别为0.956、0.954、0.954。SPI浊度、游离巯基含量与表面疏水性随柔性上升而上升,其中浊度与柔性相关性最好,其次分别为游离巯基含量和表面疏水性。
为进一步确定SPI柔性与结构的关系,将处理温度在60~100 ℃的柔性与浊度、游离巯基含量、表面疏水性分别进行曲线拟合,结果如图7所示。
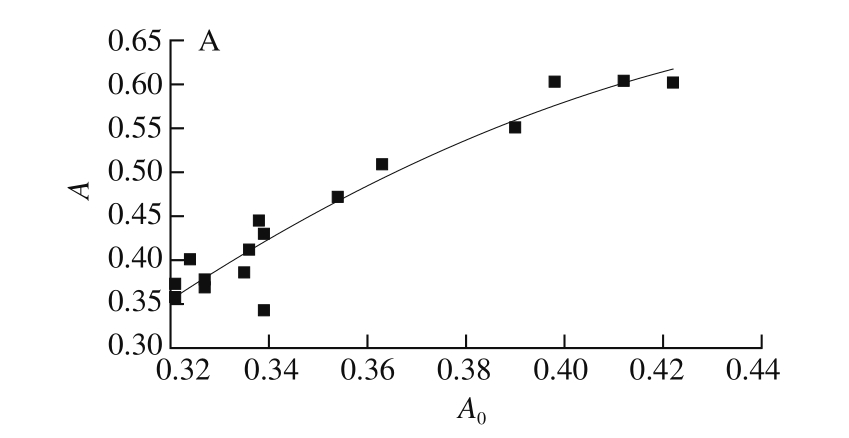

图7 SPI柔性与浊度(A)、游离巯基含量(B)、表面疏水性(C)拟合曲线
Fig. 7 Fitting curves of turbidity (A), free sulfhydryl group content (B),and surface hydrophobicity (C) of SPI as a function of flexibility
处理温度在60~100 ℃范围,SPI柔性与浊度、游离巯基含量、表面疏水性的多项式拟合模型函数分别为y=-1.937 57+10.640 22x-10.866 98x2、y=-42.404 3+210.036 8x-198.824 56x2、y=-1 674.016 59+8 421.410 56x-9 259.539 27x2,其中拟合度分别为0.911 24、0.902 59、0.915 15。浊度、游离巯基含量、表面疏水性在60~100 ℃范围都能与柔性进行较好的拟合,且拟合度都在0.900 00以上,表明SPI浊度、游离巯基含量和表面疏水性与柔性有较强的相关性。
3 结 论
热处理温度低于80 ℃时,对SPI柔性影响不显著,热处理温度高于80 ℃时,SPI柔性随处理温度的增加和时间的延长而增加。
热处理温度在60~100 ℃范围,SPI柔性与浊度、游离巯基含量、表面疏水性呈显著正相关关系,相关性系数分别为0.956、0.954、0.954。热处理温度在100~121 ℃范围时,浊度、表面疏水性随着柔性上升而下降,游离巯基含量随着柔性的上升继续上升,在121 ℃、5 min到达最大值,随后又下降。
热处理温度在80~100 ℃范围时,随着SPI柔性的增加,其结构更加舒展。
参考文献:
[1] NISHINARI K, FANG Y, GUO S, et al. Soy proteins: a review on composition, aggregation and emulsification[J]. Food Hydrocolloids,2014, 39(2): 301-318. DOI:10.1016/j.foodhyd.2014.01.013.
[2] FRIEDMAN M, BRANDON D L. Nutritional and health benefits of soy proteins[J]. Journal of Agricultural and Food Chemistry, 2001,49(3): 1069-1086. DOI:10.1021/jf0009246.
[3] MA L, LI B, HAN F, et al. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk[J]. Food Chemistry, 2015, 173: 694-701. DOI:10.1016/j.foodchem.2014.10.096.
[4] DAMODARAN S. Protein stabilization of emulsions and foams[J].Journal of Food Science, 2005, 70(3): R54-R66. DOI:10.1111/j.1365-2621.2005.tb07150.x.
[5] AND L R, DAMODARAN S. Surface activity-compressibility relationship of proteins at the air-water interface[J]. Langmuir, 1999,15(4): 1392-1399. DOI:10.1021/la980873v.
[6] TANG Chuanhe. Emulsifying properties of soy proteins: a critical review with emphasis on the role of conformational flexibility[J].Critical Reviews in Food Science and Nutrition, 2015, 57(12):2636-2679. DOI:10.1080/10408398.2015.1067594.
[7] TANG Chuanhe, SHEN Lan. Role of conformational flexibility in the emulsifying properties of bovine serum albumin[J]. Journal of Agricultural and Food Chemistry, 2013, 61(12): 3097-3110.DOI:10.1021/jf305471k.
[8] KATO A, KOMATSU K, FUJIMOTO K, et al. Relationship between surface functional properties and flexibility of proteins detected by the protease susceptibility[J]. Journal of Agricultural and Food Chemistry,1985, 33(5): 931-934. DOI:10.1021/jf00065a039.
[9] NAKAI S, MODLER H W. Food proteins: properties and characterization[J]. Food Science & Technology, 1997, 75(3): 199-200 DOI:10.1016/S0960-3085(97)70073-7.
[10] 江连洲. 食用蛋白质柔性化加工技术概述[J]. 中国食品学报, 2015,15(8): 1-9. DOI:10.16429/j.1009-7848.2015.08.001.
[11] BOHR H, BOHR J. Microwave-enhanced folding and denaturation of globular proteins[J]. Physical Review E Statistical Physics Plasmas Fluids and Related Interdisciplinary Topics, 2000, 61(4): 4310-4314.DOI:10.1103/PhysRevE.61.4310.
[12] JING L, CAI Y, WEI W U, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International, 2014, 62(6): 595-601. DOI:0.1016/j.foodres.2014.04.022.
[13] KEERATI-U-RAI M, CORREDIG M. Effect of dynamic high pressure homogenization on the aggregation state of soy protein[J].Journal of Agricultural and Food Chemistry, 2009, 57(9): 3556-3562.DOI:10.1021/jf803562q.
[14] SORGENTINI D A, WAGNER J R. Comparative study of structural characteristics and thermal behavior of whey and isolate soybean proteins[J]. Food Chemistry, 1999, 23(5): 489-507. DOI:10.1111/j.1745-4514.1999.tb00033.x.
[15] KATO A, IBRAHIM H R, WATANABE H, et al. Structural and gelling properties of dry-heating egg white proteins[J]. Journal of Agricultural and Food Chemistry, 2002, 38(1): 32-37 DOI:10.1021/jf00091a007.
[16] KURGANOV B I. Kinetics of protein aggregation. quantitative estimation of the chaperone-like activity in test-systems based on suppression of protein aggregation[J]. Biochemistry, 2002, 67(4): 409-422. DOI:10.1023/A:1015277805345.
[17] BEVERIGER T, TOMA S, NAKAI S. Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J]. Journal of Food Science, 1974, 39(1): 49-51. DOI:10.1111/j.1365-2621.1974.tb00984.x.
[18] HAYAKAWA S, NAKAI S. Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J]. Journal of Food Science, 1985, 50(2): 486-491. DOI:10.1111/j.1365-2621.1985.tb13433.x.
[19] LIANG Haini, TANG Chuanhe. Emulsifying and interfacial properties of vicilins: role of conformational flexibility at quaternary and/or tertiary levels[J]. Journal of Agricultural and Food Chemistry, 2013,61(46): 11140-11150. DOI:10.1021/jf403847k.
[20] LIU Yan, ZHAO Guanli, ZHAO Mouming, et al. Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J]. Food Chemistry, 2012, 131(3):901-906. DOI:10.1016/j.foodchem.2011.09.074.
[21] SORGENTINI D A, WAGNER J R, ANON M C. Effects of thermal treatment of soy protein isolate on the characteristics and structurefunction relationship of soluble and insoluble fractions[J]. Journal of Agricultural and Food Chemistry, 1995, 43(9): 2471-2479.DOI:10.1021/jf00057a029.
[22] VOUTSINAS L P, CHEUNG E, NAKAI S. Relationships of hydrophobicity to emulsifying properties of heat denatured proteins[J].Journal of Food Science, 1983, 48(1): 26-32. DOI:10.1111/j.1365-2621.1983.tb14781.x.
[23] CROMWELL M E M, HILARIO E, JACOBSON F. Protein aggregation and bioprocessing[J]. The AAPS Journal, 2006, 8(3):E572-E579. DOI:10.1208/aapsj080366.
[24] WANG Jinmei, XIA Ning, YANG Xiaoquan, et al. Adsorption and dilatational rheology of heat-treated soy protein at the oilwater interface: relationship to structural properties[J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 3302-3310.DOI:10.1021/jf205128v.
[25] RUSO J M, GONZÁLEZPÉREZ A, PRIETO G, et al. Study of the interactions between lysozyme and a fully-fluorinated surfactant in aqueous solution at different surfactant-protein ratios[J]. International Journal of Biological Macromolecules, 2003, 33(1/2/3): 67-73.DOI:10.1016/S0141-8130(03)00068-0.
[26] PALLAR S I, VENDRELL J, AVIL S F X, et al. Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J]. Journal of Molecular Biology, 2004, 342(1): 321-331. DOI:10.1016/j.jmb.2004.06.089.
[27] DUFOUR E, HOA G H, HAERTLÉ T. High-pressure effects on betalactoglobulin interactions with ligands studied by fluorescence[J].Biochimica et Biophysica Acta, 1994, 1206(2): 166-172.DOI:10.1016/0167-4838(94)90204-6.