进入21世纪,气候变暖趋势越来越明显,亚洲中高纬地带变暖最为显著[1],高温强光等极端天气在我国葡萄产区生长季节频繁出现,对葡萄生产造成了逆境伤害[2]。生产上人们比较重视高温强光对葡萄叶片和果实生长的影响,如日灼和气灼现象[3-4],但较少关注其对葡萄次生代谢品质的影响。花色苷作为葡萄次生代谢的重要产物,是葡萄的主要呈色物质,影响着葡萄浆果及葡萄酒的色泽、风味及营养价值等[5];同时,由于其结构类似单宁、类黄酮、黄烷醇,属于具有苯环结构的含羟基衍生物酚类物质,可以有效清除活性氧粒子[6-7]。抗氧化性是花色苷一项重要的生理功能[8-9],但高温能显著加重其降解[10-11],从而降低葡萄与葡萄酒的品质。因此,寻找一种科学有效的方式来应对气候变暖对葡萄造成的伤害已迫在眉睫。通过改变葡萄栽培架式或叶幕类型来调控微气候,从而改善果实品质是一个简便易行的技术措施。研究表明,果实转色期气温差及生育全期平均相对湿度对果实综合品质具有重要影响[12],而合理的叶幕类型可有效降低果实表面温度,使花色苷等重要次生代谢物质含量达到最优水平[13]。因此,选择适宜的叶幕类型是保证葡萄品质的基础,对我国葡萄产业的发展具有积极作用。酿酒葡萄主要采用篱架栽培,其形成的直立叶幕光照充足,作业方便,但叶幕周边的微气候波动较大,相比之下,棚架水平叶幕下果实周边微气候相对稳定,而外部又光照充足,可提高果实品质[14]。
本实验以酿酒与鲜食兼用葡萄品种‘摩尔多瓦’为试材,通过比较不同叶幕类型形成的微气候对葡萄花色苷的影响,寻求有利于提高葡萄浆果花色苷品质的栽培架式,同时结合外部环境与内部机制来探讨两种叶幕类型对果实花色苷的影响,为应对气候变化而改变栽培架式提供充分的理论依据。
1 材料与方法
1.1 材料与实验环境
以2010年定植的鲜食与酿酒兼用品种‘摩尔多瓦’(Moldova:Guzal Kala×Villard blanc)为试材。实验于2015—2016年在山东农业大学核心葡萄示范园进行,其所在地位于东经117°08’,北纬36°11’,属于暖温带半湿润性季风气候,其年平均气温12.9 ℃,10 ℃以上的活动积温为4 213 ℃,年平均降水量约为700 mm,年平均日照时间约为2 627 h。
1.2 仪器与设备
L92-1温湿度监测器 中国路格科技有限公司;PB-10 pH计 德国Sartorius公司;CR-10便携式测色仪中国柯盛行仪器有限公司;GL-20G-Ⅱ离心机 中国安科公司;SHB-III真空泵 中国长城科工贸有限公司;YRE-52C旋转蒸发仪 中国予华仪器有限责任公司;ZMD 4000高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)仪美国Waters公司。
1.3 方法
1.3.1 植株栽培与实验前处理
以小棚架龙干形代表水平叶幕、篱架单干单臂形代表直立叶幕,棚架和篱架均为南北行向,行距2.2 m,高2 m,棚架株距1.7 m,篱架株距1.2 m,两种架式均从新梢发育开始控制留梢量,每平方米5 个结果枝、50~55 个叶片,每个结果枝留2 个果穗,在黄豆大小时疏去副穗和穗尖。棚架和篱架每个架式各36 株,均种植2 行。生长期内修剪及肥水管理等技术统一。2015年6月1日及2016年6月4日(果实膨大期)分别在棚架、篱架距离果穗处5 cm左右安装温湿度监测器各两套,每30 min记录一次果实周围温湿度,每日记录48 个数值,直至果实成熟。
2015年将每种叶幕类型分为4 个小区(9 株/小区),自转色期(7月27日、花后9~11 周)至成熟期(9月17日、花后15 周)每2 周采样一次,共4 次。采样时,每个小区随机采集4 个果穗,其中篱架直立叶幕为东西两侧交叉采样,取靠近中间部位新梢上的果穗,立即带回实验室取下果粒,同一小区分别混匀,各小区每5 粒浆果剥皮后,果皮单独成包,每个时期每个处理至少15 包,液氮冷冻后存于-80 ℃,供花色苷代谢途径相关基因表达量、酶活力及花色苷单体测定,另保留部分剪取的果实鲜样测定果实品质,其余果实(测定时去除种子,仅使用果皮及果肉)用液氮冷冻后,置于-40 ℃冰箱保存,供其他果实品质相关指标测定。
1.3.2 测定指标
1.3.2.1 基本生理指标及次生代谢产物含量的测定
果实百粒质量、pH值、可滴定酸、色度的测定取混匀的新鲜果实,其余指标的测定均取冻存的样品。
取100 粒浆果使用天平称取质量,即为浆果百粒质量,重复5 次;取5 粒浆果,挤汁离心后用pH计测定果汁的pH值;酸碱滴定法测定可滴定酸质量浓度[21],重复3 次。
取单粒浆果使用便携式测色仪测定果实色度,重复30 次。L、a、b分别表示果实亮度、红绿度、黄蓝度,以篱架果实为对照,按式(1)计算棚架与篱架的色差值(ΔE)。
式中:L、a、b值表示测定的棚架果实值,L0、a0、b0值表示测定的篱架果实值。ΔE范围为0.0~0.5,表示色差微小;0.5~1.0表示色差微小到中等;1.0~2.0表示色差中等;2.0~4.0表示色差较大。
3,5-二硝基水杨酸法测定果实还原糖质量浓度[22];Folir-Denis法测定果实单宁含量[23];Folin-Cioealetu法测定果实总酚含量[24];亚硝酸盐-氯化铝法测定果实类黄酮含量[25];香草醛-盐酸法测定果实黄烷醇含量[26];pH示差法测定果实花色苷含量[27];铁还原法测定果实抗坏血酸的含量[22]。所有指标均按田间重复进行测定,每个样品平行测定3 次。
1.3.2.2 葡萄果皮花色苷单体含量的测定
花色苷单体的测定采用HPLC-MS技术,色谱条件如下:色谱柱为BEH C18柱(100 mm×2.1 mm,7 μm)流动相A为乙腈,流动相B为2%甲酸水溶液,流速为0.3 mL/min,柱温45 ℃,进样量为5 μL,检测波长为520 nm。洗脱程序为0~20 min,6%~16% A;20~28 min,16%~23% A;28~35 min,23%~50% A;35~37 min,50% A;37~40 min,50%~6% A。
MS仪鉴定花色苷,设置双通道,正离子模式,MS范围为50~2 000 m/z,1通道和2通道的碰撞能量分别为6.0 eV和25.0 eV,毛细管电压为3.0 kV,锥孔电压为30.0 V,锥孔气流速和脱溶剂气流速分别为10 L/h和700 L/h,离子源温度和脱溶剂气温度分别为100 ℃和400℃。标准物质为二甲花翠素3-O-葡萄糖苷(malvidin-3-O-glucoside,Mv),做Mv的外标定量,质量浓度梯度为0~500 mg/L,7 个水平,其他花色苷以Mv含量计。本研究花色苷定性工作基于葡萄与葡萄酒花色苷HPLC-UV-MS/MS指纹谱库[15-16],利用MS全离子扫描图谱,通过对样品质谱分析、保留时间及与文献[17]报道比对分析,确定单体花色苷的种类。MS结果用Mass Lynx V4.1分析软件进行分析,物质结构的鉴定参考标准物质及Lopes-da-Silva等[18]的方法。
1.3.2.3 葡萄果皮基因相对表达量的测定
浆果果皮花色苷RNA的提取、定量参照文献[19]的方法并略有改动,测定花色苷代谢途径中的合成基因VvUFGT与VvLDOX、修饰基因Vv5GT与VvOMT及降解基因VvPPO 5 个基因的相对表达量。具体步骤如下:1)取0.1 g左右液氮研磨的葡萄果皮,加入1 mL提取试剂(4 ℃),振荡至彻底混匀,室温下平放5 min,4 ℃、1 200 r/min离心5 min,上清液转入新的无RNase离心管中,加入200 μL的5 mol/L NaCl。2)加入600 μL氯仿,上下颠倒间歇性振荡混匀5 min,之后于4 ℃、1 200 r/min离心10 min,取上层水相转入新的无RNase离心管中(重复此步骤一次)。3)加入与所得水相等体积提前冷冻的异丙醇,混匀,于-20 ℃环境中放置30 min后,4 ℃、1 200 r/min离心20 min,弃掉上清液,加入1 mL 75%的乙醇溶液,再次离心后倒出液体,室温下晾干2~3 min。4)加入10 μL无RNase水,反复吹打混匀,充分溶解RNA,-80 ℃保存。
1.3.2.4 葡萄果皮相关酶活力的测定
相关酶活力的测定采用酶联免疫吸附分析(enzyme-linked immunosorbent assay,ELISA)方法,具体参照曹鹏[20]的实验方法,略有修改。酶的活力单位以U表示,即在特定条件下,1 min内转化1 μmol底物(或者底物中1 μmol有关基团)所需的酶量。具体步骤如下:
取1 g组织加入9 mL pH 7.4磷酸盐缓冲液(phosphate buffered saline,PBS),混匀,2 000~3 000 r/min离心20 min,收集上清液待检。将标准品按照说明书稀释5 个梯度,各个梯度每孔加样量都为50 μL。
加样:分别设空白孔、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL,轻轻晃动混匀。用封板膜封板后置37 ℃温育30 min。揭掉封板膜,弃去液体,甩干,每孔加满稀释洗涤液,静置30 s后弃去,重复5 次,拍干。
加酶:每孔加入酶标试剂50 μL,空白孔除外。温育:用封板膜封板后置37 ℃温育30 min。揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,重复5 次,拍干。
显色:每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色15 min。终止:每孔加终止液50 μL,终止反应。
以空白孔调零,于450 nm波长处依序测量各孔的吸光度。测定应在加终止液后15 min内进行。
1.4 数据统计处理
采用Excel 2010软件对数据进行处理分析及作图,采用DPS 7.05单因素试验统计分析法进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 叶幕类型对葡萄果际微气候及基本生理指标的影响
2.1.1 不同架式/叶幕类型微域环境温度差异
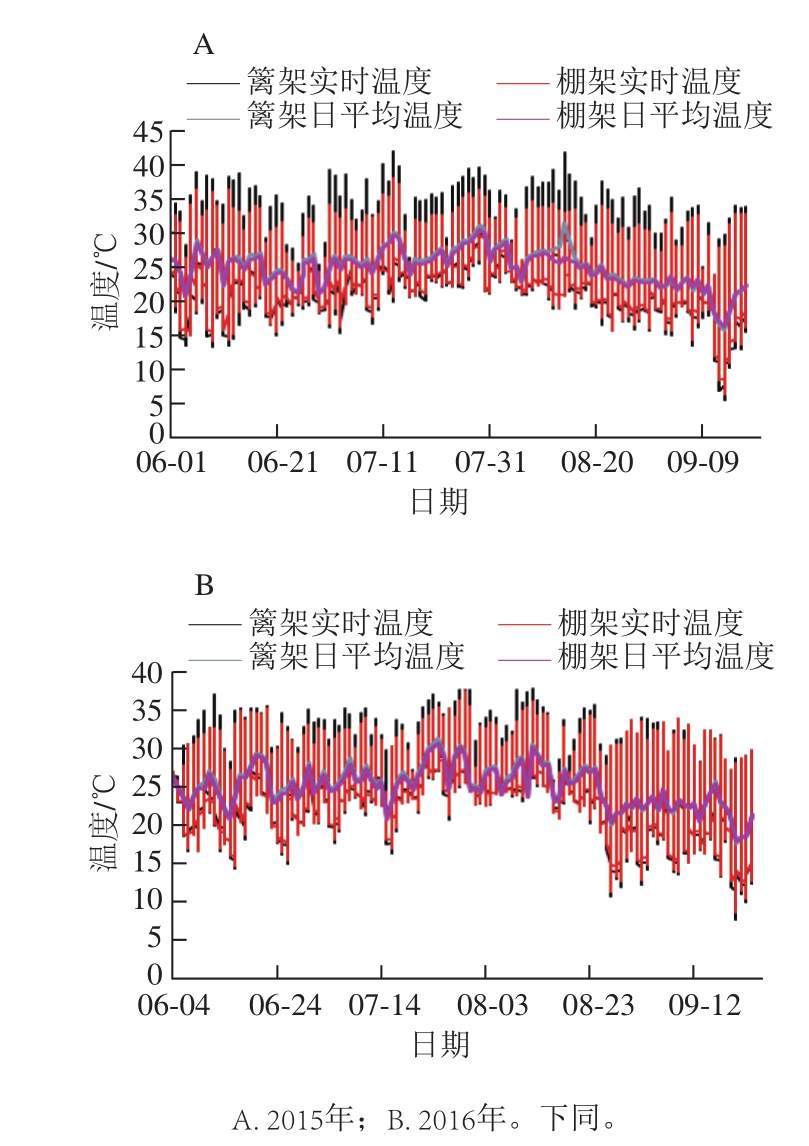
图1 架式/叶幕类型对果际温度的影响
Fig. 1 Effects of trellis systems/ canopy types on temperature around grape fruits
2015、2016两年的温度监控数据均显示,棚架水平叶幕下的实时温度波动及日平均气温均小于篱架直立叶幕(图1),即棚架的水平叶幕具有较明显的小气候调节作用,这种效果在高温天气尤为显著。经统计,在高温月7~8月,2015年篱架直立叶幕下35 ℃以上实时高温所占总测定数据的14.05%,是棚架水平叶幕的5.22 倍,2016年果实发育期间,高温比例相对较低,但篱架直立叶幕35 ℃以上实时高温所占总数据的比例也达到了8.77%,是棚架水平叶幕的3.18 倍。
2.1.2 不同架式/叶幕类型微域环境湿度差异

图2 架式/叶幕类型对果际湿度的影响
Fig. 2 Effects of trellis systems/canopy types on humidity around grape fruits
与篱架相比,棚架直立叶幕日平均湿度相对较高、波动范围较小(图2)。实时监控果实发育期6~9月的温湿度变化结果表明,2015年监控期内棚架下微环境实时湿度在60%~80%范围的比例为20.75%,比篱架高28.95%;而易引发病害的高湿天气(相对湿度≥90%)的比例为38.43%,反比篱架的低4.53%;2016年与2015年相比,测定期内降水较多,棚架下相对湿度60%~80%的比例比篱架高3.10%;相对湿度不低于90%的比例比篱架低3.77%。
2.2 叶幕类型对葡萄果实基本生理指标的影响
表1 叶幕类型对葡萄果实基本生理指标的影响
Table 1 Effects of canopy types on physicochemical indexes of grapes
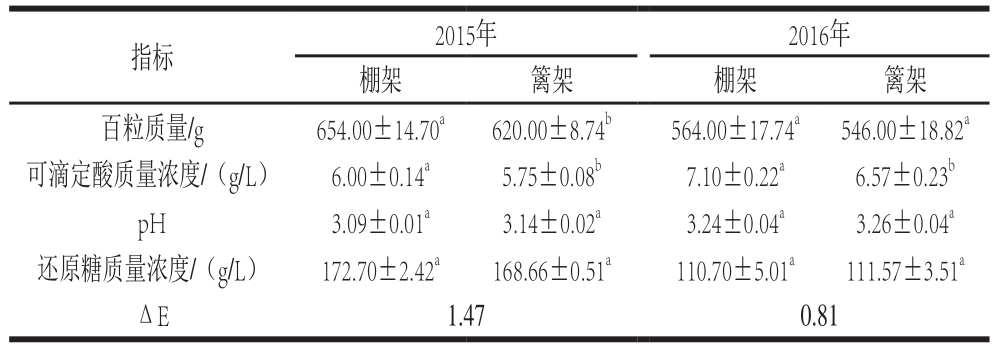
注:同行同一年份肩标字母不同表示差异显著(P<0.05)。下同。
棚架水平叶幕果实百粒质量、可滴定酸质量浓度、还原糖质量浓度整体高于篱架直立叶幕果实(表1)。2015年,棚架水平叶幕果实百粒质量、可滴定酸和还原糖质量浓度分别比篱架直立叶幕果实显著增高5.48%、4.35%、2.39%;2016年棚架与篱架果实百粒质量差异缩小至3.30%,可滴定酸含量差异增大到8.07%,还原糖质量浓度比篱架果实略低,但差异并不显著。连续两年,两种叶幕类型下果实均达到中等色差,即叶幕类型改变果实色泽。
2.3 叶幕类型对葡萄果实次生代谢产物含量的影响
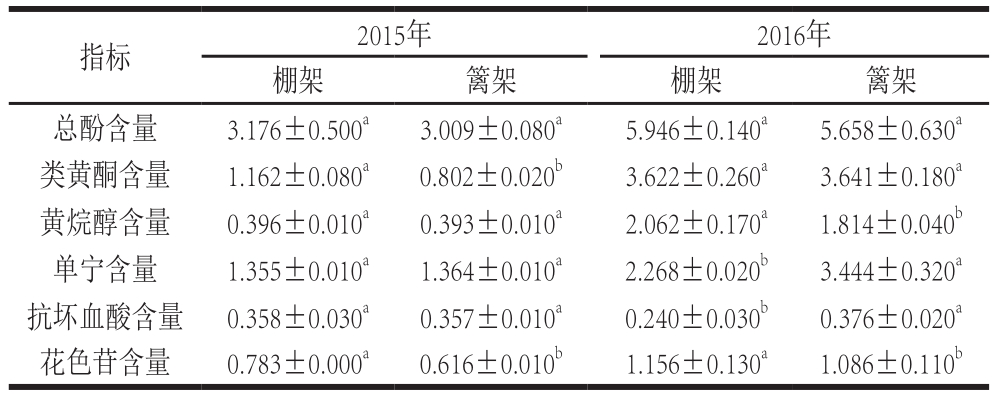
由表2可知,2015年棚架水平叶幕葡萄果实花色苷、类黄酮含量分别比篱架直立叶幕果实高27.11%、44.89%,而总酚、黄烷醇、单宁、抗坏血酸含量无显著差异;2016年棚架水平叶幕果实总酚、黄烷醇、花色苷含量分别比篱架直立叶幕果实高5.09%、13.67%、6.45%,但单宁、抗坏血酸含量均显著低于篱架直立叶幕果实(表2)。
表2 叶幕类型对葡萄果实次生代谢产物含量的影响
Table 2 Effects of canopy types on secondary metabolites of grape fruits mg/g
2.4 叶幕类型对葡萄果皮花色苷单体的影响
‘摩尔多瓦’的花色苷以双葡萄糖苷花色苷为主(表3)。花后9 周即转色初期,两种叶幕葡萄果皮的花色苷单体组分并不相同,且花色苷单体以基本结构花色苷为主,仅检测到二甲花翠素3-O-(c-6-O-香豆酰)葡萄糖苷-5-O-葡萄糖苷、花翠素3-O-(6-O-香豆酰)葡萄糖苷等6种香豆酰化花色苷单体,且除二甲花翠素3-O-(c-6-O-香豆酰)葡萄糖苷外,均以篱架直立叶幕葡萄果皮的含量较高;花后11 周是花色苷单体含量及种类急剧增加阶段,棚架水平叶幕花色苷单体种类完善且完成各种修饰,而篱架直立叶幕花色苷单体含量增长相对缓慢,直至花后15 周才检测到所有的花色苷单体,修饰节奏亦相对缓慢。果实成熟时(花后15 周),两种叶幕下的葡萄果皮中均检测到21 种花色苷单体,但其单体含量差异较大。
果实成熟时,棚架水平叶幕葡萄果皮中有19 种花色苷单体含量高于篱架直立叶幕的,其中13 种单体含量差异达显著水平,花翠素3-O-(6-O-乙酰)葡萄糖苷、甲基花翠素3-O-(6-O-乙酰)葡萄糖苷、二甲花翠素3-O-(c-6-O-香豆酰)葡萄糖苷-5-O-葡萄糖苷、二甲花翠素-3-O-(6-O-乙酰)葡萄糖苷、甲基花青素3-O-(6-O-香豆酰)葡萄糖苷5 种花色苷单体含量分别比篱架直立叶幕的高32.59%、31.47%、39.80%、33.19%、31.09%,二甲花翠素3-O-(c-6-O-香豆酰)葡萄糖苷含量甚至比篱架直立叶幕的高74.41%,棚架水平叶幕葡萄果皮中仅有甲基花青素3-O-葡萄糖苷含量比篱架果实显著降低14.89%。
表3 叶幕类型对葡萄果皮花色苷组分及含量的影响
Table 3 Effects of canopy types on anthocyanin composition of grape skin mg/kg

注:—.未检测到。
表4 叶幕类型对成熟期葡萄果皮修饰性花色苷含量及比例的影响
Table 4 Effects of canopy types on modified anthocyanin contents and percentages in grape skin at maturity
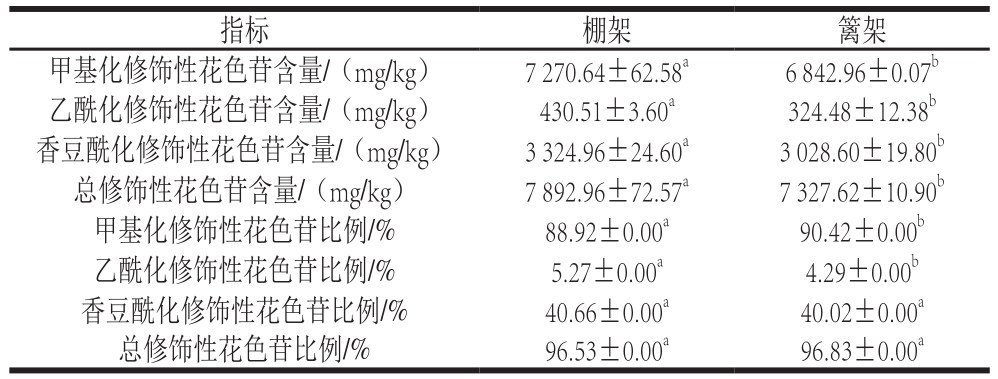
注:同行肩标字母不同表示差异显著(P<0.05)。
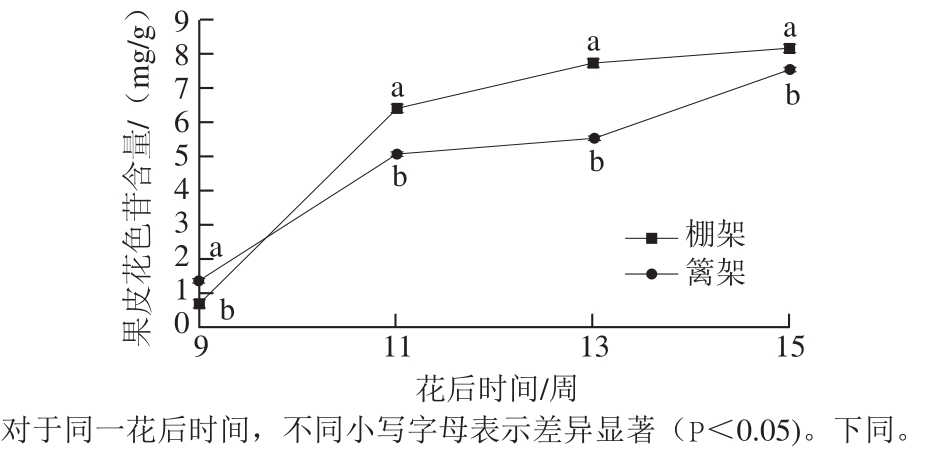
图3 叶幕类型对葡萄果皮花色苷含量的影响
Fig. 3 Effects of canopy types on anthocyanin content in grape skin
由表4可知,葡萄成熟时,在修饰性花色苷的含量方面,棚架水平叶幕葡萄果皮甲基化、乙酰化、香豆酰化修饰性花色苷含量均高于篱架,其中乙酰化修饰性花色苷含量比篱架显著提高32.68%;在花色苷的修饰程度方面,棚架葡萄果皮花色苷的乙酰化花色苷比例比篱架显著提高22.84%,香豆酰化与总修饰程度无显著差异。图3为葡萄果皮花色苷总含量变化,棚架水平叶幕葡萄果皮花色苷含量在花后9 周(转色初期)含量显著低于篱架直立叶幕,但之后增长较快,花后11 周时总含量显著高于篱架直立叶幕26.70%,11 周之后花色苷增长速率有所下降,至果实成熟时,两者果皮花色苷含量差距缩小,但棚架水平叶幕依然比篱架直立叶幕的葡萄果皮显著高8.05%。
2.5 叶幕类型对花色苷代谢途径相关基因表达量及酶活力的影响
2.5.1 对花色苷代谢相关基因表达量的影响


图4 叶幕类型对花色苷代谢途径酶相关基因表达量的影响
Fig. 4 Effects of canopy types on relative gene expression of enzymes involved in anthocyanin metabolic pathway
花色苷代谢途径中,两种叶幕类型葡萄果皮的VvUFGT、VvLDOX、Vv5GT 3 种基因表达趋势较为一致,但VvOMT、VvPPO差异较大(图4)。花后9 周,棚架葡萄果皮花色苷修饰基因Vv5GT表达量相对于篱架直立叶幕较高,合成基因VvUFGT、VvLDOX表达量则相对较低;花后11~13 周棚架水平叶幕葡萄果皮VvUFGT、VvOMT、VvPPO表达量上调,尤以修饰基因VvOMT较为显著,VvLDOX、Vv5GT表达量则显示下调状态。整个测定过程中,两种叶幕类型葡萄果皮花色苷仅有VvOMT、VvPPO在花后9~11 周表达趋势相反,花后11 周之后,除VvOMT在花后13~15 周表达略有不同外,两种叶幕类型的花色苷代谢途径相关基因表达趋势较为一致。
2.5.2 对葡萄果皮酶活力的影响
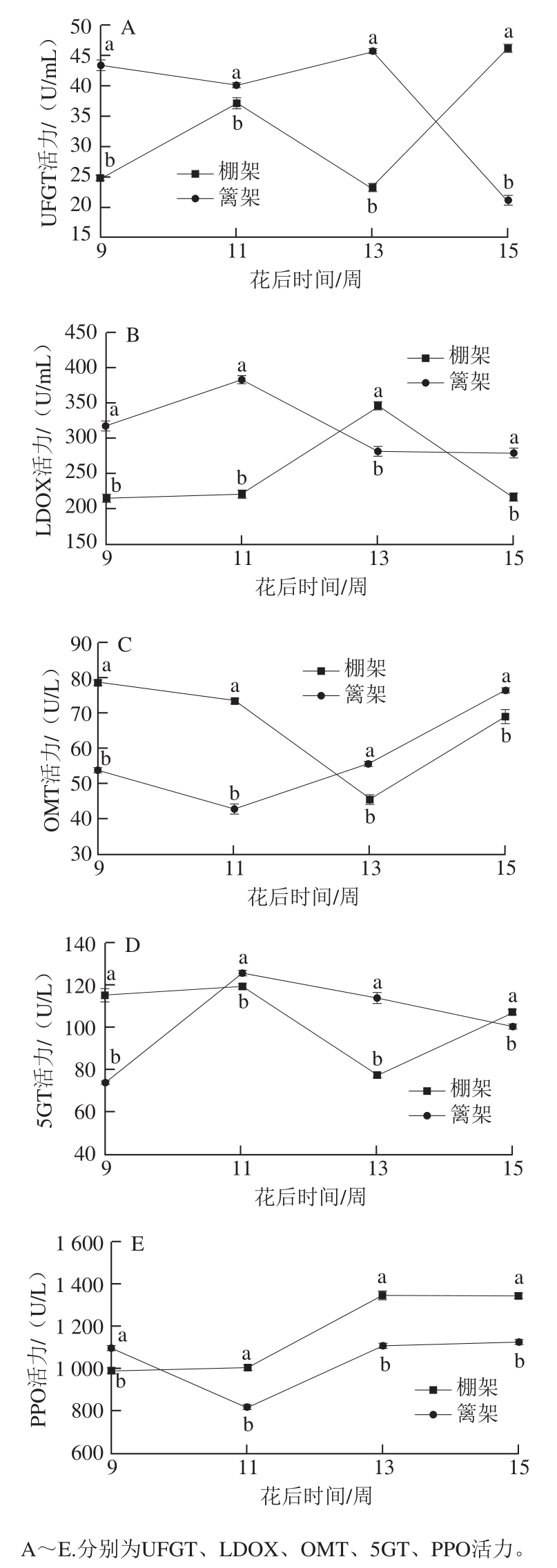
图5 叶幕类型对花色苷代谢途径相关酶活力的影响
Fig. 5 Effects of canopy types on enzyme activities involved in anthocyanin metabolic pathway
果实发育过程中,两种叶幕类型下的葡萄果皮花色苷途径相关酶活力相差较大,仅多酚氧化酶(polyphenol oxidase,PPO)活力变化趋势较为一致(图5)。篱架直立叶幕花色苷在果实发育前期表现出较为明显的合成优势,其合成相关酶UDP-葡萄糖-3-O-类黄酮糖苷转移酶(UDP-glucoseflavonoid 3-O-glucosyltransferase,UFGT)、无色花色素氧化酶(leucoanthocyanin dioxygenase,LDOX)活力在花后9~11 周显著高于棚架水平叶幕的,但修饰酶花青素苷-5-O-葡糖糖基转移酶(anthocyanin 5-O-glucosyltransferase,5GT)活力相对较低;而棚架水平叶幕葡萄果皮花色苷除合成酶LDOX、氧化酶PPO外,其他合成、修饰相关酶在果实发育过程中活力变化趋势较为一致,且花后13~15 周活力显著增高。篱架直立叶幕的花色苷代谢途径相关酶UFGT、LDOX、O-甲基转移酶(O-methyltransferase,OMT)、5GT、PPO活力变化同步性较差,且UFGT、LDOX、5GT在果实发育中后期(11~15 周)有活力下降趋势。
综合比较两种叶幕类型葡萄果皮花色苷代谢过程中的基因表达与酶活力趋势发现,9~13 周,篱架直立叶幕UFGT、LDOX、OMT、5GT、PPO 5 种酶的基因表达量与酶活力变化均趋势一致,而棚架水平叶幕的变化趋势一致性较差。
3 讨 论
3.1 叶幕类型对葡萄微环境的影响
栽培架式决定叶幕类型,叶幕类型通过调节光热条件形成不同的叶幕微气候[28]。棚架果实与地面相距较远,水平叶幕又具有遮阴作用,架下受光极低,既解决了幕下果实直接曝光的问题,又可使架下地面免受强光直射,从而减少架下微域环境的温度波动及高温比例,尤其在高温月份,水平叶幕的优势更为显著[14];而篱架则由于叶幕直立,形成的遮阴面积相对较小,且果实距地面相对较近,受地面的强光反射及温度影响较大,容易造成果实日灼现象[29]。
棚架遮蔽地面导致土壤蒸发量小于篱架,适宜果实发育的湿度比例较高而高湿比例较低,较少引发葡萄果实病害[30-31];可能是由于棚架的果穗远离地面、空间悬垂,通风条件较好,而篱架的果穗距离地面仅80 cm左右,果穗周边有叶片贴近,受到地面湿气的蒸腾易发生汽灼现象[32],雨后也容易积滞水分引发病害。
3.2 叶幕微环境对果实品质的影响
叶幕微气候不同,果实品质差异较大[33]。实验中,棚架果实百粒质量、可滴定酸质量浓度和总酚、花色苷、黄烷醇等物质含量连续两年均高于篱架直立叶幕的。一方面可能是由于棚架枝蔓水平生长,结果母枝与结果枝之间存在一定角度,削弱了新梢顶端优势[31],从而利于将更多的营养物质运输到果实中;另一方面,通过测定葡萄的净光合速率(net photosynthetic rate,Pn)发现,强光及高温强光天气会导致直立叶幕叶片Pn显著降低,水平叶幕则显著缓解高温、强光的胁迫作用,高温强光天气下,其Pn仍高于直立叶幕叶片;强光和高温强光条件下棚架叶片的光系统II最大光化学效率、捕获的激子将电子传递到电子传递链中超过光系统Ⅱ初级电子受体的其他电子受体的概率和用于电子传递的量子产额均比篱架叶片显著提高[34]。由此推测,棚架通过改善高温逆境条件下叶片光系统的能量分配,缓解了高温高光胁迫,减少了呼吸消耗[35],从而改善了葡萄品质。
3.3 叶幕微环境对花色苷单体的影响
花色苷的合成是由一系列酶相互作用产生的,结构基因可直接编码花色苷生物合成的相关酶类[36-38],花色苷的含量与其合成及修饰等相关酶基因表达量及酶活力成显著正相关[39-41]。研究表明,高温、强光照对果实造成氧化胁迫,影响结构基因的表达量,诱导果实中的过氧化物酶含量上升,减少果皮中花青素含量[42-43],35 ℃以上高温促进花色苷降解的同时抑制花色苷的合成[43]。本实验中,果实成熟时,棚架水平叶幕下果实以及果皮花色苷总含量较篱架直立叶幕显著提高,可能是由于在果实生长发育过程中,水平叶幕下花色苷各基因表达的同步性及各酶活力变化的同步性使得花色苷在合成之后修饰更为及时;而花色苷的甲基化程度、酰化程度增高使花色苷稳定性更强、颜色更深[44-48],不易受到水分子的攻击,增强其稳定性[18],这与前人研究结果一致[41,49]。尽管水平叶幕的分解酶PPO活力也相对较高,但其对花色苷含量影响较小,可能是由于PPO对花色苷具有双重作用,一方面,其可将查尔酮作为特异性底物,催化形成花色苷呈色物质类黄酮噢哢;另一方面,其又决定了花色苷的降解[50-51]。此外,Kliewer等[52]研究表明,10 ℃以上的昼夜温差会抑制果实的正常着色,本实验中,直立叶幕下微环境的温度波动显著高于水平叶幕,这可能也是导致直立叶幕葡萄果实花色苷含量低于水平叶幕的原因之一。
由此可见,棚架水平叶幕可有效缓解生态逆境对葡萄品质(尤其是花色苷含量)造成的胁迫伤害。因此,棚架水平叶幕缓解逆境胁迫的作用值得在高温及强光胁迫地区不同品种上进一步研究。
4 结 论
棚架水平叶幕显著改善了‘摩尔多瓦’果实微域环境,提高了葡萄果实百粒质量、还原糖质量浓度和总酚、类黄酮、黄烷醇含量,增加了成熟期果皮花色苷含量,打破了果实着色过程中,花色苷代谢途径相关酶活力与基因表达变化趋势的一致性,但未改变花色苷单体种类。
参考文献:
[1] STOCKER T F, QIN D, PLATTNER G K, et al. Climate change 2013: the physical science basis[M]. New York: Cambridge University Press, 2013: 1-9.
[2] JONES G V, WHITE M A, COOPER O R, et al. Climate change and global wine quality[J]. Climatic Change, 2005, 73(3): 319-343.DOI:10.1007/s10584-005-4704-2.
[3] CHEVET J M, LECOCQ S, VISSER M. Climate, grapevine phenology,wine production, and prices: Pauillac (1800–2009)[J]. The American Economic Review, 2011, 101(3): 142-146. DOI:10.1257/aer.101.3.142.
[4] CONDE C, SILVA P, FONTES N, et al. Biochemical changes throughout grape berry development and fruit and wine quality[M]. Food, 2007, 1:1-22. DOI:10.1093/jxb/ert395.
[5] 孙明霞, 王宝增, 范海, 等. 叶片中的花色素苷及其对植物适应环境的意义[J]. 植物生理学通讯, 2003, 6: 688-694. DOI:10.13592/j.cnki.ppj.2003.06.051.
[6] MAKRIS D P, KALLITHRAKA S, KEFALAS P. Flavonols in grapes,grape products and wines: burden, profile and influential parameters[J].Journal of Food Composition and Analysis, 2006, 19(5): 396-404.DOI:10.1016/j.jfca.2005.10.003.
[7] FERNÁNDEZ-PACHÓN M S, VILLAÑO D, GARCÍA-PARRILLA M C, et al. Antioxidant activity of wines and relation with their polyphenolic composition[J]. Analytica Chimica Acta, 2004, 513(1): 113-118.DOI:10.1016/j.aca.2004.02.028.
[8] 黄星培, 郑邦健, 王林, 等. 植物色素抗香烟氧化损伤的初步观察[J].职业卫生与病伤, 2001, 16(3): 136-138.
[9] BAKKER J, TIMBERLAKE C F. The distribution of anthocyanins in grape skin extracts of port wine cultivars as determined by high performance liquid chromatography[J]. Journal of the Science of Food and Agriculture, 1985, 36(12): 1315-1324. DOI:10.1002/jsfa.2740361217.
[10] CHORTI E, GUIDONI S, FERRANDINO A, et al. Effect of different cluster sunlight exposure levels on ripening and anthocyanin accumulation in Nebbiolo grapes[J]. American Journal of Enology and Viticulture, 2010, 61(1): 23-30.
[11] KRASNOW M, WEIS N, SMITH R J, et al. Inception, progression, and compositional consequences of a berry shrivel disorder[J]. American Journal of Enology and Viticulture, 2009, 60(1): 24-34.
[12] 张晓煜, 亢艳莉, 袁海燕, 等. 酿酒葡萄品质评价及其对气象条件的响应[J]. 生态学报, 2007, 27(2): 740-745.
[13] BERGQVIST J, DOKOOZLIAN N, EBISUDA N. Sunlight exposure and temperature effects on berry growth and composition of Cabernet Sauvignon and Grenache in the Central San Joaquin Valley of California[J].American Journal of Enology and Viticulture, 2001, 52(1): 1-7.
[14] 刘笑宏, 孙永江, 孙红, 等. 不同叶幕类型对‘摩尔多瓦’葡萄果穗微域环境及果实品质的影响[J]. 中国农业科学, 2016, 49(21): 4246-4254. DOI:10.3864/j.issn.0578-1752.2016.21.019.
[15] 何建军. 影响酿酒葡萄果实中花色苷结构修饰的因素分析[D]. 北京: 中国农业大学, 2010: 19-22.
[16] 程国利. 浸渍酶对蛇龙珠红葡萄酒花色苷的影响[D]. 北京: 中国农业大学, 2007: 38-40.
[17] 孙文娟. 紫薯花色苷提取、脱味、稳定性及其结构初步鉴定[D]. 无锡: 江南大学, 2015: 51-56.
[18] LOPES-DA-SILVA F, DE PASCUAL-TERESA S, RIVAS-GONZALO J,et al. Identification of anthocyanin pigments in strawberry (cv Camarosa)by LC using DAD and ESI-MS detection[J]. European Food Research and Technology, 2002, 214(3): 248-253. DOI:10.1007/s00217-001-0434-5.
[19] 成果. 微环境调控‘赤霞珠’葡萄果实花色苷代谢的研究[D]. 杨凌: 西北农林科技大学, 2015: 106-109.
[20] 曹鹏. 转色前后葡萄果实糖代谢相关酶的特性研究[D]. 杨凌: 西北农林科技大学, 2004: 25-26.
[21] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 葡萄酒,果酒通用分析方法: GB/T 15038—2006[S]. 北京: 中国标准出版社,2006:7-8.
[22] 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科技出版社, 1998: 85-86; 140.
[23] 耿娜娜, 李学英, 顾丁, 等. Folin-Denis分光光度法测定五倍子中单宁酸的含量[J]. 安徽农业科学, 2013, 41(29): 11848-11850.
[24] 刘芸, 仇农学, 杨玺玉. 葡萄皮渣提取物总酚含量及体外抗氧化活性、抑菌活性[J]. 食品科学, 2011, 32(1): 5-9.
[25] KIM H K, CHEON B S, KIM Y H, et al. Effects of naturally occurring flavonoids on nitric oxide production in the macrophage cell line RAW 264.7 and their structure-activity relationships[J]. Biochemical Pharmacology, 1999, 58(5): 759-765. DOI:10.1016/S0006-2952(99)00160-4.
[26] WATERHOUSE A L, IGNELZI S, SHIRLEY J R. A comparison of methods for quantifying oligomeric proanthocyanidins from grape seed extracts[J]. American Journal of Enology and Viticulture, 2000, 51(4):383-389.
[27] ORAK H H. Total antioxidant activities, phenolics, anthocyanins,polyphenoloxidase activities of selected red grape cultivars and their correlations[J]. Scientia Horticulturae, 2007, 111(3): 235-241.DOI:10.1016/j.scienta.2006.10.019.
[28] 华玉波. 整形方式对赤霞珠病害和果实品质的影响[D]. 杨凌: 西北农林科技大学, 2010: 3-4.
[29] 贺普超. 葡萄学[M]. 北京: 中国农业出版社, 1999: 60-61; 97-99;95-103.
[30] 马静茹, 郁松林, 崔瑜. 不同栽培架式对设施弗雷无核葡萄产量及品质的影响[J]. 新疆农垦科技, 2015, 38(5): 17-18.
[31] 贾杨, 廖康, 刘曼曼, 等. 吐鲁番不同栽培架式葡萄叶幕微气候差异分析[J]. 北方园艺, 2014(9): 23-26.
[32] 张建光, 刘玉芳, 孙建设, 等. 苹果果实日灼人工诱导技术及阈值温度研究[J]. 园艺学报, 2003, 30(4): 446-448. DOI:10.16420/j.issn.0513-353x.2003.04.018.
[33] 张大鹏. 栽植方式、叶幕微区气候与葡萄生产: 国外葡萄栽培生态生理研究进展[J]. 葡萄栽培与酿酒, 1989(3): 42-55.
[34] 孙永江. 葡萄光系统Ⅱ及光合碳同化对高温强光的响应机理[D].泰安: 山东农业大学, 2016: 25-27.
[35] JACKSON D I, LOMBARD P B. Environmental and management practices affecting grape composition and wine quality: a review[J].American Journal of Enology and Viticulture, 1993, 44(4): 409-430.
[36] 郭凤丹, 王效忠, 刘学英, 等. 植物花青素生物代谢调控[J]. 生命科学, 2011, 23(10): 938-944. DOI:10.13376/j.cbls/2011.10.011.
[37] KOES R, VERWEIJ W, QUATTROCCHIO F. Flavonoids: a colorful model for the regulation and evolution of biochemical pathways[J].Trends in Plant Science, 2005, 10(5): 236-242. DOI:10.1016/j.tplants.2005.03.002.
[38] 高燕会, 黄春红, 朱玉球, 等. 植物花青素苷生物合成及调控的研究进展[J]. 中国生物工程杂志, 2012, 32(8): 94-99. DOI:10.13523/j.cb.20120816.
[39] 于淼, 刘海峰, 王军. ABA对葡萄花色苷合成相关基因表达的影响[J]. 果树学报, 2012, 29(1): 29-35. DOI:10.13925/j.cnki.gsxb.2012.01.014.
[40] 王惠聪, 黄旭明, 胡桂兵, 等. 荔枝果皮花青苷合成与相关酶的关系研究[J]. 中国农业科学, 2004, 37(12): 2028-2032.
[41] MORI K, GOTO-YAMAMOTO N, KITAYAMA M, et al. Loss of anthocyanins in red-wine grape under high temperature[J]. Journal of Experimental Botany, 2007, 58(8): 1935-1945. DOI:10.1093/jxb/erm055.
[42] HASELGROVE L, BOTTING D, HEESWIJCK R, et al. Canopy microclimate and berry composition: the effect of bunch exposure on the phenolic composition of Vitis vinifera L cv. Shiraz grape berries[J].Australian Journal of Grape and Wine Research, 2000, 6(2): 141-149.DOI:10.1111/j.1755-0238.2000.tb00173.x.
[43] KATAOKA I, KUBO Y, SUGIURA A, et al. Effects of temperature,cluster shading and some growth regulators on L-phenylalanine ammonia-lyase activity and anthocyanin accumulation in black grapes[J].Memoirs of the College of Agriculture-Kyoto University (Japan), 1984,124: 35-44.
[44] HRAZDINA G, BORZELL A J, ROBINSON W B. Studies on the stability of the anthocyanidin-3,5-digucosides[J]. American Journal of Enology and Viticulture, 1970, 21(4): 201-204.
[45] 王博. 根域限制促进鲜食葡萄果皮花色苷合成的机制研究[D]. 上海: 上海交通大学, 2013: 122-126.
[46] SPRINGOB K, NAKAJIMA J, YAMAZAKI M, et al. Recent advances in the biosynthesis and accumulation of anthocyanins[J]. Natural Product Reports, 2003, 20(3): 288-303. DOI:10.1039/b109542k.
[47] YONEKURA-SAKAKIBARA K, NAKAYAMA T, YAMAZAKI M,et al. Modification and stabilization of anthocyanins[M]//Anthocyanins:Biosynthesis, Functions, and Applications. New York: Springer, 2008:169-190. DOI:10.1007/978-0-387-77335-3_6.
[48] 李华, 王华, 袁春龙. 葡萄酒化学[M]. 北京: 科学出版社, 2005: 106-110.
[49] SPAYD S E, TARARA J M, MEE D L, et al. Separation of sunlight and temperature effects on the composition of Vitis vinifera cv. Merlot berries[J]. American Journal of Enology and Viticulture, 2002, 53(3):171-182.
[50] 赵云鹏, 陈发棣, 郭维明. 观赏植物花色基因工程研究进展[J]. 植物学通报, 2003, 20(1): 51-58.
[51] NAKAYAMA T, YONEKURA-SAKAKIBARA K, SATO T, et al.Aureusidin synthase: a polyphenol oxidase homolog responsible for flower coloration[J]. Science, 2000, 290: 1163-1166. DOI:10.1126/science.290.5494.1163.
[52] KLIEWER W M, TORRES R E. Effect of controlled day and night temperatures on grape coloration[J]. American Journal of Enology and Viticulture, 1972, 23(2): 71-77.