几乎所有的陆生植物表面都覆盖着一层角质层,作为与外界环境的介质,角质层具有防止非气孔性水分损失、保持表面干净[1]、抵御微生物和昆虫入侵[2]等重要生理功能。角质层由表皮角质膜层和可溶性蜡质层构成。角质膜层是由羟基脂肪酸和环氧脂肪酸组成的聚酯化合物,是角质层的骨架结构。蜡质层主要由特长链(C20~C34)饱和脂肪酸及其衍生物(烃、醛、醇、酯等)、萜类物质和其他微量次生代谢物(固醇及类黄酮类等)组成。植物蜡质层又可分为两层,填充于角质膜层内的叫内蜡,覆盖在角质膜层表面并具有自组装能力的叫外蜡。植物表皮角质层的结构和组成成分决定了其不同的功能。植物果实表面蜡质含量、结构和化学组成成分受品种、成熟期以及栽培环境等因素影响[3-4],并且对其失水率[5]、气体交换率[6-7]、冷藏过程中受到的冷害影响很大[8]。果实表皮角质层在果实采后贮藏品质变化中起着重要的调控作用[9]。李宏键等[10]发现,具有厚且均匀致密的角质层的苹果品种,其采后硬度和质量损失率变化较小。郜海燕等[11]研究发现,蓝莓的外表皮蜡质受损后更容易发生软化、衰老现象。Naziri等[12]报道由野生型酵母代谢产生的角鲨烯能够作为一种安全的化学物质来清除氧自由基,推迟水果的衰亡。
柑橘作为第一大世界水果,2014年在我国的产量为3 020万 t,占全球产量的33.3%,居世界首位,其中,2014年我国宽皮柑橘和甜橙产量分别达1 940万 t和690万 t[13]。关于柑橘角质层的研究报道主要集中在纽荷尔脐橙及其突变体和果实在采前生长过程中的蜡质变化。Liu Dechun等[14]对野生型和突变型纽荷尔脐橙生长过程中蜡质成分和含量变化以及相关基因的表达量进行了分析,发现蜡质合成和运输基因的表达下调伴随着脂肪族物质含量的减少和外蜡晶体的损失,从而导致了突变体纽荷尔脐橙的光滑表型。Wang Jinqiu等[15]对纽荷尔脐橙生长和成熟过程中角质层的形成进行了转录组和代谢组分析,结果表明角质膜层的积累与果实的生长同步,而蜡质的合成与果实的成熟过程同步。温州蜜柑(Citrus unshiu Marc.)和冰糖橙(Citrus sinensis Osbeck)分别为宽皮柑橘和紧皮柑橘典型品种的代表,同时也是湖南省的主栽柑橘品种。温州蜜柑和冰糖橙在贮藏过程中易失水,且失水率存在不同,这可能与其表面角质层组分及微观结构差异有关。然而到目前为止,鲜有关于温州蜜柑和冰糖橙表面角质层组分及微观结构差异的报道。因此,本研究以温州蜜柑、冰糖橙的果实为研究对象,探究其角质层组成成分、晶体形态结构以及内外角质层蜡质分布的差异,为明确不同柑橘品种的贮藏特性提供理论依据。
1 材料与方法
1.1 材料与试剂
以果面光洁、无机械损伤、大小均一、成熟新鲜的温州蜜柑(2016年10月10日采自湖南省石门市)、冰糖橙(2016年11月25日采自湖南省永州市)果实为实验材料。
正构二十四烷(色谱纯) 国药集团化学试剂有限公司;14%三氟化硼-甲醇溶液 CNW(上海)安谱实验科技股份有限公司;N,O-双(三甲基硅烷)三氟乙酰胺(N,O-bis(trimethylsilyl trifluoroacetamid), BSTFA)美国Sigma-Aldrich公司;纤维素酶、半纤维素酶、果胶酶上海瑞海生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
LGJ-25C冷冻干燥机 北京四环科学仪器厂;Organomation氮吹仪 铭奥国际有限公司;7890A-5975C气相色谱-质谱联用(gas chromatographymass spectrometry,GC-MS)仪 安捷伦科技有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;EDT-2000型离子溅射仪、EVO/LS10扫描电子显微镜(scanning electron microscopy,SEM) 德国Zeiss公司。
1.3 方法
1.3.1 果实蜡质成分提取与测定
蜡质层提取实验的步骤为:分别选取30 个温州蜜柑和冰糖橙果实,分3 次重复,每个重复10个果实。参考Liu Dechun等[14]的方法分别提取外蜡和内蜡,并略作修改。提取外蜡时,将2 次获得的阿拉伯胶用蒸馏水溶解,并在室温下用3 倍体积的三氯甲烷抽提。最后分别加入200 μL的正构二十四烷(1 μg/μL)为内标,在氮气下吹干,贮存于-20 ℃,待测。
蜡质层成分测定的步骤为:向每个样品中加入一定体积的吡啶,50 ℃于烘箱中保持30 min,加入等体积的BSTFA,60 ℃衍生40 min。氮气吹干多余的衍生化试剂后重新溶于5 mL氯仿中,用孔径0.22 μm的微孔滤膜过滤,用于GC-MS分析。采用HP-5毛细管柱(30 m×0.25 mm,0.25 μm),色谱条件为:进样口温度280 ℃,质谱源温度230 ℃,柱流速2 mL/min,恒定流速;Aux-2温度280 ℃,载气为氦气,无分流进样,进样量1 μL。质谱条件为:电子轰电离方式,能量70 eV,质量扫描范围50~600 amu,全扫描方式,溶剂延迟8 min。升温过程为70 ℃保持1 min,以20 ℃/min升温至200 ℃,保持2 min,再以5 ℃/min升温至320 ℃,保持20 min。各种蜡质成分经GC-MS检测后得到其离子峰,依据质谱库进行检索判定,并与内标比较进行定量分析,用含量除以面积表示蜡质的含量。
1.3.2 果皮角质膜层提取与分析
用内径为1.7 cm的打孔器在去除蜡质成分的每个果实赤道部位均匀取4 个孔,参考Wang Jinqiu[15]和Pacchiano[16]等的方法,将获得的小圆片进行酶解,并略作修改。在酶解过程中,每隔1~2 d换1 次液。为了防止污染,经酶解的小圆片立即进行连续提取。用甲醇溶液浸提6 h后用二氯甲烷溶液浸提17 h,最后用四氢呋喃溶液提取20 h。得到的角质膜层在质量分数为14%的三氟化硼-甲醇溶液中于70 ℃转酯解聚16 h,冷却后过滤,加入3 倍体积的饱和碳酸氢钠水溶液终止反应。最后加入200 μL的正构二十四烷(1 μg/μL)为内标,在氮气下吹干,贮存于-20 ℃,待测。
角质膜层成分分析的步骤为:每个样品加入一定体积的吡啶,并加入等体积的BSTFA,90 ℃衍生40 min。参考1.3.1节蜡质层成分测定方法,并略做修改。升温过程为50 ℃保持2 min,以10 ℃/min升温至150 ℃,保持1 min,再以3 ℃/min升温至310 ℃,保持20 min。各角质膜层成分经GC-MS检测后得其离子峰,依据质谱库和文献进行检索判定,并与内标比较进行相对定量分析,用含量除以面积表示角质膜层的含量。
1.3.3 果实表面积测定
根据参考文献[17],温州蜜柑和冰糖橙的表面积按下式计算。
式中:X为每个重复组中果皮的总质量/g;D为在每个重复组中用内径为1.7 cm的打孔器获得的40 个小圆片的面积/cm2;Y为在每个重复组中用内径为1.7 cm的打孔器获得的40 个小圆片的总质量/g。
1.3.4 SEM观察
分别取6 个果面光洁、无机械损伤、大小一致的果实用自来水洗干净,然后在蒸馏水中清洗3次,自然晾干。参考Liu Dechun等[18]报道的方法制备样品,用EDT-2000型离子溅射仪(2×10-4MPa,25 mA,300 s)进行镀金膜,最后用EVO/LS10 SEM观察拍片。
1.3.5 水分损失率测定
分别取30 个果面光洁、无机械损伤、大小一致的温州蜜柑和冰糖橙,分为A、B、C、D 4 组。A、C组为温州蜜柑、冰糖橙非处理组(空白),B、D组为温州蜜柑、冰糖橙处理组。其中,处理组中的果实用阿拉伯胶除去外蜡。将果实在4 ℃贮藏1 周,每隔24 h测量单果质量。
1.4 数据分析
采用Origin 8.0对数据进行整理分析和作图。数据结果以 ±s表示;采用SPSS进行单因素方差分析,采用t检验。P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果与分析
2.1 温州蜜柑和冰糖橙果实表面蜡质成分分析

图1 温州蜜柑和冰糖橙果实蜡质及其各组分含量
Fig. 1 Cuticular wax composition of Satsuma mandarin and Bingtang sweet orange
由图1可知,温州蜜柑和冰糖橙外蜡的含量分别为3.7、2.2 μg/cm2,内蜡的含量分别为13.9、18.4 μg/cm2,发现温州蜜柑内蜡含量是其外蜡含量的4 倍左右,冰糖橙内蜡含量是其外蜡含量的8 倍左右。Parsons等[17]也曾对50多个辣椒品种进行了角质层脂质成分分析,发现不同辣椒品种间总蜡含量最大相差14 倍左右。Wang Jinqiu等[19]发现温州蜜柑和纽荷尔脐橙的外蜡含量分别为1.7、7.2 μg/cm2,总蜡的含量分别为3.8、8.2 μg/cm2。本研究结果与Wang Jinqiu等[19]的研究结果不一致,可能是品种和生长环境的差异造成的。温州蜜柑和冰糖橙的外、内蜡特长链脂肪酸化合物主要由烷烃、游离脂肪酸、伯醇等组成。烷烃、脂肪酸、伯醇在温州蜜柑外蜡中所占的比例分别为50.5%、12.2%、3.2%,在内蜡中所占的比例分别为21.7%、6.3%、5.6%。冰糖橙外蜡中烷烃、脂肪酸、伯醇所占的比例分别为45.5%、9.1%、8.6%,内蜡中所占的比例分别为13.1%、4.0%、7.6%。本研究中温州蜜柑和冰糖橙的外蜡和内蜡中含量最多的脂肪族化合物均为烷烃。成熟西红柿[20]、苹果[21]、苹果梨[22]等水果中蜡质的主要成分是烷烃也曾被报道。然而,Wang Jinqiu等[19]报道纽荷尔脐橙和温州蜜柑的外蜡含量最多的成分是醛类。本研究结果与其不一致表明柑橘果实蜡质的差异不仅与品种有关,还与果实生长阶段和生长环境有关[3-4,8]。此外,通过比较两种类型柑橘果实表面外蜡和内蜡特长链脂肪酸化合物的特征,发现烷烃和游离脂肪酸在外蜡中所占的比例高于内蜡,这是温州蜜柑和冰糖橙外、内蜡脂肪族化合物最主要的差异。Liu Dechun等[14]对野生型和突变型纽荷尔脐橙生长过程中的蜡质变化进行了分析,发现内蜡相对于外蜡而言,具有较低浓度的脂肪族成分和较高浓度的环状化合物,这种差异在果实的成熟阶段更明显,本研究与其结果一致。
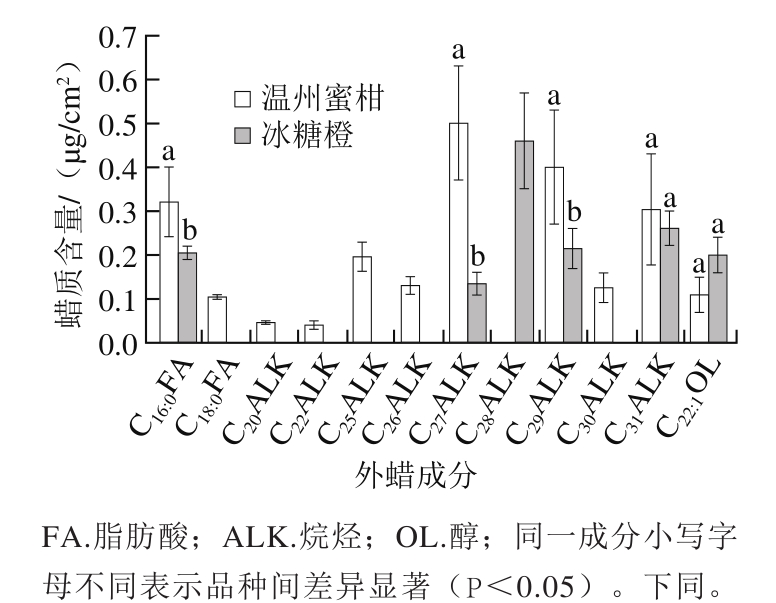
图2 温州蜜柑和冰糖橙果实外蜡脂肪族物质各成分含量
Fig. 2 Aliphatic composition in epicuticular wax of Satsuma mandarin and Bingtang sweet orange
由图2可知,温州蜜柑外蜡中脂肪族物质共有11 种,分别为棕榈酸、硬脂酸、正构二十烷、正构二十二烷、正构二十五烷、正构二十六烷、正构二十七烷、正构二十九烷、正构三十烷、正构三十一烷、13-二十二烯醇。其中,含量最高的正构二十七烷为0.5 μg/cm2,含量最低的正构二十二烷低于0.1 μg/cm2。冰糖橙外蜡中脂肪族物质共有6 种,分别为棕榈酸、正构二十七烷、正构二十八烷、正构二十九烷、正构三十一烷、13-二十二烯醇。其中,含量最高的正构二十八烷为0.5 μg/cm2。在温州蜜柑外蜡中含量最高的正构二十七烷在冰糖橙外蜡中却最低,低于0.1 μg/cm2。硬脂酸、正构二十烷、正构二十二烷、正构二十五烷、正构二十六烷、正构三十烷仅在温州蜜柑外蜡中检测到,正构二十八烷仅在冰糖橙中检测到。

图3 温州蜜柑和冰糖橙果实内蜡脂肪族物质各成分含量
Fig. 3 Aliphatic composition in intracuticular wax of Satsuma mandarin and Bingtang sweet orange
如图3所示,温州蜜柑内蜡中脂肪族物质共检出11 种:其中脂肪酸类物质分别为棕榈酸、硬脂酸;烷烃类物质分别为正构二十烷、正构二十二烷、正构二十三烷、正构二十六烷、正构二十七烷、正构二十九烷、正构三十烷、正构三十一烷;伯醇类物质仅检出1 种,为13-二十二烯醇。与图2比较发现正构二十三烷只在温州蜜柑内蜡中检测出,正构二十五烷只在温州蜜柑外蜡中检测出,其他成分在温州蜜柑内外蜡中均检测出。与温州蜜柑外蜡相同,温州蜜柑内蜡中含量最高的脂肪族物质正构二十七烷为1.1 μg/cm2;含量最低的正构二十二烷低于0.1 μg/cm2。冰糖橙内蜡中共检测出16 种脂肪族物质,比冰糖橙外蜡中脂肪族物质多了10 种:其中脂肪酸类物质分别为棕榈酸、硬脂酸、二十二碳酸;烷烃类物质分别为正构十八烷、正构十九烷、正构二十烷、正构二十三烷、正构二十六烷、正构二十七烷、正构三十烷、正构三十一烷、正构三十二烷;伯醇类物质分别为二十一烷醇、13-二十二烯醇。除冰糖橙内蜡中脂肪族物质的种类远多于冰糖橙外蜡外,含量最高和最低的成分也不同。在冰糖橙内蜡中13-二十二烯醇的含量最高,为0.8 μg/cm2;正构十九烷含量最低,远低于0.1 μg/cm2。此外,温州蜜柑和冰糖橙的内蜡组成成分和含量也存在较大差异。正构二十二烷、正构二十九烷只在温州蜜柑内蜡中检测出,二十二碳酸、正构十八烷、正构十九烷、正构二十八烷、正构三十二烷、二十一烷醇只在冰糖橙内蜡中检测出。
表1 温州蜜柑和冰糖橙果实内蜡中萜类化合物含量
Table 1 Terpenoid composition in intracuticular wax of Satsuma mandarin and Bingtang sweet orange%
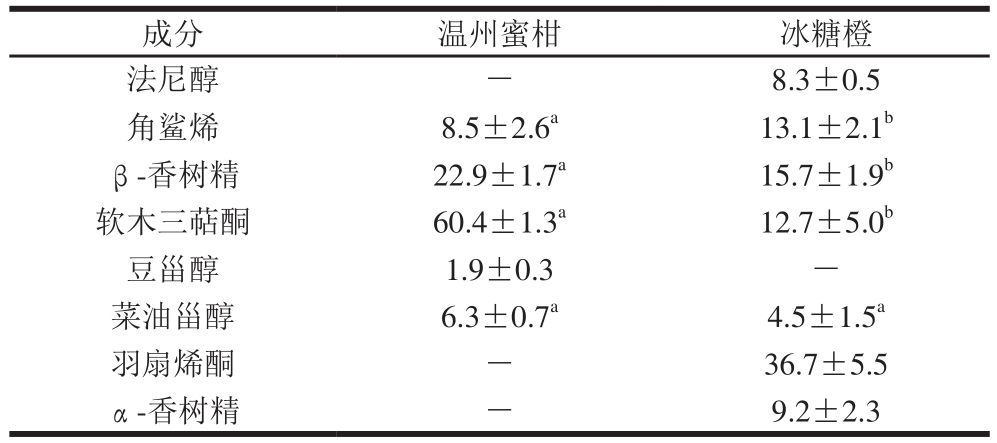
注:-.未检测到;同行小写字母不同表示差异显著(P<0.05)。下同。
除了脂肪族化合物,在温州蜜柑和冰糖橙的内蜡中还检测到了大量的萜类物质(表1)。温州蜜柑内蜡中萜类物质所占的比例为42.1%,其中三萜类化合物检测到了2 种,为β-香树精和软木三萜酮,分别占了萜类物质的22.9%和60.4%。除了三萜类化合物,在温州蜜柑中还检测到了甾醇类物质菜油甾醇和豆甾醇,分别占了萜类物质的6.3%和1.9%。冰糖橙内蜡中萜类物质所占的比例为46.3%,其中三萜类化合物检测到了4 种,为β-香树精、α-香树精、软木三萜酮和羽扇烯酮,分别占了萜类物质的15.7%、9.2%、12.7%和36.7%。仅在冰糖橙内蜡中检测到了菜油甾醇,占萜类物质的4.5%。角鲨烯和法尼醇(甾醇和三萜化合物的底物)在冰糖橙内蜡中都检测到,分别占萜类物质的13.1%和8.3%,而在温州蜜柑内蜡中仅检测到角鲨烯,占萜类物质的8.5%。Wang Jinqiu等[19]发现法尼醇和角鲨烯仅存在于纽荷尔脐橙中,在温州蜜柑中没有检测到。Liu Pu等[23]报道,法尼醇的积累能够抑制柑橘病原菌的生长、保护果实抵抗生物胁迫,实验中仅在冰糖橙中检测到金合欢醇,这很好地解释了冰糖橙比温州蜜柑有更长贮藏期的原因。
根据以上结果发现脂肪族类物质主要存在于外蜡中,三萜和甾醇类化合物仅存在于内蜡中。先前对不同成分内外蜡质分配的研究形成了多种假说。Buschhaus等[24]认为脂肪族物质呈线性一维结构,三萜类物质是环状,呈二维结构,凝聚状态下二者不能相容,因此,三萜类物质填充于聚酯结构的角质中。这个假说与本实验的研究结果一致,很好地解释了三萜类物质仅存在于内蜡中的现象。另外还发现,冰糖橙的外蜡和内蜡中都含有角鲨烯,而仅在温州蜜柑内蜡中检测出角鲨烯,这可能是由于两种类型柑橘果皮结构存在差异,同时由于角鲨烯分子结构呈线性,与脂肪族物质相似,因此,与脂肪族物质一样,在内外蜡中均有分布。基于以上分析,之前也有一些研究将蜡质应用于柑橘的分类中[23]。总之,这些结果为提高不同柑橘类型的耐贮性提供了重要信息。
2.2 温州蜜柑和冰糖橙果实角质膜层成分分析
表2 温州蜜柑和冰糖橙果实角质膜层各组分含量
Table 2 Chemical composition of cutin in Satsuma mandarin and Bingtang sweet orange μg/cm2

如表2所示,温州蜜柑和冰糖橙的角质膜层含量分别为44.00、70.00 μg/cm2,二者含量差异显著(P<0.05),由此推测温州蜜柑的采后贮藏期比冰糖橙短是角质膜层的含量低于冰糖橙果实导致的,这与他人的研究结果具有一致性。Isaacson等[25]发现在西红柿中角质膜层含量与角质层水分渗透之间无相关性,但是角质膜层在保护组织免受微生物侵染中发挥了重要作用。温州蜜柑的角质膜层主要由9 种成分组成:壬酸、壬二酸、肉桂酸、十六碳酸、十八碳酸、十六碳二酸、二十四烷酸、二十六碳酸、二十八碳酸,含量分别为0.29、2.30、16.90、5.70、1.50、12.00、2.20、1.00、2.20 μg/cm2。冰糖橙角质膜层主要由10 种成分组成,分别为月桂酸、壬二酸、肉桂酸、十六碳酸、十六碳二酸、亚油酸、十八碳酸、十八碳二酸、二十碳酸、二十四烷酸,含量分别为0.30、1.90、32.60、7.40、8.60、0.40、2.30、14.90、0.50、1.10 μg/cm2。肉桂酸是温州蜜柑和冰糖橙角质膜层含量最多的成分。温州蜜柑角质膜层含量最低的成分为壬酸,冰糖橙角质膜层含量最低的为月桂酸。本研究中温州蜜柑和冰糖橙的角质膜层在含量和组分上差异显著(P<0.05),这与他人的研究结果一致。Parsons等[17]也曾对50多个辣椒品种进行了角质层脂质成分分析,发现不同辣椒品种间角质膜层单体含量最大相差16 倍左右,其中十六碳酸、十八碳酸、肉桂酸变化范围为54%~87%、10%~38%、0.2%~8.0%。此外,将温州蜜柑和冰糖橙的蜡质和角质膜层进行组分及含量比较,发现蜡质主要由特长链饱和脂肪酸及其衍生物、萜类物质组成,角质膜层是由羟基脂肪酸组成,表明蜡质和角质膜层有不同的合成路径。Parsons等[17]对50多个辣椒品种进行角质层脂质成分分析也得到了同样的结果。
2.3 温州蜜柑和冰糖橙果实表面蜡质晶体形态分析

图4 温州蜜柑(A)和冰糖橙(B)果实表面蜡质SEM图(×1 500)
Fig. 4 SEM of epicuticular waxes in Satsuma mandarin and Bingtang sweet orange (× 1 500)
如图4所示,两种类型柑橘果实表面都由无定型蜡质和散落在其上的蜡质晶体组成:温州蜜柑的外蜡晶体呈较小、不规则血小板状,这些血小板状晶体虽然聚集在一起但是没有覆盖整个果实表面,温州蜜柑表皮细胞的某些区域明显没有蜡质晶体;冰糖橙的外蜡晶体呈较大、不规则、扁平的血小板状,这在成熟柑橘中是很普遍的。王金秋等[26]报道,宽皮柑橘与紧皮柑橘相比蜡质含量较低,蜡质晶体较小。温州蜜柑与冰糖橙的蜡质晶体形态存在明显差异,这可能是由于品种以及蜡质各成分含量的差异引起的。Koch等[27]曾报道伯醇有利于形成垂直板状形态的晶体。Wang Jinqiu等[19]曾报道,醛和烷烃在纽荷尔脐橙中占的比例越高,形成的扁平血小板状晶体就越大。在本研究中,伯醇在温州蜜柑和冰糖橙的外蜡中所占的比例很低,分别为3.3%和8.5%。相反,烷烃在温州蜜柑和冰糖橙的外蜡中所占的比例最高,分别为51.1%和45.3%。这一结果与蜡质晶体的形态一致,表明烷烃在组装扁平、更大的血小板状蜡质晶体时比伯醇发挥了更大的作用。本实验结果与其他的研究者得到的结果具有一致性[18]。然而,在本研究中,温州蜜柑的烷烃含量多于冰糖橙,但形成的晶体结构却比冰糖橙小,与他人的研究不一致,可能是由于它们蜡质各成分的差异引起的。由于蜡质成分与蜡质晶体形态结构的关系复杂,因此对于柑橘蜡质成分对蜡质晶体形态的影响,还需要进一步研究。
2.4 温州蜜柑和冰糖橙蜡质保水能力分析
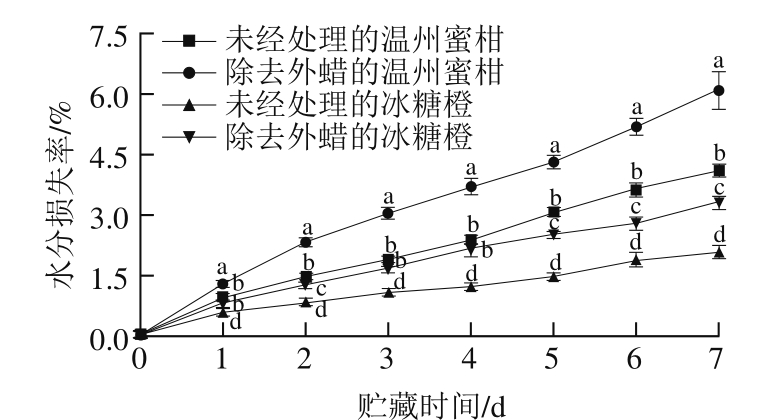
图5 温州蜜柑和冰糖橙果实贮藏1 周水分损失率
Fig. 5 Water loss rates of Satsuma mandarin and Bingtang sweet orange during storage for one week
通过覆盖表皮和保卫细胞,蜡质层在调节水果的保水能力方面发挥了关键的作用。在提取内蜡的过程中,氯仿会渗入水果内部从而影响其代谢。因此,本实验中仅研究了外蜡对水果保水能力的影响,如图5所示,在前4 d的贮藏过程中,对照组和处理组中的温州蜜柑平均水分损失率分别为0.6%和0.9%,对照组和处理组中的冰糖橙平均水分损失率分别为0.3%和0.5%,外蜡的除去会显著增加温州蜜柑和冰糖橙的水分损失速率(P<0.05),与他人的研究结果一致。Wang Jinqiu等[15]报道内蜡和角质膜层在果实生长的早期阶段发挥着重要的保水作用,然而,当角质层厚度达到一定程度时,保水能力取决于蜡质含量。Vogg等[28]报道,西红柿表面外蜡的去除会导致水分损失的增加。在贮藏4 d之后,处理组中的冰糖橙水分损失速率下降,这可能是因为新的外蜡在这些水果上形成,外蜡在保水方面可能发挥着关键的作用。此外,在对照组中,温州蜜柑的日水分损失率是冰糖橙的2 倍左右。从2 个柑橘品种的果皮结构分析,温州蜜柑属于宽皮柑橘而冰糖橙属于紧皮柑橘,二者果皮结构的厚度不同,尤其是温州蜜柑的白皮层厚度远低于冰糖橙,这可能是造成温州蜜柑水分损失更快的原因之一。同时,温州蜜柑总蜡含量比冰糖橙低可能是引起二者水分损失率差异的另一个原因。王金秋等[26]曾报道蜡质成分及结构与果皮结构存在一定联系,对多种宽皮柑橘和紧皮柑橘的蜡质分析表明,宽皮柑橘和紧皮柑橘在一维上不同,暗示果皮蜡质与果皮结构在进化上可能存在一定的连锁关系。本研究推测对照组中温州蜜柑和冰糖橙的水分损失率差异既受果皮结构影响,也受蜡质含量的影响。但果皮结构是单独直接影响柑橘水分损失,还是通过影响蜡质的成分及结构与其相互作用来间接影响柑橘的水分损失还需要进一步的探究。
表3 温州蜜柑和冰糖橙总蜡质及各组分含量与水分损失率间相关性分析(n=4)
Table 3 Correlational analysis between cuticular wax components and water loss rate in Satsuma mandarin and Bingtang sweet orange (n= 4)
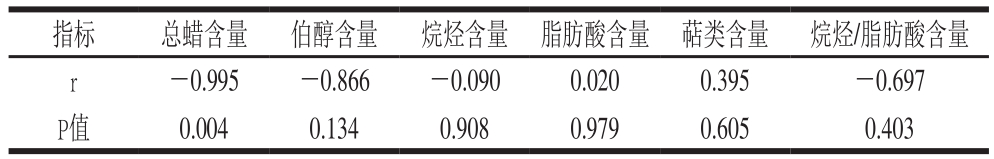
为了说明蜡质中单个组分对水果保水的贡献,对两个柑橘品种总蜡中各个组分与水分损失率间相关性进行了分析,发现水分损失与各组分间所占的比例有关。如表3所示,总蜡(r=-0.995)、伯醇(r=-0.866)、烷烃(r=-0.090)含量与水分损失呈负相关。脂肪酸(r=0.020)、萜类(r=0.395)含量与水分损失率呈正相关。此外,温州蜜柑总蜡中脂肪酸和烷烃含量分别为8.9%和33%,冰糖橙总蜡中脂肪酸和烷烃含量分别为6.5%和29%,冰糖橙中烷烃与脂肪酸含量之比高于温州蜜柑。将烷烃与脂肪酸含量之比与水分损失率间进行相关性分析,发现烷烃与脂肪酸含量之比与水分损失率呈负相关(r=-0.697),表明相对于脂肪酸组分,烷烃在保水方面具有更显著的作用,这与温州蜜柑和冰糖橙间水分损失率的差异具有一致性。Bourdenx等[29]曾经报道随着拟南芥表皮细胞中烷烃的积累,拟南芥的耐旱性越来越强。Parsons等[17]对多个辣椒品种的角质层脂质成分与水分损失进行相关性分析发现,水分流失与烷烃比例呈负相关,与脂肪酸比例呈正相关。Kosma等[30]研究证明游离脂肪酸带有分子电荷,不利于角质层间分子的靠近、压缩,从而增加了水分扩散途径的相对大小和水分扩散量。人工合成蜡通常会产生异味,但高浓度的天然蜡可以在不产生异味的情况下阻止水分损失,表明如果人工合成蜡与天然蜡相似,将更加有助于维持水果贮藏时的品质。考虑到人工合成蜡的成分与柑橘天然蜡的成分显著不同,在新的人工合成蜡中添加具有重要保水作用的烷烃是很有必要的,这个结果为柑橘人工合成蜡的生产提供了重要信息。
3 结 论
综上所述,温州蜜柑和冰糖橙的内蜡含量远高于外蜡,分别约为外蜡含量的4 倍和8 倍。两种类型柑橘果实表面蜡质脂肪族物质主要成分相同,为烷烃、游离脂肪酸、伯醇,但不同类别物质含量有差别。萜类物质的三萜类和甾醇仅在内蜡中检测出。冰糖橙的内、外蜡中都含有角鲨烯,而仅在温州蜜柑内蜡中检测出角鲨烯,这可能是由于2 种类型柑橘果皮结构的差异所致。此外,两种类型角质膜层含量和组分差异显著(P<0.05),但主要成分相同。外蜡的除去会显著增加温州蜜柑和冰糖橙的水分损失速率(P<0.05),而相对于脂肪酸组分,烷烃在保水方面具有更显著的作用(P<0.05),这和烷烃与脂肪酸之比在冰糖橙中较高的研究结果一致。因此,在新的人工合成蜡中添加具有重要保水作用的烷烃是很有必要的。2 种类型柑橘果实表面蜡质化学组分和晶体形态存在显著差异(P<0.05),与两种类型柑橘水分损失率差异具有一致性。这些结果为不同柑橘耐贮性的提高提供了重要信息。
参考文献:
[1] YEATS T H, ROSE J K. The formation and function of plant cuticles[J]. Plant Physiology, 2013, 163(1): 5-20. DOI:10.1104/pp.113.222737.
[2] EIGENBRODE S D, ESPELIE K E. Effects of plant epicuticular lipids on insect herbivores[J]. Annual Review of Entomology, 1995, 40(1):171-194. DOI:10.1146/annurev.en.40.010195.001131.
[3] SALA J M, LAFUENT E, CUÑAT P. Content and chemical composition of epicuticular wax of ‘Navelina’ oranges and‘Satsuma’ mandarins as related to rindstaining of fruit[J]. Journal of the Science of Food and Agriculture, 1992, 59(4): 489-495.DOI:10.1002/jsfa.2740590411.
[4] YEATS T H, BUDA G J, WANG Zhonghua, et al. The fruit cuticles of wild tomato species exhibit architectural and chemical diversity, providing a new model for studying the evolution of cuticle function[J]. The Plant Journal, 2012, 69(4): 655-666. DOI:10.1111/j.1365-313X.2011.04820.x.
[5] ALBRIGO L G. Ultrastructure of cuticular surfaces and stomata of developing leaves and fruit of the ‘Valencia’ oranges[J]. Journal of the American Society for Horticultural Science, 1972, 97: 761-765.
[6] BEN-YEHOSHUA S, BURG S P, YOUNG R. Resistance of citrus fruit to mass transport of water vapor and other gases[J]. Plant Physiology, 1985, 79(4): 1048-1053. DOI:10.1104/pp.79.4.1048.
[7] El-OTMANI M, COGGINS C W J, EAKS I L. Fruit age and gibberellic acid effect on epicuticular wax accumulation, respiration,and internal atmosphere of navel orange fruit[J]. Journal of the American Society for Horticultural Science, 1986, 111(2): 228-232.
[8] CAJUSTE J F, GONZÁLEZ-CANDELAS L, VEYRAT A, et al.Epicuticular wax content and morphology as related to ethylene and storage performance of ‘Navelate’ orange fruit[J]. Postharvest Biology and Technology, 2010, 55(1): 29-35. DOI:10.1016/j.postharvbio.2009.07.005.
[9] LARA I, BELGE B, GOULAO L F. The fruit cuticle as a modulator of postharvest quality[J]. Postharvest Biology and Technology, 2014, 87:103-112. DOI:10.1016/j.postharvbio.2013.08.012.
[10] 李宏键, 刘志, 王宏, 等. 苹果果实组织结构与果实失重率和硬度变化的关系[J]. 果树学报, 2013, 30(5): 753-758. DOI:10.13925/j.cnki.gsxb.2013.05.028.
[11] 郜海燕, 杨帅, 陈杭君, 等. 蓝莓外表皮蜡质及其对果实软化的影响[J]. 中国食品学报, 2014, 14(2): 102-108. DOI:10.16429/j.1009-7848.2014.02.015.
[12] NAZIRI E, MANTZOURIDOU F, TSIMIDOU M. Enhanced squalene production by wild-type Saccharomyces cerevisiae strains using safe chemical means[J]. Journal of Agriculture Food Chemistry, 2011,59(18): 9980-9989. DOI:10.1021/jf201328a.
[13] United States Department of Agriculture. Citrus: world markets and trade[R]. Washington D.C.: USDA, 2016.
[14] LIU Dechun, YANG Li, ZHENG Qiong, et al. Analysis of cuticular wax constituents and genes that contribute to the formation of ‘glossy Newhall’, a spontaneous bud mutant from the wild-type ‘Newhall’navel orange[J]. Plant Molecular Biology, 2015, 88(6): 573-590.DOI:10.1007/s11103-015-0343-9.
[15] WANG Jinqiu, LI Sun, LI Xie, et al. Regulation of cuticle formation during fruit development and ripening in ‘Newhall’ navel orange(Citrus sinensis Osbeck) revealed by transcriptomic and metabolomic profiling[J]. Plant Science, 2016, 243: 131-144. DOI:10.1016/j.plantsci.2015.12.010.
[16] PACCHIANO R A, SOHN W, CHLANDA V L, et al. Isolation and spectral characterization of plant-cuticle polyesters[J]. Journal of Agricultural Food Chemistry, 1993, 41(1): 78-83. DOI:10.1021/jf00025a017.
[17] PARSONS E, POPOPVSK Y, LOHREY G, et al. Fruit cuticle lipid composition and water loss in a diverse collection of pepper (Capsicum)[J]. Physiologia Plantarum, 2013, 149(2): 160-174. DOI:10.1111/ppl.12035.
[18] LIU Dechun, ZENG Qiong, JI Qingxun, et al. A comparison of the ultrastructure and composition of fruits’ cuticular wax from the wild-type ‘Newhall’ navel orange (Citrus sinensis [L.] Osbeck cv.Newhall) and its glossy mutant[J]. Plant Cell Reports, 2012, 31(12):2239-2246. DOI:10.1007/s00299-012-1333-x.
[19] WANG Jinqiu, HAO Haohao, LIU Runsheng, et al. Comparative analysis of surface wax in mature fruits between Satsuma mandarin(Citrus unshiu) and ‘Newhall’ navel orange (Citrus sinensis) from the perspective of crystal morphology, chemical composition and key gene expression[J]. Food Chemistry, 2014, 153: 177-185. DOI:10.1016/j.foodchem.2013.12.021.
[20] LEIDE J, HILDEBRAND T, REUSSING K, et al. The developmental pattern of tomato fruit wax accumulation and its impact on cuticular transpiration barrier properties: effects of a deficiency in a β-ketoacylcoenzyme A synthase (LeCER6)[J]. Plant Physiology, 2007, 144(3):1667-1679. DOI:10.1104/pp.107.099481.
[21] BELDING R D, SUTTON T B, BLANKENSHIP S M, et al.Relationship between apple fruit epicuticular wax and growth of Peltaster fructicola and Leptodontidium elatius, two fungi that cause sooty blotch disease[J]. Plant Disease, 2000, 84(7): 767-772.DOI:10.1094/PDIS.2000.84.7.767.
[22] YIN Yan, BI Yang, CHEN Songjiang, et al. Chemical composition and antifungal activity of cuticular wax isolated from Asian pear fruit(cv. Pingguoli)[J]. Scientia Horticulturae, 2011, 129(4): 577-582.DOI:10.1016/j.scienta.2011.04.028.
[23] LIU Pu, LUO Li, GUO Junhong, et al. Farnesol induces apoptosis and oxidative stress in the fungal pathogen Penicillium expansum[J].Mycologia, 2010, 102(2): 311-318. DOI:10.3852/09-176.
[24] BUSCHHAUS C, JETTER R. Composition differences between epicuticular and intracuticular wax substructures: how do plants seal their epidermal surfaces?[J]. Journal of Experimental Botany, 2011,62(3): 841-853. DOI:10.1093/jxb/erq366.
[25] ISAACSON T, KOSMA D K, MATAS A J, et al. Cutin deficiency in the tomato fruit cuticle consistently affects resistance to microbial infection and biomechanical properties, but not transpirational water loss[J]. The Plant Journal, 2009, 609(2): 363-377. DOI:10.1111/j.1365-313X.2009.03969.x.
[26] 王金秋, 何义仲, 徐坤洋, 等. 三种类型柑橘成熟果实表面蜡质分析[J]. 中国农业科学, 2016, 49(10): 1936-1945. DOI:10.3864/j.issn.0578-1752.2016.10.010.
[27] KOCH K, DOMMISSE A, BARTHLOTT W, et al. The use of plant waxes as templates for micro-and nanopatterning of surfaces[J]. Acta Biomaterialia, 2007, 3(6): 905-909. DOI:10.1016/j.actbio.2007.05.013.
[28] VOGG G, FISCHER S, LEIDE J, et al. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in avery-long-chain fatty acid β-ketoacyl-CoA synthase[J]. Journal of Experimental Botany, 2004,55: 1401-1410. DOI:10.1093/jxb/erh149.
[29] BOURDENX B, BERNARD A, DOMERGU E, et al. Overexpression of Arabidopsis CER1promotes wax VLC-alkane biosynthesis and influences plant response to biotic and abiotic stresses[J]. Plant Physiology, 2011, 156(1): 29-45. DOI:10.1104/pp.111.172320.
[30] KOSMA D K, BOURDENX B, BERNARD A, et al. The impact of water deficiency on leaf cuticle lipids of Arabidopsis[J]. Plant Physiology, 2009, 151(4): 1918-1929. DOI:10.1104/pp.109.141911.