血清白蛋白是生物体循环系统中最丰富的和多功能的可溶性血清蛋白成分。它能维持血液胶体渗透压,调节血液pH值,有助于内源和外源分子(如药物、脂肪酸、类固醇和金属离子)的运输、分布和新陈代谢[1-2]。牛血清白蛋白(bovine serum albumin,BSA)因其与人血清白蛋白有大约76%的结构同源性和大约88%的序列同源性,以及成本低、易于纯化、较稳定和不同寻常的配体结合特性而被广泛选作模型来评估配体与蛋白质之间的相互作用[2-4]。在结构上,BSA是由583 个氨基酸残基组成的单一的多肽链,被分为3 个结构域(Ⅰ~Ⅲ),每个域包含2 个子域(A和B)[5]。子域ⅡA和ⅢA分别被叫作Sudlow’s位点Ⅰ和Ⅱ,常常是外源和内源性配体在BSA上的结合位点[6]。当食品色素进入血液循环系统后,它与血清白蛋白结合,导致其在血液中的分布和自由浓度受到显著影响;因此,探讨食品色素与蛋白质之间的结合特性对获得食品色素的重要信息(如生物活性、药理学和毒理学行为等)十分重要。近几年,Bourassa等[7]探索了白藜芦醇、染料木黄酮和姜黄色素与BSA之间的结合作用,结果表明这3 种多元酚-BSA复合物是通过亲水和疏水相互作用形成的,结合位点主要位于蛋白质子域Ⅰ和Ⅱ中的Trp-212和Trp-134附近。Mills等[8]的研究阐明了蛋白质转移自由能符合焓熵补偿(enthalpy entropy compensation,EEC)。而目前,酸性绿9(acid green 9,AG9)和酸性蓝9(acid blue 9,AB9)(图1)与蛋白质的相互作用鲜有报道,因此,有必要探索AG9/AB9与蛋白质之间的相互作用。盐是生物体中重要的物质成分,本研究在模拟生理条件(pH 7.4)下,探讨不同盐浓度(离子强度)下AG9/AB9与BSA之间的结合,运用德拜休克尔极限理论对其进行定量分析,并从热力学角度阐述这两个结合过程中发生的焓熵补偿。
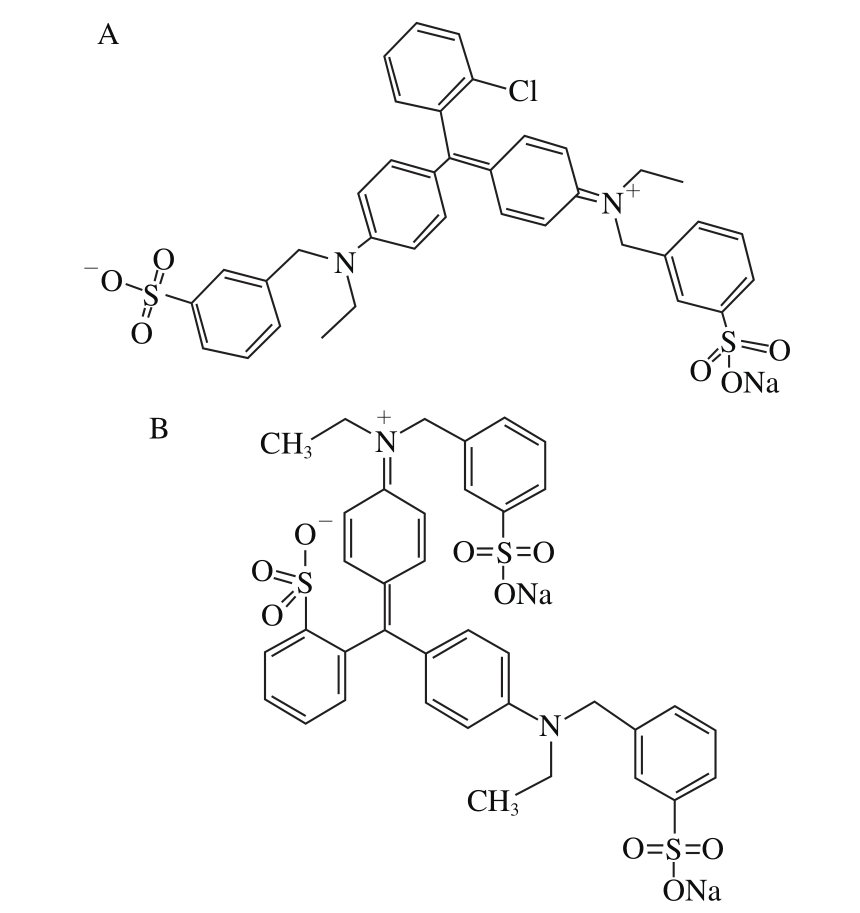
图1 AG9(A)和AB9(B)的结构
Fig. 1 Structures of AG9 (A) and AB9 (B)
1 材料与方法
1.1 材料与试剂
BSA(纯度98%)购于罗克公司,使用时没有进一步纯化,储备液用磷酸盐缓冲液(0.05 mol/L,pH 7.4)配制。
AG9 东京化工股份有限公司;AB9 阿拉丁化工股份有限公司;所有试剂均为分析纯,使用时没有进一步纯化,所有溶液储存在4 ℃条件下。整个实验过程使用二次蒸馏水。
1.2 仪器与设备
Cary Eclipse荧光分光光度计 美国瓦里安公司;UV-3600近红外-紫外-可见分光光度计 日本岛津公司;微量进样器 上海安亭公司。
1.3 方法
荧光光谱激发和发射狭缝宽均设置为5 nm,激发波长选定为280 nm。BSA浓度固定为5.0 μmol/L,AG9/AB9的浓度从0 μmol/L增加到10.32 μmol/L。采用50 μL或100 μL微量进样器进行所有荧光滴定实验,滴定实验在含有(c(NaCl)为0.03、0.08、0.15 mol/L)或者不含盐或乙醇(5%和10%)的5 mmol/L磷酸钠缓冲液(pH 7.4)中进行,它们的荧光数据均在300~500 nm波长范围内进行扫描。
紫外-可见吸收光谱通过配备s-1700电子控温装置的UV-3600近红外-紫外-可见分光光度计在298 K下进行测定。检测改变BSA浓度(0~12 μmol/L)时离子强度即盐浓度(c(NaCl)为0、0.03、0.08、0.15 mol/L)对AG9/AB9(8 μmol/L)吸收光谱的影响。
所有实验重复3 次。
2 结果与分析
2.1 不同盐浓度下BSA与AG9/AB9之间的结合特性
荧光猝灭技术是荧光团和猝灭剂之间相互作用信息的来源[9-10],故该技术可以用来评估AG9/AB9与BSA之间的结合特性。在不同盐浓度(c(NaCl)为0、0.03、0.08、0.15 mol/L)和不同温度(293、298、304、310 K)条件下,随着AG9/AB9浓度的增加,BSA的内源荧光强度逐渐减弱,并且它们的最大发射波长有微弱的蓝移,c(NaCl)为0 mol/L时两体系荧光图谱见图2。表明BSA-AG9/AB9复合物可能形成,且BSA中色氨酸残基周围微环境随着AG9/AB9的加入而发生改变[11]。
由于猝灭剂(AG9/AB9)在荧光团(BSA)的激发和发射波长处有吸收,故需要校正所有最大波长处对应的荧光强度。以减弱甚至消除两种食品色素导致的内滤效应。校正因子η通过公式(1)[12]计算。
式中:Ax0为荧光团在激发波长处的吸光度;Ay0为荧光团在发射波长处的吸光度;Axi=Ax0+ΔAxi,为荧光团和猝灭剂在激发波长处的总吸光度;Ayi=Ay0+ΔAyi,为荧光团和猝灭剂在发射波长处的总吸光度。
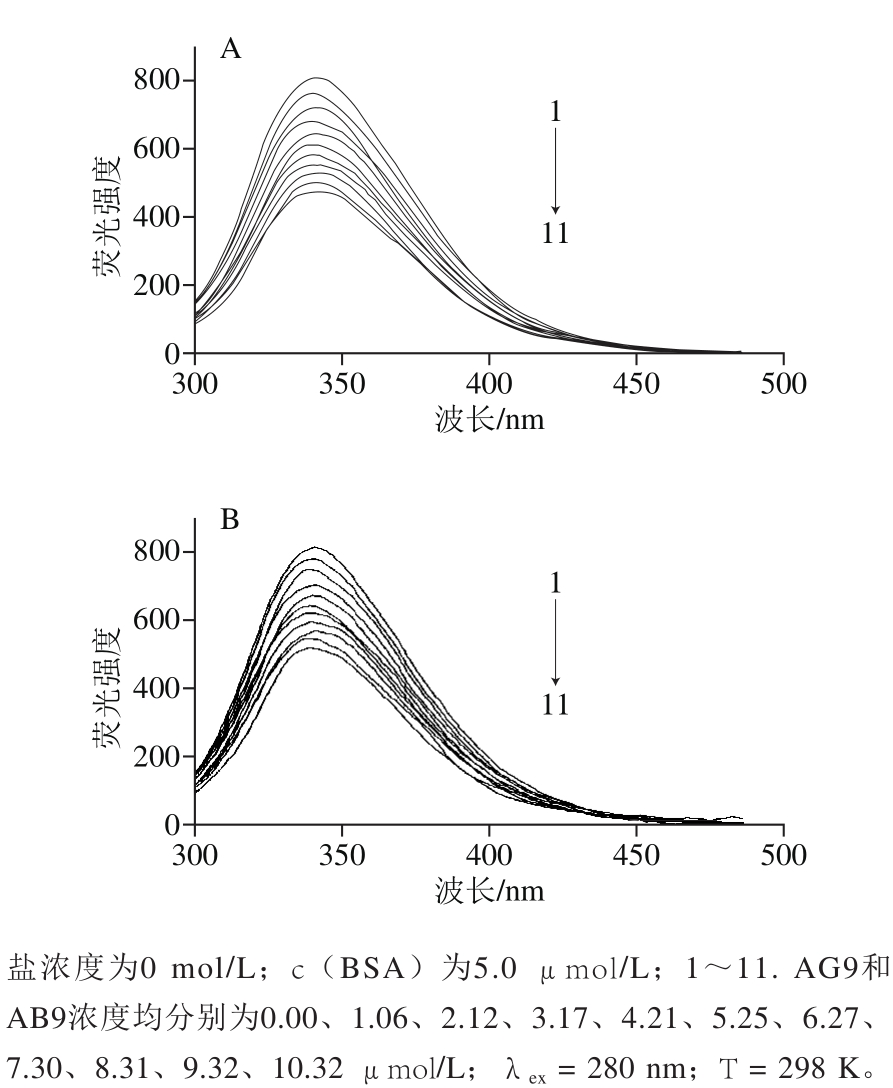
图2 BSA-AG9(A)和BSA-AB9(B)体系的荧光猝灭光谱图
Fig. 2 Fluorescence quenching spectra of BSA-AG9 (A) and BSA-AB9 (B) systems
修正的Stern-Volmer方程给出如式(2)。
式中:(F0/F)m为未加入AG9/AB9和加入AG9/AB9时检测到的荧光强度之比;η为校正系数;KSV为Stern-Volmer(S-V)猝灭常数;Kq为双分子猝灭速率常数;τ0是不存在AG9/AB9时BSA荧光团的平均寿命,通常对于大多数荧光蛋白分子τ0为10-8s[13];[Q]为AG9/AB9的浓度/(μmol/L)。
F0/F对[Q]作S-V图(图3),校正的荧光数据通过公式(2)进行分析。所有KSV值与温度呈负相关,它们的Kq值比猝灭剂与生物分子的最大散射碰撞猝灭常数高(2.0×1010L/(mol·s))[14-15],表明BSA-AG9/AB9体系的猝灭机制是静态猝灭而不是动态猝灭[16-17]。此外,随着AG9/AB9的加入,BSA的共振光散射(resonance light scattering,RLS)光谱强度增强(图4),可再次确认这两体系的静态猝灭机制[18]。
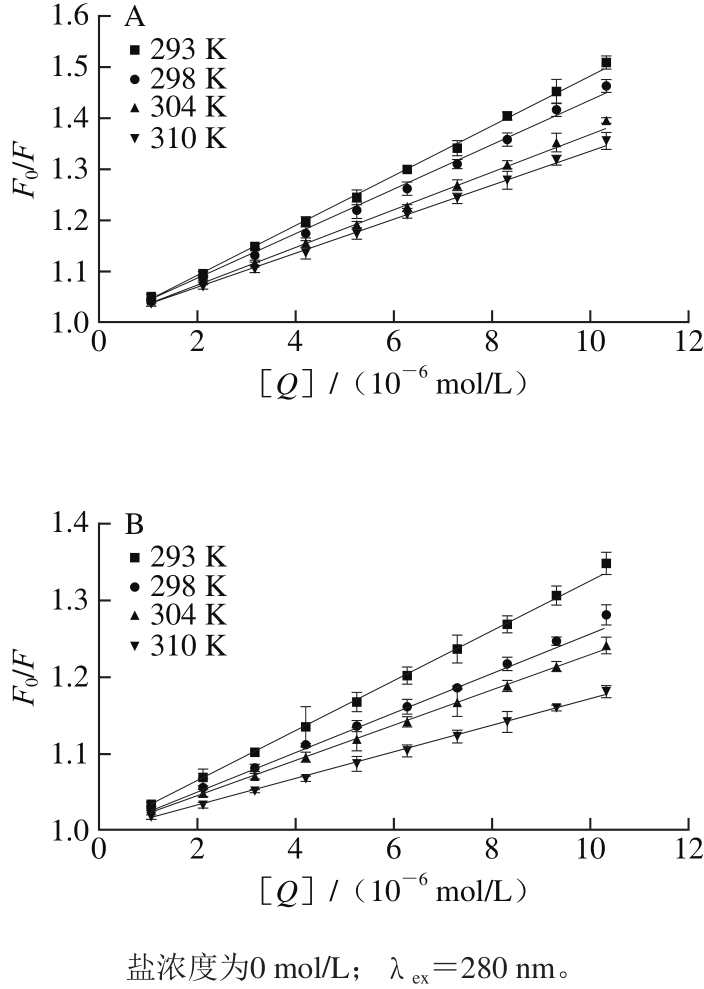
图3 BSA-AG9(A)和BSA-AB9(B)体系修正的S-V图
Fig. 3 Corrected S-V plots for the quenching of BSA by AG9 (A) or AB9 (B)
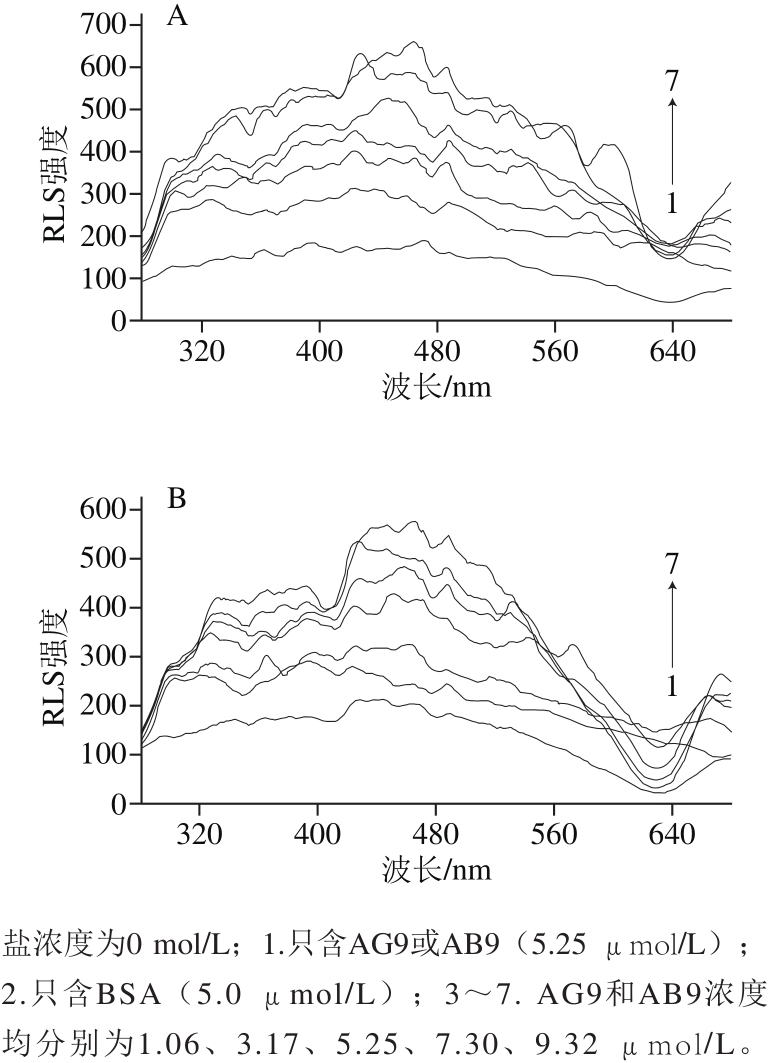
图4 BSA-AG9(A)和BSA-AB9(B)体系的RLS图谱
Fig. 4 RLS spectra of BSA-AG9 (A) and BSA-AB9 (B) systems
结合常数(K)、结合位点数(n)通过式(3)计算。
式中:F0和F分别是未加入和加入AG9/AB9后的荧光强度;K是体系结合常数;n为结合位点数;[Q]为AG9/AB9的浓度/(μmol/L)。
从表1的数据可以看出,这两个体系的n值近似等于1,表明AG9/AB9在BSA上存在一个结合位点。为了进一步确认AG9/AB9在BSA上存在特定的结合位点,考察这两个体系在pH 7.4条件下的乙醇位点竞争取代实验。若结合位点被乙醇替代,则其周围的微环境会发生改变[19],即乙醇将影响外源分子在子域ⅡA的结合[20]。BSA-AG9/AB9体系的K值随着乙醇体积分数的增加而明显减小,说明AG9/AB9在BSA上特定的结合位点位于色氨酸残基(子域ⅡA)。相同条件下结合常数K遵循下列顺序:KAG9>KAB9,表明BSA-AG9体系的结合亲和力比BSA-AB9的强。同时,较大的K值表明BSA与AG9/AB9在低温下的结合作用较强,BSA-AG9/AB9复合物在高温下更不稳定。

注:R1和R2分别是K值和Van’t Hoff图的相关系数。
体系 NaCl浓度/(mol/L)T/K K/(10-3mol/L) n R1ΔG0/ΔH0/(J/(mol·K)) R2ΔS0/(kJ/mol) (kJ/mol)293 65.21±1.99 1.03±0.000.999 4 -27.02±0.07 0298 60.63±1.52 1.03±0.000.995 3 -27.26±0.07 304 54.21±1.67 1.03±0.000.997 6-27.55±0.07 310 49.19±1.17 1.03±0.000.999 4-27.85±0.07-12.70±0.22 48.88±0.55 0.996 8 293 47.23±1.62 1.02±0.010.997 4-26.21±0.09 0.03298 41.06±1.46 1.02±0.000.995 6-26.31±0.08 304 34.40±1.14 1.01±0.010.998 9-26.43±0.08 310 29.95±0.81 1.01±0.010.999 1-26.55±0.07-20.43±0.42 19.72±1.18 0.997 9 BSA-AG9293 31.79±1.10 1.00±0.010.999 2-25.26±0.11 0.08298 25.78±1.02 0.99±0.000.995 6-25.19±0.08 304 21.12±0.49 0.99±0.010.997 7-25.10±0.04 310 16.18±0.35 0.97±0.010.998 3-25.02±0.03-29.45±2.17-14.30±7.030.995 0 293 20.12±0.30 0.97±0.010.998 7-24.14±0.05 0.15298 15.57±0.39 0.96±0.010.997 1-23.93±0.05 304 11.87±0.36 0.95±0.010.997 2-23.69±0.06 310 8.86±0.19 0.95±0.010.999 0-23.44±0.07-36.18±0.34-41.11±1.310.999 4 293 31.02±1.03 1.00±0.010.999 0-25.20±0.08 0298 29.25±1.14 1.01±0.010.997 6-25.48±0.08 304 27.45±0.61 1.02±0.010.998 5-25.81±0.08 310 25.33±0.82 1.04±0.010.998 6-26.15±0.07-8.89±0.29 55.66±0.71 0.992 0 293 21.11±0.70 0.98±0.000.998 9-24.27±0.08 0.03-19.92±0.26 14.84±0.65 0.997 5 BSA-AB9 298 18.73±0.50 0.99±0.010.996 4-24.34±0.07 304 15.67±0.47 0.99±0.010.996 1-24.43±0.07 310 13.58±0.36 1.02±0.010.995 5-24.52±0.07 293 14.70±0.39 0.97±0.010.998 4-23.36±0.07 0.08298 11.37±0.33 0.98±0.010.998 8-23.15±0.07 304 8.61±0.29 0.98±0.010.997 9-22.91±0.07 310 6.64±0.17 0.99±0.010.998 4-22.67±0.07-35.24±0.18-40.55±0.660.999 4 293 8.91±0.32 0.97±0.010.996 7-22.19±0.08 298 6.20±0.22 0.96±0.010.996 8-21.61±0.08 304 4.03±0.10 0.96±0.010.994 9-20.93±0.09 310 2.53±0.10 1.02±0.060.995 3-20.24±0.09 0.15-55.75±0.31-114.54±1.100.998 8
为了进一步确认AG9/AB9与BSA间的化学计量和结合亲和力,分别记录不同浓度BSA在AG9/AB9-NaCl体系中的吸收光谱(图5),采用公式(4)分析对应的吸收光谱数据[19,21]。
式中: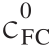 为食品色素的初始浓度/(μmol/L);KB-H为BSA-AG9/AB9复合物的结合常数/(L/mol);ΔA和Δε分别为AG9/AB9在最大吸收波长处的吸光度和摩尔吸收系数;l为石英比色皿的宽度/cm;c(BSA)为加入BSA的浓度/(μmol/L)。
为食品色素的初始浓度/(μmol/L);KB-H为BSA-AG9/AB9复合物的结合常数/(L/mol);ΔA和Δε分别为AG9/AB9在最大吸收波长处的吸光度和摩尔吸收系数;l为石英比色皿的宽度/cm;c(BSA)为加入BSA的浓度/(μmol/L)。
在式(4)中,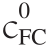 /ΔA对1/c(BSA)的Benesi-Hildebr(B-H)图见图5中的插图。可以观察到B-H图呈线性,证明在不同的盐浓度下BSA与AG9/AB9间形成1∶1复合物[19]。KB-H(BSA-AG9)>KB-H(BSA-AB9),并且在高盐浓度下,这两个体系的KB-H值(103~105L/mol)较低,这与上述荧光研究一致。
/ΔA对1/c(BSA)的Benesi-Hildebr(B-H)图见图5中的插图。可以观察到B-H图呈线性,证明在不同的盐浓度下BSA与AG9/AB9间形成1∶1复合物[19]。KB-H(BSA-AG9)>KB-H(BSA-AB9),并且在高盐浓度下,这两个体系的KB-H值(103~105L/mol)较低,这与上述荧光研究一致。
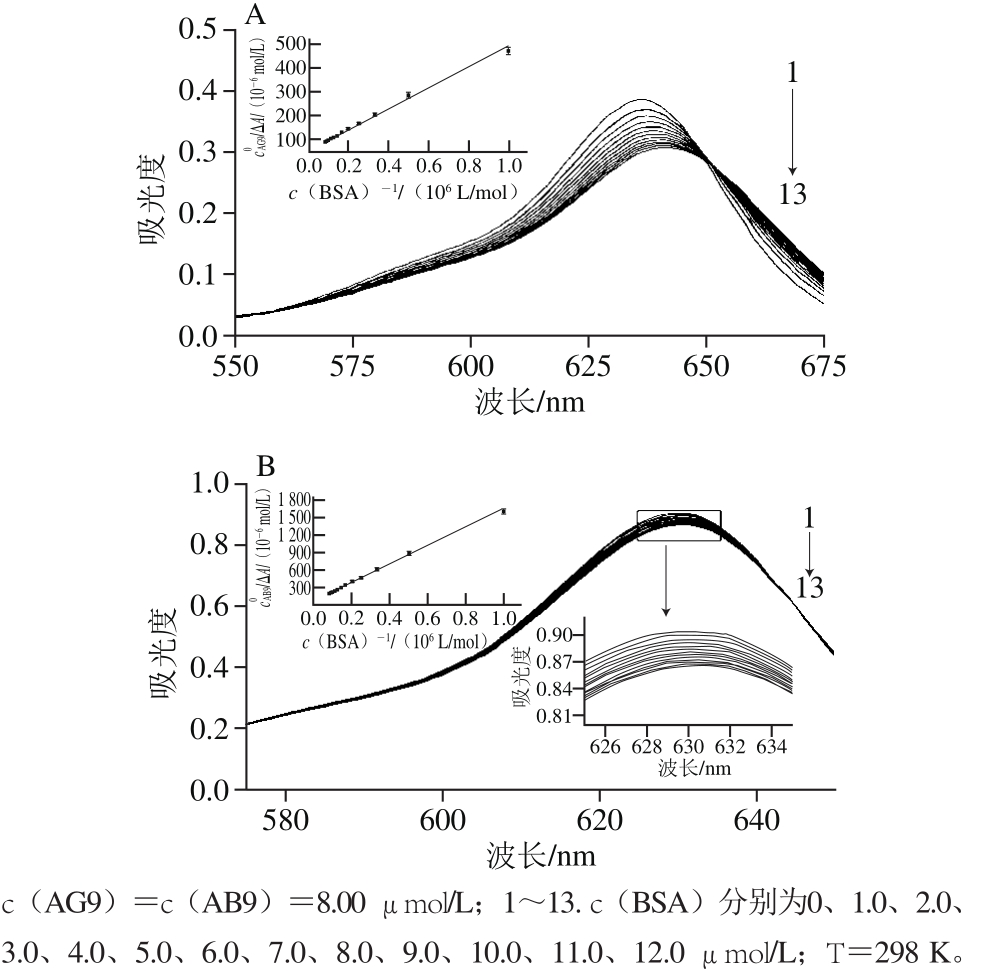
图5 BSA浓度逐渐增加时AG9/AB9的吸收光谱与BSA-AG9 (A)和BSA-AB9(B)体系的Benesi-Hildebrand图
Fig. 5 Absorption spectra of AG9 or AB9 with the increase of BSA concentration and Benesi-Hildebrand plots for BSA-AG9 (A) and BSA-AB9 (B) systems
盐浓度增加时BSA-AG9/AB9体系的S-V图如图6(相关参数未列出),可知随着盐浓度的增加,BSA的猝灭程度显著降低,这可能由于较高的盐浓度能减弱这两种食品色素的毒性和血清蛋白对它们的吸收。从表1中热力学参数可以看出(由Van’t Hoff方程拟合图求得),在较低盐浓度下,AG9/AB9主要通过静电力与BSA结合,这可能是食品色素携带的磺酸基吸引蛋白质正电荷侧链的结果。在高盐浓度下,BSA-AG9/AB9体系的EEC将在2.3节讨论。
图6 NaCl浓度对BSA-AG9(A)和BSA-AB9(B)体系猝灭的影响
Fig. 6 Effect of increasing NaCl concentration on quenching of BSA by AG9 (A) and AB9 (B)
2.2 不同离子强度下结合作用的德拜休克尔极限理论定量分析
以上结果证明AG9/AB9与BSA之间相互作用的化学计量比为1∶1,故蛋白质(BSA)与配体(食品色素)间形成1∶1复合物时存在下列平衡(式(5))。
式中:ZB为蛋白质腔(受体腔)所带电荷;ZC为配体所带电荷。
基于德拜休克尔极限理论,真实的吉布斯自由能变化ΔG0I→0(零离子强度时的自由能改变)与离子强度I之间的函数关系如下(式6)[22]。
式中:ZBC2为ZB+ZC的平方;∆G0为体系吉布斯自由能变化/(kJ/mol);R为气体常数;T为温度/K;A为吸光度。
对于给定的蛋白质-配体对,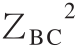 -
-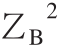 -
-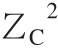 是常数,可以用ξ表示。ξ的大小和符号与平衡时两种电荷之间的平方差有关。对于水,在293、298、304、310 K下,对应的吸光度A分别为0.522、0.509、0.494、0.480(https://en.wikipedia.org/wiki/Debye-Hückel_theory)。ξ=(ZB+ZC)2-
是常数,可以用ξ表示。ξ的大小和符号与平衡时两种电荷之间的平方差有关。对于水,在293、298、304、310 K下,对应的吸光度A分别为0.522、0.509、0.494、0.480(https://en.wikipedia.org/wiki/Debye-Hückel_theory)。ξ=(ZB+ZC)2-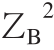 -
-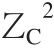 =2ZBZC,则公式(6)可以表示为式(7)。
=2ZBZC,则公式(6)可以表示为式(7)。
式(7)中不同温度(293、298、304、310 K)下的B值分别是2 928.48、2 904.28、2 875.44、2 849.09。图7显示ΔG0对I1/2拟合有较好的线性关系,表明德拜休克尔极限理论可以用来研究AG9/AB9与BSA间的相互作用。同时,从图7所观察到的正的斜率表明BSA-AG9/AB9体系的ξ值为负。实际上,ξ=2ZBZC,这里AG9/AB9的ZC值的符号是负的(表2),通过公式(7)计算ZB的值为正,这样ξ值为负,这与上面的结论一致。结果意味着相反电荷之间离子对的形成,即AG9/AB9的负电荷与BSA的净正电荷结合腔(位点-Ⅰ)相结合,这表明结合位点的局部电荷比蛋白质的整体或表面电荷更重要[22]。
表2 BSA-AG9/AB9体系的德拜休克尔极限理论分析参数
Table 2 Parameters from Debye-Hückel theory for BSA-AG9/AB9 system
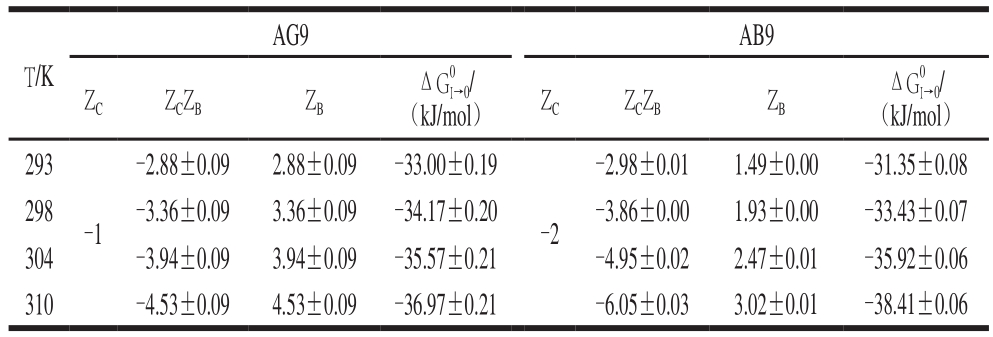
AG9 AB9 T/KZCZCZBZB(kJ/mol) ZCZCZBZBΔG0I→0/ΔG0I→0/(kJ/mol)293-2.98±0.01 1.49±0.00 -31.35±0.08 298 -3.36±0.09 3.36±0.09 -34.17±0.20 -3.86±0.00 1.93±0.00 -33.43±0.07 304 -3.94±0.09 3.94±0.09 -35.57±0.21 -4.95±0.02 2.47±0.01 -35.92±0.06 310 -4.53±0.09 4.53±0.09 -36.97±0.21 -6.05±0.03 3.02±0.01 -38.41±0.06-2.88±0.09 2.88±0.09 -33.00±0.19-1-2
所有的ΔG0值随着离子强度的增强而增大(图7),表明AG9/AB9与BSA间的静电力或结合亲和力随着盐浓度的增加而减弱,即相反电荷之间离子对的形成随着介质离子强度的增加而减弱,这可能是由于化学惰性盐(电解质)屏蔽了相互作用的电荷[22]。另外,所有Δ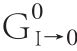 值是通过ΔG0对I1/2拟合的截距来计算的,对应的值列于表2。显然,在相同温度下,ΔG0I→0的值比ΔG0低,表明盐的加入会影响实际结合强度。
值是通过ΔG0对I1/2拟合的截距来计算的,对应的值列于表2。显然,在相同温度下,ΔG0I→0的值比ΔG0低,表明盐的加入会影响实际结合强度。
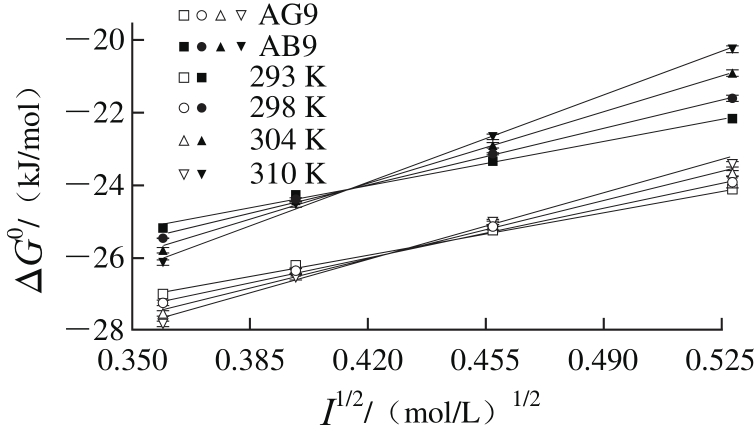
图7 0.05 mol/L磷酸盐缓冲液(pH 7.4)中BSA-AG9/AB9体系中ΔG0对I1/2的图
Fig. 7 Plots of ΔG0vs. I1/2for BSA-AG9/AB9 system in 0.05 mol/L phosphate buffer (pH 7.4)
BSA-AG9/AB9体系的德拜休克尔极限理论分析数据见表2。对于某个确定配体,其ZC值已知,如AG9的ZC值为-1,AB9的ZC值为-2;因此,可以估算得到BSA的平均正电荷(ZB)。
2.3 焓熵补偿
近年来,少数研究者探讨蛋白质-配体相互作用过程中的EEC[23-26],具体来说就是相互作用体系的熵变被对应的焓变补偿而其结合自由能改变很少的现象[27-28]。
在298 K下,BSA-AG9/AB9体系的焓变(∆H0)对熵变(T∆S0)作图(图8)。图8展现较好的线性关系,表明在这两个体系中存在EEC[22]。依据热力学参数ΔH0、ΔS0的符号来确定相互作用过程中存在的主要结合力类型的描述如下:1)正的∆H0和∆S0值表明疏水相互作用;2)负的∆H0和正的∆S0值表明水溶液中离子间特定的静电相互作用;3)负的∆H0和∆S0与氢键和范德华力的形成有关[29]。从这两个体系的热力学数据发现,c(NaCl)<0.03 mol/L时,BSA-AG9/AB9体系的熵贡献是正的;而c(NaCl)>0.03 mol/L时,这两个体系的熵变均为负值。并且,焓变随着盐浓度的增加而增加。这意味着c(NaCl)<0.03 mol/L时,相互作用由静电力主导;高于这个盐浓度时,非静电力(即氢键和范德华力)占主导[30]。通过上面分析可以得到如下结论:当静电力占主导时,配体与蛋白质的结合没有对体系局部运动产生较大的束缚,这可以从作用体系具有较低的焓变和正的熵变证明;而当氢键和范德华力占主导作用时,蛋白质配体的局部运动可能受阻,这从计算所得较高焓变和负的熵变得证。此外,当c(NaCl)增加到0.08 mol/L时,BSA-AG9体系的静电力贡献下降程度较小(∆S=(48.88±0.55)~-(14.30±7.03));而对BSA-AB9体系,静电力的贡献下降程度较大(∆S=(55.66±0.71)~-(40.55±0.66)),这表明与BSA-AB9体系相比,BSA-AG9体系有较强的离子对形成。总之,离子氛(盐)会屏蔽静电力,当BSA-AG9/AB9体系中盐浓度(离子强度)增加到一定程度时,静电力转变为非静电力,使体系结构自由度减弱,结构稳定性提高,导致熵的减小。这样结合焓的增加被熵的减少补偿,而体系结合自由能有很小的改变[23]。

图8 BSA-AG9/AB9体系中ΔH0对TΔS0的图
Fig. 8 Plots of ΔH0vs. TΔS0for BSA-AG9/AB9 system
3 结 论
在不同条件下,运用多光谱技术深入研究BSA与两种食品色素间的相互作用特性。结果表明,AG9/AB9与BSA的结合机制是静态猝灭。BSA-AG9/AB9体系在低盐浓度下结合作用较强,且相同条件下AG9与BSA间的结合亲和力较AB9强。位点竞争取代实验证实这两种食品色素可能结合在BSA的特定位点Trp残基上。∆G0对I1/2的拟合图有较好的线性关系,证实了运用德拜休克尔极限理论研究BSA-AG9/AB9体系荧光数据的合理性,通过该图估算对比其结合亲和力,表明较小的结合亲和力可以通过加入盐(增加离子强度)进行调制。当离子强度增加到一定程度,AG9/AB9与BSA相互作用的主导力由静电力转变为非静电力,导致焓和熵相互补偿并伴有结合亲和力减弱而∆G0改变很小的现象,即焓熵补偿。显然,这些方法或理论有助于探讨蛋白质-配体间的结合作用,为通过改变外部条件来减少甚至消除食品色素毒性或改善药效提供依据。
参考文献:
[1] HE Xiaoming, CARTER D C. Atomic structure and chemistry of human albumin[J]. Nature, 1992, 358: 209-215.DOI:10.1038/358209a0.
[2] BOLEL P, MAHAPATRA N, HALDER M. Optical spectroscopic exploration of binding of cochineal red A with two homologous serum albumins[J]. Journal of Agricultural and Food Chemistry, 2012,60(14): 3727-3734. DOI:10.1021/jf205219w.
[3] TIAN Zhiyong, SONG Lina, ZHAO Yuan, et al. Spectroscopic study on the interaction between naphthalimide-polyamine conjugates and bovine serum albumin (BSA)[J]. Molecules, 2015, 20(9): 16491-16523. DOI:10.3390/molecules200916491.
[4] ZHANG Qiulan, NI Yongnian, KOKOTC S. Competitive interactions between glucose and lactose with BSA: which sugar is better for children[J]. Analyst, 2016, 141(7): 2218-2227. DOI:10.1039/c5an02420j.
[5] BHUIYA S, PRADHAN A B, HAQUE L, et al. Molecular aspects of the interaction of iminium and alkanolamine forms of the anticancer alkaloid chelerythrine with plasma protein bovine serum albumin[J].Journal of Physical Chemistry B, 2016, 120(1): 5-17. DOI:10.1021/acs.jpcb.5b07818.
[6] JAHANBAN-ESFAHLAN A, PANAHI-AZAR V. Interaction of glutathione with bovine serum albumin: spectroscopy and molecular docking[J]. Food Chemistry, 2016, 202: 426-431. DOI:10.1016/j.foodchem.2016.02.026.
[7] BOURASSA P, KANAKIS C D, TARANTILIS P, et al. Resveratrol,genistein, and curcumin bind bovine serum albumin[J]. Journal of Physical Chemistry B, 2010, 114(9): 3348-3354. DOI:10.1021/jp9115996.
[8] MILLS E A, PLOTKIN S S. Protein transfer free energy obeys entropy-enthalpy compensation[J]. Journal of Physical Chemistry B,2015, 119(44): 14130-14144. DOI:10.1021/acs.jpcb.5b09219.
[9] NATESAN S, SOWRIRAJAN C, YOUSUF S, et al. Mode of encapsulation of linezolid by β-cyclodextrin and its role in bovine serum albumin binding[J]. Carbohydrate Polymers, 2015, 115: 589-597. DOI:10.1016/j.carbpol.2014.09.022.
[10] SULTAN N A, RAO R N, NADIMPALLI S K, et al. Tryptophan environment, secondary structure and thermal unfolding of the galactose-specific seed lectin from Dolichos lablab: fluorescence and circular dichroism spectroscopic studies[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2006, 1760(7): 1001-1008.DOI:10.1016/j.bbagen.2006.03.016.
[11] WANG Yingxi, LI Ling, SHENG Lijiao, et al. Spectroscopic study on the inherent binding information of cationic perfluorinated surfactant with bovine serum albumin[J]. Journal of Fluorine Chemistry, 2011,132(7): 489-494. DOI:10.1016/j.jfluchem.2011.05.003.
[12] BORISSEVITCH I E. More about the inner filter effect: corrections of Stern-Volmer fluorescence quenching constants are necessary at very low optical absorption of the quencher[J]. Journal of Luminescence,1999, 81(3): 219-224. DOI:10.1016/S0022-2313(98)00063-5.
[13] LAKOWICZ J R, WEBER G. Quenching of fluorescence by oxygen.probe for structural fluctuations in macromolecules[J]. Biochemistry,1973, 12(21): 4161-4170. DOI:10.1021/bi00745a020.
[14] EFTINK M R, GHIRON C A. Fluorescence quenching studies with proteins[J]. Analytical Biochemistry, 1981, 114(2): 199-227.DOI:10.1016/0003-2697(81)90474-7.
[15] LI Daojin, ZHU Jingfeng, JIN Jing. Spectrophotometric studies on the interaction between nevadensin and lysozyme[J]. Journal of Photochemistry and Photobiology A Chemistry, 2007, 189(1): 114-120. DOI:10.1016/j.jphotochem.2007.01.017.
[16] 倪志华, 张玉明, 邓传怀, 等. 荧光光谱法研究杆菌肽与溶菌酶的相互作用[J]. 食品科学, 2016, 37(9): 139-143. DOI:10.7506/spkx1002-6630-201609026.
[17] LIU Xiaoli, XIA Wenshui, JIANG Qixing, et al. Binding of a novel bacteriostatic agent: chitosan oligosaccharides-kojic acid graft copolymer to bovine serum albumin: spectroscopic and conformation investigations[J]. European Food Research and Technology, 2015,240(1): 109-118. DOI:10.1007/s00217-014-2312-y.
[18] WANG Zhen, CHEN Junhui, WANG Shaobin, et al. Characterizing the interaction between oridonin and bovine serum albumin by a hybrid spectroscopic approach[J]. Journal of Luminescence, 2013,134(3): 863-869. DOI:10.1016/j.jlumin.2012.06.035.
[19] DATTA S, MAHAPATRA N, HALDER M. pH-insensitive electrostatic interaction of carmoisine with two serum proteins: a possible caution on its uses in food and pharmaceutical industry[J].Journal of Photochemistry and Photobiology B Biology, 2013, 124:50-62. DOI:10.1016/j.jphotobiol.2013.04.004.
[20] MICHNIK A, DRZAZGA Z. Effect of ethanol on the thermal stability of human serum albumin[J]. Journal of Thermal Analysis and Calorimetry, 2007, 88(2): 449-454. DOI:10.1007/s10973-006-8072-6.
[21] BENESI H A, HILDEBRAND J H. A spectrophotometric investigation of the interaction of iodine with aromatic hydrocarbons[J]. Journal of the American Chemical Society, 1949, 71(8): 2703-2707.DOI:10.1021/ja01176a030.
[22] BOLEL P, DATTA S, MAHAPATRA N, et al. Spectroscopic investigation of the effect of salt on binding of tartrazine with two homologous serum albumins: quantification by use of the Debye-Hückel limiting law and observation of enthalpy-entropy compensation[J]. Journal of Physical Chemistry B, 2012, 116(34):10195-10204. DOI:10.1021/jp304537m.
[23] MELOUN M, FERENČÍKOVÁ Z. Enthalpy-entropy compensation for some drugs dissociation in aqueous solutions[J]. Fluid Phase Equilibria, 2012, 328(12): 31-41. DOI:10.1016/j.fluid.2012.05.011.
[24] NAGARAJAN A, ANDERSEN J P, WOOLF T B. Coarse-grained simulations of transitions in the E2-to-E1 conformations for Ca ATPase(SERCA) show entropy-enthalpy compensation[J]. Journal of Molecular Biology, 2012, 422(4): 575-593. DOI:10.1016/j.jmb.2012.06.001.
[25] BIELA A, NASIEF N N, BETZ M, et al. Dissecting the hydrophobic effect on the molecular level: the role of water, enthalpy, and entropy in ligand binding to thermolysin[J]. Angewandte Chemie International Edition, 2013, 52(6): 1822-1828. DOI:10.1002/anie.201208561.
[26] SENSKE M, TÖRK L, BORN B, et al. Protein stabilization by macromolecular crowding through enthalpy rather than entropy[J].Journal of the American Chemical Society, 2014, 136(25): 9036-9041.DOI:10.1021/ja503205y.
[27] WARD J M, GORENSTEIN N M, TIAN J, et al. Constraining binding hot spots: NMR and molecular dynamics simulations provide a structural explanation for enthalpy-entropy compensation in SH2-ligand binding[J]. Journal of the American Chemical Society,2010, 132(32): 11058-11070. DOI:10.1021/ja910535j.
[28] BREITEN B, LOCKETT M R, SHERMAN W, et al. Water networks contribute to enthalpy/entropy compensation in protein-ligand binding[J]. Journal of the American Chemical Society, 2013, 135(41):15579-15584. DOI:10.1021/ja4075776.28
[29] TIAN Zhiyong, ZANG Fenglei, LUO Wen, et al. Spectroscopic study on the interaction between mononaphthalimide spermidine (MINS)and bovine serum albumin (BSA)[J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 142(9): 103-109. DOI:10.1016/j.jphotobiol.2014.10.013.
[30] 朱国飞, 滕腾, 邓斌. 分子对接模拟与光谱法研究没食子酸丙酯和牛血清白蛋白的相互作用[J]. 食品工业科技, 2016, 37(18): 158-164;191. DOI:10.13386/j.issn1002-0306.2016.18.022.
Interaction of AG9/AB9 with BSA: Analysis by Debye-Hückel Limiting Law and Observation of Enthalpy-Entropy Compensation
曹丽君, 程正军, 蒋晓慧. AG9/AB9与牛血清白蛋白相互作用的德拜休克尔极限理论分析及其焓熵补偿[J]. 食品科学,2018, 39(7): 146-152. DOI:10.7506/spkx1002-6630-201807022. http://www.spkx.net.cn
CAO Lijun, CHENG Zhengjun, JIANG Xiaohui. Interaction of AG9/AB9 with BSA: analysis by Debye-Hückel limiting law and observation of enthalpy-entropy compensationation[J]. Food Science, 2018, 39(7): 146-152. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201807022. http://www.spkx.net.cn
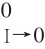 )和BSA的阴离子受体腔内有效电荷(ZB)。配体AG9/AB9所带电荷ZC的值为负,ZB的值为正,意味着相反电荷之间离子对的形成,即AG9/AB9的负电荷与BSA的净正电荷结合腔(位点-Ⅰ)相结合,表明BSA的局部电荷主导BSA-AG9/AB9体系的相互作用,而不是它的整体或表面电荷。随着盐浓度的增加,这两个体系的熵变逐渐由正值变为负值,且焓变逐渐增大,使ΔG0几乎不变而发生焓熵补偿。最终其热力学参数由ΔH0<0、ΔS0>0(静电力)在高盐浓度下转变为ΔH0<0、ΔS0<0(非静电力),表明AG9/AB9与BSA相互作用时,它们的移动或局部运动由于主导力的转变而受阻。
)和BSA的阴离子受体腔内有效电荷(ZB)。配体AG9/AB9所带电荷ZC的值为负,ZB的值为正,意味着相反电荷之间离子对的形成,即AG9/AB9的负电荷与BSA的净正电荷结合腔(位点-Ⅰ)相结合,表明BSA的局部电荷主导BSA-AG9/AB9体系的相互作用,而不是它的整体或表面电荷。随着盐浓度的增加,这两个体系的熵变逐渐由正值变为负值,且焓变逐渐增大,使ΔG0几乎不变而发生焓熵补偿。最终其热力学参数由ΔH0<0、ΔS0>0(静电力)在高盐浓度下转变为ΔH0<0、ΔS0<0(非静电力),表明AG9/AB9与BSA相互作用时,它们的移动或局部运动由于主导力的转变而受阻。




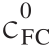 为食品色素的初始浓度/(μmol/L);K
为食品色素的初始浓度/(μmol/L);K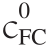 /ΔA对1/c(BSA)的Benesi-Hildebr(B-H)图见图5中的插图。可以观察到B-H图呈线性,证明在不同的盐浓度下BSA与AG9/AB9间形成1∶1复合物
/ΔA对1/c(BSA)的Benesi-Hildebr(B-H)图见图5中的插图。可以观察到B-H图呈线性,证明在不同的盐浓度下BSA与AG9/AB9间形成1∶1复合物

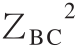 -
-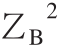 -
-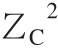 是常数,可以用ξ表示。ξ的大小和符号与平衡时两种电荷之间的平方差有关。对于水,在293、298、304、310 K下,对应的吸光度A分别为0.522、0.509、0.494、0.480(https://en.wikipedia.org/wiki/Debye-Hückel_theory)。ξ=(Z
是常数,可以用ξ表示。ξ的大小和符号与平衡时两种电荷之间的平方差有关。对于水,在293、298、304、310 K下,对应的吸光度A分别为0.522、0.509、0.494、0.480(https://en.wikipedia.org/wiki/Debye-Hückel_theory)。ξ=(Z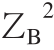 -
-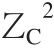 =2Z
=2Z
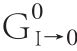 值是通过ΔG
值是通过ΔG

 ) and effective charge (Z
) and effective charge (Z