玉米醇溶蛋白(zein)是玉米加工副产物玉米黄粉中的主要蛋白质成分,约占其质量的65%[1],每年有大量的玉米黄粉被生产和浪费[2]。zein的疏水性氨基酸含量达50%以上,是一种典型的水不溶性植物蛋白。zein因为具有独特的自组装和生物兼容特性,经常被用作疏水性药物或营养素的载运体系,具有良好的包埋效果和实际应用价值,已报道的载运活性成分有百里香酚[3]、姜黄素[4-5]、白藜芦醇[6]、番茄红素[7]等。常用的zein造粒方法为反相沉淀法制备纳米微粒[8-9]或者使用喷雾干燥制备微米级微粒[10-11]。而单纯zein微粒粒径虽然较小,但通常不稳定,需要酪蛋白酸钠、果胶、卵磷脂[12]或其美拉德反应产物[6]等来稳定。有研究表明,通过转谷氨酰胺酶催化对zein进行糖基化改性[13]或直接采用湿法美拉德改性[14]可提高其溶解性。近年来,有关zein的改性、造粒与应用已有较多文献报道,包括蛋白纳米微粒成型、干法制备玉米肽糖基化纳米微粒、利用zein与多糖及蛋白质的相互作用制成多种复合微粒(如zein/酪朊酸钠、zein/硬脂酸、zein/甜菜果胶、zein/甲壳素复合微粒等),并对这些微粒在活性物质输送和乳液稳定等领域做了一系列的研究[15-19],拓宽了zein的实际应用范围。虾青素富含多不饱和长链使其具有很强的抗氧化性和生理活性功能,如抗肿瘤、提高免疫力、增强心血管功能等[20-21]。但是,由于含有较多共轭双键结构,虾青素极易被光、热、氧气等环境因素所破坏,而且,作为一种油溶性功能成分,虾青素也无法均匀分散于水溶液中,很大程度上限制了其在食品中的应用。有研究表明,利用喷雾干燥法造粒,以β-环糊精和麦芽糊精体系作为壁材,制备虾青素包埋产物[22],可有效改进其利用效率。本研究利用葡萄糖和木糖两种还原糖对zein进行接枝改性,通过喷雾造粒法制备改性zein/虾青素复合颗粒,用于包埋虾青素,以期开发改性zein新产品,扩展其食品应用范围。
1 材料与方法
1.1 材料与试剂
虾青素标准品(分析纯,纯度≥98%) 上海阿拉丁公司;zein粉末 上海耐今实业公司;无水乙醇、D(+)-葡萄糖、D(+)-木糖,十二烷基硫酸钠(sodium dodecyl sulfate,SDS),考马斯亮蓝、二氯甲烷、过氧化物酶、牛血清白蛋白(均为分析纯) 国药化学试剂有限公司;虾青素粉末(纯度≥10%) 陕西澳源生物技术有限公司。
1.2 仪器与设备
SU-8010冷场发射扫描电子显微镜 日本日立公司;差示扫描量热(differential scanning calorimeter,DSC)仪瑞士梅特勒-托利多公司;LC-2010A高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;MOS-450多功能圆二色谱仪 法国比奥罗杰公司;SY-6000小型喷雾干燥仪 上海世远生物设备工程公司;Infinite®200 PRO酶标仪 瑞士帝肯公司。
1.3 方法
1.3.1 zein糖接枝样品的制备
取6 g葡萄糖或木糖,加热溶解于15 mL体积分数80%的乙醇溶液中,并加入3 g zein粉,调pH值至9.00。将溶液置于安瓿瓶中,熔融封口后于油浴锅中115 ℃反应30 min。反应完毕后,利用体积分数80%乙醇溶液将所得溶液稀释至zein的质量浓度为4 g/100 mL,与水体积比1∶4混合得到粒径100 nm左右的zein纳米微粒悬浮液。
1.3.2 接枝产物蛋白质量分数和接糖量的测定
采用GB 50095—2010《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法测定接枝产物蛋白质量分数。反应产物与空白组的蛋白质量分数差值即为蛋白中的接糖量。
1.3.3 利用SDS-PAGE表征糖蛋白
对接枝产物进行SDS-聚丙烯凝胶电泳(SDS-polyacrylamide gel electrophoresis,PAGE)后染色,以表征新增的糖蛋白。电泳步骤如下:以体积分数80%乙醇溶液制备1 mg/mL蛋白溶液,取样15 μL,15%分离胶,5%浓缩胶,80 V恒压3 h。糖染色采用改进的席夫试剂糖染色法,蛋白质染色采用考马斯亮蓝染色法,以牛血清白蛋白作为非糖蛋白的标记,以辣根过氧化物酶作为糖蛋白的标记[23]。
席夫试剂的配制[24]如下:将1 g碱性品红溶于200 mL 100 ℃蒸馏水中,搅拌5 min;冷却至50 ℃过滤,加入20 mL 1 mol/L盐酸过滤;冷却至25 ℃,加入2 g亚硫酸钠,避光放置24 h,加入2 g活性炭搅拌1 min过滤,避光保存。
1.3.4 圆二色谱表征结构的变化
将糖接枝产物溶于体积分数70%乙醇溶液中,调节其蛋白质量浓度为0.1 mg/mL,进行圆二色谱扫描。扫描波长190~250 nm,样品池光程为 10 mm,扫描速率100 nm/min,扫描步长1.0 nm。每个样品扫描3 次,累加取平均光谱作为样品的最终光谱[25],对光谱解析后计算蛋白二级结构的含量。
1.3.5 喷雾造粒微粒的制备
取25 g虾青素粉末,加入300 mL二氯甲烷,搅拌并超声30 min后加入233.3 mL无水乙醇,再次搅拌并超声10 min,以2 000 r/min离心5 min,取上清液即为V(二氯甲烷):V(无水乙醇)=9∶7的虾青素溶液。调节虾青素质量浓度为0.4 g/mL。向该溶液中加入相应质量的zein粉或经上述实验糖接枝改性后的zein粉,40 ℃超声振荡30 min使蛋白质充分溶解,将蛋白质量浓度控制在2 g/mL,2 000 r/min离心5 min去除不溶性杂质,即可得到zein/虾青素混合溶液。将上述所得溶液喷雾造粒,造粒条件为:进风口温度115 ℃,进料速率15 mL/min,喷雾气流1 000 L/h,通针频率4 次/分。所得微粒4 ℃条件下密闭避光保存备用。
1.3.6 微粒的形貌特征观察
利用冷场发射扫描电子显微镜观察分析造粒产物的形貌特征。电子显微镜观察方法如下:将少量待检测微粒涂抹于导电胶上,使用离子喷镀仪喷金,喷金电流15 mA,喷镀时间90 s,于3 kV电压下观察样品。
1.3.7 DSC法分析微粒的热特性
称取不同处理的复合微粒各5.00 mg,在40 μL铝坩埚中压制均匀,采用氮气气氛,升温速率10 ℃/min,吹扫氮气150 mL/min,扫描温度0~250 ℃。数据使用STARe Evaluation软件处理分析。空白对照组采用zein和虾青素以9∶1(m/m)混合均匀后取样。
1.3.8 虾青素含量测定标准曲线的制作
精密称取5.00 mg虾青素标准品,加入0.5 mL二氯甲烷溶解,然后用二氯甲烷-无水乙醇(1∶9,V/V)溶液定容到250 mL,此为虾青素母液。将虾青素母液适当稀释后,用酶标仪进行全波长扫描以确定其最大吸收波长。
取虾青素母液,以相同溶剂体系制得质量浓度为0、1、2、4、6、8、10、12、14 μg/mL的虾青素标准溶液。使用HPLC法检测标准溶液中虾青素含量,建立虾青素含量测定的标准曲线。HPLC条件如下:ZORBAX SB-C18(250 mm×4.6 mm,5 μm)色谱柱;紫外检测器检测波长475 nm;流动相为95%体积分数甲醇溶液;流速1 mL/min;自动进样量20 μL。
1.3.9 复合微粒对虾青的包埋效果
复合微粒表面虾青素质量浓度的测定:取样品20 mg,加入无水乙醇250 mL,磁力搅拌5 min,取上清液,12 000 r/min离心1 min,将离心所得溶液过0.22 μm有机系滤器后,利用HPLC在最大吸收波长475 nm处测定吸光度,通过标准曲线(浓度-峰面积标准曲线y=245 768x+3 943.5,R²=0.999 9,其中y表示HPLC检测所得峰面积,x为虾青素质量浓度/(mg/L)),计算不同溶液中虾青素的质量浓度。
复合微粒中虾青素总质量浓度的测定:取样品10 mg,加入混合溶剂(V(二氯甲烷)∶V(无水乙醇)=9∶7)20 mL,超声3 min使微粒溶解均匀,取1 mL该混合溶液用无水乙醇适当稀释后测定虾青素总质量浓度。
复合微粒表面虾青素质量分数、复合微粒虾青素载运率、复合微粒虾青素包埋率计算如式(1)~(3)所示。

1.3.10 复合微粒的缓释效果分析
取复合微粒25 mg,加入无水乙醇250 mL,常温磁力搅拌,分别于5 min和12 h时取上清液1 mL,12 000 r/min离心1 min,经0.22 μm有机系滤器过滤后测定虾青素质量浓度。比较5 min、12 h后溶液中自由虾青素质量浓度,按式(4)计算虾青素释放率。
1.3.11 复合微粒中虾青素热稳定性
取10 mg虾青素粉末或者50 mg虾青素包埋粉末,加入25 mL去离子水,振荡均匀后95 ℃水浴8 h。冷却至室温后使用二氯甲烷和混合溶剂(V(二氯甲烷)∶V(无水乙醇)=9∶7)提取各实验组中的虾青素,然后将该提取液用无水乙醇稀释25 倍后测定虾青素质量分数(式(5))并计算虾青素的破坏率(式(6))。

1.4 数据统计分析
通过统计软件SPSS 19.0的Duncan模型进行方差分析与多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 zein的糖接枝
表1 糖接枝反应产物的蛋白质量分数和接糖量
Table 1 Protein contents and sugar contents of zein and its grafts%

注:同行肩标小写字母不同表示差异显著(P<0.05)。表3~6同。
通过凯氏定氮法分别测定了原料zein、空白处理zein、zein-葡萄糖、zein-木糖的蛋白质量分数,通过反应前后蛋白质质量分数变化值即可计算出接枝产物的接糖量。从表1可知,原料中蛋白质量分数为90.25%,经过空白处理后,原料蛋白进一步提纯,蛋白质量分数从90.25%提高到99.86%。接枝反应后,zein-葡萄糖、zein-木糖的蛋白质量分数分别为97.27%、97.33%。经计算可知美拉德接枝产物中葡萄糖、木糖与zein的反应程度相同,反应产物新增加还原糖量约为2.6%。

图1 席夫试剂染色(A)和考马斯亮蓝染色(B)的SDS-PAGE图
Fig. 1 SDS-PAGE of zein with Schiff staining (A) and Coomassie blue staining (B)
为了验证糖蛋白的产生,本研究采用SDS-PAGE技术分离不同亚基分子质量的蛋白质,并采用高碘酸-席夫试剂和考马斯亮蓝法先后对同一电泳凝胶进行染色(图1A、B),检测得到糖蛋白的具体信息。其中泳道2、4分别是质量浓度为0.5、1.0 mg/mL 的辣根过氧化物酶,一种典型的糖蛋白用于糖蛋白染色的阳性标记物;泳道3是牛血清白蛋白,因不含糖蛋白而用做阴性标记物。泳道5和泳道6分别是原料zein和热处理后的原料zein,其条带经糖染色后显色微弱,说明原料zein中本身糖基含量较少,且加热并不会增加其含糖量。泳道7、8分别为zein和葡萄糖、木糖的反应产物,相较于泳道5和6,其在21 kDa条带处糖染色较深,说明有糖蛋白产物生成。而且zein-木糖颜色深于zein-葡萄糖,说明糖基化反应程度zein-木糖大于zein-葡萄糖。造成这种结果的可能原因是:木糖为五碳糖,发生美拉德反应的速率会大于作为六碳糖的葡萄糖以及双糖的麦芽糖。
2.2 糖接枝后zein的结构变化
表2 糖接枝产物的二级结构含量
Table 2 Secondary structures of zein and its grafts%

注:同列肩标字母不同表示差异显著(P<0.05)。
圆二色谱紫外区段(190~240 nm),主要生色团是肽链,这一波长范围主要包含了生物大分子主链构象的信息。本实验对zein及其糖接枝产物进行圆二色谱检测,并应用DichroWeb在线网站分析蛋白质二级结构含量,使用SELCON3分析方法获取数据。从表2中可见,经过糖接枝处理后蛋白质的α-螺旋结构和无规卷曲结构含量显著减少,而β-折叠结构含量增加。这可能是因为经过糖接枝改性后,蛋白空间结构发生一定的变化,从而使蛋白质更加展开。α-螺旋是一种紧密且没有空腔的稳定结构,其结构中存在较多的氢键,导致规则二级结构具有一定的刚性。而β-折叠结构是二级结构中的较为无序的结构,结构的有序性与蛋白质的某些功能性质存在协同性,β-折叠含量的增加会提高蛋白质的柔韧性和扩展性,从而发挥蛋白质的某些功能性质[26]。蛋白质二级结构在糖基化反应之后的这种变化表明,zein整个分子构象从有序向无序的转化,这也预示其相应功能的变化。
2.3 复合微粒的包埋

图2 虾青素微粒(A)、zein/虾青素复合微粒(B)和经过液氮处理后的zein/虾青素复合微粒(C)的场发射扫描电子显微镜图
Fig. 2 FESEM pictures of pure astaxanthin particles (A), zein/astaxanthin composite particles (B) and particles treated with liquid nitrogen (C)
图2 为场发射扫描电子显微镜观察的虾青素微粒以及改性zein包埋虾青素复合微粒的形貌图。从图中可以看出,虾青素本身微粒粒径较小(图2A),经zein包埋后形成的复合微粒粒径显著增大(图2B),证明在该实验条件下能实现较好的包埋效果,包埋的完整率也较高。图2C表明,经过液氮处理后的微粒冻破后呈现空心状态。这是因为随着溶液中zein的添加,单位时间里喷出的蛋白与液滴中的有机溶剂结合,后者在瞬间挥发时恰好形成实心或者壁层更厚的中空球,这种结构的形成与zein本身的性质有关。这种表面圆滑的中空结构能够更好地包埋虾青素,从而达到保护虾青素的效果。
为了进一步分析得到有关zein与虾青素复合微粒结构的重要信息,对不同处理的微粒进行DSC分析。zein为生物大分子,具有复杂的三级空间结构和四级亚基结构,在一定的条件下,总是在折叠(自然态)和展开(变性态)构象之间保持平衡,而热处理会诱导蛋白质发生构象变化,使非共价键重新分配导致热吸收[27]。DSC可测量因热变性造成的去折叠热焓(∆H),热跃迁中点(Tm,即蛋白质完全变性点)等指标[28]。当zein与虾青素发生了分子层面的结合时,蛋白质空间结构和键位都会发生一定的变化,从而导致热量吸收的变化。
表3 原料及其复合微粒的DSC热吸收峰
Table 3 Thermal absorption peaks of raw materials and composite particles

DSC结果表明(表3),虾青素在220 ℃处有特征热吸收峰,zein在90 ℃处有特征吸收峰,zein和虾青素的简单混合物在90 ℃和220 ℃处同时出现吸收峰,而zein/虾青素和改性zein/虾青素微粒在220 nm波长处均无明显吸收峰,说明复合微粒中zein和虾青素形成了致密交联的状态,虾青素均匀分布在球体中,而并非典型的壳核结构。糖接枝改性后的zein/虾青素复合微粒的特征吸热峰从90 ℃偏移至84 ℃左右,这可能是因为相比原料蛋白,接枝产物引入了新的糖链导致其结构更加展开与无规则,进而与虾青素氢键的相互作用更强烈[29-30]。
表4 复合微粒对虾青素的包埋效果
Table 4 Encapsulation efficiency of astaxanthin in composite particles%

表4比较了相同造粒条件下,zein、zein-葡萄糖、zein-木糖复合微粒对虾青素的包埋效果。从表4可知,糖接枝(zein-葡萄糖、zein-木糖)改性后的产物相比zein对虾青素的包埋率分别提高了12.55%、15.09%,说明蛋白质的糖接枝反应对蛋白质结构的改变对包埋效果产生了有利的影响。有研究发现,经过糖接枝改性的大豆分离蛋白对番茄红素的包埋同样具有提高的效果[31]。
2.4 复合微粒的缓释效果
表5 复合微粒的虾青素释放率
Table 5 Release rates of astaxanthin from composite particles
%

表5所示为复合微粒和虾青素粉末在无水乙醇中虾青素的释放情况。可以看到在搅拌初期(5 min),没有经过包埋的虾青素粉末已经几乎完全溶解在无水乙醇中,结合表4可知,复合微粒仅表面附着的虾青素溶解在无水乙醇溶液中。搅拌12 h后,未包埋的虾青素粉末溶解度没有显著变化,而复合微粒的无水乙醇溶液中虾青素质量分数有一定程度的上升,但糖接枝改性zein/虾青素复合微粒的虾青素释放率显著低于未经过糖接枝改性的zein/虾青素复合微粒的虾青素释放率。这说明复合微粒对虾青素有很好的包埋缓释作用,且糖接枝改性有助于提升zein对虾青素包埋的虾青素缓释效果更佳。
2.5 复合微粒中虾青素的热稳定性
表6 热处理对复合微粒中虾青素质量分数的影响
Table 6 Effect of heating treatment on astaxanthin contents in particles
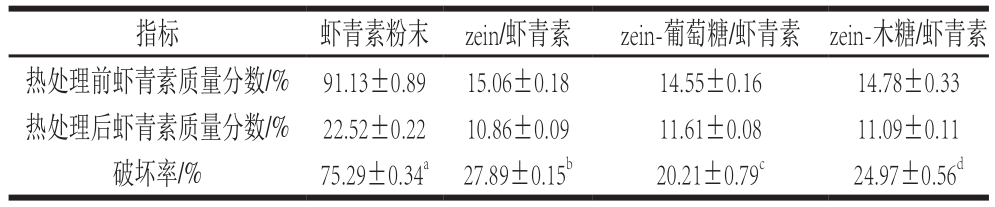
将虾青素粉末和复合微粒进行长时间剧烈热处理,检测虾青素的破坏率。由表6可见,没有经过包埋造粒的虾青素经过热处理后破坏率高达75.29%,而包埋造粒后虾青素的破坏率下降至25%左右,这些损失大部分来源于包埋微粒上表面附着的虾青素。在95 ℃的水溶液中,被包埋的虾青素受到了良好的保护,基本保留了下来,说明复合造粒对虾青素有良好的热稳定性保护作用。且经过糖接枝改性的复合微粒相比原料zein包裹的复合微粒,对虾青素的保护效果更好[32]。在水溶液中,加热会引起zein分子展开而产生聚集变性。而经过糖基化改性后,zein与糖之间的共价作用抑制了同样条件下zein结构的展开,因此可以很好地改善zein的热稳定性,从而使得其复合微粒的包埋热稳定性提升。
3 结 论
本研究以糖接枝改性的zein为研究对象,制备得到了单糖接枝改性zein,并以此建立改性zein/虾青素复合微粒载运体系,考察复合微粒包埋载运虾青素效果的影响。主要研究结论如下:
将zein与两种单糖(木糖、葡萄糖)进行糖接枝反应,zein-葡萄糖/木糖的接糖量分别为2.59%和2.53%。SDS-PAGE后经过考马斯亮蓝染色和席夫试剂染色,充分证明了糖接枝反应的发生并生成了糖蛋白。圆二色谱结果表明,蛋白二级结构发生了一些变化,其中α-螺旋结构含量减小,β-折叠和β-转角结构含量增加,表明糖接枝后蛋白空间结构发生了一定程度的展开。
通过低温喷雾造粒法,制备了改性zein/虾青素的复合微粒。场发射扫描电子显微镜观察表明复合微粒可能为空心塌陷的微粒,DSC研究表明zein/虾青素形成了均一的复合体系,而不是简单的混合状态,其内部结构非典型的壳核结构,而是虾青素和zein相互作用,虾青素均匀分布于微粒中。HPLC法检测虾青素包埋效率,发现相比未改性的zein,糖接枝的zein对虾青素的载运量没有明显变化,而对虾青素的包埋率却提高了10%。复合微粒对虾青素具有很强的缓释作用,在无水乙醇体系下溶解12 h,未包埋的虾青素释放率达99.8%,而zein/虾青素、zein-葡萄糖/虾青素、zein-木糖/虾青素复合微粒中虾青素释放率分别为49.7%、31.7%和30.2%,经过糖接枝改性后的复合微粒对虾青素的包埋率提高,缓释效果更为显著,且明显提高了虾青素的热稳定性。
参考文献:
[1] 罗晶, 涂瑾, 黄婷玉, 等. 玉米醇溶蛋白的磷酸化修饰及结构研究[J]. 现代食品科技, 2015, 31(8): 88-94. DOI:10.13982/j.mfst.1673-9078.2015.8.016.
[2] 黄国平, 温其标, 杨晓泉, 等. 超声波法提取玉米醇溶蛋白的研究[J]. 食品与发酵工业, 2002, 28(10): 1-5. DOI:10.13995/j.cnki.11-1802/ts.2002.10.001.
[3] ZHANG Y Q, NIU Y G, LUO Y C, et al. Fabrication, characterization and antimicrobial activities of thymol-loaded zeinnanoparticles stabilized by sodium caseinate-chitosan hydrochloride double layers[J]. Food Chemistry, 2014, 142: 269-275. DOI:10.1016/j.foodchem.2013.07.058.
[4] HU K, HUANG X X, GAO Y Q, et al. Core-shell biopolymer nanoparticle delivery systems: synthesis and characterization of curcumin fortified zein-pectin nanoparticles[J]. Food Chemistry, 2015, 182: 275-281. DOI:10.1016/j.foodchem.2015.03.009.
[5] WANG L J, HU Y Q, YIN S W, et al. Fabrication and characterization of antioxidant pickering emulsions stabilized by zein/chitosan complex particles (ZCPs)[J]. Journal of Agricultural and Food Chemistry, 2015,63(9): 2514-2524. DOI:10.1021/jf505227a.
[6] DAVIDOV-PARDO G, JOYE I J, ESPINAL-RUIZ M, et al. Effect of Maillard conjugates on the physical stability of zein nanoparticles prepared by liquid antisolvent coprecipitation[J]. Journal of Agricultural and Food Chemistry, 2015, 63(38): 8510-8518. DOI:10.1021/acs.jafc.5b02699.
[7] XUE F, LI C, LIU Y, et al. Encapsulation of tomato oleoresin with zein prepared from corn gluten meal[J]. Journal of Food Engineering, 2013,119(3): 439-445. DOI:10.1016/j.jfoodeng.2013.06.012.
[8] LI K K, ZHANG X, HUANG Q, et al. Continuous preparation of zein colloidal particles by flash nanoprecipitation (FNP)[J]. Journal of Food Engineering, 2014, 127: 103-110. DOI:10.1016/j.jfoodeng.2013.12.001.
[9] DE FOLTER J W J, VAN RUIJVEN M W M, VELIKOV K P. Oilin-water pickering emulsions stabilized by colloidal particles from the water-insoluble protein zein[J]. Soft Matter, 2012, 8(25): 6807-6815.DOI:10.1039/c2sm07417f.
[10] ZHONG Q, JIN M. Nanoscalar structures of spray-dried zein microcapsules and in vitro release kinetics of the encapsulated lysozyme as affected by formulations[J]. Journal of Food Engineering, 2009, 57(9):3886-3894. DOI:10.1021/jf803951a.
[11] CHEN H Q, ZHONG Q X. Processes improving the dispersibility of spray-dried zein nanoparticles using sodium caseinate[J]. Food Hydrocolloids, 2014, 35: 358-366. DOI:10.1016/j.foodhyd.2013.06.012.
[12] PODARALLA S, PERUMAL O. Influence of formulation factors on the preparation of zein nanoparticles[J]. AAPS Pharmscitech, 2012,13(3):919-927. DOI:10.1208/s12249-012-9816-1.
[13] 周利敏, 刘晓兰, 刘玥, 等. TGase催化玉米醇溶蛋白糖基化改性[J]. 食品科学, 2014, 35(24): 15-19. DOI:10.7506/spkx1002-6630-201424003.
[14] 孔繁惠, 刘景圣, 修琳, 等. 玉米醇溶蛋白湿热法糖基化初步研究[J]. 中国食物与营养, 2012, 18(4): 55-58. DOI:10.3969/j.issn.1006-9577.2012.04.015.
[15] 任晓鸣, 王丽娟, 王金梅, 等. 超临界CO2反溶剂法制备大豆异黄酮-玉米醇溶蛋白复合纳米颗粒[J]. 食品工业科技, 2012, 33(24): 273-276.
[16] 任晓鸣, 张晋博, 杨晓泉, 等. 玉米肽-麦芽糊精糖基化产物与α-生育酚共组装纳米粒子的制备及其性质[J]. 化工学报, 2014, 65(4):1381-1386. DOI:10.3969/j.issn.0438-1157.2014.04.031.
[17] WANG L J, YIN Y C, YIN S W, et al. Development of novel zeinsodium caseinate nanoparticle (ZP)-stabilized emulsion films for improved water barrier properties via emulsion/solvent evaporation[J].Journal of Agricultural and Food Chemistry, 2013, 61(46): 11089-11097.DOI:10.1021/jf4029943.
[18] LI K K, YIN S W, YANG X Q, et al. Fabrication and characterization of novel antimicrobial films derived from thymol-loaded zein-sodium caseinate (SC) nanoparticles[J]. Journal of Agricultural and Food Chemistry, 2012, 60(46): 11592-11600. DOI:10.1021/jf302752v.
[19] GAO Z M, YANG X Q, WU N N, et al. Protein-based pickering emulsion and oil gel prepared by complexes of zein colloidal particles and stearate[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12):2672-2678. DOI:10.1021/jf500005y.
[20] GHLISSI Z, HAKIM A, SILA A, et al. Evaluation of efficacy of natural astaxanthin and vitamin E in prevention of colistin-induced nephrotoxicity in the rat model[J]. Environmental Toxicology &Pharmacology, 2014, 37(3): 960-966. DOI:10.1016/j.etap.2014.03.004.
[21] JYONOUCHI H, SUN S, IIJIMA K, et al. Antitumor activity of astaxanthin and its mode of action[J]. Nutrition & Cancer, 2000, 36(1):59-65. DOI:10.1207/s15327914nc3601_9.
[22] 胡婷婷, 王茵, 吴成业. 响应面法优化虾青素微胶囊制备工艺[J]. 食品科学, 2014, 35(12): 53-59. DOI:10.7506/spkx1002-6630-201412010.
[23] 王玉琪, 巫光宏, 林先丰, 等. 多糖和糖蛋白聚丙烯酰胺凝胶电泳染色方法的改进[J]. 植物生理通讯, 2009, 45(2): 169-172.
[24] 张世雄, 程立均. 一种改进的糖蛋白染色鉴别方法的建立[J]. 中国生物制品学杂志, 2012, 25(1): 108-110.
[25] KIM D Y, SHIN W S. Characterisation of bovine serum albuminfucoidan conjugates prepared via the Maillard reaction[J]. Food Chemistry, 2015, 173: 1-6. DOI:10.1016/j.foodchem.2014.09.167.
[26] 李晨. 基于糖基化反应的花生蛋白成膜性及其风味缓释效应的研究[D]. 无锡: 江南大学, 2015: 36-41.
[27] SCHUBRING R. Characterizing protein changes caused by application of high hydrostatic pressure on muscle food by means of DSC[J]. Journal of Thermal Analysis & Calorimetry, 2005, 82(1): 229-237. DOI:10.1007/s10973-005-0872-6.
[28] 汪立君, 李里特, 张晓峰, 等. 利用DSC对大豆蛋白质热变性的研究[J]. 中国农业大学学报, 2001, 6(6): 93-96. DOI:10.3321/j.issn:1007-4333.2001.06.020.
[29] JOYE I J, DAVIDOV-PARDO G, LUDESCHER R D, et al. Fluorescence quenching study of resveratrol binding to zein and gliadin: towards a more rational approach to resveratrol encapsulation using waterinsoluble proteins[J]. Food Chemistry, 2015, 185: 261-267. DOI:10.1016/j.foodchem.2015.03.128.
[30] 任晓鸣. 玉米醇溶蛋白与玉米肽复合纳米颗粒制备及其输送、抗氧化性质研究[D]. 广州: 华南理工大学, 2014: 25-30.
[31] 侯园园, 刘锐, 张民, 等. 糖接枝蛋白对番茄红素微胶囊包埋影响的研究[J]. 食品科技, 2014, 32(9): 252-255. DOI:10.13684/j.cnki.spkj.2014.09.053.
[32] SOLÁ R J, KAI G. Effects of glycosylation on the stability of protein pharmaceuticals[J]. Journal of Pharmaceutical Sciences, 2009, 98(4):1223-1245. DOI:10.1002/jps.21504.