作为物理改性蛋白质性质的代表,磨球超微粉碎是一种简便、常用的物理手段。它利用研磨体(如钢球、石球、陶瓷球等)的冲击作用以及研磨体与磨球内壁的研磨作用将物料粉碎[1],改变蛋白质的空间结构,从而改善其功能特性[2],常用于中药粉碎[3]、小麦淀粉的处理[4]等。王丹丹[5]利用超微粉碎辅助化学改性处理豆渣,改性处理后豆渣持水力和膨胀率下降,阳离子交换能力增强。乔一腾等[6]利用超微粉碎技术对大豆分离蛋白进行改性处理,改性处理后的大豆分离蛋白的功能特性明显提高。酶法改性是利用蛋白酶有限度地水解肽键或酰胺键,或者进行分子间共价交联,使蛋白质功能性质发生定向改变[7]。由于酶法改性蛋白具有条件温和及节能环保的优点,被广泛用于蛋白质的改性当中。黄群等[8]利用碱性蛋白酶改性卵白蛋白并优化其工艺,在最优条件下卵白蛋白起泡性可达202.0%,相比未处理组提高了1.683 倍。张兆丽[9]报道酶法改性可显著提高花生分离蛋白的吸水性和乳化性。酶法改性还能应用于大豆分离蛋白、大米蛋白、玉米胚芽蛋白等多种蛋白的改性中。然而,单一的物理改性、化学改性和酶法改性对蛋白质特性的改变都有一定的局限性。因此,探讨理化方法与酶解处理的联合方法对改善蛋白质的功能特性具有积极意义。
我国是世界上最大的蚕丝产地,蚕业历史悠久[10],年产鲜蚕蛹50万 t以上。蚕蛹蛋白在干蚕蛹中的质量分数达60%左右,含有18 种氨基酸,包含所有人体的必需氨基酸和含硫氨基酸,必需氨基酸在总氨基酸中的质量分数约为42%,与非必需氨基酸含量的比值为0.7,高于世界卫生组织(World Health Organization,WHO)和联合国粮食及农业组织(Food and Agriculture Organization,FAO)提出的参考蛋白模式值,是一种优质的营养蛋白源。经特定微生物发酵工艺处理,蚕蛹蛋白的异味物质可被有效脱除[11]。但缫丝过程中的高温、碱煮等脱胶程序,易引起蚕蛹蛋白质变性,导致其功能特性(如溶解性、起泡性、乳化性和持水性等)变差,限制了其在食品工业生产中的应用[2]。目前,缫丝后的蚕蛹主要利用途径有两方面:一是经简单灭菌处理制成蚕蛹罐头,作为初级食品食用;二是经干燥粉碎后添加到动物饲料中,以提高家禽或家畜的生长性能。现有加工技术仅处于简单的初级加工水平,蚕蛹蛋白的高营养性和功能性未得到体现。为高效利用蚕蛹蛋白这一优质资源,其功能特性的改善已成为研究热点。本实验以蚕蛹蛋白为研究对象,结合磨球超微粉碎预处理和碱性蛋白酶解技术改性蚕蛹蛋白,研究其功能特性和相关免疫活性,为改性蚕蛹蛋白提供理论和技术参考。
1 材料与方法
1.1 材料与试剂
缫丝后蚕蛹由中国农业科学院蚕业研究所提供。
噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)美国Bio Basic有限公司;Alcalase 2.4L FG碱性蛋白酶 诺维信(中国)投资有限公司;石油醚、氢氧化钠、盐酸、无水乙醇、考马斯亮蓝G-250、磷酸二氢钠、磷酸氢二钠、葡聚糖凝胶G-100、三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、甘氨酸、乙二胺四乙酸二钠、尿素、硫酸铜、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、溴化钾(均为分析纯) 上海国药集团化学试剂有限公司。
1.2 仪器与设备
H205DR-1高速冷冻离心机 长沙湘仪离心机仪器有限公司;FDU-2100冷冻干燥机 日本东京理化器械;UV-2450紫外-可见分光光度计 日本岛津公司;KS-JY92-IL超声波细胞破碎机 宁波海曙科生超声设备有限公司;HZM系列振动磨球超微粉碎机 青岛海纳微粉工程有限公司;EL310型酶标仪 美国Bio-Tek公司;HERACELL 150i CO2培养箱 上海新苗医疗器械制造有限公司;J-810型圆二色(circular dichroism,CD)光谱仪 日本JASCO公司。
1.3 方法
1.3.1 蚕蛹蛋白的制备
将蚕蛹烘干、粉碎,然后用石油醚脱脂、烘干,备用。将脱脂蚕蛹粉用质量分数为1%的NaOH溶液配制成质量分数为10%的悬浮液,在55 ℃条件下恒温水浴搅拌提取3 h后离心收集上清液,将所得的上清液用1 mol/L的HCl溶液调节pH值至4.5,离心收集沉淀,冷冻干燥机冷冻干燥[12]。
1.3.2 微细化-蛋白酶解改性处理蚕蛹蛋白
将蚕蛹蛋白配制成质量分数为8.3%的溶液,调节pH值至8.1,用磨球超微粉碎机处理61 s。将处理后的溶液稀释成质量分数为5%的溶液,调节pH值至8.0,用Alcalase 2.4L FG碱性蛋白酶进行酶解,加酶量为6 000 U/g,温度为55 ℃,酶解2 h后煮沸使蛋白酶失活,冷却后冷冻干燥,得到处理后蚕蛹蛋白粉,备用。
1.3.3 氨基酸分析
1.3.3.1 氨基酸组成分析
取0.5 g蛋白样品溶于6 mL浓度为6 mol/L的HCl溶液中,置于水解管氮气密封后,110 ℃条件下水解24 h。水解液采用邻苯二甲醛柱前自动衍生,用反相高效液相色谱在338 nm波长处分析氨基酸组成。
1.3.3.2 营养学评价
根据FAO/WHO建议的氨基酸评分标准模式和中国预防医学科学院营养与食品卫生研究所提出的鸡蛋蛋白质模式进行营养评价。按公式(1)~(3)分别计算氨基酸评分(amino acid score,AAS)、化学评分(chemical score,CS)及必需氨基酸指数(essential amino acid index,EAAI)[13-14]。

式中:n为比较的氨基酸数目;t为实验蛋白质的氨基酸含量/(mg/g);s为鸡蛋蛋白质的氨基酸含量/(mg/g)。
1.3.4 水解度的测定
水解度的测定采用pH-stat法[15],水解度用公式(4)计算。
式中:c(NaOH)是所用NaOH溶液的浓度/(mol/L);V(NaOH)是消耗NaOH溶液的体积/mL;α是α-NH2的解离度;mp是底物蛋白的质量/g;htot是底物蛋白的肽键含量/(mmol/g)。对于蚕蛹蛋白,htot为8.2 mmol/g,α为0.44。
1.3.5 巯基与二硫键含量测定
巯基含量测定采用Beveridge等[16]的方法,略作修改。分别取0.5 g经不同处理的蛋白样品,溶解于50 mL的pH值为8.0的Tris-Gly缓冲液中,稀释一定倍数,测定其质量浓度。取蛋白样品0.5 mL,加入2.5 mL尿素浓度为8 mol/L的Tris-Gly缓冲液(pH 8.0),再加入0.02 mL质量浓度为4 g/L的DTNB,迅速混匀后在25 ℃下反应30 min,用紫外-可见分光光度计测定其在412 nm波长处的吸光度。巯基含量cSH/(μmol/g)的计算见式(5)。
式中:ASH为巯基吸光度;ρS为样品蛋白质量浓度/(g/L)。
分别取经不同处理的蛋白样品溶液0.5 mL,加入5 mL尿素浓度为10 mol/L的Tris-Gly缓冲液(pH 8.0),再加入0.1 mL β-巯基乙醇,在25 ℃下反应1 h,加入50 mL质量分数为12%的三氯乙酸溶液,继续反应1 h后,离心去上清液,沉淀用50 mL质量分数为12%的三氯乙酸溶液洗涤,离心去上清液,重复操作2 次,最后在沉淀中加入15 mL尿素浓度为8 mol/L的Tris-Gly缓冲液(pH 8.0),然后加入0.15 mL质量浓度为4 g/L的DTNB,迅速混匀后在25 ℃下反应30 min,用紫外-可见分光光度计测定其在412 nm波长处的吸光度。二硫键含量cSS/(μmol/g)的计算公式为:
式中:ASS为二硫键吸光度;ρS为样品蛋白的质量浓度/(g/L);cSH为巯基含量/(μmol/g)。
1.3.6 CD光谱的测定
将样品蛋白配制成1 μg/mL,利用CD光谱仪进行测定,扫描波长范围为190~250 nm,样品池的光径为0.1 cm,扫描速率100 nm/min,并用Bio-Logic快速动力学光谱分析系统进行分析。
1.3.7 分子质量分布的测定
将样品用pH 8.0的磷酸盐缓冲液配制成10 g/L的溶液。样品溶液过葡聚糖凝胶G-100凝胶柱分离,用恒流泵控制磷酸盐缓冲液的洗脱速率为1 mL/min,每2 min收集一个样品,用紫外分光光度计测定其在280 nm波长处的吸光度。
1.3.8 溶解度的测定
分别取0.1 mL的样品溶液和0.9 mL蒸馏水混合,然后加5.0 mL考马斯亮蓝G-250溶液,充分混合,静置2 min后,在595 nm波长处测定吸光度,根据得到的标准曲线计算得到的蛋白质量浓度。取蚕蛹蛋白样品2 g悬浮于100 mL蒸馏水中,调节pH值为7.0,搅拌30 min后8 000 r/min离心20 min,测上清液中的蛋白质量浓度[17]。
1.3.9 乳化性的测定
在测试管中分别加入15 mL质量浓度为1 g/L的蛋白质溶液和5 mL玉米油,用高速均质机24 000 r/min处理1 min后,从测试管底部取出50 μL乳化液,用1 g/L十二烷基硫酸钠稀释100 倍后,于500 nm波长处比色,测定吸光度A0。同样地,在10 min后,取样测定吸光度A10。乳化活性指数(emulsifying activity index,EAI)/(m2/g)和乳化稳定性指数(emulsifying stability index,ESI)的计算公式如式(7)、(8)[18]。
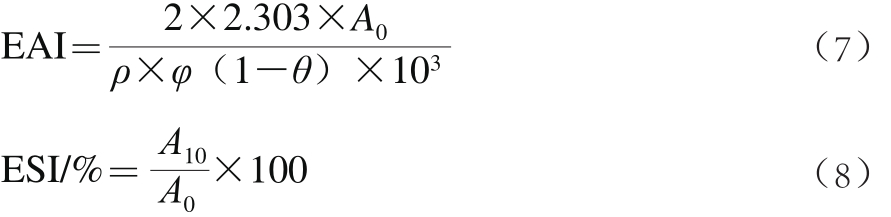
式中:ρ为蛋白质量浓度/(g/L);φ为光程/(0.01 m);θ为油相所占的比例。
1.3.10 起泡性的测定
取50 mL 1 g/L的蛋白溶液置于25 ℃水浴中,使用高速分散器以13 500 r/min分散2 次,每次30 s,快速移至250 mL量筒,记下泡沫体积V0。以起泡度作为蛋白溶液起泡能力(foaming capacity,FC)的评价参数,并按式(9)计算。
将量筒静置30 min后,再测量泡沫的残留体积Vr。泡沫稳定性(foaming stability,FS)按式(10)进行计算[19]。
1.3.11 促小鼠脾细胞增殖实验
取8 周龄小鼠颈椎脱臼处死,无菌取脾,用注射器塞研磨后,于200 目铜网过筛,收集细胞悬液,离心去上清液,加红细胞裂解液裂解,然后加入培养基重悬细胞,计数,并将脾细胞浓度调整至5×106个/mL。
在96 孔板中加入5×106个/mL的脾细胞悬液,100 μL/孔。再分别加入蚕蛹蛋白样品溶液100 μL,每个样品设3 个剂量(25、50、100 μg/mL),每个剂量设3 个重复。对照组加入100 μL RPMI-1640培养液,于37 ℃、5% CO2培养箱中培养48 h后,每孔加入20 μL 5 mg/mL的MTT溶液,继续培养4 h。取出后1 000 r/min离心5 min,吸去上清液,每孔加入100 μL二甲基亚砜,轻轻振荡使紫色结晶溶解,置暗处室温反应15 min后用酶标仪于570 nm波长处测OD值[20]。
1.4 数据统计分析
实验中样品处理重复3 次,实验数据采用Excel和SPSS18.0软件进行分析,结果以 ±s表示,用Tukey test法进行数据分析,以P<0.05表示差异显著,以P<0.01表示差异极显著。
2 结果与分析
2.1 微细化-蛋白酶解对蚕蛹蛋白营养价值的影响
2.1.1 氨基酸组成分析
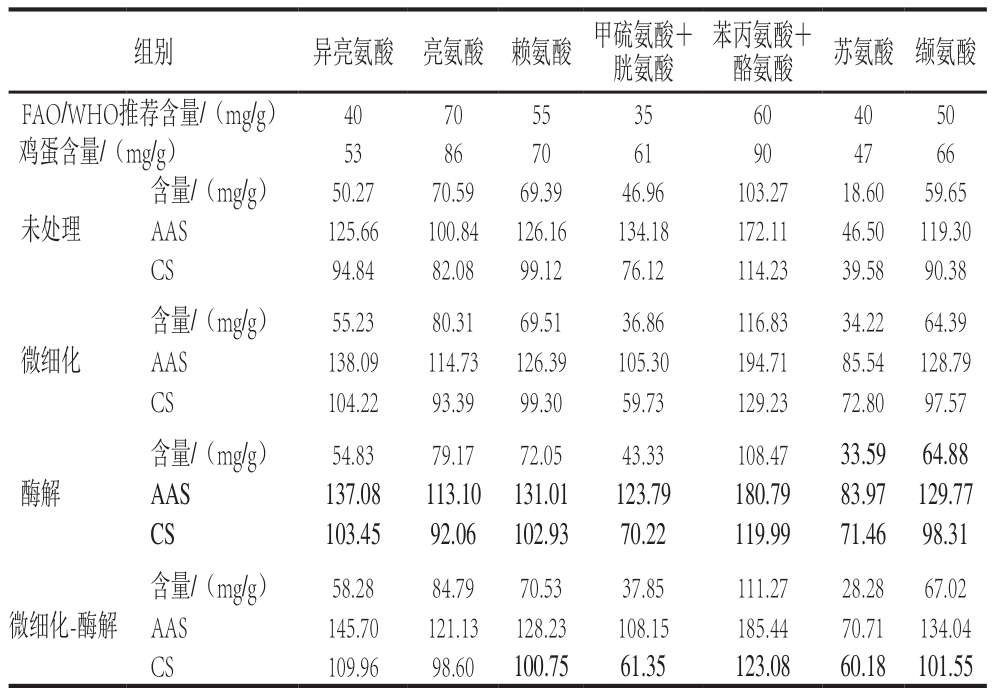
表1 不同处理蚕蛹蛋白的氨基酸组成比较
Table 1 Comparison of amino acid composition of silkworm pupa protein after different treatments

由于色氨酸在酸水解条件下被破坏,共检测出17 种氨基酸。未处理的对照组蚕蛹蛋白必需氨基酸与非必需氨基酸含量的比值为54.66%,低于理想蛋白模式标准(60%);经微细化、蛋白酶解和微细化-酶解处理后,其必需氨基酸与非必需氨基酸含量的比值分别为64.21%、65.09%和66.79%,均高于理想蛋白模式标准。处理前蚕蛹蛋白的必需氨基酸/总氨基酸的值为35.34%,略低于FAO/WHO模式36%的标准;不同处理后蚕蛹蛋白的必需氨基酸/总氨基酸的值分别为39.10%、39.43%和40.05%,均高于FAO/WHO推荐模式标准。陈佳婕等[21]报道酶解处理显著提高了蚕蛹蛋白必需氨基酸含量,其中双酶解处理后其必需氨基酸/总氨基酸的值达到45%。
2.1.2 氨基酸营养评价
不同处理后蚕蛹蛋白的AAS值除苏氨酸外均高于100,对照组苏氨酸的AAS值为46.5,微细化、蛋白酶解和微细化-酶解处理后苏氨酸的AAS值分别为85.54、83.97和70.71。苏氨酸是一种重要的营养强化剂,具有缓解人体疲劳、促进生长发育的效果。其他氨基酸的AAS值与未处理组相比也得到了不同程度的提高,说明改性处理后的蚕蛹蛋白的营养价值得到提升,高于FAO/WHO推荐模式标准以及鸡蛋的营养价值。
经3 种方法改性处理后的蚕蛹蛋白EAAI值分别为94.67、96.13和93.86,均高于对照组的92.34,略低于经双酶解改性处理的蚕蛹蛋白多肽产物[21]。
表2 不同处理蚕蛹蛋白的氨基酸营养评价
Table 2 Nutritional assessment of silkworm pupa protein after different treatments
2.2 微细化-蛋白酶解改性处理对蚕蛹蛋白物理特性的影响
2.2.1 对蚕蛹蛋白水解度的影响
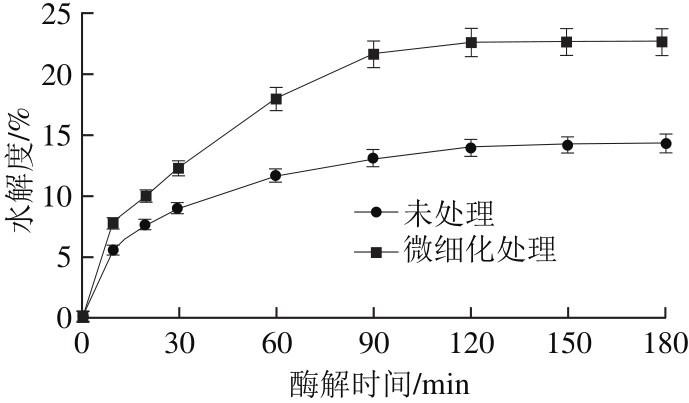
图1 微细化-蛋白酶解后蚕蛹蛋白水解度变化
Fig. 1 Changes in the hydrolysis degree of silkworm pupa protein treated by micronization-alcalase
图1显示蚕蛹蛋白在微细化预处理后,经Alcalase碱性蛋白酶酶解不同时间(30、60、90、120、150、180 min)水解度的变化。酶解前期,蚕蛹蛋白的水解度随酶解时间的延长显著增加,经Alcalase碱性蛋白酶酶解90 min,细微化处理水解度较未处理提高了65.62%;再延长酶解时间对水解度几乎没有影响。酶解时间与蛋白水解度的关系与赵鹏等[22]报道的结果一致。金建等[23]的研究表明,经超声波预处理后碱性蛋白酶酶解可显著提高玉米蛋白的水解度。这可能是因为机械预处理后蚕蛹蛋白的溶解性提高,使底物与酶更好地接触,反应速率增加;另一方面,处理后蛋白分子质量变小,可能暴露出更多的酶的结合位点,促进了反应的进行。
2.2.2 对溶解度、起泡性和乳化性的影响
表3 不同处理对蚕蛹蛋白物理特性的影响
Table 3 Effect of different treatments on physical properties of silkworm pupa protein
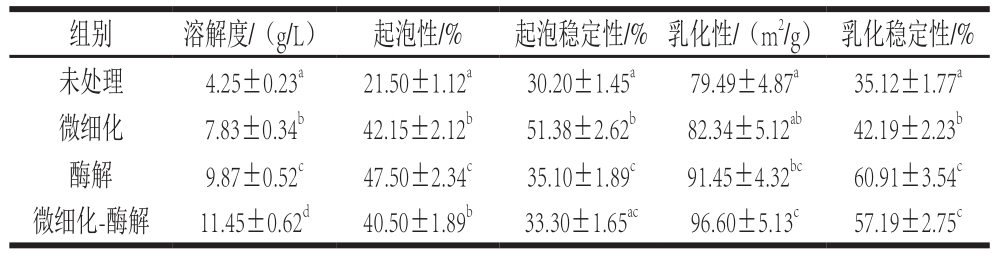
注:同列肩标小写字母不同表示差异显著(P<0.05)。
表3结果显示,经过3 种改性方法可显著提高蚕蛹蛋白的溶解度、起泡性和乳化性,其中微细化-酶解改性处理可分别提高了169.41%、97.82%和21.52%。微细化-酶解复合处理后蚕蛹蛋白的起泡稳定性和乳化稳定性比单一处理略低,这可能是由于复合处理后,蛋白质分子变得更小,而溶解性的提高不利于形成泡沫和乳化状态。任子旭等[24]用超声波改性处理蚕蛹蛋白得到最优工艺,在此条件下,改性蚕蛹蛋白的溶解度、乳化性和起泡性分别是处理前的4.02、1.87 倍和1.41 倍。金青哲等[25]研究表明经酶解改性处理后蚕蛹蛋白质的功能性质特别是溶解性大为改善;钟振声等[26]利用物理方法处理大豆分离蛋白,能够很好地改善其起泡性和乳化性。说明这些蛋白质的基本性质可通过物理、化学、酶解等手段获得改善。
2.3 微细化-蛋白酶解改性处理对蚕蛹蛋白分子结构的影响
2.3.1 对蚕蛹蛋白分子质量的影响
以葡聚糖凝胶柱分离蚕蛹蛋白,测定280 nm波长处吸光度,获得图2分子质量分布曲线。由结果可以看出不同处理的蛋白均有2 个洗脱峰,分别在15 min和54 min。在15 min时,未处理、微细化、酶解及微细化-酶解处理蛋白的洗脱峰依次降低,而在54 min时的洗脱峰依次升高,说明经微细化、酶解及微细化-酶解处理后,大分子质量的蛋白减少,小分子质量的蛋白增多。未处理的对照蛋白在18~42 min间有多个小峰,在54 min处有2 个并肩峰,说明其分子质量不均一,分子质量小的物质较少且不均匀。改性处理后蛋白在54 min的洗脱峰逐渐变窄,说明蛋白的分子质量更加集中。

图2 不同处理蚕蛹蛋白的分子质量分布
Fig. 2 Molecular weight distribution of silkworm pupa protein after different treatments
2.3.2 对蚕蛹蛋白巯基和二硫键含量的影响
二硫键与稳定蛋白质的空间结构和性能的关系非常密切,尤其是会影响到蛋白质表面活性的表现[27]。不同处理蚕蛹蛋白的巯基与二硫键的含量见图3。结果显示,处理后蚕蛹蛋白的巯基含量明显升高,二硫键含量降低,经微细化-酶解改性处理后蚕蛹蛋白巯基含量增加了57%,二硫键含量降低了21%。韩苗等[28]利用超声波处理蚕蛹蛋白发现二硫键含量降低,巯基含量增加,本研究的结果与之相似,这可能是由于在处理时导致二硫键断裂,暴露出更多的巯基。
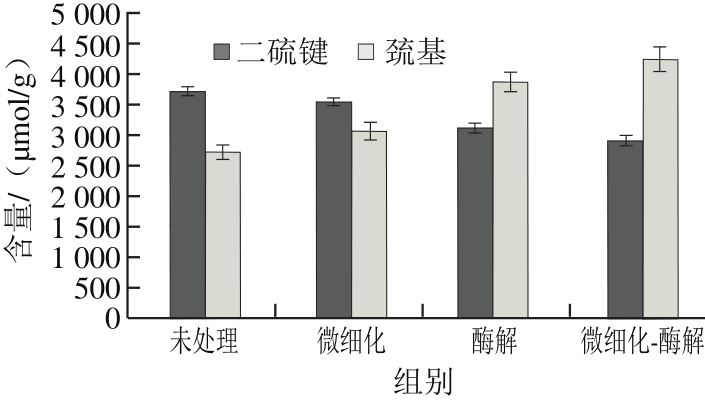
图3 不同改性处理后蚕蛹蛋白的二硫键与巯基含量变化
Fig. 3 Changes in the contents of sulfhydryl group and disulfide bond in silkworm pupa protein after different treatments
2.3.3 对蚕蛹蛋白二级结构的影响
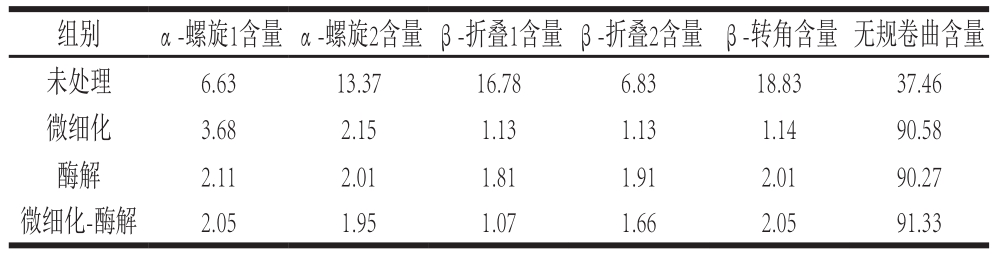
蛋白质的CD光谱一般分为2 个波长范围,即远紫外区(178~250 nm)和近紫外区(250~320 nm)。蛋白质的α-螺旋、β-折叠、β-转角和无规卷曲等二级结构可通过远紫外区CD光谱数据反映出来,一般天然蛋白质的CD光谱含有一个正峰(190 nm波长处)和一个负槽(205~235 nm波长范围)[29]。利用软件分析得到不同改性处理后蚕蛹蛋白中α-螺旋、β-折叠、β-转角和无规卷曲的含量(表4)。未处理蚕蛹蛋白的α-螺旋、β-折叠、β-转角和无规卷曲的含量分别为20.00%、23.61%、18.83%和37.46%,结果与贾俊强等[30]的研究极为接近,即蚕蛹水溶性蛋白的α-螺旋、β-折叠和β-转角以及无规卷曲的含量分别为20.9%、24.1%、19.2%和36.4%。微细化-酶解改性处理后蚕蛹蛋白的无规卷曲含量超过90%,说明其二级结构发生极大的变化,α-螺旋、β-折叠和β-转角等结构几乎被完全破坏,可能暴露出更多的功能位点或活性位点。
表4 不同改性处理蚕蛹蛋白二级结构的比较
Table 4 Comparison of the secondary structure of silkworm pupa protein after different treatments%
2.4 微细化-蛋白酶解改性处理后的蚕蛹蛋白对小鼠脾细胞增殖的影响
为了解改性蛋白的免疫调节能力,本实验研究了微细化-蛋白酶解改性处理后蚕蛹蛋白对小鼠脾细胞增殖的影响(表5)。不同改性蚕蛹蛋白均具有促进小鼠脾细胞增殖的能力,随着剂量的增加其增殖能力升高;同等剂量条件下,促进小鼠脾细胞增殖能力由高到低依次是微细化-蛋白酶解、酶解、微细化和未处理。经微细化-蛋白酶解改性处理,25 μg/mL的蚕蛹蛋白促进小鼠脾细胞增殖能力较对照组提高了100%,在50 μg/mL时提高79.56%,在100 μg/mL时提高52.61%。昌友权等[31]报道蚕蛹蛋白能够明显促进B淋巴细胞和T淋巴细胞的增殖,蚕蛹蛋白具有较强的提高免疫活性的能力,经微细化-蛋白酶解改性处理后其提高免疫活性能力可进一步增强。
表5 不同改性蚕蛹蛋白对小鼠脾细胞增殖能力的影响
Table 5 Effect of silkworm pupa protein subjected to different treatments on the proliferation of mouse splenocytes
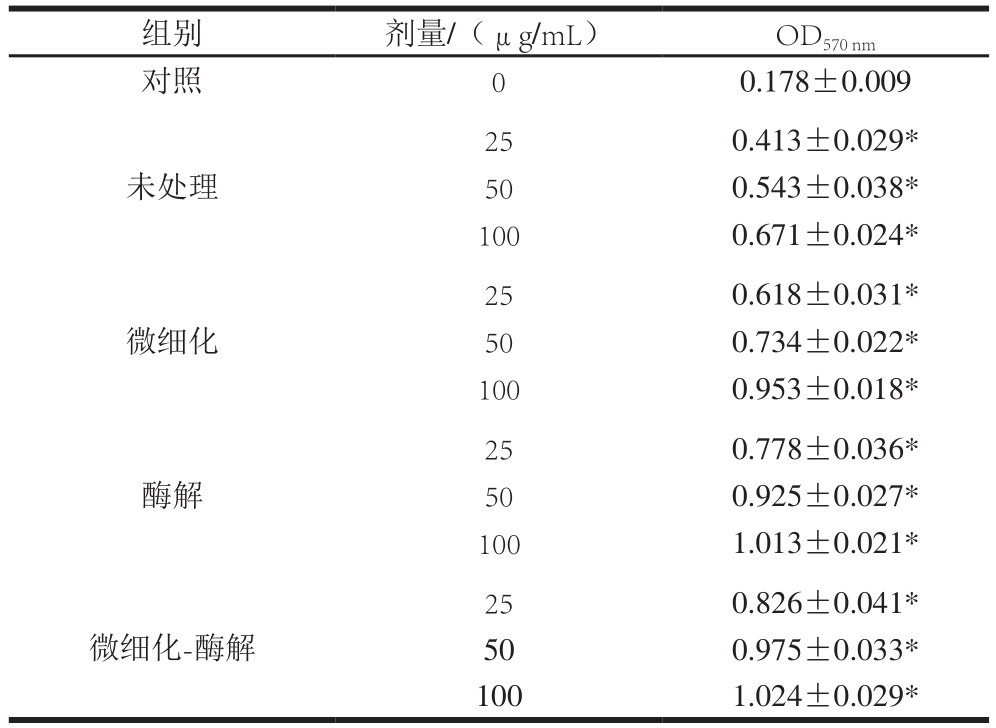
注:⋆.与对照组相比差异极显著(P<0.01)。
3 结 论
与未处理的蚕蛹蛋白相比,微细化-酶解改性处理后蚕蛹蛋白的水解度提高了65.62%,溶解度、乳化性和起泡性分别提高了402%、187%和141%,巯基含量增加了57%,而二硫键含量降低了21%,且分子大小和二级结构组成发生了较明显的变化,小分子物质增多,无规卷曲含量由37.46%增加到91.33%。微细化-酶解改性处理后蚕蛹蛋白必需氨基酸与非必需氨基酸含量的比值达到了理想蛋白模式标准(60%),必需氨基酸/总氨基酸的值也达到了FAO/WHO推荐模式标准(36%),蛋白营养价值得到显著提高。微细化-酶解改性处理后的蚕蛹蛋白在剂量为25 μg/mL时,促小鼠脾细胞增殖能力增加了100%,免疫调节能力显著提高。
参考文献:
[1] 林江娇, 朱立学, 韦鸿钰. 银杏干叶球磨法超微粉碎的试验研究[J].仲恺农业工程学院学报, 2011, 24(4): 62-64. DOI:10.3969/j.issn.1674-5663.2011.04.018.
[2] 周志峰, 任子旭, 贾俊强, 等. 磨球超微粉碎改性蚕蛹蛋白的工艺优化及功能特性[J]. 江苏大学学报(自然科学版), 2015, 36(6): 679-684.DOI:10.3969/j.issn.1671-7775.2015.06.011.
[3] 李壮哲, 卢伟文, 黄志洪, 等. 药用三七球磨法超微粉碎的试验研究[J]. 仲恺农业工程学院学报, 2014, 27(3): 18-22. DOI:10.3969/j.issn.1674-5663.2014.03.005.
[4] 沈莎莎, 田建珍, 郑学玲, 等. 球磨微细化处理对硬质小麦淀粉理化特性影响研究[J]. 粮食与油脂, 2014, 27(4): 19-22. DOI:10.3969/j.issn.1008-9578.2014.04.005.
[5] 王丹丹. 豆渣超高压、超微粉碎及超声波辅助化学处理的研究[D].郑州: 河南农业大学, 2013: 15-18.
[6] 乔一腾, 司玉慧, 盖国胜, 等. 超微粉碎对大豆分离蛋白功能性质的影响[J]. 中国食品学报, 2012, 12(9): 57-61.
[7] 程云龙, 管军军, 李世豪, 等. 酶法改性大豆分离蛋白最新研究进展[J]. 粮食与饲料工业, 2015(3): 20-23; 27. DOI:10.7633/j.issn.1003-6202.2015.03.006.
[8] 黄群, 杨万根, 金永国, 等. 酶法改善卵白蛋白起泡性[J]. 食品科学,2014, 35(23): 171-175. DOI:10.7506/spkx1002-6630-201423034.
[9] 张兆丽. 酶法改性花生分离蛋白的研究[J]. 潍坊工程职业学院学报,2015, 28(2): 84-86. DOI:10.3969/j.issn.1009-2080.2015.02.022.
[10] 张海娜. 蚕蛹活性多肽的制备及降血压、降血糖活性研究[D]. 重庆: 西南大学, 2013: 1-2.
[11] 贾俊强, 桂仲争, 吴琼英, 等. 同时蒸馏萃取与气相色谱-质谱联用分析蚕蛹挥发性成分[J]. 蚕业科学, 2011, 37(6): 1111-1116.DOI:10.3969/j.issn.0257-4799.2011.06.025.
[12] 李朝品, 湛孝东, 施自伦. 蚕蛹蛋白提取研究[J]. 农产品加工(学刊),2011(2): 26-27; 35. DOI:10.3969/jissn.1671-9646(X).2011.02.007.
[13] WU Q Y, JIA J Q, TAN G X, et al. Physicochemical properties of silkworm larvae protein isolate and gastrointestinal hydrolysate bioactivities[J]. African Journal of Biotechnology, 2011, 10(32): 6145-6153. DOI:10.12737/13127.
[14] 吴琼英, 徐金玲, 贾俊强, 等. 蚕蛹不同溶解性蛋白的营养学评价及酶解物对血管紧张素转换酶的抑制活性[J]. 蚕业科学, 2011, 37(2):352-357. DOI:10.3969/j.issn.0257-4799.2011.02.028.
[15] LI Z J, YIN X M, YE J. Effects of pH management during deep hypothermic bypass on cerebral oxygenation: alpha-stat versus pH-stat[J]. Journal of Zhejiang University (Science), 2004, 5(10):1290-1297. DOI:10.1631/jzus.2004.1290.
[16] BEVERIDGE T, TOMA S J, NAKAI S. Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J]. Journal of Food Science, 2006, 39(1): 49-51. DOI:10.1111/j.1365-2621.1974.tb00984.x.
[17] YIN S W, TANG C H, CAO J S, et al. Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp (Cannabis sativa L.) protein isolate[J]. Food Chemistry, 2008, 106(3): 1004-1013.DOI:10.1016/j.foodchem.2007.07.030.
[18] 张根生, 岳晓霞, 李继光, 等. 大豆分离蛋白乳化性影响因素的研究[J]. 食品科学, 2006, 27(7): 48-51. DOI:10.3321/j.issn:1002-6630.2006.07.005.
[19] 刘坚, 江波, 李艳红, 等. 超高压对鹰嘴豆分离蛋白起泡性能的影响[J]. 安徽农业科学, 2007, 35(28): 9012-9013. DOI:10.3969/j.issn.0517-6611.2007.28.114.
[20] 刘洋, 殷璐, 龚桂萍, 等. 黑果枸杞叶多糖LRLP3的结构、抗氧化活性及免疫活性[J]. 高等学校化学学报, 2016, 37(2): 261-268.DOI:10.7503/ cjcu20150690. doi:10.7503/cjcu20150690.
[21] 陈佳婕, 吴文惠, 倪玲, 等. 蚕蛹蛋白的氨基酸构成分析及模拟胃/肠道消化性研究[J]. 食品工业科技, 2014, 35(1): 333-338.
[22] 赵鹏, 董秀萍, 叶楠, 等. 酶解蚕蛹蛋白工艺的研究及产物分析[J].大连轻工业学院学报, 2005, 24(2): 123-127. DOI:10.3969/j.issn.1674-1404.2005.02.012.
[23] 金建, 马海乐, 曲文娟, 等. 超声预处理对玉米蛋白可酶解性的影响[J]. 中国粮油学报, 2015, 30(11): 58-64. DOI:10.3969/j.issn.1003-0174.2015.11.011.
[24] 任子旭, 周志峰, 方银, 等. 用超声波改善蚕蛹蛋白性能的工艺条件优化及产品性能测试[J]. 蚕业科学, 2015, 41(3): 548-554.
[25] 金青哲, 刘元法, 王兴国. 蚕蛹蛋白酶法改性研究[J]. 食品科技,2004(2): 35-39. DOI:10.3969/j.issn.1005-9989.2004.02.012.
[26] 钟振声, 文锡莲, 陈然, 等. 物理改性对大豆分离蛋白功能性质的影响[J]. 中国油脂, 2008, 33(5): 21-24. DOI:10.3321/j.issn:1003-7969.2008.05.007.
[27] 李丽娜, 李军生, 阎柳娟, 等. 分光光度法测定食品蛋白质中二硫键的含量[J]. 食品科学, 2008, 29(8): 562-564. DOI:10.3321/j.issn:1002-6630.2008.08.135.
[28] 韩苗, 颜纵横, 贾俊强, 等. 超声波处理对蚕蛹蛋白理化性质及酶解产物抗氧化活性的影响[J]. 蚕业科学, 2016, 42(4): 711-716.DOI:10.13441/j.cnki.cykx.2016.04.021.
[29] 沈琼, 黄滨, 邵嘉亮, 等. 运用圆二色谱研究酶与化合物相互作用的机理[J]. 中山大学学报(自然科学版), 2006, 45(4): 62-64.DOI:10.3321/j.issn:0529-6579.2006.04.015.
[30] 贾俊强, 徐金玲, 谭广秀, 等. 蚕蛹水溶性蛋白营养学评价及理化性质分析[J]. 食品研究与开发, 2011, 32(8): 121-125. DOI:10.3969/j.issn.1005-6521.2011.08.038.
[31] 昌友权, 戚颖欣, 孙学伟, 等. 蚕蛹蛋白对小鼠免疫作用的研究[J]. 食品科学, 2007, 28(9): 520-523. DOI:10.3321/j.issn:1002-6630.2007.09.127.