新疆阿克苏灰枣(Zizyphus jujube cv. Huizao)是阿克苏地区的主栽品种,引种于河南新郑,因得天独厚的光热资源,成为新疆红枣产业发展的主导品种。阿克苏灰枣富含多种微量元素和多糖、黄酮、三萜类、多酚类、环核苷酸、生物碱、胡萝卜素、VC等功能成分[1],多糖、黄酮、酚酸、萜类化合物和环核苷酸是枣果中主要功能性成分。多糖是枣果发挥护肝和免疫刺激作用的物质基础;VC、酚酸和黄酮类化合物是枣果中主要的抗氧化物质;三萜类化合物是枣果中主要的抗癌活性成分[2]。大枣具有免疫[3]、抗氧化、抗衰老、抗癌、抗炎、护肝、护肠、抗焦虑、防止肥胖、抑菌等特性[2,4]。
多糖是大枣中重要的生物活性物质,是机体免疫系统良好的调节剂,主要表现为免疫增强或免疫刺激,它不仅能激活巨噬细胞、T细胞、自然杀伤细胞等免疫细胞,还能提高巨噬细胞的吞噬能力[5-6];以熊果酸和齐墩果酸为代表的五环三萜类化合物是枣果实的主要活性成分[7],具有提高免疫力、杀伤癌细胞和抗肿瘤等多种功能[8-9];枣多酚提取物具有明显的提高机体自身免疫能力和抗逆境功效[10]。目前我国枣果实功能成分及其保健食品的研究与开发尚处于起步阶段,免疫作用是红枣的重要保健作用之一,不同枣品种的免疫功能成分需深入研究阐明,枣果实中的多糖、多酚和三萜类化合物都具有免疫调节活性,但其交互作用需进一步深入研究明确。
通过小鼠免疫脏器指数、碳粒廓清实验、血清溶血素形成实验和绵羊红细胞诱导的迟发型超敏反应实验,研究新疆阿克苏灰枣多糖、多酚和三萜类化合物3 种活性成分及其两两组合对小鼠免疫功能的影响,以期阐明新疆阿克苏灰枣的免疫活性因子及其相互间的作用,为新疆灰枣免疫功能特性研究与功能产品开发提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
雄性小鼠,体质量(20±2)g,购于山东泰邦生物制品有限公司,生产许可证号SCXK(鲁)2013 0006。
新疆阿克苏灰枣由中华全国供销总社济南果品研究院提供。
印度墨汁 北京Solarbio公司;绵羊红细胞悬液、补体(豚鼠血清) 郑州百基生物科技有限公司;生理盐水 山东华信制药集团股份有限公司;乙醇、氯仿、正丁醇均为分析纯。
都氏试剂:碳酸氢钠1.0 g、氰化钾0.05 g、高铁氰化钾0.2 g,加蒸馏水至1 000 mL,置4 ℃冰箱保存。
1.2 仪器与设备
HH-2数显恒温水浴锅 常州国华有限公司;EQUINOX55型傅里叶变换红外光谱仪 德国布鲁克公司;KQ-500DB型数控超声波清洗器 昆山市超声仪器有限公司;FA2104A分析天平 上海精天电子仪器有限公司;SHB-Ⅲ循环水式真空泵 郑州长城有限公司;NE-1001旋转蒸发仪 上海爱朗仪器有限公司;T-6新世纪紫外-可见光分光光度计 北京普析通用仪器有限责任公司;BSZ-100自动部分收集器、HL-2恒流泵 上海沪西仪器厂有限公司;Alphal-2冻干机 德国Christ公司;TDL-40B高速台式离心机 上海安亭科学仪器厂;游标卡尺(精确度0.02mm) 无锡凯保鼎工具有限公司。
1.3 方法
1.3.1 样品制备
枣粉的制备:灰枣经清洗、去核,50 ℃烘干后,粉碎并过40 目筛。
灰枣多糖提取:取10 g枣粉,加300 mL蒸馏水,70℃水浴6h,抽滤,滤液加4倍无水乙醇醇沉12h,离心弃上清液,蒸馏水溶解多糖沉淀,Sevag法脱蛋白6次,透析,冻干[11]。取样品经KBr压片,4000~400 cm-1波数范围内经红外光谱扫描[12],光谱图在3 400 cm-1和2 940 cm-1有糖类物质的特征吸收峰[13],经鉴定为多糖且纯度为93.87%,经换算得枣中多糖质量分数为5.61%。
灰枣多酚提取:取10 g枣粉,加250mL 80%乙醇,超声提取25min,抽滤,滤液浓缩,过AB-8大孔吸附树脂,收集洗脱液,浓缩至无醇味,透析,冻干[14]。以茴香醛- 浓硫酸-乙醇体系为显色剂,甲醇-水和氯仿-甲醇-甲酸为展开体系,经薄层层析分析确定样品为多酚[15]。经福林-酚比色法确定多酚纯度为41.32%,经换算得枣中多酚质量分数为0.824%。
灰枣三萜类化合物提取:取10 g枣粉,加250 mL 80%乙醇,超声提取20 min[16],抽滤,滤液浓缩,过S-8大孔吸附树脂,收集洗脱液,浓缩至无醇味,透析,冻干[17]。经Molish反应和Liebermann-Burchard反应为阳性,确定样品为三萜类化合物[18],经香草醛冰醋酸比色法确定纯度为63.17%,经换算得枣中三萜类化合物质量分数为0.865%。
1.3.2 实验动物分组及给药方法
设计空白对照、多糖、多酚、三萜、多糖+多酚、多糖+三萜、多酚+三萜7 个实验组,每组10 只小鼠,以100 mg/kg的剂量每天经口灌胃,空白对照组灌以等量蒸馏水,连续给予受试物7 d后活杀小鼠并测定各项免疫指标[19]。
1.3.3 对小鼠免疫器官的影响
连续给予受试物7 d后称小鼠体质量,颈椎脱臼处死小鼠,取脾脏、胸腺用滤纸吸干血迹后称其湿质量,分别根据式(1)、(2)计算脾脏指数和胸腺指数[6]。

1.3.4 对小鼠碳粒廓清速率的影响
末次给药后1 h,称体质量,各鼠均按0.1 mL/10 g剂量由尾静脉注入印度墨汁(以生理盐水按体积比1∶5稀释),注射后分别在1 min(t1)、10 min(t2)从小鼠眼眶静脉丛取血20 μL溶于2.0 mL 0.1% Na2CO3溶液中摇匀,放置20 min后于680 nm波长处测其吸光度,以0.1% Na2CO3溶液为空白对照,将小鼠处死后取肝脏和脾脏,称质量,分别根据式(3)、(4)计算廓清指数K值和吞噬指数α值[20]。
式中:t1、t2分别为取血时间;A1、A2分别为在时间t1、t2时所取血样对应的吸光度。
1.3.5 对小鼠血清溶血素的影响
给药第3天,每鼠腹腔注射2% SRBC 0.2 mL致敏,并继续给药。致敏后第4天于末次给药后90 min取小鼠眼球血,静置1h,2 000 r/min离心10 min,取上层血清20 μL用生理盐水稀释50倍,取此血清样1 mL加10% SRBC混悬液0.5 mL,置冰浴,再加入以生理盐水1∶10稀释的豚鼠血清1 mL混合,另设不加血清的空白对照,37 ℃温浴30min,反应结束,将反应管立即移入冰浴中,以终止反应,以2 000 r/min离心10 min,取1 mL上清液加3 mL都氏试剂,混匀,放置10 min后于540 nm波长处测其吸光度,另取10% SRBC混悬液0.25 mL加都氏试剂至4 mL,同上测定吸光度,作为半数溶血值(half value of hemolysis,HC50)[20]。
血清溶血素含量以HC50表示,HC50根据式(5)计算。
式中:A1、A2分别为样品的吸光度和SRBC半数溶血时的吸光度。
1.3.6 对小鼠迟发型变态反应的影响
给药第3天,每鼠腹腔注射2% SRBC 0.2 mL致敏,并继续给药。致敏后第4天取20% SRBC 50 µL悬液注射在小鼠右侧足垫皮下,24 h后用游标卡尺测定小鼠右足垫厚度,同一部位测量3 次,取平均值[20]。
1.3.7 多糖、多酚和三萜类化合物两两组合免疫交互作用的评价方法
当受试物的组合产生的效果显著大于其单独使用效果之和时,判定该组合产生了协同作用;当受试物的组合产生的效果与其单独使用效果之和差异不显著时,判定该组合产生了加和作用;当受试物的组合产生的效果显著小于其单独使用效果之和时,判定该组合产生了拮抗作用[21]。
1.4 数据处理方法
实验所得数据利用SPSS Stastistics 20软件进行分析处理。各组间的比较采用单因素方差分析(One-way ANOVA),P<0.05时认为差异具有统计学意义。
2 结果与分析
2.1 灰枣活性成分及组合对小鼠免疫器官指数的影响
小鼠每天经口灌胃给予100 mg/kg剂量的受试物,连续给药7 d后,称质量,取脾脏、胸腺并称其湿质量,计算免疫器官指数。由图1可知,灰枣3 种不同成分及其两两组合的灌胃处理,均可增加实验小鼠的免疫器官质量,提高小鼠的脾脏指数和胸腺指数,其影响排序为:多糖+多酚>多糖+三萜>多酚+三萜>多糖>多酚>三萜。经SPSS统计分析表明,单一成分组即多糖组、多酚组和三萜组的脾脏指数分别为3.48、3.25、3.18 mg/g,胸腺指数分别为2.15、2.06、1.95 mg/g,与空白对照组的脾脏指数与胸腺指数(2.88、1.76 mg/g)差异显著(P<0.05);多糖+多酚组的脾脏指数与胸腺指数为7.06、4.52 mg/g,较空白对照组差异达到高度显著水平(P<0.001),多糖+三萜组和多酚+三萜组的脾脏指数与胸腺指数分别为6.62、6.44 mg/g和4.07、4.06 mg/g,与空白对照之间也达到极显著差异(P<0.01)。说明多糖和多糖+多酚组合更可促使小鼠的胸腺和脾脏质量增加,促进其产生免疫细胞[22-23]。
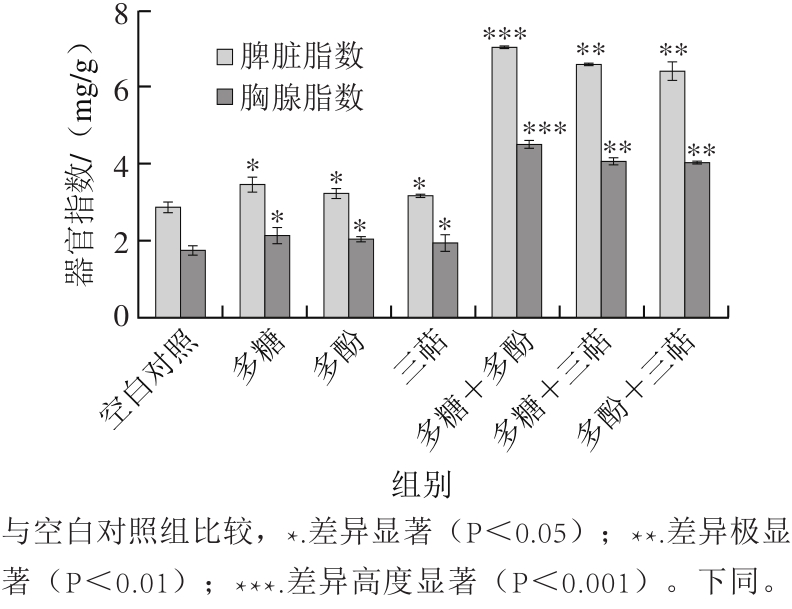
图1 灰枣3 种活性成分及组合对小鼠免疫器官的影响
Fig. 1 Effect of three bioactive components of Huizao jujubes on mouse immune organs
2.2 灰枣3 种活性成分及组合对小鼠碳粒廓清速率的影响
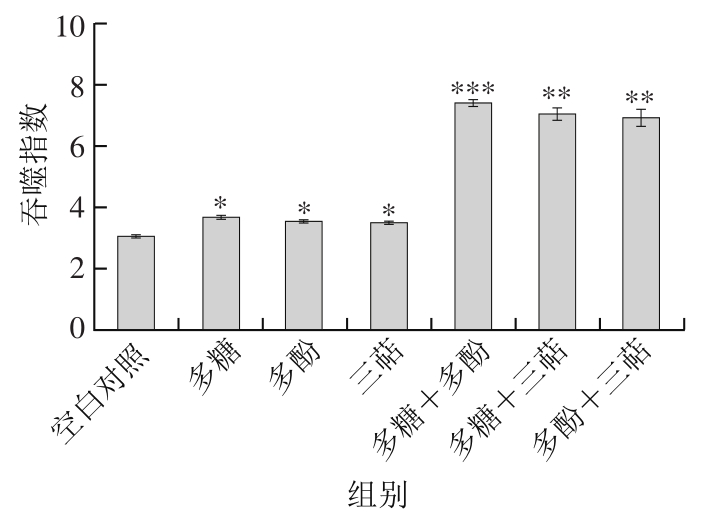
图2 灰枣3 种活性成分及组合对小鼠碳粒廓清速率的影响
Fig. 2 Effect of three bioactive components of Huizao jujubes on phagocytic index
由图2可知,灰枣3 种不同成分及其两两组合的灌胃处理均可提高小鼠巨噬细胞的吞噬指数α。经SPSS统计分析表明,多糖组、多酚组和三萜组的吞噬指数α分别为3.67、3.53和3.48,与空白对照组的吞噬指数α(3.04)差异显著(P<0.05);多糖+多酚组的吞噬指数α为7.40,较空白对照组差异达到高度显著水平(P<0.001);多糖+三萜组和多酚+三萜组的吞噬指数α分别为7.02和6.91,较空白对照组差异达到极显著水平(P<0.01)。由此表明灰枣多糖、多酚和三萜类化合物及其组合均具有提高小鼠单核巨噬细胞吞噬能力、增强非特异性免疫的作用。说明灰枣多糖、多酚及其组合更能显著增强小鼠单核巨噬细胞的吞噬能力,加速碳粒的清除[24]。
2.3 灰枣3 种活性成分及组合对小鼠血清溶血素的影响
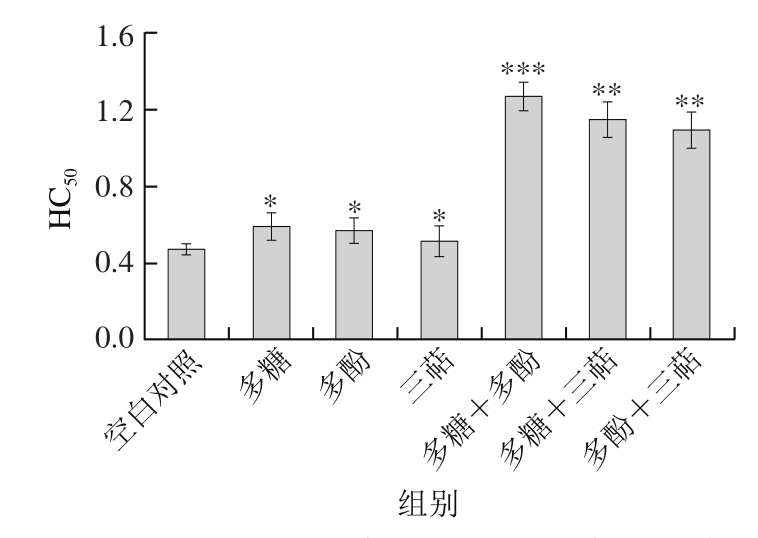
图3 灰枣3 种活性成分及其组合对小鼠血清溶血素的影响
Fig. 3 Effect of three bioactive components of Huizao jujubes on HC50
由图3可知,灰枣3 种不同成分及其两两组合的灌胃处理,均可提高小鼠的HC50,也就是可以增加小鼠的血清溶血素含量。经SPSS统计分析表明,单一成分组即多糖组、多酚组和三萜组的HC50分别为0.59、0.56和0.52,较空白对照组的HC50均差异显著(P<0.05);多糖+多酚组的HC50为1.27,与空白对照组差异达到高度显著水平(P<0.001),多糖+三萜组和多酚+三萜组的HC50分别为1.15和1.10,与空白对照组之间也达到极显著差异(P<0.01)。由此表明灰枣多糖、多酚和三萜类化合物及其组合均具有提高小鼠血清溶血素含量、增强小鼠体液免疫的作用。说明多糖和多糖与多酚组合更可促进小鼠溶血素抗体的形成[25]。
2.4 灰枣3 种活性成分及其组合对小鼠迟发型变态反应的影响
迟发型变态反应又称“迟发型超敏反应”,属细胞免疫,是由T淋巴细胞介导的一种超敏反应。由图4可知,灰枣3 种不同成分及其两两组合的灌胃处理,均可增加小鼠的足跖厚度。经SPSS统计分析表明,单一成分组即多糖组、多酚组和三萜组小鼠足跖厚度分别为1.96、1.90mm和1.86mm,与空白对照组的小鼠足跖厚度差异显著(P<0.05);多糖+多酚组的足跖厚度为3.99mm,较空白对照组差异达到高度显著水平(P<0.001),多糖+三萜组和多酚+三萜组的足跖厚度分别为3.77mm和3.75mm,与空白对照组之间也达到极显著差异(P<0.01)。由此表明灰枣多糖、多酚和三萜类化合物及其组合均具有增强由 T细胞介导的迟发型超敏反应的作用。说明多糖和多糖与多酚组合更可对小鼠因SRBC 引起的迟发型过敏反应有促进作用。
以上实验说明多糖、多酚和三萜是灰枣具有免疫作用的主要活性成分。Li Jinwei等[6]的研究表明金丝小枣多糖组分可增强脾淋巴细胞增殖转化和腹腔巨噬细胞吞噬能力和抗补体活性,具有增强小鼠免疫功能的作用。郝婕等[10]的研究表明枣多酚能提高机体自身免疫能力。Qiao Aimin等[9]的研究表明酸枣三萜类化合物中组分有较高的抑制肝癌细胞增殖的能力。从作用机制上来说,多糖通过与淋巴细胞表面特异受体结合,影响淋巴细胞的信息传递过程,进而影响淋巴细胞基因表达和淋巴细胞功能;多酚可促进淋巴细胞的转化和增殖,影响细胞因子的分泌,从而影响机体细胞因子的含量;三萜类化合物能有效地抑制补体激活的经典途径[26]。枣的水提物能抑制IL-1β和IL-6的表达,但不抑制脂多糖中的TNF-α刺激巨噬细胞。IL-1β和IL-6在mRNA和蛋白水平受枣水提物的抑制。枣的双向免疫调节作用是通过调节促炎细胞因子在巨噬细胞中的表达实现的[27]。
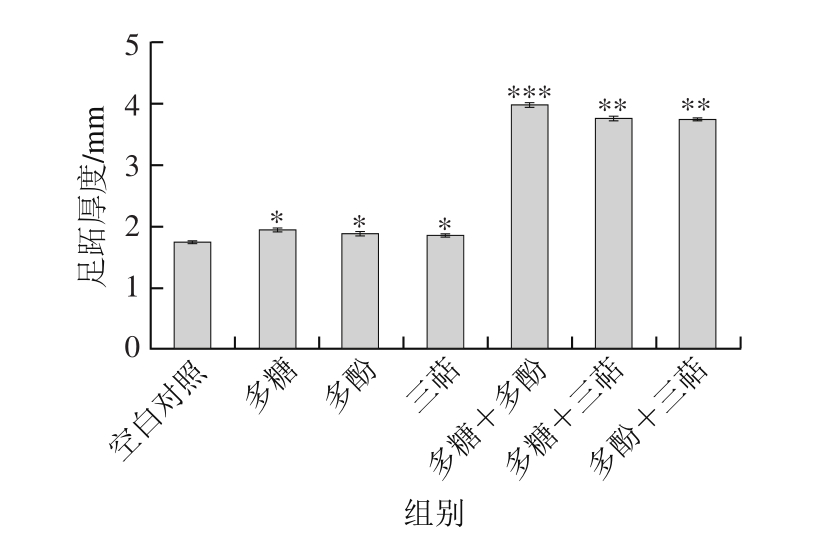
图4 灰枣3 种活性成分及其组合对小鼠迟发型变态反应的影响
Fig. 4 Effect of three bioactive components of Huizao jujubes on DTH
2.5 多糖、多酚和三萜类化合物两两组合的免疫交互作用分析
表1 多糖、多酚和三萜类化合物两两组合的免疫交互作用
Table 1 Combined effects of three bioactive components on immune parameters

注:*.与实际值相比差异显著(P<0.05)。
对三个组合的交互免疫作用的分析结果如表1所示,在小鼠体内免疫实验中,多糖与多酚合用后,其各个免疫指标(脾脏指数、胸腺指数、HC50、吞噬指数α、足跖厚度)均显著高于单独使用的加和,说明该组合在小鼠免疫实验中产生了协同作用;多糖与三萜类化合物的组合则与之相反,其合用后的吞噬指数α(7.02)和足跖厚度(3.77mm)显著小于理论上两种物质单独使用之和(7.16和3.83mm),说明该组合在小鼠免疫实验中产生了拮抗作用;多酚与三萜类化合物组合的各个免疫指标的理论值和实际值未呈现显著性差异,表明该组合在小鼠免疫实验中呈现出加和作用。从作用机制上来说,多糖和多酚其作用的途径不同,可以同时起作用,可互相增强对方的免疫作用,从而提高组合的整体免疫活性;多糖与三萜类化合物作用机制相似,两者存在竞争,且三萜类化合物也具有一定的负面影响,如一定的毒性,易与铁、锌、钙形成难溶的复合盐[28],从而降低了其组合的整体免疫活性,有关灰枣多糖、多酚和三萜类化合物的免疫交互作用机制有待深入研究阐明。
3 结 论
阿克苏灰枣多糖、多酚和三萜类化合物3 种活性成分及其组合免疫实验表明,灰枣多糖、多酚和三萜类化合物均可显著提高小鼠体内免疫实验的免疫指标,即免疫器官指数、HC50、吞噬指数α以及小鼠足跖厚度,具有增强小鼠细胞免疫、体液免疫以及非特异性免疫的作用,灰枣多糖增强免疫活性作用最强,脾脏指数和胸腺指数分别为3.48 mg/g和2.15 mg/g,吞噬指数α为3.67,HC50值为0.59,足趾厚度为1.96 mm。3 个成分组合中,灰枣多糖与多酚组合增强免疫活性作用最强,脾脏指数和胸腺指数分别为7.06 mg/g和4.52 mg/g,HC50为1.27,吞噬指数α为7.40,足趾厚度为3.99 mm,均显著高于单独使用的加和,灰枣多糖与多酚组合能产生协同免疫作用;多糖与三萜类化合物组合的吞噬指数α(7.02)和足跖厚度(3.77 mm)显著小于理论上两种物质单独使用之和(7.16和3.83 mm),该组合能产生拮抗作用;多酚与三萜类化合物组合的各个免疫指标的理论值和实际值未呈现显著性差异,该组合呈现出加和免疫作用。
参考文献:
[1] CHEN C F, LEE J F, WANG D, et al. Water extract of Zizyphus jujube attenuates ischemia/reperfusion-induced liver injury in rats (PP106)[J]. Transplantation Proceedings, 2010, 42(3): 741-743. DOI:10.1016/j.transproceed.2010.03.020.
[2] 丁胜华, 王蓉蓉, 吴继红, 等. 枣果实中生物活性成分与生物活性的研究进展[J]. 现代食品科技, 2016, 32(5): 332-347. DOI:10.13982/j.mfst.1673-9078.2016.5.049.
[3] 王晓琴, 王力伟, 赵岩, 等. 广枣的化学成分和药理活性研究进展[J]. 食品科学, 2014, 35(13): 281-285. DOI:10.7506/spkx1002-6630-201413056.
[4] SHEN Xiangchun, TANG Yuping, YANG Ruihui, et al. The protective effect of Zizyphus jujube fruit on carbon tetrachlorideinducedhepatic injury in mice by anti-oxidative activities[J]. Journal of Ethnopharmacology, 2009, 122(3): 555-560. DOI:10.1016/j.jep.2009.01.027.
[5] ZHANG Li, LIU Xinquan, WANG Yongjie, et al. In vitro antioxidative and immunological activities of polysaccharides from Zizyphus jujuba cv.Muzao[J]. International Journal of Biological Macromolecules, 2017, 95:1119-1125. DOI:110.101-6/j.ijbiomac.2016.10.102.
[6] LI Jinwei, SHAN Liang, LIU Yuanfa, et al. Screening of a functional polysaccharide from Zizyphus Jujuba cv. Jinsixiaozao and its property[J].International Journal of Biological Macromolecules, 2011, 49(3): 255-259. DOI:10.1016/j.ijbiomac.2011.04.006.
[7] GUO S, TANG Y P, DUAN J A, et al. Two new terpenoids from fruits of Ziziphus jujuba[J]. Chinese Chemical Letters, 2009, 20(2): 197-200.DOI:10.1016/j.cclet.2008.10.041.
[8] PLASTINA P, BONOFIGLIO D, VIZZA D, et al. Identification of bioactive constituents of Ziziphus jujube fruit extracts exerting antiproliferative and apoptotic effects in human breast cancer cells[J].Journal of Ethnopharmacology, 2012, 140: 325-332. DOI:10.1016/j.jep.2012.01.022.
[9] QIAO Aimin, WANG Yihai, XIANG Limin, et al. Triterpenoids of sour jujube show pronounced inhibitory effect on human tumor cells and antioxidant activity[J]. Fitoterapia, 2014, 98: 137-142. DOI:10.1016/j.fitote.2014.07.020.
[10] 郝婕, 王艳辉, 董金皋. 金丝小枣多酚提取物的生理功效研究[J].中国食品学报, 2008, 8(5): 22-27. DOI:10.16429/j.1009-7848.2008.05.023.
[11] WANG Dongying, ZHAO Yan, JIAO Yadong, et al. Antioxidative and hepatoprotective effects of the polysaccharides from Zizyphus jujube cv. Shaanbeitanzao[J]. Carbohydrate Polymers, 88(4): 1453-1459.DOI:10.1016/j.carbpol.2012.02.046.
[12] 青宁, 吕兴连, 彭韵硕, 等. 沙枣多糖EAP-2的提取纯化及初步分析[J].食品科学, 2007, 28(1): 43-46.
[13] 张耀雷, 黄立新, 张彩虹. 壶瓶枣多糖的纯化及结构初步分析[J].食品科学, 2016, 37(3): 138-149. DOI:10.7506/spkx1002-6630-201603007.
[14] 王雅, 樊明涛, 赵萍, 等. 大孔树脂对沙枣多酚的动态吸附解析性能研究[J]. 西北农林科技大学学报, 2010, 38(12): 215-220.DOI:10.13207/j.cnki.jnwafu.2010.12.028.
[15] 张赟彬, 谈毅婷. 甘薯渣中多酚类化合物的分离与结构鉴定[J]. 食品研究与开发, 2007, 28(12): 120-122.
[16] 张娜, 陈锦屏, 严静. 和田玉枣总皂甙超声提取工艺[J]. 食品科学,2011, 32(2): 108-110.
[17] 樊君, 高续春, 郭璞, 等. 大孔吸附树脂分离纯化枣渣中三萜酸的研究[J]. 离子交换与吸附, 2008, 24(5): 426-433. DOI:10.16026/j.cnki.iea.2008.05.010.
[18] 陆娟, 杨瑞杰, 桂明玉. 狗枣猕猴桃叶中一个新三萜皂苷[J]. 中国药学杂志, 2009, 44(16): 1215-1217.
[19] ZHAO Zhihui, LI Jun, WU Xiangmei, et al. Structures and immunological activities of two pectic polysaccharides from the fruits of Ziziphus jujube Mill. cv. jinsixiaozao Hort[J]. Food Research International, 2006, 39(8): 917-923. DOI:10.1016/j.foodres.2006.05.006.
[20] RAJ S, GOTHANDAM K M. Immunomodulatory activity of methanolic extract of Amorphophallus commutatus var. wayanadensis under normal and cyclophosphamide induced immunosuppressive conditions in mice models[J]. Food and Chemical Toxicology, 2015, 81: 151-159.DOI:10.1016/j.fct.2015.04.026.
[21] FREEMAN B L, EGGETT D L, PARKER T L. Synergistic and antagonistic interactions of phenolic compounds found in navel oranges[J]. Journal of Food Science, 2010, 75(6): C570-C576.DOI:10.1111/j.1750-3841.2010.01717.x.
[22] GAO Qinghan, WU Senchun, WANG Min. The jujube (Ziziphus jujuba Mill.) fruit: a review of current knowledge of fruit composition and health benefits[J]. Agricultural and Food Chemistry, 2013, 61(14): 3351-3363.DOI:10.1021/jf4007032.
[23] ZHANG Jing, CHEN Jin, WANG Deyun, et al. Immune-enhancing activity comparison of sulfated ophiopogonpolysaccharide and sulfated jujube polysaccharide[J]. International Journal of Biological Macromolecules, 2013, 52: 212-217. DOI:10.1016/j.ijbiomac.2012.09.025.
[24] 叶文斌, 樊亮, 王昱, 等. 拐枣多糖对环磷酰胺诱导免疫低下小鼠免疫功能的影响[J]. 现代食品科技, 2016, 32(7): 26-32. DOI:10.13982/j.mfst.1673-9078.2016.7.005.
[25] 袁红波, 赵文赵, 仁邦, 等. 金丝小枣糖浆对小鼠免疫功能的影响[J].中国食品学报, 2008, 8(1): 13-16.
[26] MIN B S, GAO J J, HATTORI M, et al. Anticomplement activity of terpenoids from the spores of Ganoderma lucidum[J]. North American Journal of Medical Sciences, 2001, 67: 811-814. DOI:10.1055/s-2001-18854.
[27] CHEN Jianping, DU C Y Q, LAM K Y C, et al. The Standardized extract of Ziziphus jujuba fruit (jujube) regulat-es pro-inflammatory cytokine expression in cultured murine macrophages: suppression of lipopolysaccharide-stimulated NF-κB activity[J]. Phytotherapy Research, 2014, 28: 1527-1532. DOI:10.1002/ptr.5160.
[28] MILGATE J, ROBERTS D C K. The nutritional and biological significance of saponins[J]. Nutrition Research, 1995, 15: 1223-1248.DOI:10.1016/0271-5317(95)00081-S.