随着生活节奏的加快和压力的增大,我国心血管疾病和肝病的发病率明显上升[1]。据资料显示,在全球约10亿 人患有高血压症状,其中25 岁以上人群占40%左右[2],而我国高血压患者数量目前已超过2.7亿[3],占世界患者总数量1/4以上。对肝病而言,非酒精性脂肪性肝病在全世界的发病率高达17%~33%[4];而全球每年因患酒精肝死亡的人数约250万,在北美洲有1%的人群患有酒精肝,在我国过度饮酒成为引起肝脏损害的第二大病因[5]。
研究发现,高血压与肝病之间存在密切关系,根据郑盛等[6]研究结果,原发性高血压伴非酒精性脂肪性肝病患者体质量指数、超重率、血清总胆固醇、甘油三酯(triglyceride,TG)、谷丙转氨酶(alanine aminotransferase,ALT)等指标水平均显著高于原发性高血压不伴非酒精性脂肪性肝病的患者。另外,赵文革等[7]研究发现,非酒精性脂肪性肝病患者中高血压的患病率较高。赵宇等[8]通过对非原发性高血压患者(41 例)和非酒精性脂肪性肝病伴原发性高血压患者(62 例)相关指标检测,发现后者在体质量指数、腰臀比值、空腹血糖、胰岛素浓度、三酰甘油、高敏C反应蛋白、胰岛素抵抗指数、丙氨酸氨基转移酶、天冬氨酸氨基转移酶和γ-谷氨酰转肽酶等指标水平均高于前者,且存在显著差异,进而得出结论,老年非酒精性脂肪性肝病是原发性高血压的危险因素。
多年来,高血压和肝病的治疗多以药物治疗为主,但长期服用会产生一些副作用[9]。因此,开发具有辅助降血压和护肝功能的食品,对高血压和肝病的预防和辅助治疗工作尤为重要。
研究发现,紫薯花青素具有护肝[10-14]、抗高血压[15-16]、抗高血糖[17-20]、抗氧化[21-24]、抗动脉粥样硬化[22,25]、降血脂减肥[26]等功能。而通过酪蛋白水解产生的ACE抑制肽,具有抗高血压和改善心脏功能[27-29]。
在功能食品开发方面,到目前为止,鲜见一种产品同时具有降高血压和护肝功能。本研究以富含花青素的紫薯提取物(purple sweet potato extract,PSPE)和富含血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽的酪蛋白水解物为主要功能原料,在普通酸奶发酵工艺的基础上,生产具有辅助降压和护肝功能的酸奶,利用实验动物模型评价其降血压和护肝功能,旨在通过功能食品的途径辅助预防高血压症状和保护肝脏。
1 材料与方法
1.1 动物、材料与试剂
雄性原发性高血压大鼠(spontaneously hypertensive rats,SHR)(SPF级)购自中国人民解放军军事医学科学院实验动物中心;正常雄性Wistar大鼠(SPF级)购自北京维通利华实验动物技术有限公司。
富含花青素的PSPE(PSPE-A)(花青素质量分数9.25%)、富含ACE抑制肽的酪蛋白水解物(CH-A)(有效ACE抑制肽质量分数大于10%) 天津商业大学生物技术与食品科学学院食品工艺实验室;MRS固体培养基、MRS液体培养基 北京陆桥技术有限公司;直投式发酵剂、全脂鲜牛乳 天津海河乳业有限公司;联苯双酯滴丸 浙江万邦药业股份有限公司;谷草转氨酶(aspartate aminotransferase,AST)、ALT、TG、还原型谷胱甘肽(reduced glutathione,GSH)、丙二醛(malondialdehyde,MDA)、总蛋白定量测定试剂盒南京建成生物工程研究所;无水乙醇、10%福尔马林、二甲苯 天津昊斯生物技术有限公司;多赖处理防脱片、伊红染液、Harris苏木素染液 北京中杉金桥公司;切片石蜡 上海懿洋仪器有限公司;组织包埋盒江苏世泰实验器材有限公司。
1.2 仪器与设备
TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司;FA1104N电子天平 上海精密科学仪器有限公司;HZQ-F160A高低温恒温振荡培养箱 上海一恒科技有限公司;FA40均质机 上海弗鲁克流体机械制造有限公司;PB-10型pH计 德国赛多利斯股份公司;LS-50HJ高压灭菌锅 江阴滨江医疗设备有限公司;BJ-1CD超净工作台 上海博迅实业有限公司;BP-2006A型智能无创血压计 北京软隆科技有限责任公司;SpectraMax 190型酶标分析仪 深圳市山特科技有限公司;M165C体视显微镜 德国徕卡公司;YD-335电脑切片机、YD-A生物组织摊片机、YD-B生物组织烤片机 金华市益迪医疗设备厂;GOLD-SIM冷冻干燥机 金西盟北京仪器有限公司;Supcre G6R全自动菌落计数仪 杭州迅数科技有限公司。
1.3 方法
1.3.1 添加PSPE-A和CH-A酸奶的制备
1.3.1.1 酸奶的制备流程
全脂牛乳→加入蔗糖及其他原料→加入CH-A和PSPE-A→搅拌均匀→均质→巴氏杀菌→冷却→接种→保温发酵(43 ℃)→冷藏后酵→成品
1.3.1.2 功能性成分添加量的确定
根据本实验室前期研究[30],选用CH-A与PSPE-A联合添加,有效降血压剂量为每千克SHR体质量:10.0 mg CH-A+5.0 mg PSPE-A、10.0 mg CH-A+10.0 mg PSPE-A,添加上述功能性成分并发酵制备酸奶,按照每人(体质量60 kg)喝200 g酸奶计算,制备的两种酸奶中,1 kg酸奶中功能成分的添加量分别为:3.0 g CH-A+1.5 g PSPE-A、3.0 g CH-A+3.0 g PSPE-A。PSPE-A的制备参照文献[30],CH-A的制备参照文献[31]。
1.3.1.3 CH-A和PSPE-A添加量对乳酸菌生长的影响
制作乳酸菌标准曲线:无菌条件下,称取0.01 g直投式乳酸菌菌种,用无菌生理盐水20 mL溶解,振荡5 min,使菌体充分分散。无菌条件下吸取一定量乳酸菌悬液,添加至灭菌的MRS液体培养基中,37 ℃厌氧培养24 h。将活化后的菌液按体积分数10%添加量于灭菌的MRS液体培养基中,37 ℃厌氧培养24 h。无菌条件下取二次活化后菌液,将菌液浓度调整为108CFU/mL左右,然后用无菌水分别稀释1.5、2.0、2.5、3.0、4.0、5.0 倍,振荡摇匀并迅速测定600 nm波长处OD值;同时将稀释液分别进行平板计数培养。计算菌落数,绘制乳酸菌标准曲线。
添加CH-A和PSPE-A对乳酸菌生长的影响:取4 支三角瓶,分别添加100 mL的MRS液体培养基,灭菌(121 ℃、20 min)后迅速加入PSPE-A和CH-A,每升添加量分别为:0.0 g CH-A+0.0 g PSPE-A、3.0 g CH-A+1.5 g PSPE-A、3.0 g CH-A+3.0 g PSPE-A。充分振荡混匀,冷却至室温,吸取10 mL上述培养基至灭菌的试管中(作为空白)。向剩余培养基中添加10 mL经活化的菌液,37 ℃恒温培养,分别于0、2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32 h测定菌液的OD值,测定波长为600 nm。
1.3.1.4 添加CH-A和PSPE-A对酸奶发酵的影响
在普通酸奶的配方(牛乳887 g、白砂糖85 g、其他物料28 g)中,按照1.3.1.2节的剂量添加CH-A和PSPE-A,并按照1.3.1.1节的工艺制备酸奶,发酵温度43 ℃,发酵时间5.5 h,然后,在6 ℃环境下存放12 h。检测相关指标。
酸奶活菌数测定:分别称取5 g酸奶放入三角瓶中,加入45 mL无菌生理盐水稀释,振荡摇匀,制成1∶10(m/V)的稀释样液,再取1 mL稀释液加9 mL无菌生理盐水稀释,作10 倍递增稀释,制成1∶100的稀释液,以此类推。选择105~107稀释倍数进行厌氧平板培养,每个稀释度作2 个平板。置于37 ℃恒温培养箱中,培养24 h,用全自动菌落计数仪测定菌落数。
酸奶酸度的测定:参照文献[32]方法,结合pH计用0.1 mol/L的NaOH溶液滴定100 mL酸奶至pH值为8.3(酚酞的变色点),所消耗NaOH溶液的体积即为酸奶的酸度。
凝固型酸奶黏度测定:NDJ-5S型黏度计测量黏度。
凝固型酸奶质构分析:选用A/BE探头,压力盘直径35 mm。设定参数为:下降速率与测试速率为1.0 mm/s,提升速率为1.0 mm/s,测试深度300 mm,感应力为Auto-5 g,记录速率200 PPS。每个样品重复测定2 次。
1.3.2 含有CH-A和PSPE-A酸奶降血压效果评价
1.3.2.1 单次灌胃含有CH-A和PEPE-A的酸奶
雄性SHR 32 只,周龄为12 周,体质量为(255±15)g。自由采食饮水,在(23±1)℃和相对湿度为(60±5)%的条件下预饲养1 周。然后随机分为4 组,每组8 只。以3.33 g/kg剂量分别灌胃生理盐水、普通酸奶(0 g CH-A+0 g PSPE-A)、1 kg酸奶中含有3.0 g CH-A+1.5 g PSPE-A的酸奶及含有3.0 g CH-A+3.0 g PSPE-A的酸奶。每天灌胃1 次,测定灌胃后1~8 h的尾动脉收缩压(systolic blood pressure,SBP),观察灌胃后SHR每小时的SBP的变化。另取正常Wistar大鼠20 只,分为4 组,分别作为空白组(生理盐水组)和3 个样品组,灌胃剂量为3.33 g/kg。
1.3.2.2 每天两次灌胃添加CH-A和PSPE-A的酸奶
12 周龄雄性SHR 16 只,体质量为(260±15)g,自由采食饮水,在(23±1)℃和相对湿度为(60±5)%的条件下预饲养1 周。SHR随机分为2 组,每组8 只,分别灌胃在1 kg酸奶中含有3.0 g CH-A+1.5 g PSPE-A的酸奶及3.0 g CH-A+3.0 g PSPE-A的酸奶,灌胃剂量3.33 g/kg,每隔4 h灌胃1 次,每天2 次,测定灌胃后2、4、6、8 h时SHR的SBP。
1.3.2.3 动物血压测定
采用BP-2006A型智能无创血压计,测定SHR的SBP[33]。测定前,将SHR固定于鼠网保温套中39 ℃恒温预热,使尾动脉扩张,血流畅通。每只SHR的SBP连续测3 次,对测得的SBP进行读数,取有效数据记录[34]。
1.3.3 添加CH-A和PSPE-A酸奶对肝脏指标影响
1.3.3.1 实验动物分组
12 周龄雄性SHR 80 只,体质量为(256±12)g,分笼饲养,自由采食饮水,保持环境温度(23±1)℃,相对湿度(60±5)%,预饲养一周,按体质量随机分为10 组,每组8 只。分别为正常对照组(生理盐水,灌胃剂量3.33 g/kg)、酒精性肝损伤模型组、普通酸奶组(灌胃剂量3.33 g/kg)、联苯双酯阳性对照组(灌胃剂量150.0 mg/kg)、不同剂量PSPE-A组(灌胃剂量5.0 mg/kg和10.0 mg/kg)、CH-A组(灌胃剂量10.0 mg/kg和20.0 mg/kg)、1 kg酸奶中含有3.0 g CH-A+1.5 g PSPE-A组及含有3.0 g CH-A+3.0 g PSPE-A组(灌胃剂量3.33 g/kg)。
各种样品按照设计的剂量,每日灌胃一次,连续灌胃30 d。最后一天灌胃各样品1 h后,按照《保健食品检验与评价技术规范(2003)》,对酒精性肝损伤模型组和样品组SHR给予体积分数50%乙醇溶液12 mL/kg灌胃,正常对照组给予同体积生理盐水灌胃,禁食(自由饮水)。
1.3.3.2 血清和肝组织相关指标测定
将各样品组灌胃体积分数50%乙醇溶液后,禁食,16 h后各个剂量组SHR摘眼球取血,3 000 r/min离心10 min,取上清液,分装入EP管,检测血清中AST、ALT和TG等指标。
迅速脱臼处死SHR后,取肝脏右叶的小块肝组织,以冷的生理盐水制成质量分数10%肝组织匀浆液,检测肝组织中的MDA和GSH含量。
检测方法分别按照AST、ALT、TG、GSH、MDA试剂盒说明书的步骤。
1.3.3.3 肝脏病理组织学检测
剪下肝脏左叶相同部位浸于体积分数4%的甲醛溶液中,做肝脏组织病理研究。重点观察脂滴在肝脏的分布及干细胞的损伤情况。
肝脏病理组织切片与染色:固定→洗涤脱水→透明→浸蜡包埋→切片、展片、贴片→脱蜡→复水→染色→脱水→复染→脱水→透明封胶[35]。
1.4 数据处理与分析
用SPSS 17.0软件对结果进行分析,结果采用 ±s表示。应用配对t检验分析各组之间差异的显著性,P<0.05表明有显著性差异。
2 结果与分析
2.1 添加CH-A和PSPE-A对乳酸菌生长的影响2.1.1 乳酸菌菌落数与OD600nm的关系曲线
根据方法1.3.1.3节制作乳酸菌菌落数与OD600nm的关系曲线,拟合菌落对数(y)和OD600nm(x)关系曲线为y=1.684 8x+7.135 7,R2=0.939 45。
2.1.2 添加CH-A和PSPE-A对乳酸菌生长的影响
将不同剂量的CH-A和PSPE-A添加到乳酸菌培养基中,培养乳酸菌,结果见图1。当单独添加CH-A时,其对乳酸菌的生长有促进作用;当添加PSPE-A后,对乳酸菌的生长有一定的抑制作用[36-38],且随着PSPE-A添加量的增加,抑制作用增强。因此,在酸奶发酵过程中添加紫薯花青素要注意添加量对乳酸菌生长的影响。在添加PSPE-A量较大时,可采用发酵后添加,以免影响发酵的效果。
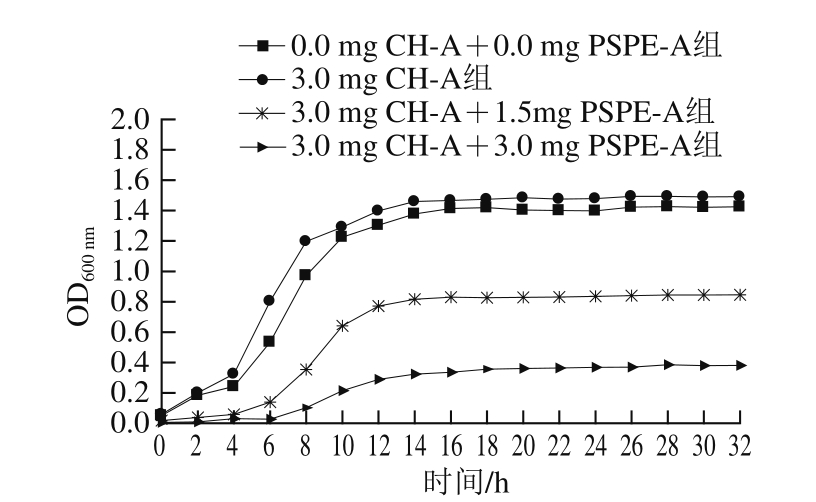
图1 不同剂量CH-A和PSPE-A对乳酸菌生长的影响
Fig. 1 Effect of different dosage of CH-A and PSPE-A on the growth of lactic acid bacteria
2.2 添加CH-A和PSPE-A对酸奶发酵的影响
表1 添加CH-A和PSPE-A对酸奶发酵品质的影响
Table 1 Effect of adding CH-A and PSPE-A on quality of fermented milk
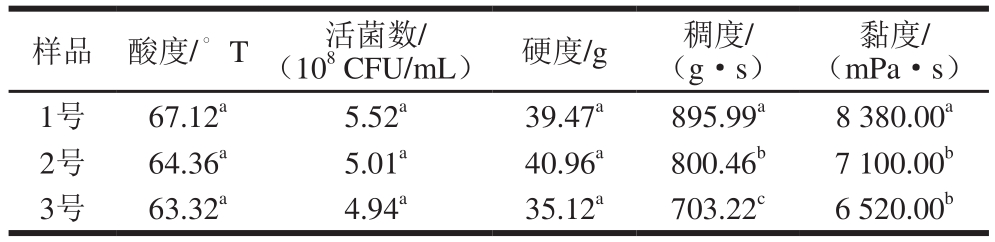
注:同列肩标字母不同表示差异显著(P<0.05)。
将CH-A和PSPE-A按照设计的量与原料乳混合,按照普通酸奶的发酵工艺进行发酵,在43℃下发酵5.5h,检测发酵乳的酸度、活菌数,并对质构进行分析,结果见表1。1号样品为每升添加0.0 g CH-A+0.0 g PSPE-A组,2号样品为每升添加3.0 g CH-A+1.5 g PSPE-A组,3号样品为每升添加3.0 g CH-A+3.0 g PSPE-A组。
与1号样品进行对比,添加CH-A和PSPE-A的酸奶的酸度、活菌数都有所降低,但无显著差异,且随着PSPE-A添加量的增加,逐渐降低,但无显著差异,该结果与图1的结果有较大差异,该差异可能是由乳成分的影响产生的。作为凝固型酸奶,3 种样品的硬度虽然无显著性差异,但2号与3号样品相比,随着PSPE-A的添加量增加,其硬度有所下降,这与PSPE-A对乳酸菌生长的影响有关;2号、3号样品酸奶的稠度和黏度均有显著降低,且随着PSPE-A添加量的增加,其降低程度增加。
综合分析,添加PSPE-A会影响乳酸菌的生长,从而导致酸度、硬度、黏度及稠度等指标的下降,且PSPE-A添加量越多,影响就越大。因此,在添加PSPE-A生产发酵酸奶时,要注意其对发酵效果的影响。
2.3 含有CH-A和PSPE-A酸奶降血压效果
2.3.1 单次灌胃酸奶含有CH-A和PSPE-A对SHR血压的影响
含有不同添加量的CH-A和PSPE-A发酵酸奶,以3.33 g/kg的剂量灌胃SHR,其SBP的变化见图2。各样品组都具有降血压作用,含有CH-A和PSPE-A组与0.0 g CH-A+0.0 g PSPE-A组比较有显著差异(P<0.05)。0.0 g CH-A+0.0 g PSPE-A组在灌胃后3 h达到最低,SBP下降了(9.10±2.88)mm Hg。而含有3.0 g CH-A+1.5 g PSPE-A组、3.0 g CH-A+3.0 g PSPE-A组在灌胃后4 h达到最低,SBP分别下降了(23.13±2.41)、(26.23±1.44)mm Hg。然后SBP缓慢回升。表明添加了CH-A和PSPE-A的发酵酸奶具有显著的辅助降血压作用。

图2 含有CH-A与PSPE-A的酸奶对SHR血压的影响
Fig. 2 Effect of yogurt containing CH-A and PSPE-A on SBP of SHR
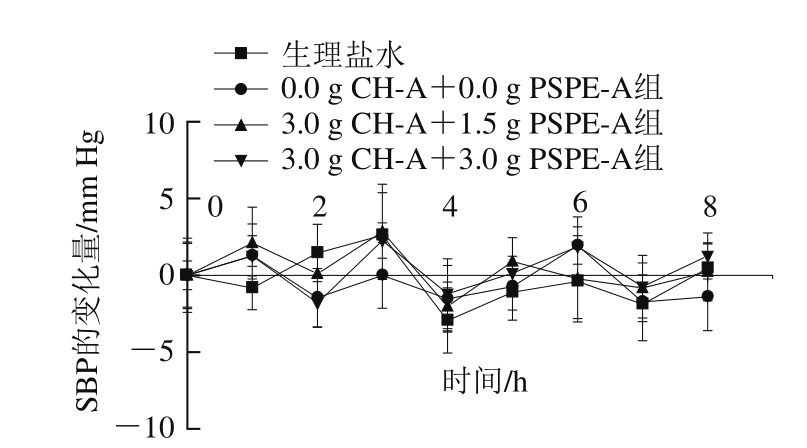
图3 含有CH-A与PSPE-A的酸奶对Wistar大鼠血压的影响
Fig. 3 Effect of yogurt containing CH-A and PSPE-A on SBP of Wistar rats
将含有不同添加量的CH-A和PSPE-A酸奶以相同剂量灌胃Wistar大鼠,其SBP变化见图3。添加CH-A和PSPE-A的酸奶对正常大鼠的SBP无影响。
2.3.2 每天两次灌胃含有CH-A和PSPE-A的酸奶对SHR血压的影响
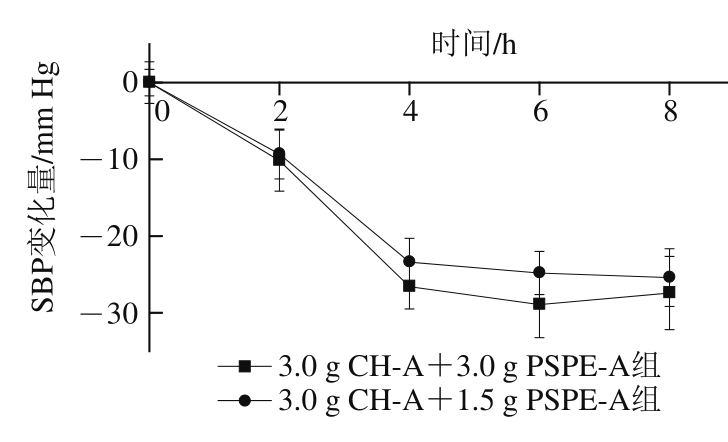
图4 连续灌胃含CH-A与PSPE-A的酸奶对SHR血压的影响
Fig. 4 Effect of continuous administration of yogurt containing CH-A and PSPE-A on SBP of SHR
将添加CH-A和PSPE-A的酸奶,间隔4 h灌胃1 次,每天灌胃2 次,SHR血压变化见图4。在灌胃后2 h,3.0 g CH-A+1.5 g PSPE-A组、3.0 g CH-A+3.0 g PSPE-A组的SHR SBP分别降低了(9.31±3.24)、(10.17±3.97)mm Hg。4 h后其血压分别降低了(23.40±3.12)、(26.58±2.92)mm Hg。然后进行第2次灌胃,灌胃后其血压均维持在较低的水平,6 h后SHR血压分别下降至(24.81±2.81)mm Hg和(28.92±4.30)mm Hg,并且在8 h时,依然保持相对较低的水平。这表明含有CH-A和PSPE-A的酸奶不仅有较好的降血压效果,如果按照一定的时间间隔进行服用,还能够维持血压的相对稳定。
2.4 含有CH-A和PSPE-A酸奶对肝脏指标影响
2.4.1 含有CH-A和PSPE-A酸奶对SHR血清与肝组织相关指标的影响
将不同剂量的CH-A和PSPE-A及添加后所制备的酸奶,按照设计的剂量灌胃SHR。以联苯双酯为阳性对照组,按照《保健食品检验与评价技术规范(2003)》[39],造模并评价对SHR血清和肝组织相关指标的影响,结果见表2、3。酒精性肝损伤模型组SHR血清中的ALT、AST、TG和肝组织中的GSH、MDA等5 个指标水平与正常对照组比较差异极显著(P<0.01),模型建立成功,表明后续实验可以使用这个剂量(体积分数50%乙醇溶液12 mL/kg)建立酒精性肝损伤模型。
普通酸奶组:与正常对照组相比,SHR血清的AST、ALT和TG 3 个指标水平差异极显著(P<0.01),肝组织中GSH和MDA水平存在极显著差异(P<0.01)。与酒精性肝损伤模型组相比,5 个指标均无显著差异(P>0.05)。因此,普通酸奶没有护肝作用。
联苯双酯组:与正常对照组相比,SHR血清的AST和ALT水平无显著差异(P>0.05),TG水平差异极显著(P<0.01);肝组织中的GSH和MDA水平差异极显著(P<0.01)。与酒精性肝损伤模型组相比,AST水平差异极显著(P<0.01),ALT水平差异显著(P<0.05),TG、GSH和MDA水平无显著差异(P>0.05);因此,该药物可通过作用转氨酶起到护肝作用。
PSPE-A组(灌胃剂量5.0 mg/kg):与正常对照组相比,AST、ALT、MDA水平无显著差异(P>0.05);TG和GSH水平差异显著(P<0.05);与酒精性肝损伤模型组相比,AST、ALT水平差异极显著(P<0.01),MDA水平差异显著(P<0.05),TG和GSH水平无显著差异(P>0.05)。与联苯双酯组相比,5 个指标均无显著差异(P>0.05);因此,在该剂量下PSPE-A(花青素含量9.25%)具有护肝作用。
PSPE-A组(灌胃剂量10.0 mg/kg):与正常对照组相比,AST、ALT、MDA水平无显著差异(P>0.05);TG和GSH水平差异显著(P<0.05)。与酒精性肝损伤模型组相比,AST、ALT、MDA水平差异极显著(P<0.01),TG和GSH水平无显著差异(P>0.05)。与联苯双酯组相比,5 个指标均无显著差异(P>0.05);因此,在该剂量下PSPE-A(花青素含量9.25%)具有护肝作用。
CH-A组(灌胃剂量10.0 mg/kg):与正常对照组相比AST、ALT水平无显著差异(P>0.05),TG水平差异显著(P<0.05),GSH和MDA水平差异极显著(P<0.01)。与酒精性肝损伤模型组相比,AST水平差异极显著(P<0.01),ALT水平差异显著(P<0.05),TG、GSH和MDA水平无显著差异(P>0.05)。与联苯双酯组相比,5 个指标水平均无显著差异(P>0.05);因此,CH-A对AST和ALT有降低作用。
表2 含两种功能性成分的酸奶对SHR血清AST、ALT和TG水平的影响
Table 2 Effect of yogurt containing CH-A and PSPE-A on the contents of AST, ALT and TG in serum of SHR

注:同列中,与正常对照组相比,*.差异显著(P<0.05),**.差异极显著(P<0.01);与酒精性肝损伤模型组组相比,#.差异显著(P<0.05);##.差异极显著(P<0.01);与联苯双酯组相比,∆.差异显著(P<0.05),∆∆.差异极显著(P<0.01)。下同。
表3 含CH-A和PSPE-A的酸奶对SHR肝组织GSH、MDA含量的影响
Table 3 Effect of yogurt containing CH-A and PSPE-A on the contents of GSH and MDA in liver tissues of SHR
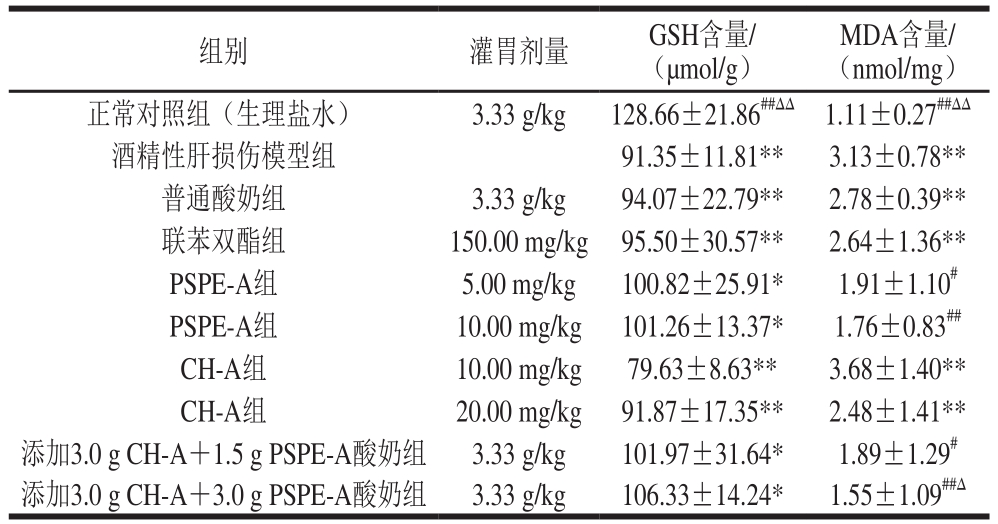
CH-A组(灌胃剂量20.0 mg/kg):与正常对照组相比,AST、ALT和TG水平无显著差异(P>0.05),GSH和MDA水平差异极显著(P<0.01);与酒精性肝损伤模型组相比,AST水平差异极显著(P<0.01),ALT、TG水平差异显著(P<0.05),GSH和MDA水平无显著差异(P>0.05)。与联苯双酯组相比,5 个指标水平均无显著差异(P>0.05);因此,在该剂量下,CH-A具有护肝作用。
添加3.0 g CH-A+1.5 g PSPE-A酸奶组:与正常对照组相比AST、ALT、MDA水平无显著差异(P>0.05),TG、GSH水平差异显著(P<0.05);与酒精性肝损伤模型组相比,AST、ALT水平差异极显著(P<0.01),MDA水平差异显著(P<0.05),TG、GSH水平无显著差异(P>0.05)。与联苯双酯组相比,AST水平差异显著(P<0.05),其他指标水平无显著差异;因此,含有该剂量CH-A和PSPE-A的酸奶具有护肝作用。
添加3.0 g CH-A+3.0 g PSPE-A酸奶组:与正常对照组相比,AST、ALT、TG、MDA水平无显著差异(P>0.05),GSH水平差异显著(P<0.05);与酒精性肝损伤模型组相比,AST、ALT、TG、MDA水平差异极显著(P<0.01),GSH水平无显著差异(P>0.05)。与联苯双酯组相比,除了GSH水平无差异外,其他指标均优于对照组(P<0.05,P<0.01);因此,添加该剂量的CH-A和PSPE-A的酸奶具有护肝作用。
综合表2、3的结果,CH-A(有效ACE抑制肽含量10%)、PSPE-A(花青素含量9.25%)以及添加两种原料所制备的酸奶,在实验剂量范围内具有护肝作用。
2.4.2 肝脏病理组织学检测
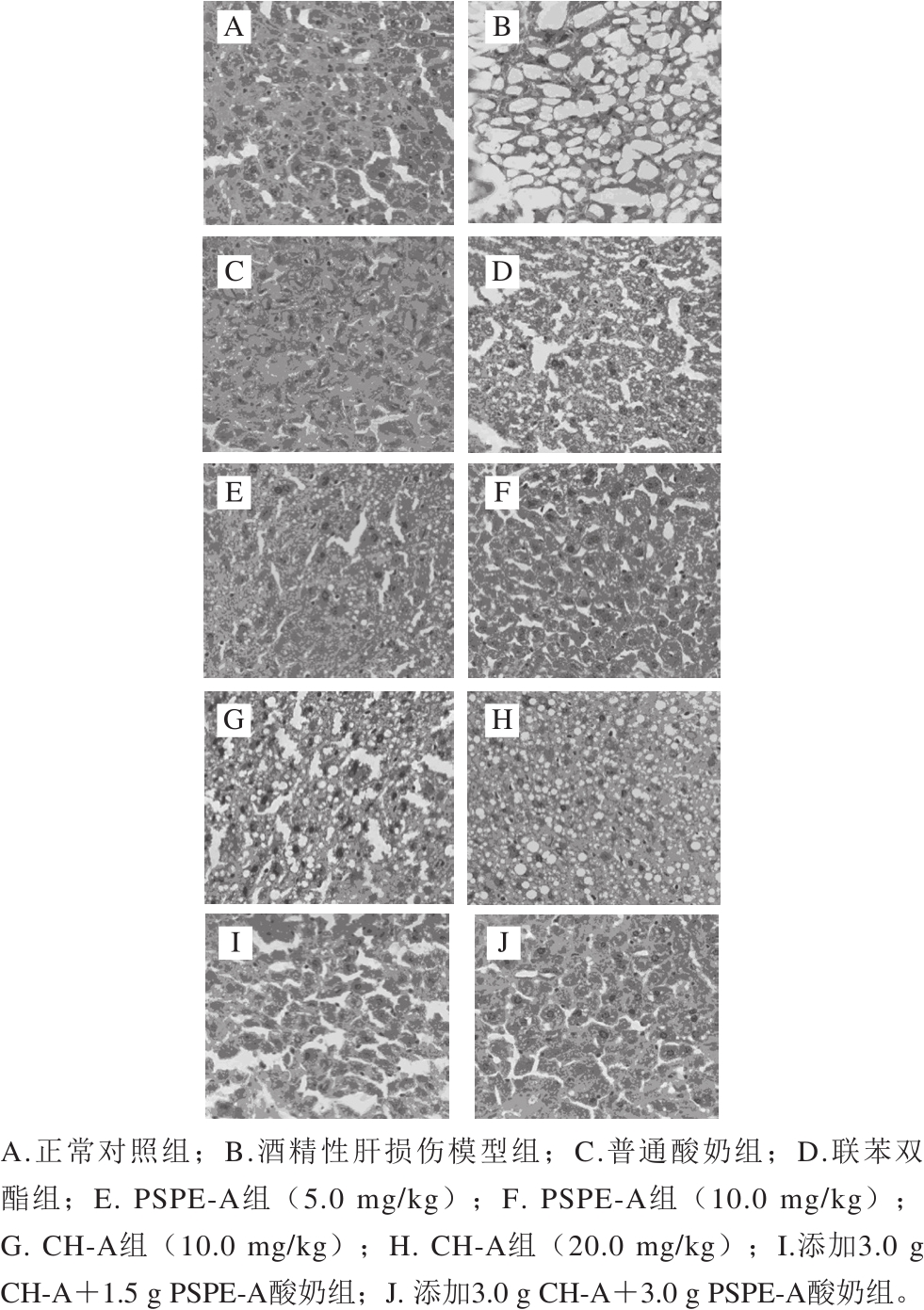
图5 添加CH-A和PSPE-A酸奶对SHR肝脏组织的影响(10×40 倍)
Fig. 5 Effect of yogurt containing CH-A and PSPE-A on liver tissues ofSHR (10 × 40)
由于过量饮酒会造成肝组织的损伤,同时,还会造成脂肪代谢障碍,导致脂肪在肝脏细胞内沉积,造成脂肪肝[39]。通过观察不同样品对SHR肝脏组织的影响(图5),正常对照组的肝细胞结构完整,呈多边形,肝细胞之间的界限明显,具有规则,细胞核位于肝细胞的中央,形态正常,基本没有坏死的细胞,且肝组织细胞内几乎没有脂肪的沉积。酒精性肝损伤模型组中,大部分肝细胞凋亡或坏死,细胞核变形,细胞质流失,基本无正常细胞结构。联苯双酯组细胞虽然保持相对完整,但组织间和细胞内沉积较多脂肪。普通酸奶组中,细胞结构变形,且细胞内沉积较多的脂肪。灌胃剂量为5 mg/kg的PSPE-A组,细胞相对完整,大部分细胞内沉积脂肪。灌胃剂量为10 mg/kg的PSPE-A组,细胞完整,部分细胞内沉积脂肪。灌胃剂量为10 mg/kg和20 mg/kg的CH-A组,部分细胞结构被破坏,且组织间和细胞内沉积脂肪。灌胃添加3.0 g CH-A+1.5 g PSPE-A酸奶组,细胞结构完整,组织间有脂肪沉积,但细胞内沉积脂肪量较少。灌胃添加3.0 g CH-A+3.0 g PSPE-A酸奶组,细胞结构完整,组织间有少量脂肪沉积,有部分细胞内有少量脂肪沉积。因此,通过肝组织病理切片观察可知,添加CH-A和PSPE-A的酸奶,在实验剂量范围内对肝脏有保护作用。
3 结 论
添加CH-A(含有效ACE抑制肽质量分数10%)和PSPE-A(花青素质量分数9.25%)制备发酵酸奶,在实验的剂量范围内有较好的降血压和保护肝脏的作用。当1 kg酸奶中含有3.0 g CH-A+3.0 g PSPE-A时,对SHR的血压有显著降低作用,且对肝组织和血清中AST、ALT、TG、MDA 4 个指标水平均有显著改善作用(P<0.05);1 kg中含有3.0 g CH-A+1.5 g PSPE-A酸奶,对SHR的血压有显著降低作用,且对肝组织和血清中AST、ALT、MDA 3 个指标水平有显著改善作用(P<0.05)。通过肝组织病理切片观察,两种酸奶对肝细胞和脂肪代谢均有改善作用。
参考文献:
[1] 揭红波. 浅谈心血管疾病的发病机理与预防[J]. 中外医疗, 2011,30(12): 184. DOI:10.16662/j.cnki.1674-0742.2011.12.071.
[2] 桑甜, 丁淑贞, 路岩, 等. 原发性高血压患者自我管理及护理干预研究进展[J]. 中国护理管理, 2017, 17(3): 401-405. DOI:10.3969/j.issn.1672-1756.2017.03.027.
[3] 康玉明, 李宏宝, 齐杰, 等. 高血压中枢发病机制的研究进展[J].西安交通大学学报(医学版), 2017, 38(1): 1-6. DOI:10.7652/jdyxb201701001.
[4] 池肇春. 非酒精性脂肪性肝病发病机制研究进展与现状[J]. 世界华人消化杂志, 2017, 25(8): 670-683. DOI:10.11569/wcjd.v25.i8.670.
[5] 刘国涛, 张涛, 王进, 等. 酒精性肝病研究进展[J]. 世界华人消化杂志, 2017, 25(15): 1382-1388. DOI:10.11569/wcjd.v25.i15.1382.
[6] 郑盛, 唐映梅, 杨晋辉. 原发性高血压伴发非酒精性脂肪性肝病的多代谢异常[J]. 临床内科杂志, 2014, 31(8): 550-552. DOI:10.16439/j.cnki.1673-7245.2015.02.040.
[7] 赵文革, 史昌河. 非酒精性脂肪性肝病与高血压的关系[J]. 临床医药文献杂志, 2016, 3(31): 6124-6125. DOI:10.16281/j.cnki.jocml.2016.31.006.
[8] 赵宇, 杨莉莉, 尹璐, 等. 老年非酒精性脂肪性肝病与原发性高血压的关系[J]. 中华高血压杂志, 2011, 19(10): 929-932. DOI:10.16439/j.cnki.1673-7245.2011.10.035.
[9] 张茂云, 牟宗毅. 非药物疗法治疗老年性高血压的研究进展[J]. 中国老年学杂志, 2013, 33(2): 461-464. DOI:10.3969/j.issn.1005-9202.2013.02.113.
[10] ZHANG Z F, LU J, ZHENG Y L, et al. Purple sweet potato color protects mouse liver against D-galactose-induced apoptosis via inhibiting caspase-3 activation and enhancing PI3K/Akt pathway[J].Food and Chemical Toxicology, 2010, 48(8/9): 2500-2507.DOI:10.1016/j.fct.2010.06.023.
[11] HWANG Y P, CHOI J H, CHOI J M, et al. Protective mechanisms of anthocyanins from purple sweet potato against tert-butyl hydroperoxide-induced hepatotoxicity[J]. Food and Chemical Toxicology, 2011, 49(9): 2081-2089. DOI:10.1016/j.fct.2011.05.021.
[12] CHOI J H, HWANG Y P, CHOI C Y, et al. Anti-fibrotic effects of the anthocyanins isolated from the purple-fleshed sweet potato on hepatic fibrosis induced by dimethylnitrosamine administration in mice[J]. Food and Chemical Toxicology, 2010, 48(11): 3137-3143.DOI:10.1016/j.fct.2010.08.009.
[13] SUDA I, ISHIKAWA F, HATAKEYAMA M, et al. Intake of purple sweet potato beverage affects on serum hepatic biomarker levels of healthy adult men with borderline hepatitis[J]. European Journal of Clinical Nutrition, 2008, 62(1): 60-67. DOI:10.1038/sj.ejcn.1602674.
[14] SUN H N, MU T H. Purple sweet potato (Ipomoea batatas L.)anthocyanins: preventive effect on acute and subacute alcoholic liver damage and dealcoholic effect[J]. Agriculture and Food Chemistry,2014, 62(11): 2364-2373. DOI:10.1021/jf405032f.
[15] SHINDO M, KASAI T, ABE A, et al. Effects of dietary administration of plant-derived anthocyanin-rich colors to spontaneously hypertensive rats[J]. Nutrition Science Vitaminol, 2007, 53(1): 90-93. DOI:10.3177/jnsv.53.90.
[16] 胡志和, 张然嬉, 冯永强, 等. 提取紫薯淀粉的副产物对SHR血压的影响[J]. 食品科学, 2010, 31(21): 361-364.
[17] 孟文, 贺炜, 钟英丽, 等. 紫甘薯花青素体外抑制α-糖苷酶活性研究[J].食品科学, 2011, 32(17): 32-36.
[18] MATSUI T, UEDA T, OKI T, et al. α-Glucosidase inhibitory action of natural acylated anthocyanins. 1. survey of natural pigments with potent inhibitory activity[J]. Journal of Agricultural and Food Chemistry, 2001, 49(4): 1948-1951. DOI:10.1021/jf001251u.
[19] MATSUI T, EBUCHI S, KOBAYASHI M, et al. Anti-hyperglycemic effect of diacylated anthocyanin derived from Ipomoea batatas cultivar ayamurasaki can be achieved through the α-glucosidase inhibitory action[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25):7244-7248. DOI:10.1021/jf025913m.
[20] MATSUI T, UEDA T, OKI T, et al. α-Glucosidase inhibitory action of natural acylated anthocyanins. 2. α-glucosidase inhibition by isolated acylated anthocyanins[J]. Journal of Agricultural and Food Chemistry, 2001, 49(4): 1952-1956. DOI:10.1021/jf0012502.
[21] TEOW C C, TRUONG V D, MCFEETERS R F, et al. Antioxidant activities, phenolic and β-carotene contents of sweet potato genotypes with varying flesh colours[J]. Food Chemistry, 2007, 103(3): 829-838.DOI:10.1016/j.foodchem.2006.09.033.
[22] KANO M, TAKAYANAGI T, HARADA K, et al. Antioxidative activity of anthocyanins from purple sweet potato, Ipomoera batatas cultivar Ayamurasaki[J]. Bioscience, Biotechnology and Biochemistry,2005, 69(5): 979-988. DOI:10.1271/bbb.69.979.
[23] HAN K, SEKIKAWA M, SHIMADA K, et al. Anthocyanin rich purple potato flake extract has antioxidant capacity and improves antioxidant potential in mice[J]. British Journal of Nutrition, 2006,96(6): 1125-1133. DOI:10.1017/BJN20061928.
[24] HAN Y T, CHEN X H, XIE J, et al. Purple sweet potato pigments scavenge ROS, reduce p53 and modulate Bcl-2/Bax to inhibit irradiation-induced apoptosis in murine thymocytes[J].Cellular Physiology and Biochemistry, 2011, 28: 865-872.DOI:10.1159/000335801.
[25] 姜云发, 丁涛, 朱忠宁, 等. 葡萄籽原花青素对兔动脉粥样硬化血管病理形态的影响[J]. 河北医药, 2016, 38(3): 338-340. DOI:10.3969/.j.issn.1002-7386.2016.03.004.
[26] JU J H, YOON H S, PARK H J, et al. Anti-obesity and antioxidative effects of purple sweet potato extract in 3T3-L1 adipocytes in vitro[J].Journal of Medicinal Food, 2011, 14(10): 1097-1106. DOI:10.1089/jmf.2010.1450.
[27] 王佳佳, 胡志和, 蒋毅. 富含ACE抑制肽的酪蛋白水解物及其功能性酸乳对SHR血压的影响[J]. 食品工业科技, 2013, 34(10): 345-351;356. DOI:10.13386/j.issn1002-0306.2013.10.075.
[28] 朱明燕, 柳景景, 石雷. 血管紧张素转换酶抑制剂研究进展与临床应用[J]. 中国医药导报, 2011, 8(1): 9-10.
[29] 张叶, 刘景陶, 王强, 等. 血管紧张素转化酶抑制剂研究进展[J]. 科技创新与应用, 2016(35): 84.
[30] 夏磊, 胡志和, 李艳军. 含血管紧张素转化酶抑制肽的酪蛋白水解物与紫薯提取物联用对原发性高血压大鼠血压的影响[J]. 食品科学, 2016, 37(19): 243-248. DOI:10.7506/spkx1002-6630-201619041.
[31] 赵勇, 胡志和, 孙振刚, 等. RP-HPLC法测定酪蛋白水解物中ACE抑制肽的含量[J]. 食品工业科技, 2015, 36(10): 54-58. DOI:10.13386/j.issn1002-0306.2015.10.002.
[32] 李思宁. 紫薯酸乳发酵工艺研究[J]. 食品与发酵科技, 2011, 47(4):101-103.
[33] 张燕, 王红英, 胡艳君, 等. SHR大鼠血压尾套法测定影响因素探讨[J].西北药学杂志, 2008, 23(2): 94-95.
[34] 王茵, 刘淑集, 苏永昌, 等. 紫菜降血压肽大鼠体内降压效果研究[J].中国海洋药物杂志, 2010, 29(3): 17-21. DOI:10.13400/j.cnki.cjmd.2010.03.005.
[35] 王春梅, 李贺, 李生, 等. 北五味子木脂素对小鼠酒精性肝损伤的保护作用[J]. 食品科学, 2014, 35(13): 262-265.
[36] 韩永斌, 朱洪梅, 顾振新, 等. 紫甘薯花色苷色素的抑菌作用研究[J].微生物学通报, 2008, 35(6): 913-917.
[37] 韩永斌, 朱洪梅, 顾振新, 等. 紫甘薯花色苷色素抑制金黄色葡萄球菌作用初探[J]. 食品科学, 2008, 29(10): 59-62.
[38] 张俊, 程卫东, 史学伟, 等. 紫胡萝卜花青素提取工艺及其体外抗菌活性研究[J]. 中国调味品, 2016, 41(11): 140-144; 151. DOI:10.3969/j.issn.1000-9973.2016.11.033.
[39] 卫生部. 保健食品检验与评价技术规范[A]. 2003版. 北京: 中华人民共和国卫生部, 2003: 133-139.