近年来,随着人们对食品品质要求的提升和环保意识的增强,食品包装中广泛使用的塑料膜因其不易分解和有害物迁移、环保性和安全性等问题受到质疑,新型可降解膜成为国内外食品包装研究的热点。不少学者研究了以蛋白质为基料的可食用膜,主要以大豆蛋白膜[1-2]和乳清蛋白膜[3-4]为代表。明胶是胶原的热变性提取物,具有良好的成膜特性。同时,明胶具有良好的生物可降解性、可食用性,是开发可食用膜的良好资源。我国是鱼类生产大国,每年产生大量鱼皮废弃物,既造成环境污染也造成资源浪费。事实上,鱼皮中含有丰富的胶原蛋白(80%左右),可作为制备明胶的重要来源,且鱼皮明胶不受宗教文化限制,是开发可食用膜的优质基料。近年来,我国马哈鱼加工业发展迅速,每年产生大量马哈鱼鱼皮,是开发明胶膜的潜在资源。
明胶膜的性质主要受明胶性质和添加物的影响,前者性质主要取决于其氨基酸组成、分子结构、分子质量分布,其中氨基酸组成与鱼种类有关,分子结构和分子质量分布取决于胶原变性时的处理工艺[5-6]。温度是明胶制备过程的重要因素,不少研究发现提取温度显著影响明胶膜的机械性能和稳定性[7-8]。目前,国内外对鱼皮明胶膜的研究集中在鱿鱼[9]、大眼鲷鱼[10]、鲨鱼[11]和罗非鱼[12]等,而马哈鱼鱼皮明胶膜的研究鲜见报道。另外,大部分研究集中于添加物对膜性质的改善[13-15],而从成膜基料角度考察提取温度对明胶膜性质影响的研究较少。本研究以马哈鱼鱼皮为原料,探究不同温度(40、50、60、70、80、90 ℃)提取鱼皮明胶的成膜特性,同时考察甘油质量浓度(1.1、1.2、1.5 g/100 mL)对其成膜性质的影响,为合理利用马哈鱼鱼皮明胶膜提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
马哈鱼(Oncorhynchus keta)鱼皮由大连东霖食品公司提供。
氢氧化钠(分析纯) 天津市大茂化学试剂厂;磷酸(分析纯) 天津市科密欧化学试剂有限公司;甘油(分析纯) 天津市光复科技发展有限公司。
1.2 仪器与设备
MGC-350HPY-2恒温恒湿培养箱 上海一恒科学仪器有限公司;数字测厚仪 台州市艾测仪器有限公司;TA.XT plus质构仪 英国SMS公司;UltraScan PRO测色仪 美国亨特立公司;Frontier傅里叶变换红外光谱仪美国珀金埃尔默公司;UV-5200型紫外分光光度计上海元析仪器有限公司;JSM-7800F扫描电子显微镜日本JEOL公司。
1.3 方法
1.3.1 鱼皮明胶的提取
马哈鱼鱼皮解冻,剔尽鱼肉及其他组织,剪成0.5 cm×0.5 cm小块,冷藏备用。鱼皮预处理按Kaewruang等[16]方法稍加改动:鱼皮首先以1∶10(m/V)比例与体积分数2%洗洁精溶液混合,磁力搅拌6 h去除脂肪,然后以1∶10(m/V)比例与0.05 mol/L氢氧化钠溶液混合,室温下磁力搅拌4 h去除杂蛋白(每2 h换一次氢氧化钠溶液),后用0.05 mol/L磷酸溶液溶胀鱼皮(1∶10,m/V),室温下磁力搅拌3 h(每1.5 h换一次磷酸溶液),最后分别在40、50、60、70、80、90 ℃下将鱼皮与水以1∶5(m/V)比例提取10 h,离心收集上清液,冷冻干燥即得马哈鱼鱼皮明胶。
1.3.2 明胶膜的制备
明胶膜的制备参照翁武银等[11]的方法略作改动。将不同温度制得明胶溶于60 ℃去离子水,使蛋白质量浓度为5 g/100 mL,分别添加质量浓度1.1、1.2、1.5 g/100 mL的甘油制备成膜液。将膜液(5 mL)均匀倒在直径为10 cm的培养皿中,于温度(25±1)℃,相对湿度(50±5)%的恒温恒湿培养箱中干燥24 h,得明胶膜。用于电子显微镜观察的膜采用7 mL膜液于直径3.5 cm的培养皿中制备,其余步骤同上。记40、50、60、70、80、90 ℃提取明胶所制膜分别为F40、F50、F60、F70、F80和F90。
1.3.3 膜厚度和机械性能测定
采用数字测厚仪测定膜的厚度。每种膜选取6 张测定,每张选取9 个点,其中1 个为中心点。
机械性能测定依据Iwata等[17]方法略加调整。将明胶膜切成宽10 mm×35 mm小块,采用质构仪测定拉伸强度(tensile strength,TS)和断裂伸长率(elongation at break,EAB)。质构仪参数为:间隔15 mm,拉伸速率30 mm/min。TS和EAB分别按公式(1)、(2)计算。
式中:F为膜断裂时承受最大张力/N;S为膜的横截面面积/m2。
式中:E为膜断裂时被拉伸的长度/mm。
1.3.4 膜的颜色性质测定
采用测色仪测定膜的颜色性质,以L⋆(黑-白)、a⋆(红-绿)、b⋆(黄-蓝)和总色差∆E来表示。∆E按公式(3)计算。
式中:∆L⋆、∆a⋆和∆b⋆为测量数值与白板参数差值(白板参数为L⋆=94.1,a⋆=-0.79,b⋆=1.2)。
1.3.5 膜的水蒸气透过率测定
膜的水蒸气透过率(water vapour permeability,WVP)参照Shiku等[18]方法测定。于直径为2.5 cm的10 mL烧杯中放置干燥硅胶,用膜盖住烧杯口,将小烧杯置于装有蒸馏水的(25±1)℃干燥皿中,每1 h测定烧杯质量。WVP由式(4)计算。
式中:∆m为t时间间隔烧杯质量增加量/g;d为膜厚度/m;A为烧杯瓶口面积/m2;t为测定时间间隔/s;∆p为膜内外蒸气压差/Pa。
1.3.6 膜的透光率测定
将膜贴壁于比色皿,采用分光光度计测定200~800 nm范围内的透光率。
1.3.7 膜的傅里叶变换红外光谱分析
膜经冷冻干燥后置于全反射托盘上,用傅里叶变换红外光谱仪进行全波段(4 000~400 cm-1)扫描,分辨率为4 cm-1。
1.3.8 膜的微观结构观察
以液氮淬断膜,取样品粘于金属柱上,喷金后采用扫描电子显微镜观察膜的表面和横断面微观结构,膜表面的放大倍数为5 000 倍,膜横断面的放大倍数为2 000 倍。
1.4 数据统计与分析
数据采用SPSS 16.0软件处理分析,数据以 ±s表示,采用单因素方差法分析数据,进一步以Duncan法进行多组平均数的差异水平分析,显著性水平设定为P<0.05。
2 结果与分析
2.1 鱼皮明胶膜的厚度
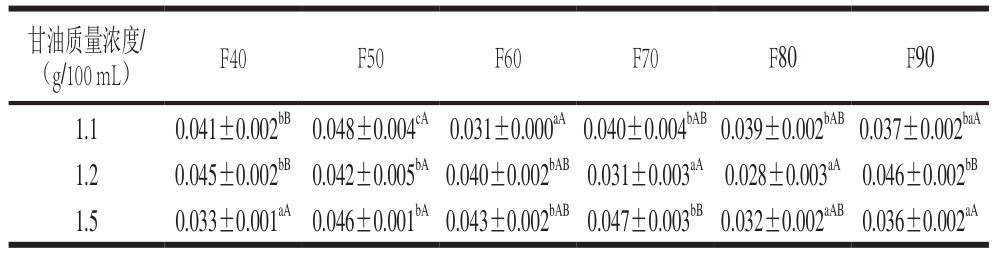
表1 不同温度提取的马哈鱼鱼皮明胶在不同甘油质量浓度下制得膜的厚度
Table 1 Thickness of films prepared from chum salmon skin gelatin extracted at different temperatures and different concentrations of glycerol mm
注:肩标小写字母不同表示相同甘油质量浓度不同温度明胶膜间差异显著(P<0.05);肩标大写字母不同表示不同甘油质量浓度相同温度明胶膜间差异显著(P<0.05)。下同。
马哈鱼鱼皮明胶膜的厚度如表1所示。膜的厚度集中于0.030~0.045 mm。甘油质量浓度1.1 g/100 mL时,F50厚度最高(P<0.05);甘油质量浓度1.2 g/100 mL时,F40、F50、F60厚度高于F70、F80厚度(P<0.05);甘油质量浓度1.5 g/100 mL时,F50、F60、F70厚度高于F80和F90厚度(P<0.05)。以上表明,低中温段明胶所制膜(F40、F50、F60)厚度略高于高温段明胶膜(F70、F80、F90)。Nagarajan等[8]在鱿鱼明胶膜研究中也发现50 ℃明胶膜厚度高于60、70、80 ℃明胶膜厚度。Hoque等[7]认为高温提取和深度水解对胶原结构破坏较严重,所获明胶分子质量较低、分子链较短,分子间可较好地交联形成有序网状结构,突起结点较少,膜较薄。
F40中,添加1.1 g/100 mL和1.2 g/100 mL甘油的膜厚度高于添加1.5 g/100 mL甘油的膜厚度(P<0.05);F50中添加不同质量浓度甘油对厚度无显著差异(P>0.05);F60中添加1.2 g/100 mL和1.5 g/100 mL甘油的膜厚度较高(P<0.05);甘油的质量浓度对F70、F80和F90的膜厚度影响无显著规律。甘油对低温段明胶膜(F40)厚度的降低作用可能源于后者成膜能力较佳,过多甘油不利于膜网状结构形成,故厚度变薄。甘油对于中温段明胶膜(F60)厚度有一定提升,可能因为中温段明胶分子质量相对较小,疏水键暴露较多,不易形成立体网状结构,甘油的加入可促进该结构的形成,致膜厚度增加。F80、F90中甘油对膜厚度影响无显著规律,可能因为高温提取明胶分子质量较小,不易在膜的网状结构中形成突起使膜增厚[19]。
2.2 鱼皮明胶膜的机械性能
表2 不同温度提取的马哈鱼鱼皮明胶在不同甘油质量浓度下制得明胶膜的机械性能
Table 2 Mechanical properties of films prepared from chum salmon skin gelatin extracted at different temperatures and different concentrations of glycerol
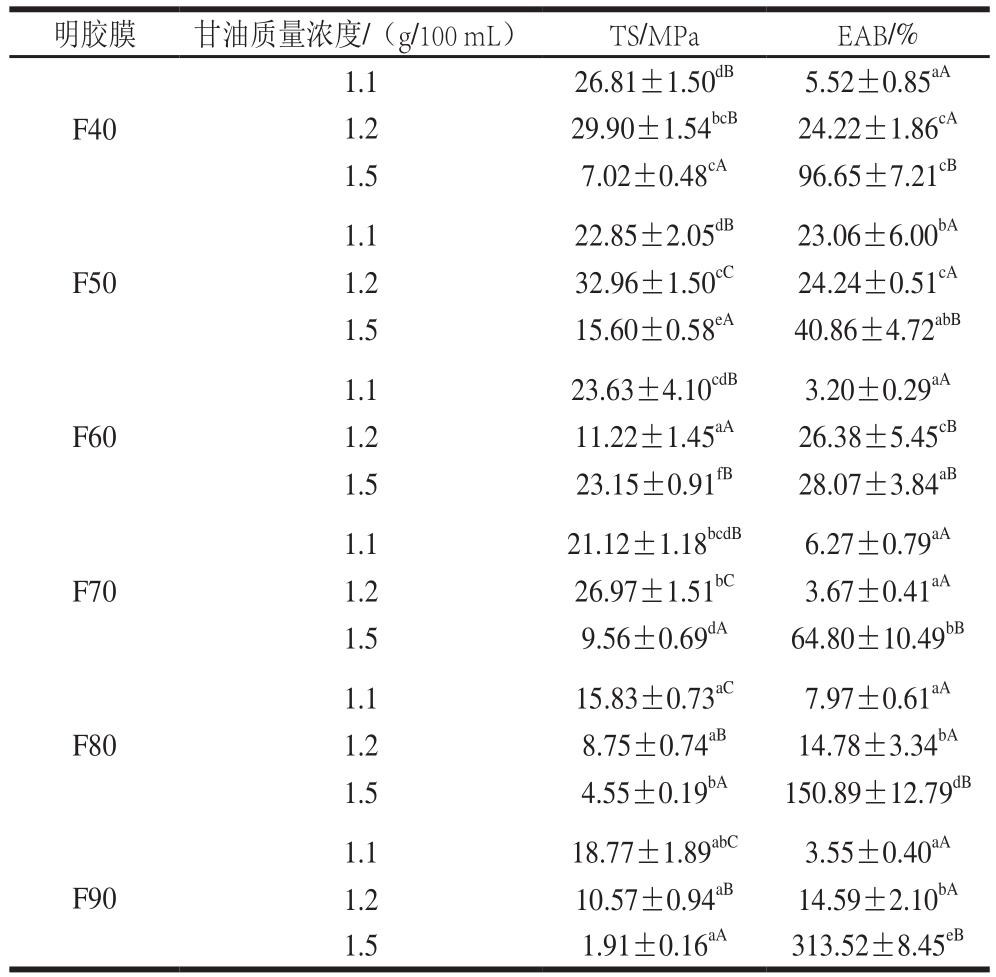
马哈鱼鱼皮明胶膜的机械性能如表2所示。相同甘油质量浓度下,F40、F50、F60的TS高于F70、F80、F90的(1.2 g/100 mL甘油质量浓度下F60除外)(P<0.05),且最高TS集中于F50和F60,最高可达30 MPa,这与商业鱼皮明胶所制膜的TS接近[20]。Nagarajan等[8]指出明胶链的长度与提取温度相关,对网状结构的形成有直接影响。低温提取明胶分子链较长,易发生交联,成膜网络结构较强,TS较强;而高温提取明胶短肽链较多,分子间作用不强,形成较弱网状结构,同时短肽链端头较多,流动性增加,TS较弱[6]。本研究中,甘油低质量浓度下(1.1 g/100 mL和1.2 g/100 mL)F50和F40的TS高于F60(P<0.05),而甘油高质量浓度下(1.5 g/100 mL)F60最高。Hoque等[7]发现70 ℃鱿鱼明胶膜TS高于40、50 ℃和60 ℃鱿鱼明胶膜TS,但温度高于70 ℃时TS迅速下降。适当加热可促进明胶分子间结构的展开和交联,形成较强网络结构,故TS较高;而过高温度使得明胶分子短链大量形成,分子间作用较弱,故TS下降。此外,1.1 g/100 mL和1.2 g/100 mL的甘油质量浓度下温度对EAB的影响无显著规律,但甘油质量浓度达1.5 g/100 mL时,EAB随着温度升高而上升(P<0.05),最高达300%。Perez-Gago等[21]也发现乳清蛋白膜的EAB随着加热温度的上升呈下降。这是因为高温提取明胶短肽链较多,一定拉力下更容易下滑,故EAB较高。
表2显示,相同温度(50、70 ℃)下TS随着甘油质量浓度先增加后下降(P<0.05),80 ℃和90 ℃则一直下降。以上表明,甘油添加对明胶膜TS有一定提升作用,但高质量浓度甘油则降低TS。Jongjareonrak等[22]也发现大眼鲷鱼鱼皮明胶膜TS随甘油质量浓度增加而降低。可能是因为甘油分子与蛋白质分子间产生了氢键,弱化了明胶分子间本身的相互作用导致TS下降[20]。另一方面,相同温度下(40、50、70、80、90 ℃)随着甘油质量浓度增加EAB明显上升(P<0.05),尤其在质量浓度为1.5 g/100 mL时,EAB迅速上升(P<0.05)。以上结果表明,甘油添加对于EAB有显著促进作用。Arfat等[20]也指出甘油质量浓度增加导致膜流动性增加,进而EAB增加。
以上研究结果表明,明胶提取温度和甘油质量浓度都在不同程度上对明胶膜机械性能产生影响。如表2所示,F40、F50和F60分别添加1.2、1.1 g/100 mL或1.2、1.5 g/100 mL所制得明胶膜TS和EAB均较好;而70~90 ℃明胶膜或TS过低或EAB过低,机械性能较差。故研究选定明胶提取温度为40、50、60 ℃,甘油添加质量浓度分别为1.1、1.2、1.5 g/100 mL进一步研究马哈鱼鱼皮明胶膜性质。
2.3 鱼皮明胶膜的颜色
表3 不同温度提取的马哈鱼鱼皮明胶在不同甘油质量浓度下制得明胶膜的颜色
Table 3 Color of films prepared from chum salmon skin gelatin extracted at different temperatures and different concentrations of glycerol
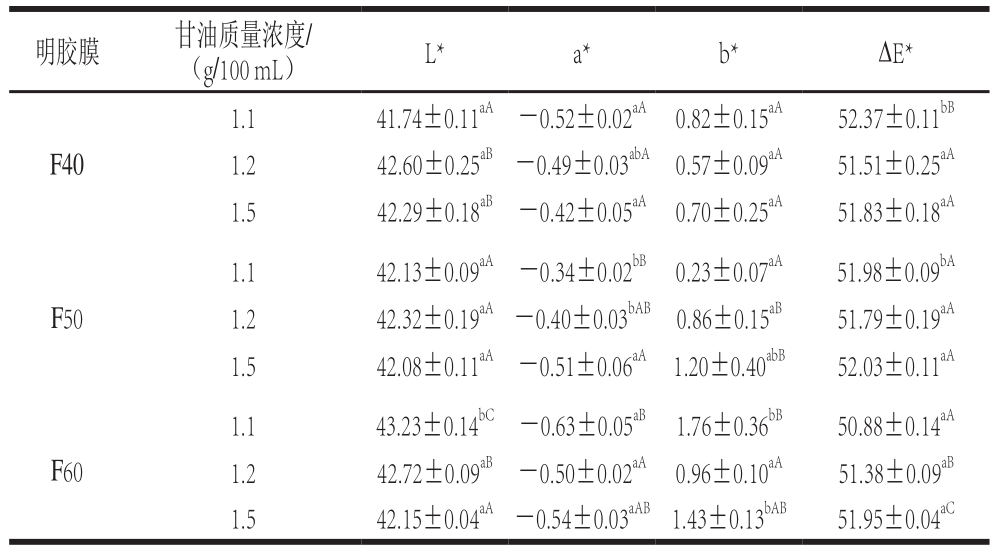
马哈鱼鱼皮明胶膜的颜色性质如表3所示。1.1 g/100 mL甘油质量浓度下,F50的a⋆值高于F40的a⋆值(P<0.05),但L⋆值和∆E⋆值在相同甘油质量浓度下受温度影响较小。以上结果表明,明胶膜的a⋆值随提取温度的上升有增加趋势,Hoque等[7]在鱿鱼明胶膜的研究也发现相似的结果。低温段提取的明胶分子质量较大,结构相对较完整,游离氨基端暴露较少,美拉德反应不明显[8],同时低温段提取的明胶中鱼皮色素引入较少,故明胶膜的颜色较浅。F60随甘油质量浓度的增加L⋆值降低(P<0.05),∆E⋆值上升(P<0.05);F50的b⋆值随甘油质量浓度增加而上升(P<0.05);其他温度明胶膜颜色性质随甘油质量浓度变化无明显规律,与翁武银等[11]的研究结论一致。以上表明甘油质量浓度对较高温度明胶膜的颜色有一定影响,但对中等温度明胶膜颜色影响不大。
2.4 鱼皮明胶膜的WVP
表4 不同温度提取的马哈鱼鱼皮明胶在不同甘油质量浓度下制得明胶膜的WVP
Table 4 Water vapor permeability of films prepared from chum salmon skin gelatin extracted at different temperatures and different concentrations of glycerol
10-9g/(m·s·Pa)

马哈鱼鱼皮明胶膜的WVP如表4所示。甘油质量浓度1.1 g/100 mL时,F60的WVP高于F40和F50(P<0.05);甘油质量浓度为1.2 g/100 mL时,F50和F60的WVP高于F40(P<0.05),明胶膜的WVP随提取温度的升高而增加(P<0.05)。这与Nagarajan等[8]鱿鱼明胶膜的研究结果一致。低温提取明胶分子形成较强网状结构,水分子不易透过,高温提取的明胶分子链变短[16],更容易随机插入膜的网状结构,破坏膜的紧密度,水分子更容易透过[23]。
Giménez等[24]发现添加明胶水解物会导致明胶膜中短链分子增加,WVP增加。此外,短链明胶分子拥有更多羰基和氨基,这些基团会与水分子间形成氢键,增加膜的WVP[25]。
F50的WVP随甘油质量浓度的增加而上升(P<0.05)。Jongjareonrak等[22]在黄笛鲷鱼皮明胶膜的研究中也发现了类似结果。甘油富含羟基,可与水分子形成氢键,使膜的吸湿性能提高。但本研究中F60的WVP随甘油质量浓度的增加呈下降趋势(P<0.05)。可能是高温下明胶分子与甘油形成特殊的结构,暴露出更多的疏水基团,导致WVP下降,具体原因有待进一步研究。
2.5 鱼皮明胶膜的透光率
表5 不同温度提取的马哈鱼鱼皮明胶在不同甘油质量浓度下制得明胶膜的透光率
Table 5 Light transmission of films prepared from chum salmon skin gelatin extracted at different temperatures and different concentrations of glycerol%
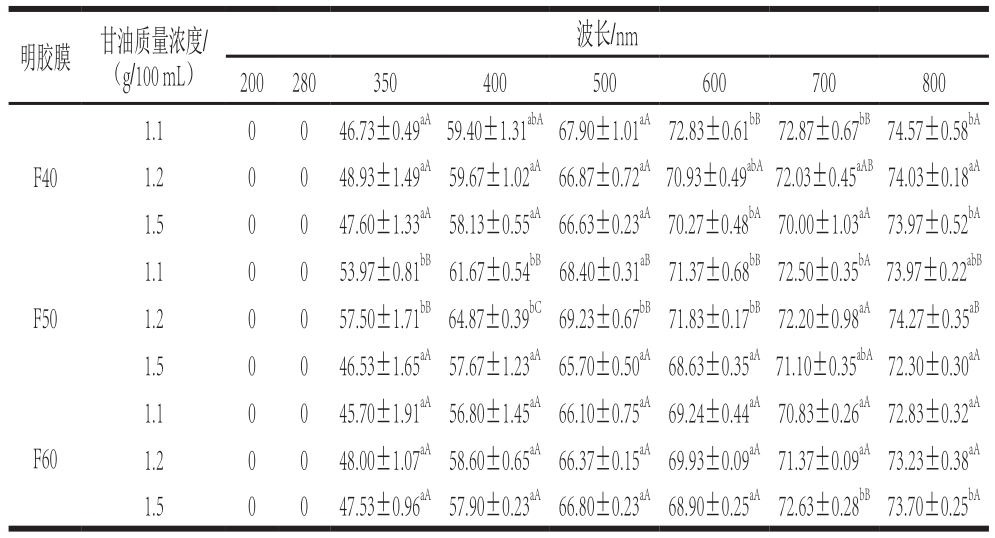
表5为马哈鱼鱼皮明胶膜在波长200~800 nm范围内的透光率。波长200 nm和280 nm下膜的透光率均为0.00%。Limpisophon等[26]指出紫外光可引起脂肪的氧化,由本研究结果可推测马哈鱼皮明胶膜能够有效阻止紫外引起的食品氧化。350~800 nm波长范围内,膜的透光率是46.53%~74.57%。相同甘油质量浓度,F60透光率总体低于F40和F50透光率(P<0.05),这与a⋆和b⋆值的增加(表3)可能有一定的关系。提取过程中,明胶分子可发生美拉德反应,其产物种类与数量影响明胶膜的透光率[7]。相同提取温度下,甘油质量浓度对明胶膜的透光率影响无显著规律。Vanin等[27]也发现增塑剂的种类和浓度对明胶膜的透光率没有影响。
2.6 鱼皮明胶膜的傅里叶变换红外光谱分析
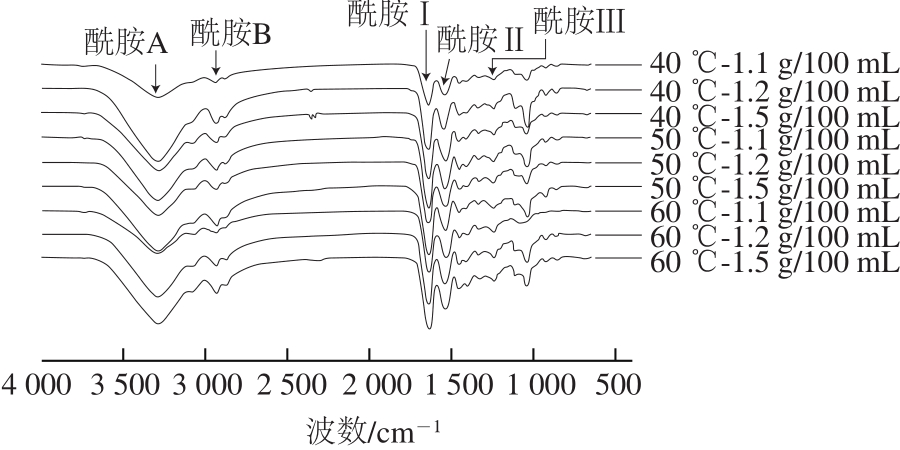
图1 不同温度提取的马哈鱼鱼皮明胶在不同甘油质量浓度下制得明胶膜的衰减全反射傅里叶变换红外光谱图
Fig. 1 ATR-FTIR spectra of films prepared from chum salmon skin gelatin extracted at different temperatures and different concentrations of glycerol
马哈鱼鱼皮明胶膜的衰减全反射傅里叶变换红外光谱如图1所示。甘油质量浓度1.1 g/100 mL时,F40、F50和F60酰胺A带分别位于3 286.06、3 285.13 cm-1和3 284.25 cm-1;甘油质量浓度为1.2 g/100 mL时,F40、F50和F60酰胺A带分别位于3 287.88、3 284.29 cm-1和3 285.40 cm-1;甘油质量浓度为1.5 g/100 mL,F40、F50和F60酰胺A带则位于3 283.37、3 283.92 cm-1和3 284.46 cm-1。Hoque[7]和涂宗财[28]等发现墨鱼明胶膜和鱼鳞明胶膜的酰胺A带分别位于3 275 cm-1和3 290 cm-1,与本研究结果相似。本研究结果表明酰胺A带随温度升高向低波数移动,说明氢键作用加强,这与机械性能的改善相一致。Nagarajan等[8]在鱿鱼明胶膜和金喆民等[29]在聚乙烯醇膜的研究中都发现酰胺A带随温度升高向低波数移动且性质得到改善。相同提取温度下,酰胺A带振幅随甘油质量浓度的升高逐渐增大,表明甘油与明胶分子作用加强,Hoque等[7]在墨鱼明胶膜的近红外图谱中也有相似结果。
本研究中明胶膜酰胺B带出现在2 930~2 935 cm-1,酰胺Ⅰ带位于1 636~1 639 cm-1,酰胺Ⅱ带位于1 535~1 546 cm-1,酰胺Ⅲ带位于1 238~1 240 cm-1,且在1 037~1 042 cm-1范围内皆有较明显吸收,以上结果与其他明胶膜的红外特征吸收谱一致[10,30-31]。酰胺B带反映C—N伸缩振动,酰胺Ⅰ带反映C=O伸缩振动和氢键信息,酰胺Ⅱ带反映N—H基团的弯曲振动和C—N的伸缩振动,酰胺Ⅲ带反映平面内的C—H和N—H振动以及甘油骨架与羟脯氨酸侧链—CH2基团的振动。以上结果表明甘油的羟基与马哈鱼鱼皮明胶分子相互作用强烈,对膜的结构和性质产生了显著影响。
2.7 鱼皮明胶膜的微观结构

图2 不同温度提取的马哈鱼鱼皮明胶在不同甘油质量浓度下制得的明胶膜表面扫描电子显微镜图(5 000×)
Fig. 2 SEM micrographs of surface of films prepared from chum salmon skin gelatin extracted at different temperatures and different concentrations of glycerol (5 000 ×)

图3 不同温度提取的马哈鱼鱼皮明胶在不同甘油质量浓度下制得的明胶膜截面扫描电子显微镜图(2 000×)
Fig. 3 SEM micrographs of cryo-fractured cross-section of films prepared from chum salmon skin gelatin extracted at different temperatures and different concentrations of glycerol (2 000 ×)
马哈鱼鱼皮明胶膜的扫描电子显微镜表面和截面微观结构如图2、3所示。所有明胶膜都具有光滑连续的表面结构,且截面未出现明显断裂或空隙。Nagarajan等[8]在鱿鱼明胶膜研究中发现,高温(80 ℃)提取明胶所成膜较低温(50、60 ℃)提取明胶所成膜的表面呈现明显粗糙和裂纹,同时膜的截面更粗糙、松散。该学者认为高温得到明胶小分子短链较多,分子间作用不强,不易形成网络紧密的结构,因而微观结构不佳。本研究未发现提取温度和甘油对膜的微观结构的显著影响,这可能是由于低温段(40~60 ℃)提取的明胶结构较完整,成膜过程中能形成有序的网状结构[20]。明胶膜的微观结构连续致密,与低温段(40、50、60 ℃)明胶制得膜的TS较强相一致。
3 结 论
提取温度对马哈鱼鱼皮明胶膜机械性能、WVP、颜色、透光率等性质有着显著影响,甘油质量浓度对机械性能、WVP有显著影响,但对颜色和透光率无显著影响。低温(40~60 ℃)提取的明胶所成膜的机械性能较好,WVP较低。甘油分子中的羟基可与蛋白分子间产生氢键,进而减弱蛋白分子将的相互作用,使明胶膜的TS下降,EAB增加;甘油是亲水小分子,随甘油质量浓度增加,膜的WVP增加。可以通过优化明胶提取温度与甘油质量浓度改善马哈鱼鱼皮明胶膜的性能。
参考文献:
[1] 马丹, 赵晓燕, 马越, 等. 不同工艺生产大豆分离蛋白的成膜性能[J]. 农业工程学报, 2008, 24(10): 239-242. DOI:10.3321/j.issn:1002-6819.2008.10.048.
[2] 郭宽, 张超, 赵晓燕, 等. 甘油含量对大豆蛋白膜功能性质的影响[J].食品工业科技, 2012, 33(4): 349-352.
[3] WANG Y, XIONG Y L, RENTFROW G K, et al. Oxidation promotes cross-linking but impairs film-forming properties of whey proteins[J].Journal of Food Engineering, 2013, 115(1): 11-19. DOI:10.1016/j.jfoodeng.2012.09.013.
[4] 王晶, 任发政, 商洁静, 等. 增塑剂对乳清蛋白-丝胶复合可食用膜性能的影响[J]. 食品科学, 2008, 29(6): 59-63.
[5] 刘俊豪, 黄珊, 杨文鸽. 基于鱼皮明胶的可食膜改性及其应用[J]. 食品工业科技, 2014, 35(6): 373-376; 382.
[6] GÓMEZ-GUILLÉN M C, PÉREZ-MATEOS M, GÓMEZ-ESTACA J,et al. Fish gelatin: a renewable material for developing active biodegradable films[J]. Trends in Food Science & Technology, 2009, 20(1): 3-16.
[7] HOQUE M S, BENJAKUL S, PRODPRAN T. Effect of heat treatment of film-forming solution on the properties of film from cuttlefish (Sepia pharaonis) skin gelatin[J]. Journal of Food Engineering, 2010, 96(1): 66-73. DOI:10.1016/j.jfoodeng.2009.06.046.
[8] NAGARAJAN M, BENJAKUL S, PRODPRAN T, et al. Properties of film from splendid squid (Loligo formosana) skin gelatin with various extraction temperatures[J]. International Journal of Biological Macromolecules, 2012, 51(4): 489-496. DOI:10.1016/j.ijbiomac.2012.06.017.
[9] HOQUE M S, BENJAKUL S, PRODPRAN T. Properties of film from cuttlefish (Sepia pharaonis) skin gelatin incorporated with cinnamon,clove and star anise extracts[J]. Food Hydrocolloids, 2011, 25(5): 1085-1097. DOI:10.1016/j.foodhyd.2010.10.005.
[10] JONGJAREONRAK A, RAWDKUEN S, CHAIJAN M, et al. Chemical compositions and characterisation of skin gelatin from farmed giant catfish (Pangasianodon gigas)[J]. LWT-Food Science and Technology,2010, 43(1): 161-165. DOI:10.1016/j.lwt.2009.06.012.
[11] 翁武银, 刘光明, 苏文金, 等. 鱼皮明胶蛋白膜的制备及其热稳定性[J]. 水产学报, 2011, 35(12): 1890-1896. DOI:10.3724/SP.J.1231.2011.17517.
[12] 唐兰兰, 赵阳芳, 翁武银, 等. pH和双醛淀粉对罗非鱼鱼皮明胶膜性质的影响[J]. 食品工业科技, 2014, 35(1): 98-101; 105.
[13] TONGNUANCHAN P, BENJAKUL S, PRODPRAN T, et al. Mechanical, thermal and heat sealing properties of fish skin gelatin film containing palm oil and basil essential oil with different surfactants[J]. Food Hydrocolloids, 2016, 56: 93-107. DOI:10.1016/j.foodhyd.2015.12.005.
[14] WU J L, GE S Y, LIU H, et al. Properties and antimicrobial activity of silver carp (Hypophthalmichthys molitrix) skin gelatin-chitosan films incorporated with oregano essential oil for fish preservation[J].Food Packaging and Shelf Life, 2014, 2(1): 7-16. DOI:10.1016/j.fpsl.2014.04.004.
[15] ARFAT Y A, BENJAKUL S, PRODPRAN T, et al. Properties and antimicrobial activity of fish protein isolate/fish skin gelatin film containing basil leaf essential oil and zinc oxide nanoparticles[J].Food Hydrocolloids, 2014, 41(20): 265-273. DOI:10.1016/j.foodhyd.2014.04.023.
[16] KAEWRUANG P, BENJAKUL S, PRODPRAN T, et al. Physicochemical and functional properties of gelatin from the skin of unicorn leatherjacket(Aluterus monoceros) as affected by extraction conditions[J]. Food Bioscience, 2013, 2: 1-9. DOI:10.1016/j.fbio.2013.03.002.
[17] IWATA K I, ISHIZAKI S H, HANDA A K, et al. Preparation and characterization of edible films from fish water-soluble proteins[J]. Fisheries Science, 2000, 66(2): 372-378. DOI:10.1046/j.1444-2906.2000.00057.x.
[18] SHIKU Y, HAMAGUCHI P Y, BENJAKUL S, et al. Effect of surimi quality on properties of edible films based on Alaska pollack[J]. Food Chemistry, 2004, 86(4): 493-499. DOI:10.1016/j.foodchem.2003.09.022.
[19] TONGNUANCHAN P, BENJAKUL S, PRODPRAN T. Physicochemical properties, morphology and antioxidant activity of film from fish skin gelatin incorporated with root essential oils[J]. Journal of Food Engineering, 2013, 117(3): 350-360. DOI:10.1016/j.jfoodeng.2013.03.005.
[20] ARFAT Y A, BENJAKUL S, PRODPRAN T, et al. Development and characterisation of blend films based on fish protein isolate and fish skin gelatin[J]. Food Hydrocolloids, 2014, 39: 58-67.
[21] PEREZ-GAGO M B, KROCHTA J M. Denaturation time and temperature effects on solubility, tensile properties, and oxygen permeability of whey protein edible films[J]. Journal of Food Science,2001, 66(5): 705-710. DOI:10.1111/j.1365-2621.2001.tb04625.x.
[22] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W, et al.Characterization of edible films from skin gelatin of brownstripe red snapper and bigeye snapper[J]. Food Hydrocolloids, 2006, 20(4): 492-501. DOI:10.1016/j.foodhyd.2005.04.007.
[23] TONGNUANCHAN P, BENJAKUL S, PRODPRAN T, et al.Characteristics of film based on protein isolate from red tilapia muscle with negligible yellow discoloration[J]. International Journal of Biological Macromolecules, 2011, 48(5): 758-767. DOI:10.1016/j.ijbiomac.2011.02.017.
[24] GIMÉNEZ B, GÓMEZ-ESTACA J, ALEMÁN A, et al. Improvement of the antioxidant properties of squid skin gelatin films by the addition of hydrolysates from squid gelatin[J]. Food Hydrocolloids, 2009, 23(5):1322-1327.
[25] HOQUE M S, BENJAKUL S, PRODPRAN T. Effects of partial hydrolysis and plasticizer content on the properties of film from cuttlefish(Sepia pharaonis) skin gelatin[J]. Food Hydrocolloids, 2011, 25(1): 82-90. DOI:10.1016/j.foodhyd.2010.05.008.
[26] LIMPISOPHON K, TANAKA M, WENG W, et al. Characterization of gelatin films prepared from under-utilized blue shark (Prionace glauca)skin[J]. Food Hydrocolloids, 2009, 23(7): 1993-2000. DOI:10.1016/j.foodhyd.2009.03.014.
[27] VANIN F M, SOBRAL P J A, MENEGALLI F C, et al. Effects of plasticizers and their concentrations on thermal and functional properties of gelatin-based films[J]. Food Hydrocolloids, 2005, 19(5): 899-907.DOI:10.1016/j.foodhyd.2004.12.003.
[28] 涂宗财, 黄涛, 王辉, 等. 3 种淡水鱼鳞明胶成膜性的比较[J]. 食品与发酵工业, 2014, 40(2): 151-154.
[29] 金喆民, 秦培勇, 陈翠仙, 等. 交联聚乙烯醇膜材料结构与性能的相关性(Ⅰ)交联膜的红外分析[J]. 膜科学与技术, 2003, 23(4): 16-19.DOI:10.3969/j.issn.1007-8924.2003.04.004.
[30] BERGO P, SOBRAL P J A. Effects of plasticizer on physical properties of pigskin gelatin films[J]. Food Hydrocolloids, 2007, 21(8): 1285-1289.DOI:10.1016/j.foodhyd.2006.09.014.
[31] 翁武银, 吴菲菲, 大迫一史, 等. 蛋白浓度对罗非鱼皮明胶高温干燥成膜的影响[J]. 农业机械学报, 2014, 45(7): 209-215. DOI:10.6041/j.issn.1000-1298.2014.07.033.