荔枝(Litchi chinensis Sonn.)是亚热带常绿植物无患子科(Sapindaceae)荔枝属植物,原产于我国华南亚热带地区,具有广泛的市场价值[1]。荔枝果实在采摘前后都容易遭受病原菌的入侵,主要腐败菌包括霜疫霉、黑曲霉、黄曲霉、青霉等,此外一些酵母菌和细菌也会在果皮表面繁殖并深入果内,使果肉变酸、腐烂[2]。另外,荔枝采后的生理代谢旺盛,极易发生果皮褐变、水分流失和果肉营养成分降解等问题,十分不耐贮存。目前,荔枝采后病原菌的防治仍然主要依靠化学药物[3],如广谱低毒的杀菌剂等。然而这类杀菌剂容易在果皮上残留,甚至通过果皮渗入果肉,对人体健康造成危害。随着社会生活水平的提高,人们对食品品质要求越来越高,天然防腐剂的开发和应用受到广泛关注。因此,开发更为安全有效的防腐保鲜剂是目前荔枝保鲜技术的研究热点。
抗菌肽是一类天然来源的具有抗菌活性的多肽类物质,对各种细菌和真菌均具有抑制作用[4],但其抗菌机制有异于传统抗生素[5-6],可以有效抑制对抗生素产生耐药性的细菌[7],还具有杀菌速度快、不易被蛋白酶水解等特点[8]。因此,抗菌肽目前已被广泛应用于食品保鲜等领域。
在前期研究中[9-11],本实验室从由西藏开菲尔中筛选得到了一株新菌株——副干酪乳杆菌(Lactobacillus paracasei)FX-6,通过该菌株发酵获得的发酵产物,经初步分离纯化及冷冻干燥后得到了抗菌肽粗提物。经分离鉴定,该抗菌肽粗提物中主要作用物质包括具有广谱性、高效性的天然抗菌肽F1、F3以及少量乳酸,对多种常见的食源性致病菌(包括荔枝采后的主要致病菌:黑曲霉、黑根霉、黄曲霉、灰绿青霉等)均有较强的抑制作用。目前已发现该抗菌肽粗提物能够有效抑制牛乳、馒头、冷鲜肉、鲜虾等食品在贮藏过程中的腐败变质[11-13],具有潜在的应用前景。
本研究通过离体实验研究抗菌肽粗提物对荔枝霜疫霉菌(荔枝主要腐败菌之一)的抑制作用;选取‘桂味’荔枝为研究对象,通过检测用抗菌肽粗提物处理后的不同贮藏时期荔枝果实感官指标和理化指标,探讨常温条件下抗菌肽粗提物对荔枝贮藏品质的影响。
1 材料与方法
1.1 材料与试剂
抗菌肽粗提物由广东省天然活性物工程技术研究中心实验室自制[13];‘桂味’荔枝采摘于潮州市果树研究所;发酵菌为副干酪乳杆菌FX-6,从西藏开菲尔中分离得到,现保存于华南农业大学食品学院;供试菌株为荔枝霜疫霉菌(Peronophythora litchi),由华南农业大学资源环境学院杀菌剂研究室分离和保存。
施保克咪鲜胺(以下简称施保克) 江门市大光明农化新会有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基 广东环凯微生物科技有限公司;磷酸盐缓冲液(phosphate buffer saline,PBS) 武汉博士德生物工程有限公司;2,6-二氯靛酚 上海源叶生物科技有限公司;酒石酸钾钠、3,5-二硝基水杨酸 天津市大茂化学试剂厂;氢氧化钠 上海国药集团。
1.2 仪器与设备
PL203型电子天平 瑞士梅特勒-托利多仪器有限公司;UV-1750型紫外-可见光分光光度计 日本岛津公司;DH500BII型电热恒温培养箱 天津市泰斯特仪器有限公司;EnSpire2300型多功能酶标仪 美国PerkinElmer公司;DC-P3型全自动测色色差仪 北京市兴光测定仪器有限公司;PHS-3C型酸度计 上海仪电科学仪器股份有限公司;手持式折光仪 衢州艾普计量仪器有限公司;90plus型Zeta电位测定仪 美国布鲁克海文仪器公司。
1.3 方法
1.3.1 菌落培养及抑菌率的测定
参照陈兴龙等[14]的方法并修改,分别向培养皿中倒入含有抗菌肽粗提物0.0(对照)、2.5、5.0、7.5、10.0 mg/mL的PDA培养基20 mL,待培养基凝固后,在培养基中心放置一个直径为8 mm的荔枝霜疫霉菌菌饼,使长有菌丝的一面与培养基相接触,于25 ℃条件下培养72 h,用十字交叉法测量不同处理组的菌落直径,抑菌率、菌落净生长直径计算分别如式(1)、(2)所示。

1.3.2 抗菌肽粗提物对采后荔枝保鲜作用的评价
1.3.2.1 分组及处理
选取大小均一、颜色均匀、无病虫害的荔枝果实,从果蒂处剪断后随机分组。将各组荔枝分别用蒸馏水(对照组)、0.5 mg/mL施保克水溶液、0.5 mg/mL和1.0 mg/mL抗菌肽粗提物水溶液浸泡2 min,取出后自然风干,用聚乙烯自封袋(36 mm×26 mm,厚0.05 mm)包装,每袋装20 个果实,密封后于(25.0±0.5)℃、85%~95%相对湿度条件下贮存,并于贮藏第0、2、4、6、8天对荔枝的相关指标进行检测。
1.3.2.2 荔枝果实感官指标的测定
好果率的测定参照李念文等[15]的方法,计算如式(3)所示。
霉变率计算如式(4)所示。
褐变指数的测定参照Scott等[16]的分级法,计算如式(5)所示。
1.3.2.3 荔枝果皮色泽的测定
色泽的测定参照McGuire[17]的方法,每组取5 颗荔枝,采用色差仪在每颗荔枝果肩不同部位测定3 次,以L值表示亮度、C值表示色度,其中![]() a值表示红度(色泽由红到绿的变化),b值表示黄度(色泽由黄到蓝的变化)。
a值表示红度(色泽由红到绿的变化),b值表示黄度(色泽由黄到蓝的变化)。
1.3.2.4 荔枝果皮水分含量的测定
每组随机取3 份果皮,每份(1.0±0.2)g,用烘箱法测定水分含量。
1.3.2.5 荔枝果皮相对电导率的测定
相对电导率的测定参照杨松夏等[18]的方法。用打孔器从果皮打取直径0.8 mm的圆片(3 片/果),每组取10 片,加入25 mL蒸馏水浸泡30 min,使用Zeta电位测定仪测定电导率C1;再在沸水中煮15 min,迅速冷却到室温后测定电导率C2,相对电导率计算如式(6)所示。
1.3.2.6 荔枝果皮pH值的测定
将荔枝果皮加入液氮研磨成粉,取5 g冻粉用蒸馏水定容至50 mL,静置提取30 min后过滤,用pH计测量滤液的pH值。
1.3.2.7 荔枝果皮花色苷含量的测定
参照张昭其等[19]的方法,采用pH值示差法检测。
1.3.2.8 荔枝果皮多酚氧化酶和过氧化物酶活力的测定
多酚氧化酶(polyphenol oxidase,PPO)活力的测定参照王德培等[20]的方法,以每克果皮在415 nm波长处每分钟吸光度变化0.001为1 个酶活力单位,单位为U/g;过氧化物酶(peroxidase,POD)活力的测定参照庞学群等[21]的方法,以每克果皮在470 nm波长处每分钟吸光度变化0.01为1 个酶活力单位,单位为U/g。
1.3.2.9 荔枝果肉营养成分的测定
将每个重复20 个果的果肉充分匀浆,用4 层纱布过滤。可溶性固形物(total soluble solid,TSS)含量的测定参考Cabral等[22]的方法,使用手持式折光仪测定;VC含量采用2,6-二氯靛酚滴定法测定;还原糖含量采用3,5-二硝基水杨酸比色法测定。
1.4 数据分析
运用Origin 9.0软件绘图,运用SPSS 18.0软件进行统计分析,采用单因素方差法,当方差齐时采用Duncan’s新复极差法,当方差不齐时采用Dunnett’s T3法。P<0.05时表示具有统计学意义。
2 结果与分析
2.1 抗菌肽粗提物对荔枝霜疫霉菌菌丝生长的影响
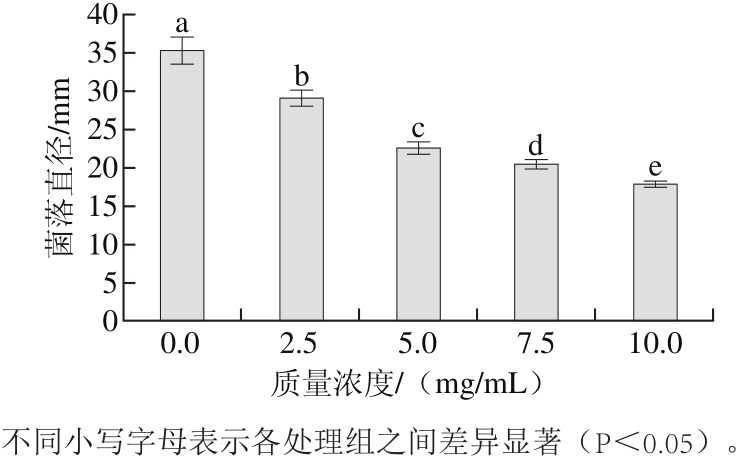
图1 抗菌肽粗提物对荔枝霜疫霉菌生长的影响
Fig. 1 Effect of crude antimicrobial peptide extract on the growth of Peronophythora litchi
荔枝霜疫霉菌既是荔枝采前的主要病原菌之一,也是采后荔枝腐败变质的重要因素[23]。由图1可知,抗菌肽粗提物能够有效抑制荔枝霜疫霉菌的生长,并随其添加物质量浓度的增加,抑菌效果显著增加(P<0.05),其中含有抗菌肽粗提物10.0 mg/mL的培养基上,72 h的菌落净生长直径仅为9.9 mm,抑菌率达到63.33%。
2.2 抗菌肽粗提物对荔枝好果率的影响
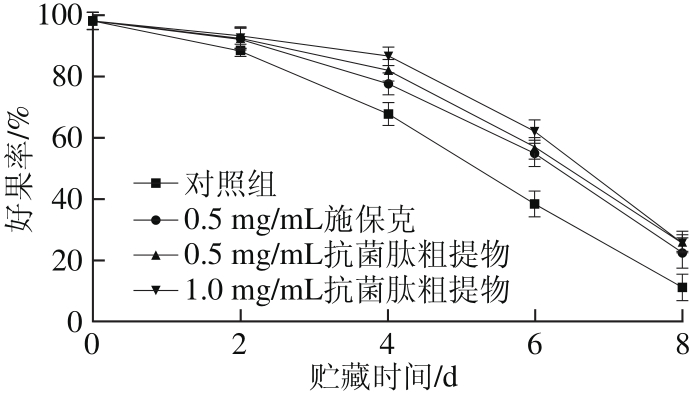
图2 抗菌肽粗提物对荔枝好果率的影响
Fig. 2 Effect of crude antimicrobial peptide extract on the percentage of marketable fruits
由图2可知,荔枝在贮藏过程中好果率呈下降趋势,并且贮藏中后期下降迅速。对照组的好果率下降速率最快,从第4天起显著低于施保克和抗菌肽粗提物处理组(P<0.05)。抗菌肽粗提物组的好果率在贮藏初期下降缓慢,其中1.0 mg/mL抗菌肽粗提物组的好果率在第4天时与施保克组具有显著性差异(P<0.05)。随着贮藏时间的延长,各处理组间好果率差异减小,但仍然高于对照组,说明抗菌肽粗提物可有效提高荔枝的好果率,延长荔枝的贮藏期。
2.3 抗菌肽粗提物对荔枝霉变率的影响
由图3可知,荔枝在贮藏过程中霉变率呈上升趋势,并且随贮藏时间的延长,霉变率上升速率加快。对照组的荔枝从贮藏第2天起即发生霉变现象,并且不断加剧,在第6天时已达到28.33%。而经过施保克和抗菌肽粗提物处理过的荔枝霉变率始终较低,显著低于对照组(P<0.05),在第8天时,1.0 mg/mL抗菌肽粗提物组的霉变率仅为18.33%,低于施保克组,且与对照组之间具有极显著差异(P<0.01)。说明抗菌肽粗提物和施保克都能够有效抑制荔枝果皮表面微生物的生长繁殖,防止荔枝霉变,但0.5 mg/mL的抗菌肽粗提物效果不及同等质量浓度的施保克,而将质量浓度提高至1.0 mg/mL后效果优于0.5 mg/mL施保克。
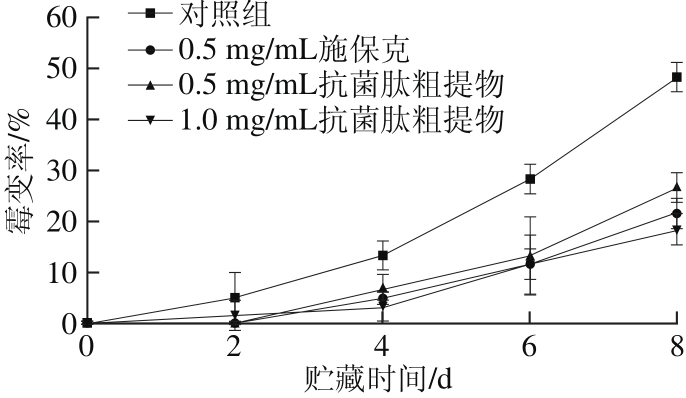
图3 抗菌肽粗提物对荔枝霉变率的影响
Fig. 3 Effect of crude antimicrobial peptide extract on mildewing rate of litchi fruits
2.4 抗菌肽粗提物对荔枝褐变指数的影响
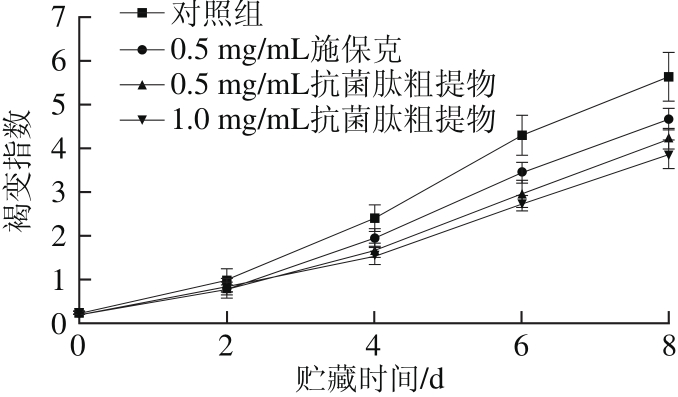
图4 抗菌肽粗提物对荔枝褐变指数的影响
Fig. 4 Effect of crude antimicrobial peptide extract on browning index of litchi pericarp
荔枝果皮的褐变通常是由水分流失、pH值升高、花青素降解、相关酶的作用和微生物生长等因素引起的,并且这些因素之间往往存在相互协同作用[24]。果皮褐变严重影响荔枝的品质和商品价值,是缩短荔枝贮存时间的主要问题之一[25]。由图4可知,各组荔枝在实验过程中褐变指数呈持续上升趋势。对照组的褐变指数始终高于施保克和抗菌肽粗提物处理组,并且从第4天起开始与其他处理组之间呈现显著差异(P<0.05)。在整个实验期间,施保克处理组的褐变指数始终高于抗菌肽粗提物处理组,从第6天开始与1.0 mg/mL抗菌肽粗提物处理组差异显著(P<0.05)。说明抗菌肽粗提物能够显著抑制荔枝果皮的褐变,并且效果优于施保克。
2.5 抗菌肽粗提物对荔枝果皮色泽的影响
果皮色泽的变化可以客观地反映出荔枝在贮藏过程中的褐变情况。L值表示亮度,由图5A可知,实验过程中荔枝果皮L值呈下降趋势。在贮藏初期各组间差异不显著(P>0.05),至中期对照组L值迅速下降,6 d后下降速率有所减慢。施保克处理组的L值在贮藏中后期高于对照组,在第4天时与对照组差异显著(P<0.05)。抗菌肽粗提物组L值始终高于对照组,且各处理组在4~6 d均与对照组具有显著性差异(P<0.05),贮藏后期与对照组逐渐接近,其中1.0 mg/mL的抗菌肽粗提物处理组的L值最大。
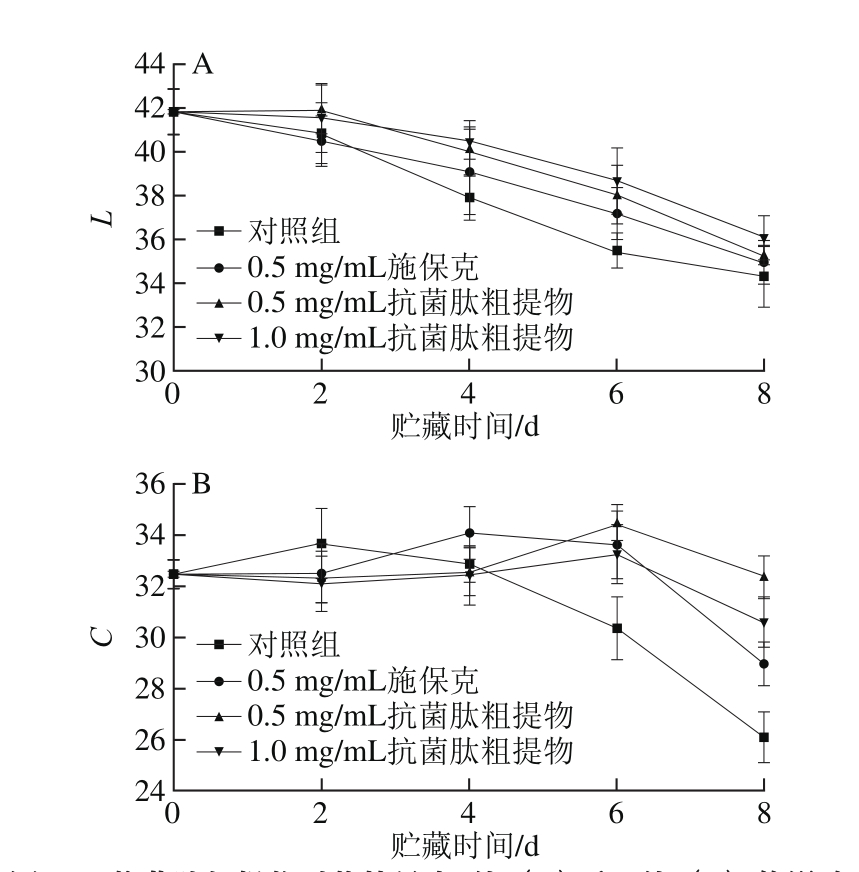
图5 抗菌肽粗提物对荔枝果皮L值(A)和C值(B)的影响
Fig. 5 Effect of crude antimicrobial peptide extract on L (A) and C value (B) of litchi pericarp
C值表示色度,体现荔枝果皮色泽的饱和度。由图5B可知,实验前期各组C值总体变化不大,贮藏至6 d后,抗菌肽粗提物处理组和施保克处理组开始显著高于对照组(P<0.05),但各处理组间差异不显著(P>0.05)。实验后期各组C值均有所下降,对照组C值仍处于最低水平。综合L值和C值可知,抗菌肽粗提物能够显著抑制果皮亮度和色度的下降,效果优于施保克。各处理组L值和C值的变化规律与果皮褐变指数具有负相关性。
2.6 抗菌肽粗提物对荔枝果皮水分含量的影响
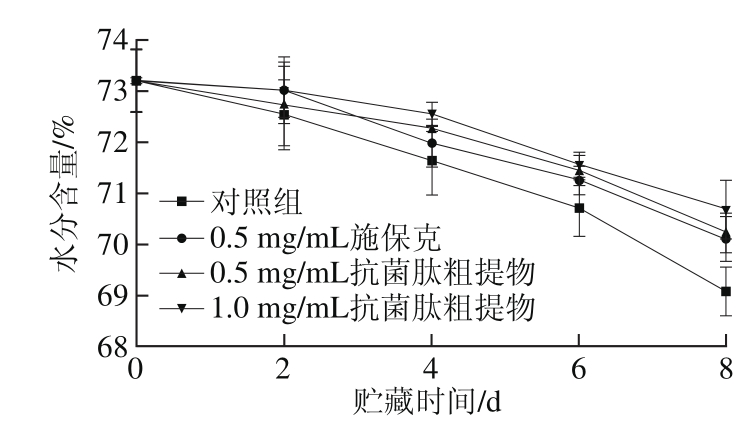
图6 抗菌肽粗提物对荔枝果皮水分含量的影响
Fig. 6 Effect of crude antimicrobial peptide extract on moisture content of litchi pericarp
荔枝在贮藏过程中果皮水分会随果实自身的呼吸代谢而不断流失,当果实受到微生物侵染时,果皮结构的完整性下降,水分流失增加,而果皮的水分含量与褐变是息息相关的。由图6可知,各组荔枝果皮水分含量均呈下降趋势。对照组的果皮水分含量始终处于最低水平,并且在贮藏后期下降速率加快。抗菌肽粗提物组和施保克组的果皮水分含量均高于对照组,从第6天起与对照组差异显著(P<0.05),其中1.0 mg/mL抗菌肽粗提物处理组水分含量最高,但各处理组之间差异不显著(P>0.05)。说明抗菌肽粗提物能够在一定程度上减少荔枝果皮的水分流失,有利于减少褐变,延长荔枝果实的贮藏时间。
2.7 抗菌肽粗提物对荔枝果皮相对电导率的影响

图7 抗菌肽粗提物对荔枝果皮相对电导率的影响
Fig. 7 Effect of crude antimicrobial peptide extract on relative conductivity of litchi pericarp
荔枝采收后,随细胞内的呼吸代谢作用持续进行,细胞膜透性增加,导致生物膜系统受损,从而加剧了荔枝果实的衰老和变质。相对电导率与细胞膜透性具有一定的正相关性,可以用相对电导率来表征细胞膜透性,从而反映果皮细胞衰老和破坏的程度[18]。由图7可知,在实验过程中荔枝果皮相对电导率呈上升趋势。对照组的果皮相对电导率高于其他处理组,至第4天显著高于施保克组和1.0 mg/mL抗菌肽粗提物组(P<0.05),从第6天起与其他处理组均具有显著差异(P<0.05)。1.0 mg/mL抗菌肽粗提物组的相对电导率最低,但与其他处理组之间无显著差异(P>0.05)。说明抗菌肽粗提物有利于延缓荔枝果皮相对电导率的上升,保持果皮的完整性,有利于荔枝的贮藏。
2.8 抗菌肽粗提物对荔枝果皮pH值的影响
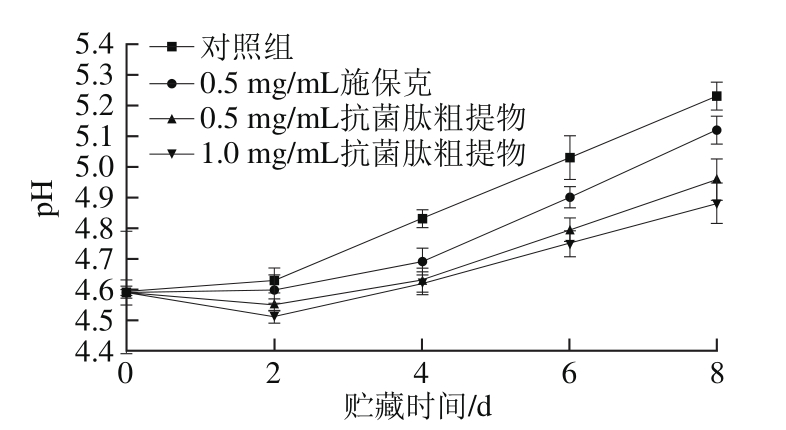
图8 抗菌肽粗提物对荔枝果皮pH值的影响
Fig. 8 Effect of crude antimicrobial peptide extract on pH of litchi pericarp
荔枝在贮藏过程中,表皮水分的流失会引起果皮pH值升高,从而导致果皮组织显微结构被破坏,发生细胞破裂、底物溢出等现象,加速了果皮的衰老和褐变;另外,pH值的变化会改变花色苷结构,当pH值高于4.69时,花色苷就开始褪色和变褐[26]。因此抑制果皮pH值的上升对采后荔枝的保鲜和防止荔枝褐变具有重要的意义,在生产中,采后荔枝就常用浸酸处理来改善荔枝果皮褐变[27]。
由图8可知,在实验过程中荔枝果皮pH值总体呈上升趋势,尤其从第2天后加速上升。对照组果皮pH值上升最快,至第6天已经超过5.0。施保克处理组果皮pH值低于对照组,从第4天起具有显著性差异(P<0.05)。抗菌肽粗提物处理组果皮pH值较低,第2天时甚至低于初始值,这是由于抗菌肽粗提物中含少量的乳酸,呈天然弱酸性所致。随着贮藏时间的延长,抗菌肽粗提物组果皮pH值缓慢上升,但始终低于对照组和施保克组,其中1.0 mg/mL抗菌肽粗提物组果皮pH值最低,至第8天时仍然低于4.9,与对照组具有极显著差异(P<0.01)。结果表明,抗菌肽粗提物和施保克能延缓荔枝贮藏过程中果皮pH值上升,其中抗菌肽粗提物的作用更明显,可延缓荔枝果皮的褐变和衰老。
2.9 抗菌肽粗提物对荔枝果皮花色苷含量的影响
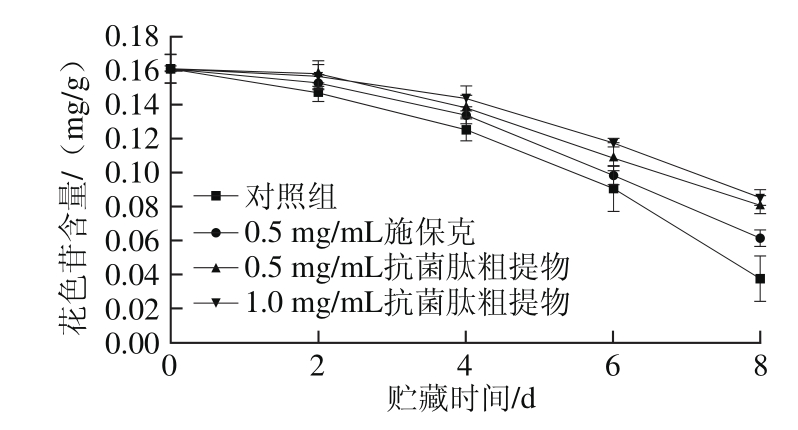
图9 抗菌肽粗提物对荔枝果皮花色苷含量的影响
Fig. 9 Effect of crude antimicrobial peptide extract on anthocyanin content of litchi pericarp
花色苷是一类水溶性黄烷类植物色素,是导致荔枝褐变的重要物质之一,其结构容易受到pH值和温度等因素的影响[19]。由图9可知,常温下荔枝果皮花色苷含量在贮藏过程中呈下降趋势,并且与荔枝的褐变指数具有负相关性,与张昭其等[19]的研究结果一致。对照组果皮花色苷含量下降较快,贮藏4 d后显著低于其他处理组(P<0.05)。贮藏过程中施保克组和抗菌肽粗提物处理组果皮花色苷含量缓慢降低,并且抗菌肽粗提物处理组花色苷含量高于施保克处理组,其中1 mg/mL抗菌肽粗提物组下降较慢,从第6天起已显著高于施保克处理组(P<0.05)。结果表明,抗菌肽粗提物能够抑制荔枝在贮藏过程中果皮花色苷含量下降,可能是由于抗菌肽粗提物所具有的广谱抗菌性及其降低果皮pH值的作用所致。
2.10 抗菌肽粗提物对荔枝果皮PPO和POD活力的影响
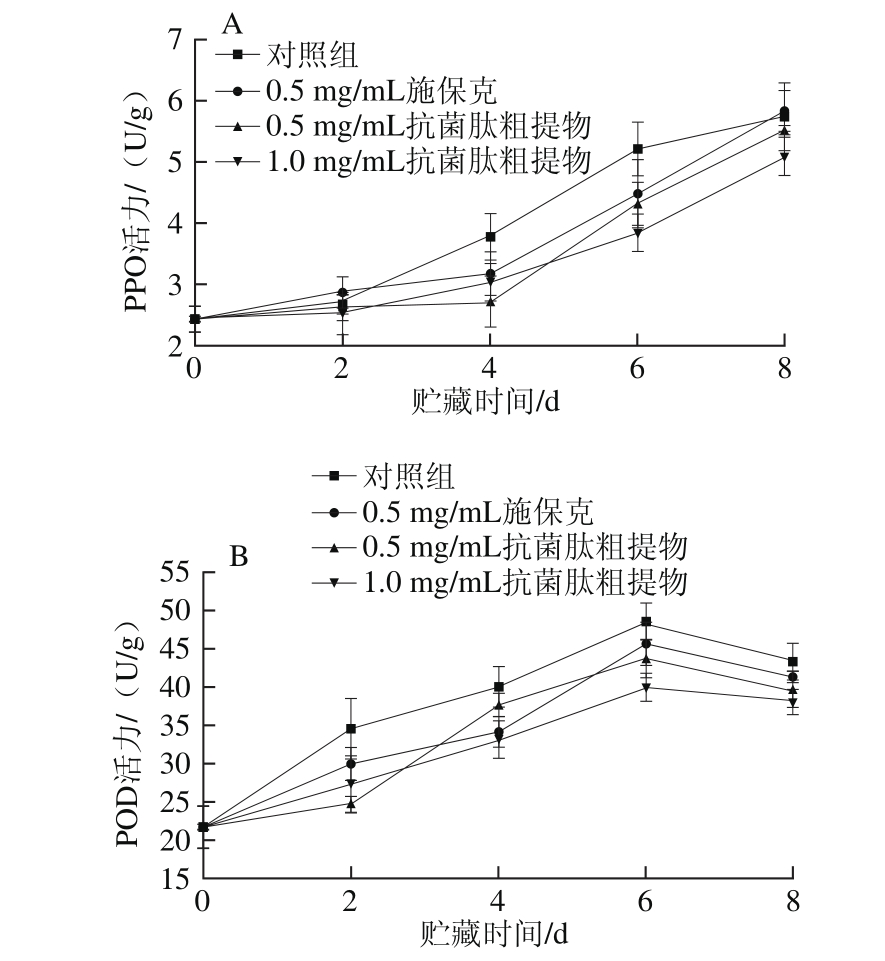
图10 抗菌肽粗提物对荔枝果皮PPO(A)和POD(B)活力的影响
Fig. 10 Effect of crude antimicrobial peptide extract on PPO activity (A)and POD activity (B) of litchi pericarp
荔枝在贮藏过程中,随着细胞膜透性的增加,细胞内多种有机物释放出来,成为酶促褐变的底物,其中PPO和POD在褐变过程中具有重要作用[28-29]。并且PPO和POD能够共同氧化酚成醌,醌转变成缩合型鞣制,最后形成褐色的聚合体[30]。
由图10A可知,贮藏期间各组荔枝果皮PPO活力总体呈上升趋势,但前期上升较缓慢,中后期上升速率加快。各处理组间荔枝果皮PPO活力在前2 d内差异不明显,4 d后对照组的果皮PPO活力显著上升(P<0.05),且显著高于其他处理组(P<0.05),然后上升速率有所减慢,至第8天时接近其他处理组。抗菌肽粗提物处理组和施保克处理组的果皮PPO活力在前4 d内较低,4 d后迅速上升,其中0.5 mg/mL抗菌肽粗提物处理组略低于施保克处理组,但无显著性差异(P>0.05);而1.0 mg/mL抗菌肽粗提物处理组在贮藏后期处于最低水平。
由图10B可知,各处理组荔枝在常温贮藏过程中果皮POD活力均呈现先上升后下降的趋势,在第6天达到峰值。对照组荔枝果皮POD活力在贮藏前期迅速上升,且高于其他处理组。施保克处理组和抗菌肽粗提物处理组荔枝果皮POD活力呈交替上升趋势,在第6天时抗菌肽粗提物处理组果皮POD活力显著低于对照组(P<0.05),其中1.0 mg/mL抗菌肽粗提物处理组的POD活力最低,比对照组低8.44 U/g,0.5 mg/mL抗菌肽粗提物处理组次之。
以上结果表明,抗菌肽粗提物能够有效延缓荔枝果皮PPO和POD活力上升,且效果优于施保克,对荔枝褐变及衰老的控制具有积极意义。
2.11 抗菌肽粗提物对荔枝果肉营养成分含量的影响
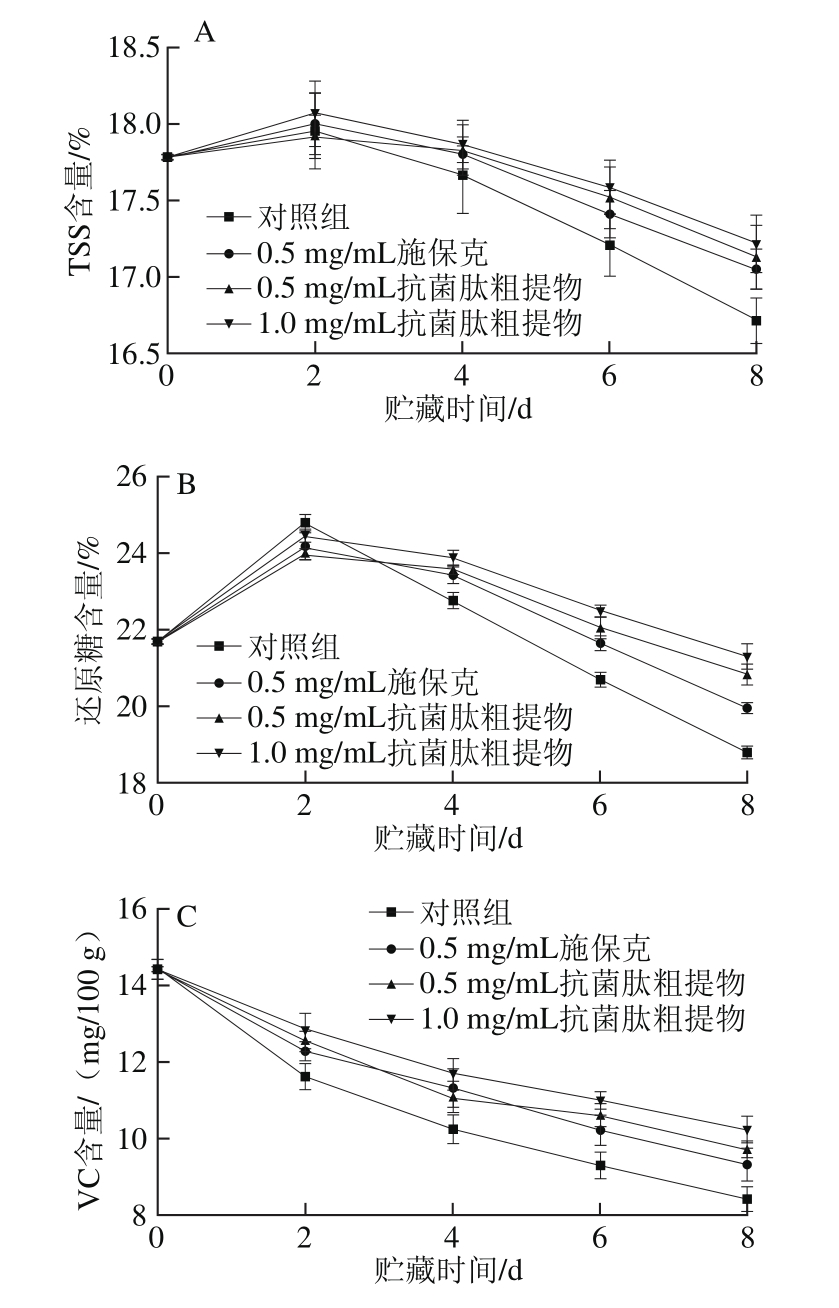
图11 抗菌肽粗提物对荔枝果肉TSS(A)、还原糖(B)和VC(C)含量的影响
Fig. 11 Effect of crude antimicrobial peptide extract on TSS (A),reducing sugar (B) and vitamin C (C) content of litchi pulp
荔枝果肉中含有丰富的营养物质,不仅使荔枝具有营养价值,也赋予其良好的口感。由图11A可知,贮藏前期各组荔枝TSS含量略微上升,各组间差异不显著(P>0.05)。随着贮藏时间的延长,对照组TSS含量迅速下降,施保克处理组和抗菌肽粗提物处理组TSS含量下降较缓慢,至第8天显著高于对照组(P<0.05),但各处理组间无显著性差异(P>0.05)。
对于荔枝果肉的还原糖含量(图11B),各处理组均呈先上升后下降的趋势,这是由于荔枝采收后果实不断成熟,一部分淀粉转化为还原糖。对照组的还原糖含量变化范围最大,在第2天时上升至24.78%,随后迅速降低,显著低于其他处理组(P<0.05)。施保克处理组和抗菌肽粗提物处理组的还原糖含量也在第2天时达到峰值,随后不断降低,但始终高于对照组。贮藏第8天时,各处理组间还原糖含量出现较大差异,其中1.0 mg/mL抗菌肽粗提物处理组的还原糖含量最高,比对照组高2.49%。
由图11C可知,荔枝在贮藏过程中果肉VC含量不断下降,并且在前2 d内迅速下降,这与VC容易发生氧化反应有关;随着贮藏时间的延长,下降趋势逐渐趋于平缓。对照组果肉VC含量下降最快,在贮藏第2天已显著低于其他处理组(P<0.05);施保克处理组和0.5 mg/mL抗菌肽粗提物处理组的VC含量下降速率次之,1.0 mg/mL抗菌肽粗提物处理组VC含量始终高于其他处理组,并且从第6天后与施保克处理组具有显著性差异(P<0.05)。
以上结果表明,抗菌肽粗提物能够显著抑制荔枝果肉在常温条件下贮藏过程中TSS、还原糖和VC含量下降,使荔枝果肉保持较高的营养价值,且效果优于0.5 mg/mL施保克。
3 结 论
本研究表明,抗菌肽粗提物对荔枝霜疫霉菌具有显著的抑制作用。在荔枝采后的常温贮藏过程中,抗菌肽粗提物能够显著抑制荔枝的霉变和褐变的发生,抑制荔枝果皮水分含量和花色苷含量下降,有效延缓荔枝果皮pH值、相对电导率、PPO和POD活力上升,同时抑制荔枝果肉的TSS、还原糖和VC含量的下降。其机理可能是抗菌肽粗提物中含有天然抗菌肽F1和F3,能够抑制荔枝在生长和采摘过程中感染的多种细菌及真菌的生长繁殖,从而维持果皮结构的完整性,减少酶促反应底物的泄露,延缓PPO和POD活力上升;同时抗菌肽粗提物中含有少量乳酸,呈天然弱酸性,有利于花色苷保持其鲜艳的色泽,并且抑制PPO和POD活力的升高,对控制荔枝褐变具有积极作用。总之,抗菌肽粗提物能够显著改善荔枝果实在贮藏过程中的品质,其中0.5 mg/mL抗菌肽粗提物效果优于同等质量浓度的施保克,1.0 mg/mL抗菌肽粗提物对荔枝保鲜效果更佳,能将‘桂味’荔枝常温下的贮藏期延长1~2 d。
参考文献:
[1] LIANG D W, LIN F Y, YANG G M, et al. Advantages of immersion freezing for quality preservation of litchi fruit during frozen storage[J].LWT-Food Science and Technology, 2015, 60(2): 948-956. DOI:10.1016/j.lwt.2014.10.034.
[2] 蔡学清. 荔枝采后主要病原菌的特性及内生细菌对其防治保鲜研究[D]. 福州: 福建农林大学, 2010: 3-4.
[3] 彭埃天, 凌金锋, 习平根, 等. 我国荔枝产区杀菌剂的使用现状及建议[J]. 中国热带农业, 2011(5): 64-67. DOI:10.3969/j.issn.1673-0658.2011.05.024.
[4] AFSHAR M, GALLO R L. Innate immune defense system of the skin[J].Veterinary Dermatology, 2013, 24(1): 32-39. DOI:10.1111/j.1365-3164.2012.01082.x.
[5] DERDE M, LECHEVALIER V, GUERIN-DUBIARD C, et al. Hen egg white lysozyme permeabilizes Escherichia coli outer and inner membranes[J]. Journal of Agricultural and Food Chemistry, 2013,61(41): 9922-9929. DOI:10.1021/jf4029199.
[6] SHARMA P C, JAIN S, YADAV G, et al. Natural preservatives: current insights and applications[J]. Der Pharmacia Sinica, 2010, 1(3): 95-108.
[7] MOLLOY E M, FIELD D, O’CONNOR P M, et al. Saturation mutagenesis of lysine 12 leads to the identification of derivatives of nisin a with enhanced antimicrobial activity[J]. PLoS ONE, 2013, 8(3): e58530.DOI:10.1371/journal.pone.0058530.
[8] DE ZOTTI M, BIONDI B, PARK Y, et al. Antimicrobial lipopeptaibol trichogin GA IV: role of the three Aib residues on conformation and bioactivity[J]. Amino Acids, 2012, 43(4): 1761-1777. DOI:10.1007/s00726-012-1261-7.
[9] MIAO J Y, GUO H X, OU Y W, et al. Purification and characterization of bacteriocin F1, a novel bacteriocin produced by Lactobacillus paracasei subsp. tolerans FX-6 from Tibetan kefir, a traditional fermented milk from Tibet, China[J]. Food Control, 2014, 42: 48-53. DOI:10.1016/j.foodcont.2014.01.041.
[10] MIAO J Y, GUO H X, CHEN F L, et al. Antibacterial effects of a cellpenetrating peptide isolated from kefir[J]. Journal of Agricultural and Food Chemistry, 2016, 64(16): 3234-3242. DOI:10.1021/acs.jafc.6b00730.
[11] 苗建银, 郭浩贤, 符翠欢, 等. 西藏开菲尔发酵提取物对牛奶和馒头防腐作用的研究[J]. 现代食品科技, 2013, 29(7): 1509-1513.DOI:10.13982/j.mfst.1673-9078.2013.07.047.
[12] 陈飞龙, 苗建银, 廖玮灵, 等. 副干酪乳杆菌坚韧亚种FX-6发酵提取物对鲜虾的保鲜评价[J]. 食品工业科技, 2016, 37(4): 351-355.DOI:10.13386/j.issn1002-0306.2016.04.062.
[13] MIAO J, PENG W, LIU G, et al. Biopreservative effect of the natural antimicrobial substance from Lactobacillus paracasei subsp. Tolerans FX-6 on fresh pork during chilled storage[J]. Food Control, 2015, 56: 53-56. DOI:10.1016/j.foodcont.2015.03.013.
[14] 陈兴龙, 潘汝谦, 盖云鹏, 等. 31 种植物甲醇提取物对荔枝霜疫霉菌和炭疽病菌的抑菌活性测定[J]. 广东农业科学, 2012, 39(3): 1-3.DOI:10.16768/j.issn.1004-874x.2012.03.045.
[15] 李念文, 陈丽君, 徐桦, 等. 不同保鲜剂对冷藏条件下荔枝品质保鲜效果的研究[J]. 上海农业科技, 2015(5): 80; 81-82. DOI:10.3969/j.issn.1001-0106.2015.05.048.
[16] SCOTT K J, BROWN B I, CHAPLIN G R, et al. The control of rotting and browning of litchi fruit by hot benomyl and plastic film[J]. Scientia Horticulturae,1982, 16(3): 253-262. DOI:10.1016/0304-4238(82)90073-5.
[17] MCGUIRE R G. Reporting of objective color measurements[J].Hortscience, 1992, 27(12): 1254-1255.
[18] 杨松夏, 吕恩利, 陆华忠, 等. 不同保鲜运输方式对荔枝果实品质的影响[J]. 农业工程学报, 2014, 30(10): 225-232. DOI:10.3969/j.issn.1002-6819.2014.10.028.
[19] 张昭其, 庞学群, 段学武, 等. 荔枝果皮褐变过程中花色素苷含量的变化及测定[J]. 华南农业大学学报, 2002(1): 16-19. DOI:10.3969/j.issn.1001-411X.2002.01.005.
[20] 王德培, 彭志英. 荔枝护色干制的工艺研究[J]. 农业工程学报,2005(11): 158-162. DOI:10.3321/j.issn:1002-6819.2005.11.034.
[21] 庞学群, 段学武, 张昭其, 等. 荔枝果皮过氧化物酶的纯化及部分酶学性质研究[J]. 热带亚热带植物学报, 2004(5): 449-454. DOI:10.3969/j.issn.1005-3395.2004.05.011.
[22] CABRAL T A, DE MORAIS CARDOSO L, PINHEIRO-SANT’ANA H M. Chemical composition, vitamins and minerals of a new cultivar of lychee (Litchi chinensis cv. Tailandes) grown in Brazil[J]. Fruits, 2014,69(6): 425-434. DOI:10.1051/fruits/2014031.
[23] 戚佩坤, 潘雪萍, 刘任. 荔枝霜疫病的研究I. 病原菌的鉴定及其侵染过程[J]. 植物病理学报, 1984(2): 113-119. DOI:10.13926/j.cnki.apps.1984.02.009.
[24] MANGARAJ S, GOSWAMI T K, GIRI S K, et al. Permselective MA packaging of litchi (cv. Shahi) for preserving quality and extension of shelf-life[J]. Postharvest Biology and Technology, 2012, 71: 1-12.DOI:10.1016/j.postharvbio.2012.04.007.
[25] SOMBOONKAEW N, TERRY L A. Influence of temperature and packaging on physiological and chemical profiles of imported litchi fruit[J]. Food Research International, 2011, 44(7): 1962-1969.DOI:10.1016/j.foodres.2010.04.035.
[26] 庞学群, 张昭其, 段学武, 等. pH值和温度对荔枝果皮花色素苷稳定性的影响[J]. 园艺学报, 2001(1): 25-30. DOI:10.3321/j.issn:0513-353X.2001.01.005.
[27] NEOG M, SAIKIA L. Control of post-harvest pericarp browning of litchi(Litchi chinensis Sonn)[J]. Journal of Food Science and Technology,2010, 47(1): 100-104. DOI:10.1007/s13197-010-0001-9.
[28] ZAUBERMAN G, RONEN R, AKERMAN M, et al. Post-harvest retention of the red colour of litchi fruit pericarp[J]. Scientia Horticulturae, 1991, 47(1/2): 89-97. DOI:10.1016/0304-4238(91)90030-3.
[29] ZHANG D, QUANTICK P C. Effects of chitosan coating on enzymatic browning and decay during postharvest storage of litchi (Litchi chinensis Sonn.) fruit[J]. Postharvest Biology and Technology, 1997, 12(2): 195-202. DOI:10.1016/s0925-5214(97)00057-4.
[30] 张永丽. 荔枝果皮褐变过程中POD活性变化及其基因表达分析[D].海口: 华南热带农业大学, 2007: 1-15.